miR-196通過靶向調控CDK6表達對骨肉瘤細胞增殖的影響
張靖勇,賀 明
(中國醫科大學附屬盛京醫院 骨科,遼寧 沈陽110000)
骨肉瘤是一種轉移率高、惡性程度高的原發性骨腫瘤,最常見于青少年和兒童[1]。近年來,隨著新輔助化療與保守手術切除的結合,骨肉瘤患者的5年存活率從以往的不足20%提高至60%以上[2]。但骨肉瘤患者的復發和轉移這兩大難題仍然難以解決,約有1/3的患者出現局部復發,其中轉移患者復發率可高達1/4[3]。細胞周期蛋白依賴性激酶(cyclin dependent kinases,CDKs)家族包含13種不同的絲氨酸/蘇氨酸激酶,CDK6和與其高度同源的CDK4是較為經典的細胞周期激酶,它們通過與D型細胞周期蛋白(D1、D2和D3)結合,調節細胞周期進展和轉錄等多種關鍵細胞進程。這些激酶的異常激活會導致細胞周期紊亂,從而使細胞的增殖出現失控,進一步導致癌癥的發展[4]。MicroRNAs(miRNAs)是一類高度保守的內源性非編碼RNA,它可以識別靶信使RNA(mRNA)3’端非翻譯區的特定種子序列并與之結合,通過降低mRNA自身結合的穩定性或干擾蛋白質的翻譯對基因的表達產生影響[5]。在增殖、分化、凋亡和組織內環境穩定的背景下,miRNAs參與機體內多種生物學功能和細胞進程的調節,同時也參與癌癥的形成和轉移[6]。研究表明miR-196a-5p在卵巢癌和結直腸癌中過度表達,且其高表達的水平與這些癌的進展和轉移有關[7-8]。還有研究證實了miR-196b通過靶向抑制FOXP2來促進肝癌的進展,miR-196b高表達的肝癌患者5年生存率和無病生存率顯著降低[9]。本研究通過生物信息學分析miR-196在骨肉瘤中的差異性表達,實驗驗證miR-196在骨肉瘤中對CDK6的表達是否具有調控作用,從而明確miR-196對骨肉瘤細胞增殖的影響并初步研究其分子作用機制,為骨肉瘤的臨床診治和預后開辟新的領域。
1 材料與方法
1.1 材料
1.1.1實驗細胞 人骨肉瘤MG63細胞與U2OS細胞購于中國科學院上海生物科學院細胞源中心。
1.1.2試劑 DMEM培養基和胎牛血清購自美國Gibco公司,miR-196 mimic、miR-196 inhibitor、miR-196 control、CDK6和內參U6 PCR引物的設計及雙熒光載體的構建均購自廣州銳博生物技術有限公司,Lipo-fectamine3000轉染試劑、Trizol試劑、PCR試劑盒購自美國Invitrogen公司,四氮唑藍(Thiazolyl Blue Tetrazolium Bromide,MTT)購自美國 Sigma-Aldrich公司,CDK6抗體和GAPDH 抗體購自英國 Abcam公司。
1.2 方法
1.2.1miR-196在骨肉瘤中的表達分析 通過沈陽陌信信息技術有限公司對miRNA在骨肉瘤組織中的表達進行差異性分析,使用miRDB(www.mirdb.org)數據庫尋找CDK6蛋白的mRNA序列,并尋找能夠調控CDK6蛋白的潛在miRNA序列及靶點,對其相關性進行分析。
1.2.2細胞培養 配制骨肉瘤MG63和U2OS細胞培養基(高糖DMEM+10%FBS+1%青-鏈霉素雙抗混合液);當細胞生長至融合度大約為80%以上時用胰酶消化傳代,置于37℃、5%CO2的孵箱中培育。
1.2.3細胞轉染 將處于對數生長期的骨肉瘤MG63和U2OS細胞取出,使用胰酶進行消化處理,均勻地接種于6孔板中,待細胞密度長至50%~70%時根據說明書分別將miR-196 mimic、miR-196 control和miR-196 inhibitor轉染于骨肉瘤MG-63細胞中。
1.2.4實時熒光定量PCR(RT-qPCR)檢測mRNA表達水平 收集轉染48 h后的細胞,加入1 ml Trizol吹打裂解細胞后轉入EP管中室溫下靜置,再加入0.2 ml氯仿,于手中用力震蕩少許時間靜置2~3 min后以12 000 g(2~8℃)的條件離心15 min。取上層水相加入到另一EP管中并加入0.5 ml異丙醇,再次按上述步驟震蕩靜置離心。棄去上清,加入1 ml 75%乙醇洗滌后再螺旋混合,再次離心棄上清獲得細胞的總RNA,再通過反轉錄得到cDNA。PCR檢測方法使用SYBR Green法,PCR擴增條件如下:先于94℃環境中預變性3 min,而后94℃ 30 s、60℃ 30 s、72℃ 2 min,一共進行35個循環。檢測引物如表1。

表1 RT-qPCR檢測引物序列
1.2.5MTT實驗測定細胞活性 于轉染6~8 h后使用胰酶消化細胞,以4×103個/孔的濃度接種于96孔板中,分別在培養至0 h、12 h、24 h、36 h、48 h進行MTT實驗,每孔加入10 μLMTT溶液(5 mg/mL)培養4 h,棄去上層清液后再于每孔中加入100 μL DMSO,室溫下低速震蕩混勻10 min后測定OD490 nm吸光度(A)值。
1.2.6雙熒光素酶報告基因實驗驗證miRNA與mRNA的調控關系 收集轉染48 h的MG-63與U2OS細胞,消化稀釋后以1×104個細胞/孔的濃度接種于24孔板中,繼續培養24 h,當細胞融合度達到80% ~90%左右時,按照1.2.3進行轉染,將構建好的CDK6的野生型(WT-CDK6)和突變型(MUT-CDK6,突變了二者的結合位點)雙熒光素酶報告載體分別與miR-196 mimic和miR-196 control共轉染培養好的MG-63細胞轉染48 h,收集細胞驗證轉染效果,將轉染的細胞使用裂解緩沖液于室溫下裂解20 min,離心收集上清,加入熒光素酶底物后立即使用發光儀對熒光素酶活性進行檢測。以海腎熒光素酶活性為內參,計算螢火蟲熒光素酶活性。
1.2.7Western blotting檢測蛋白表達 取出培養的細胞吸凈培養液后加入細胞裂解液,于冰盒上充分裂解后再吸出裂解液。提取各組總蛋白進行蛋白定量,120 V恒壓電泳60 min分離蛋白,電泳結束后切取條帶,加入轉膜緩沖液,恒定電流200 mA轉膜2 h。室溫下,將PVDF膜使用快速封閉液封閉1 h后將PVDF膜放入一抗中4℃水平搖床孵育過夜。吸去一抗后TBST洗膜3次,每次5~10 min。再加入按說明書比例稀釋好的標記二抗室溫孵育1 h并洗膜后,系統發光成像,檢測目的蛋白的表達情況。
1.3 統計學處理
圖表中的數據資料采用均數±標準差表示,miR-196和CDK6的相關性通過spearman相關系數進行分析,采用單因素或多因素方差分析對各組數據之間差異是否顯著進行評估,P<0.05為差異具有統計學意義。所有實驗數據均使用GraphPad 8.1進行數據統計和分析處理。
2 結果
2.1 miRDB數據庫及生物信息公司分析miR-196在骨肉瘤中的表達情況并篩選可能靶向CDK6的miRNA序列
通過信息技術公司分析miR-196在骨肉瘤中的表達,結果顯示miR-196在骨肉瘤中的表達顯著下調1.773 993倍,差異具有統計學意義(P<0.05),見表2。通過miRDB數據庫篩選發現miR-196前體序列與CDK6序列有結合位點,說明CDK6可能是miR-196的靶基因之一(圖1)。
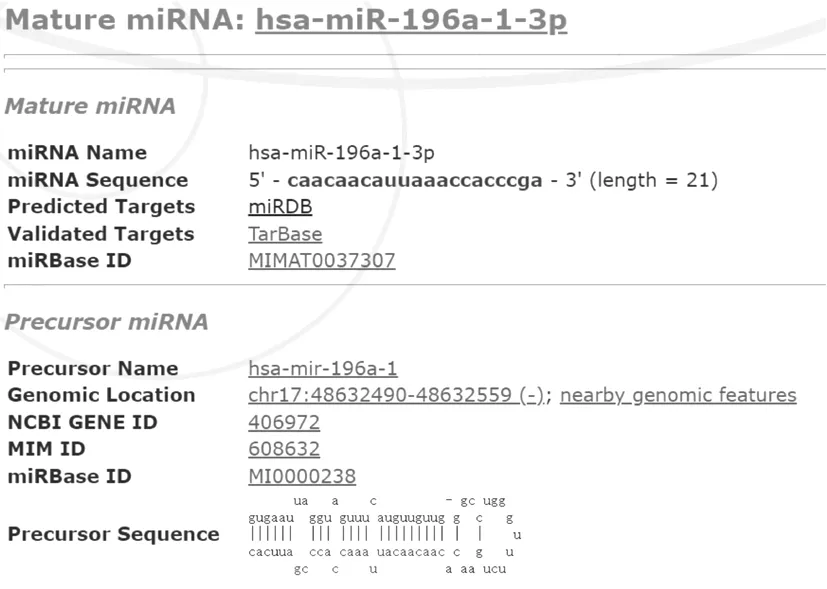
圖1 miR-196與CDK6存在結合位點
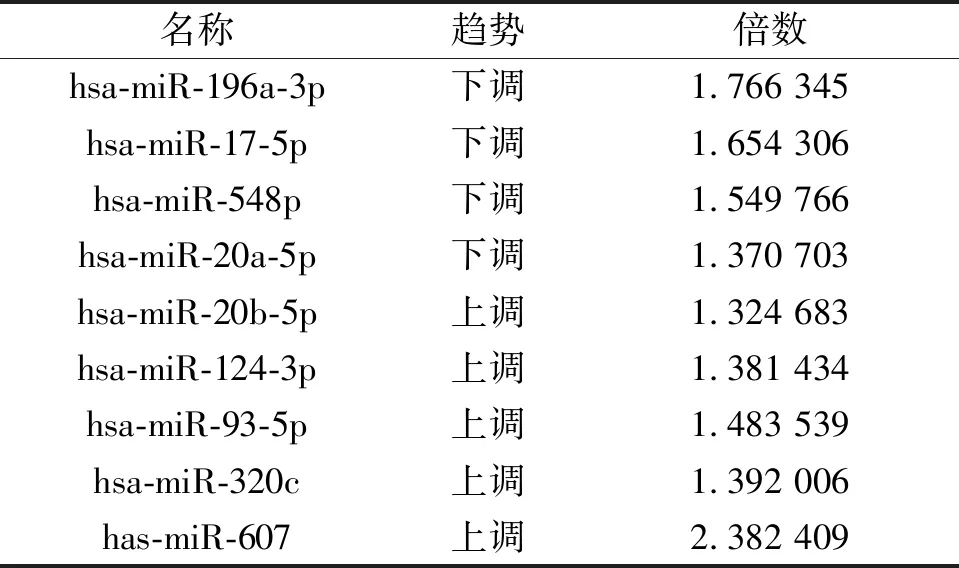
表2 生信預測miR-196在骨肉瘤細胞中的表達情況
2.2 spearman相關系數分析骨肉瘤中miR-196和CDK6表達的相關性
對miR-196和CDK6在骨肉瘤組織中的表達量使用spearman相關系數進行相關性分析,統計分析結果指出miR-196與CDK6在骨肉瘤組織中的表達呈負相關(rs=-0.8055,P<0.05,圖2),說明miR-196的過表達能夠抑制CDK6在骨肉瘤中的表達。
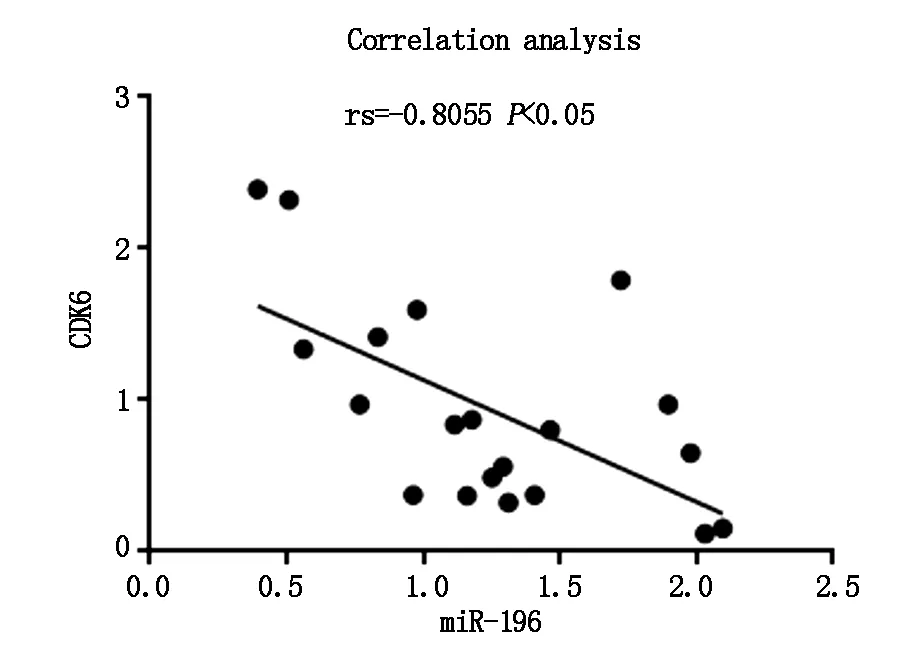
圖2 miR-196和CDK6表達的相關性分析
2.3 雙熒光素酶報告基因實驗驗證miR-196與CDK6在骨肉瘤中的關系
通過miRDB生物數據庫分析發現CDK6與miR-196存在結合位點,由此猜測CDK6可能是miR-196的靶基因之一,因此采用熒光素酶報告基因實驗分別對骨肉瘤MG63細胞系和U2OS細胞系中miR-196與CDK6的靶向結合進行驗證,見于圖3A與圖3B。CDK6-WT+miR-196 control組的熒光活性低于CDK6-WT+miR-196 mimic組,兩者相比差異較為顯著(P<0.05)。CDK6-MUT+miR-196 control組和CDK6-MUT+miR-196 mimic組的熒光活性相比差異無統計學意義(P>0.05)。
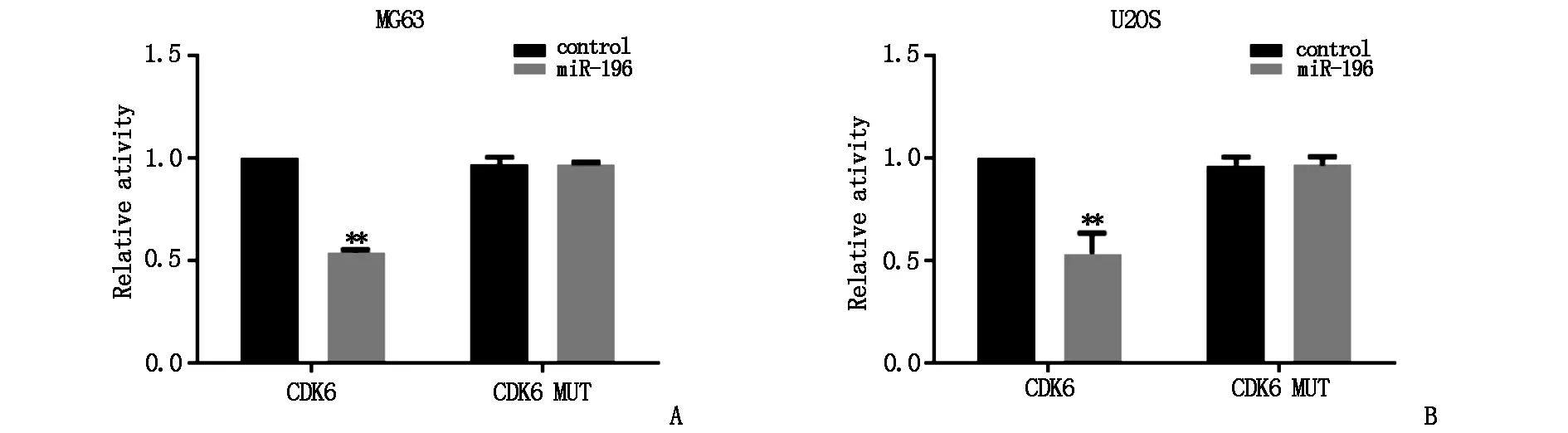
圖3 熒光素酶報告基因實驗驗證miR-196與CDK6的相互作用(*)*P<0.05)
2.4 RT-qPCR檢測骨肉瘤中miR-196對CDK6表達的調控
采用RT-qPCR分別驗證MG63與U2OS細胞系中miR-196對CDK6表達的調控作用,結果顯示,對比miR-196 control組,miR-196 mimic組中miR-196的表達顯著上調,與此同時miR-196 mimic組中的CDK6表達量顯著降低,差異具有統計學意義(P<0.05),見圖4A與圖4C。對比miR-196 control組,miR-196 inhibitor組中miR-196的表達下調,而miR-196 inhibitor組中CDK6的表達顯著上調,差異具有統計學意義(P<0.05),見圖4B與圖4D。
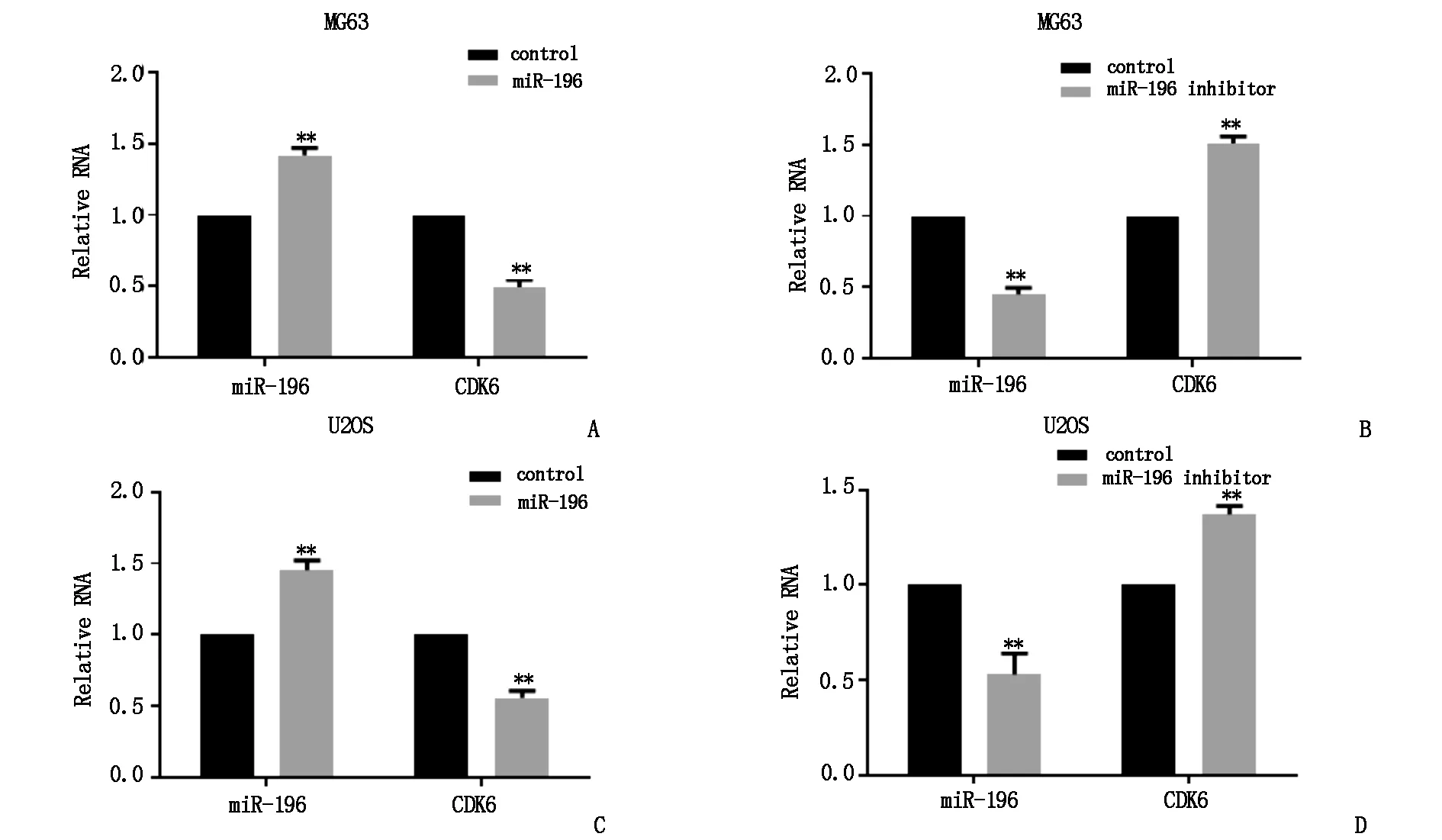
圖4 RT-qPCR檢測miR-196和CDK6的表達水平(*)*P<0.05)
2.5 Western blotting檢測骨肉瘤中miR-196和CDK6表達的關系
采用western blotting分別檢測MG63細胞和U2OS細胞中miR-196 control組、miR-196 mimic組和miR-196 inhibitor組中CDK6蛋白的表達情況,以GAPDH為內參。結果顯示miR-196 mimic組中CDK6蛋白表達量減少,而miR-196 inhibitor組中CDK6蛋白表達量增多,差異有統計學意義(P<0.05),見圖5A與圖5B。

圖5 western blotting檢測CDK6的表達
2.6 miR-196過表達或低表達對骨肉瘤MG-63細胞增殖的影響
miR-196 mimic與miR-196 inhibitor轉染后采用MTT實驗檢測骨肉瘤MG63和U2OS細胞的增殖能力,結果如圖6所示。與轉染miR-196 control組相比,轉染miR-196 mimic組的增殖活性在12 h、24 h、36 h和48 h均顯著降低(P<0.05,圖6A與圖6C),而轉染miR-196 inhibitor組的增殖活性在12 h、24 h、36 h和48 h均有不同程度的升高(P<0.05,圖6B與圖6D)。實驗證明過表達miR-196能夠抑制骨肉瘤MG63和U2OS細胞的增殖活性,而當miR-196呈低表達時能夠促進骨肉瘤MG63和U2OS細胞的增殖能力。

圖6 miR-196 mimic和miR-196 inhibitor對骨肉瘤細胞增殖的影響(*)*P<0.05)
3 討論
目前miRNA在骨肉瘤領域的研究取得了大量進展,為腫瘤的臨床診治、化療耐藥以及改善預后等提供了新的思路。HE等[10]發現miR-486可以靶向抑制PKC-δ信號通路而抑制骨肉瘤MG-63細胞的增殖和侵襲,可見miR-486是骨肉瘤潛在的治療靶點之一。另外一些miRNA的靶點與骨肉瘤的病理生理學有關,SUN等[11]證明了FOS樣抗原2(FOSL2)是miR-143-3p的直接靶點,并檢測出miR-143-3p在預后不良的骨肉瘤患者中表達下調,當miR-143-3p過表達時能夠抑制骨肉瘤細胞增殖和侵襲,促進骨肉瘤細胞的凋亡。而FOSL2在骨肉瘤中的過量表達能夠逆轉miR-143-3p的作用,從而得出結論,miR-143-3p通過靶向FOSL2抑制骨肉瘤的增殖、侵襲和轉移。這些研究共同支持miRNAs在骨肉瘤方面可能具有診斷和治療價值的觀點。
近年來miR-196已被許多研究證實其參與腫瘤的發生和進展,ZHAO等[12]和KANNO等[14]發現,miR-196b通過靶向抑制SOCS2的表達來促進喉鱗狀細胞癌的增殖和侵襲能力,并抑制其癌細胞的凋亡,從而可將miR-196b視為喉鱗狀細胞癌的一個預后因素。LI等[13]發現miR-196b在非小細胞肺癌中過表達,且與其靶基因GATA6的表達呈負相關,并證明miR-196b的過表達通過靶向GATA6而促進非小細胞肺癌的侵襲和轉移。同時,在胰腺癌中,KANNO等[14]發現miR-196b的高表達與胰腺癌患者的不良預后顯著相關,miR-196b可以作為胰腺癌患者的生物標志物來檢測和評估患者的預后情況。還有一項研究指出miR-196a-5p可能參與了小鼠破骨細胞中對線粒體代謝的抑制作用,從而證實了miR-196-5p能夠抑制小鼠體內破骨細胞的形成[15]。
CDK在促進癌癥發生發展方面的關鍵性使其成為受到大量關注的潛在藥物靶點。CDK4/6抑制劑能夠使細胞周期中G1期到S期的進展出現阻滯進而抑制腫瘤細胞的增殖[16]。除了阻斷細胞周期外,CDK4/6抑制劑還能通過多種作用機制來抑制腫瘤細胞的生長,如增強信號通路抑制劑引起的細胞抑制、誘導衰老、調節細胞代謝,甚至促進抗腫瘤免疫反應等[17]。ZHU等[18]發現miR-29b通過抑制CDK6蛋白的表達而起到了抑制骨肉瘤細胞增殖和遷移的作用,揭示了靶向CDK6是miRNAs作用于骨肉瘤的一種新的調節途徑。TIAN等[19]也證實了miR-497通過靶向CDK6和plexinA4來抑制骨肉瘤的生長和遷移,首次闡明了miR-497和CDK6、plexinA4之間的關系及其在骨肉瘤中的作用。但目前關于miR-196能否通過靶向調控CDK6的表達來影響骨肉瘤細胞增殖的研究尚未見相關報道,本研究填補了這一空白。
本研究分析了骨肉瘤組織中miR-196的差異性表達情況,發現miR-196在骨肉瘤組織中的表達量顯著下調,且通過MTT實驗證明過表達的miR-196可以抑制骨肉瘤MG63和U2OS細胞的增殖,證實了miR-196在能夠抑制骨肉瘤發生與進展的作用。此外,還通過生物信息學預測結果發現CDK6與miR-196的前體序列存在結合位點,猜測CDK6可能是miR-196的靶點并對其進行驗證。使用spearman相關系數對miR-196和CDK6在骨肉瘤組織中的表達量進行相關性分析,結果顯示二者呈負相關(rs=-0.805 5,P<0.05)。通過螢光素酶報告基因實驗證明miR-196在骨肉瘤組織中能夠顯著抑制CDK6的活性,又采用RT-qPCR檢測miR-196和CDK6在mRNA水平表達的調控關系,western blotting檢測在miR-196調控下骨肉瘤MG63和U2OS細胞中CDK6蛋白的表達情況。結果顯示過表達miR-196能夠顯著地抑制CDK6的表達,而miR-196的低表達則能夠促進骨肉瘤中CDK6的表達。
綜上所述,本研究發現miR-196在骨肉瘤中的表達顯著下調,當miR-196過表達時,可以對骨肉瘤細胞的增殖起到抑制作用,并且能抑制CDK6的表達,由此推斷得出miR-196通過靶向調控CDK6的表達而起到抑制骨肉瘤細胞增殖的作用。miR-196和CDK6有望成為新的骨肉瘤早期診斷和治療的分子靶點,構建miRNA相關生物制劑可能從基因層面出發改變腫瘤細胞的轉錄翻譯等過程,進而影響骨肉瘤的發生與進展,對骨肉瘤未來的臨床護理和診治情況做出改善。

