H4及A172神經膠質瘤細胞系高親和腺相關病毒載體的研究
高 騰,趙琳琳,汪煜楠,初婷婷,鄭永慧,張驚宇
(哈爾濱醫科大學附屬第四醫院 神經內科,黑龍江 哈爾濱150001)
腺相關病毒(Adeno-associated virus,AAV)屬于細小病毒科的依賴病毒屬,AAV的線性單鏈DNA基因組約為4.7 kb,有兩個主要編碼基因:編碼復制相關蛋白(Rep)與衣殼蛋白(Cap)[1-3]。AAV基因組末端長度為145 bp的反向末端重復序列(ITR)是DNA的復制來源,也是包裝信號和整合位點所需的唯一基本活性序列。重組AAV基因傳遞載體包含一個保留ITR的基因組,但野生型AAV編碼序列被治療基因(轉基因)取代。這些載體是通過添加編碼VP和Rep蛋白的質粒結構來組裝的[4-5]。腺相關病毒宿主范圍較廣,可整合到染色體但無致病性,免疫原性較弱,可長期表達外源基因,是體內基因轉移理想的候選載體[6]。目前已經發現13種腺相關病毒血清型,現階段發現的腺相關病毒血清型尚不能破壞寄主并誘發病害[7]。使用腺相關病毒載體進行體內基因轉移的安全性和有效性都受到宿主免疫系統的影響。針對轉導細胞的衣殼特異性,T細胞反應在腺相關病毒介導的轉基因過程中,對外源基因表達時間的長短有一定影響[8-10]。目前腺相關病毒介導的基因轉移在腦腫瘤領域的應用尚處于萌芽階段,其中一個重要原因就是缺乏高效轉導腫瘤細胞的腺相關病毒載體。所以如何提高腺相關病毒轉導腦腫瘤細胞的效率是重要的研究方向。因此本研究通過在AAV5的衣殼蛋白Cap的氨基酸N573后插入一段寡肽GIVADNLNL以替換Q574到T578之間的蛋白序列QSSTT,同時引入兩個點突變S2A和T711S得到AAVX01,進而研究其產量及轉導效率。
1 材料與方法
1.1 主要材料AAV5、AAV8兩種腺相關病毒血清型,pAAV-CMV-GFP質粒,pHelper質粒,HEK293細胞,H4細胞系和A172細胞系。
1.2 AAVX01的構建在AAV5的Cap基因N573后隨機插入7個氨基酸寡肽片段,同時引入S2A、T711S兩個點突變位點,經合理設計并合成形成AAV5隨機質粒,將構建的病毒包裝質粒與pHelper質粒共轉染HEK293細胞形成具有感染性的嵌合AAV5。將嵌合AAV5與Ad5質粒共感染H4細胞系及A172細胞系,感染48 h后收集細胞裂解液用于下一輪的感染,如此反復感染兩組細胞系4~5次,提取病毒DNA,并對突變的衣殼蛋白基因進行測序,分析出現頻次最高的突變體,此變體在H4細胞系及A172細胞系中轉導效率優于其他變體,實驗中發現插入寡肽片段為GIVADNLNL的突變體轉導效率優異,命名為AAVX01。
1.3 細胞的培養、轉染、病毒包裝、純化、感染用含10%FBS、1%雙抗(體積分數)的DMEM高糖培養基培養HEK293細胞,用含10% FBS、1%雙抗(體積分數)、10%熱滅活胎牛血清的DMEM高糖培養基培養H4和A172細胞。將AAV包裝質粒、pHelper質粒、pAAV-CMV-GFP質粒在PEI條件下進行三質粒轉染。48 h后,收集細胞并通過離心沉淀,將細胞重懸于含150 mmol/L NaCl,50 mmol/LTris-HCl(pH7.5)的PBS溶液中,冷凍與融化交替進行反復若干次,并在37℃下用Benzonase酶(50 U/mL)處理0.5 h,去除細胞裂解物,并將上清液加到碘克沙醇梯度溶液(按體積分數使用PBS配制10%、20%、40%、50%碘克沙醇梯度溶液)中,在4℃下以78 000 r/min的轉速離心120 min,從40%碘克沙醇相中收獲病毒顆粒。將收獲的病毒以感染復數=1×105vg/cell感染H4、A172細胞,觀察GFP綠色熒光表達,每組平行進行5次實驗。
1.4 嵌合AAV和嵌合質粒的構建AAV Cap基因重組后,用特異性引物進行PCR擴增生成全長Cap嵌合體,克隆到野生型AAV5主鏈中生成重組質粒。對20個重組質粒進行克隆和DNA測序。建立質粒后,分兩步生成AAV衣殼。首先通過將pXR2和AAV質粒共轉染,將含有重組Cap基因的部分包裝到AAV5衣殼中。然后將得到的AAV感染HEK293細胞和腺病毒Ad5重復感染的H4細胞系及A172細胞系,從而確保產生包裝相應嵌合AAV基因組的嵌合AAV衣殼。
輔助質粒pXR和引物序列設計:利用外層引物P1和P2擴增DNA,進行片段反應。從輔助質粒中擴增出包含整個Cap、部分Rep基因和部分質粒主干序列的4.4 k堿基片段。然后將PCR產物以等摩爾量混合在一起,用DNaseI隨機破碎。大小在400到1 200個堿基對之間的片段在瓊脂糖凝膠中被分解,并在沒有引物的情況下通過變性、退火和延伸的循環重新組裝。然后在4℃下,用內引物P3和P4擴增組裝好的片段,用SfiI和XbaI酶切,并連接到用相同酶酶切的主鏈上結扎混合物并純化。將此20個樣本克隆進行序列分析。
1.5 提取mRNA和PCR檢測實時熒光定量PCR對采集病毒進行檢測,以pAAV-CMV-GFP為標準品,在GFP基因上設計上游引物和下游引物。從GenBank中查詢得到人AAV5的cDNA。用Prime Primier軟件設計引物。引物由納川生物技術有限公司合成。
上游引物(Forward primer):5’-GGAAGCTTATGTCCATCTTGTTTTATG-3’
下游引物(Reverse primer):5’-ATGCGGCCGCTTCATGTTCTTCCGATT-3’
1.6 銀染銀染檢測出蛋白和核酸的陽性率較高,AAV的外殼由VP1、VP2、VP3 3種蛋白按1∶1∶10比例組成,利用Thermo Scientific的銀染試劑盒對收集的病毒顆粒進行純度分析。
1.7 統計學處理本實驗各定量數據的統計描述以標準差的方式來體現。用雙尾檢驗及不成對資料的t檢驗來比較各組血清型的神經膠質瘤轉導效率。P<0.05為差異具有統計學意義。
2 結果
2.1 與H4及A172細胞系高親和AAV載體
利用肽展示技術通過在AAV5衣殼蛋白Cap的氨基酸N573后插入一段氨基酸GIVADNLNL以替換Q574到T578之間的蛋白序列QSSTT,同時引入兩個點突變S2A和T711S得到AAVX01(圖1)。本研究該改造是否會對AAV產量造成影響,通過qPCR定量分析從5×107個細胞中產出的病毒量,發現AAVX01的產量不比常用的野生型AAV5,8低(表1);進而計算qPCR和銀染測得的病毒滴度比值(即實心率,反映有活性的病毒量),發現AAVX01的實心率不明顯低于野生型AAV5,8。上述結果說明對AAV5改造產生的AAVX01產量和實心率不低于野生型AAV5,8。
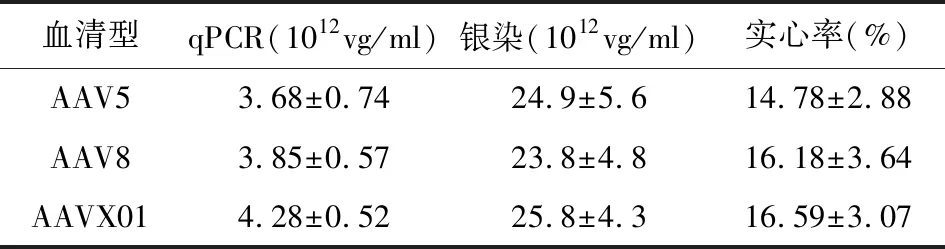
表1 AAV5、AAV8及AAVX01產量和實心率
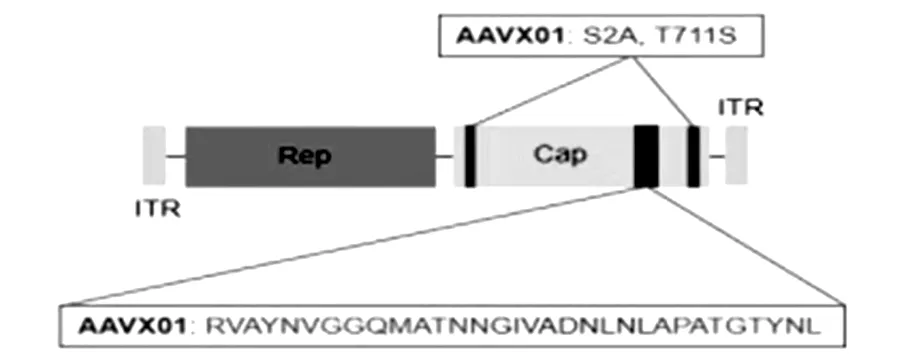
圖1 與H4及A172細胞系高親和AAV載體AAVX01
2.2 AAVX01有優異的H4及A172細胞系轉導效率
為了研究AAVX01感染腫瘤細胞的效率,本研究選擇了H4和A172這兩種常用的神經膠質瘤細胞系,將包裝了GFP報告基因的AAV以5×104vg/cell的感染復數(MOI)感染細胞,于72 h后觀察綠色熒光表達。對于被病毒感染神經膠質母瘤細胞A172的比例,AAVX01是AAV5的2.85倍,是AAV8的9.27倍(圖2A,B);對于神經膠質瘤細胞H4的轉導效率AAVX01是AAV5的6.85倍,是AAV8的1.67倍(圖3A,B)。上述結果說明AAVX01相比于野生型AAV5,8對于H4及A172神經膠質瘤細胞系有更好的轉導效率。
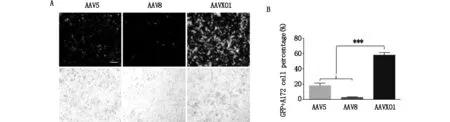
圖2 AAVX01轉導A172細胞系的效率
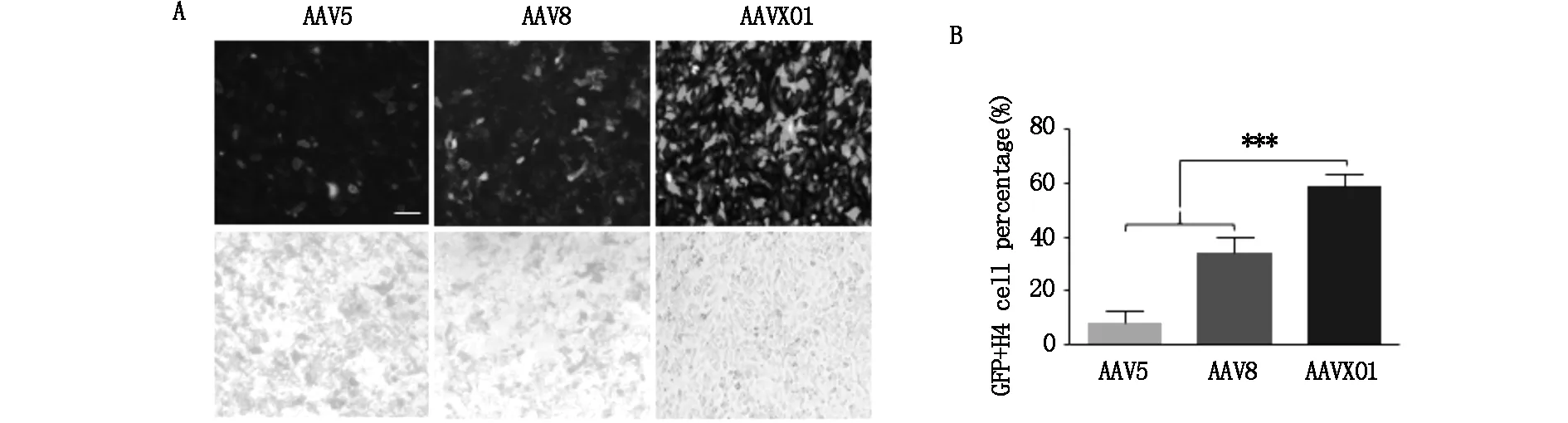
圖3 AAVX01轉導H4細胞系的效率
AAVX01載體的構建:通過在AAV5衣殼蛋白Cap的氨基酸N573后插入一段氨基酸GIVADNLNL以替換Q574到T578之間的蛋白序列QSSTT,同時引入兩個點突變S2A和T711S得到AAVX01。
通過qPCR定量分析從5×107個細胞中產出的病毒量;進而計算qPCR和銀染測得的病毒滴度比值,數據以平均值的形式體現,n=3,數據統計采取非配對t檢驗。
3 討論
AAV已成為人類基因治療最常用的傳遞方式之一。事實上,目前歐洲和美國食品和藥物管理局已經批準了3種rAAV藥物[11-12]。總體來講,rAAV藥物臨床應用取得了積極的治療效果且AAV基因治療具有較強的安全性。然而,關于AAV載體的研發仍面臨諸多問題:衣殼和轉基因產品的免疫原性、靶器官體內如何高效轉導。通過對AAV載體衣殼蛋白的修飾能夠減低體內抗體的中和作用,從而降低免疫原性。本研究獲得具有高效神經膠質瘤親和性和神經膠質瘤細胞感染性新型AAV血清型,且中和抗體分布較低。此新型血清型對膠質瘤的治療有重要意義。
目前已有相關研究表明AAV5在眼睛、肺和神經系統的轉導效率優于其他血清型[13-15],AAV8則表現出突出的肝臟轉導優勢,有研究團隊由此開發出用于改善胰島素基因治療糖尿病的肝臟特異性Tet-off AAV8載體[16]。AAV8的肌肉親和性也表現出良好的應用前景[17]。現有研究表明,AAV9在全身組織和器官中都有廣泛的表達。由于AAV9具有可以穿越血腦屏障的特性[18-19],所以在神經系統的相關研究中AAV9是較受歡迎的病毒載體之一。目前在野生的AAV中尚缺乏理想的血清型能夠對多種腫瘤細胞有較高的基因遞送效率,這是AAV在腫瘤治療方面應用受到限制的一個重要原因。然而本研究中新型的AAVX01對于至少兩種神經膠質瘤細胞有相對優異的轉導效率,使其具有成為抗腫瘤藥物載體的潛力,因此可遞送多種例如抗腫瘤單抗,雙特異性抗體,自殺基因,RNAi等藥物并維持它們在體內的穩定表達,為腫瘤的治療提供更多的選擇。
有團隊也對AAV5在神經系統的轉導效率進行了研究,在雌性Wistar大鼠采用背根神經元直接注射的方式,比較了不同血清型腺相關病毒(AAV1、AAV2、AAV3、AAV4、AAV5、AAV6 和 AAV8) 載體對初級感覺神經元的轉染效果,發現 AAV5 的轉染效果最佳[20]。已有研究表明,AAV2優先轉導神經元而AAV5同時轉導神經元和神經膠質細胞[21]。早在2003年,有學者就已經在研究AAV8介導的可溶性VEGF受體向中樞神經系統的基因傳遞治療膠質母細胞瘤,在研究過程中發現,由于rAAV載體的表達在中樞神經系統內是穩定和長期的[22],因此抗VEGF治療存在反饋機制。這表明對神經膠質瘤高親和性的新型AAVX01血清型介導的基因轉移,有希望在中樞神經系統持續表達一種有效的腫瘤抑制,但其療效可能會同時受限于機體的反饋機制,如何將對神經膠質瘤高親和性的新型AAVX01載體所攜帶的抗神經膠質瘤基因的作用進行優化,將成為動物實驗和臨床實驗的重點。隨著對rAAV研究的深入,會有更多、更安全的rAAV載體出現,具有廣闊的臨床應用前景。

