瓜蔞薤白半夏湯預處理對心肌缺血再灌注損傷模型大鼠的心肌保護作用及機制研究
翁錦龍,熊尚全,江澍,鄭峰,林超,趙利
心肌缺血再灌注損傷(myocardial ischemia-reperfusion injury,MIRI)指急性阻塞的冠狀動脈血運重建后造成不可逆損傷的病理過程,其可危及患者的生命安全,且具有較高的致死率[1]。近年來缺血性心臟病已逐漸成為心血管疾病患者的重要死亡原因之一[2],而血運重建是恢復心肌血供最直接、有效的治療手段,但其常伴隨再灌注損傷,進而影響血運重建效果[3]。同時,MIRI還是急性心肌梗死患者預后不良的關鍵影響因素,與后期心力衰竭的發生密切相關[4]。因此,如何有效防治MIRI以提高心肌缺血救治效果是當前亟需解決的臨床問題。研究表明,核因子κB(nuclear factor κB,NF-κB)信號通路與心肌缺血損傷關系密切,而Toll樣受體4(Toll-like receptor 4,TLR4)是其上游因子,故TLR4/NF-κB信號通路可作為中醫藥防治MIRI的靶點[5]。
瓜蔞薤白半夏湯是醫圣張仲景基于“陽微陰弦”病機理論創立的治療“胸痹病”的經典名方,研究表明,該方可通過減輕炎癥反應、抑制自噬、改善細胞凋亡等機制而減輕心肌細胞損傷,具有良好的心肌保護作用,且應用前景廣泛[5]。但瓜蔞薤白半夏湯的心肌保護作用機制尚需要進一步挖掘。本研究以瓜蔞薤白半夏湯為干預藥物,旨在探究其對MIRI模型大鼠的心肌保護作用及機制,以期為發掘經方提供有價值的實驗依據。
1 材料與方法
1.1 實驗時間 本實驗時間為2022年2月至2023年2月。
1.2 實驗動物 選取健康雄性SD大鼠40只,SPF級,購自斯貝福(北京)生物技術有限公司,體質量(300±20)g,動物許可證號:SCXK(京)2019-0010。在動物實驗中心分籠飼養(5只/籠),大鼠可自由飲水,普通飼料喂養,不限制進食,飼養溫度控制在18~22 ℃,相對濕度為40%~70%,12 h/12 h明暗晝夜循環,實驗操作均符合動物倫理要求。
1.3 主要實驗藥物、試劑及儀器
1.3.1 藥物 制備瓜蔞薤白半夏湯[6],具體藥材如下:瓜蔞24 g,薤白9 g、半夏12 g;統一由福建中醫藥大學附屬人民醫院中藥房采購,藥材均為同一批次,將藥材放于2 L白酒(市售的米酒頭,酒精含量35%)中,攪拌后浸泡0.5~1.0 h以充分浸泡藥材,加入適量水,開啟自動煎藥機統一煎煮,按成人(70 kg)每日劑量換算,濃縮成含生藥1.3 g/ml的水煎液,4 ℃條件下保存備用。
1.3.2 試劑 吡咯烷二硫代氨基甲酸(pyrrolidinedi thiocarbamate,PDTC)(生產批號:BM000043)、兔抗TLR4抗體(貨號:66350-1-Ig)、兔抗NF-κB抗體(貨號:66535-1-Ig)、GAPDH(貨號:60004-1-Ig)、山羊抗兔HRP二抗(貨號:SA00001-2)、IL-1β酶聯免疫吸附試驗(enzyme-linked immunosorbent assay,ELISA)試劑盒(貨號:KE20005)、TNF-α ELISA試劑盒(貨號:KE20018)均購自Proteintech公司,PVDF膜(貨號:AR0136-02)、RIPA裂解液(貨號:AR0102)、蛋白酶抑制劑(貨號:AR1178)、BCA蛋白定量試劑盒(貨號:AR0198)、超敏ECL化學發光即用型底物(貨號:AR1111)均購自武漢博士德生物工程有限公司,丙二醛(malondialdehyde,MDA)測試盒(貨號:A001-3)、超氧化物歧化酶(superoxide dismutase,SOD)測定試劑盒(貨號:A003-1)、乳酸脫氫酶(lactate dehydrogenase,LDH)試劑盒(貨號:A020-2)均購自南京建成生物工程研究所。
1.3.3 儀器 DYCP-31DN型電泳儀(北京六一生物科技有限公司),冷凍離心機(廣州吉迪儀器有限公司,JID-17R),凝膠成像系統(上海培清科技有限公司,JS-2012),透射電鏡(日本日立公司,HT7700),SpectraMax酶標儀(上海美谷分子儀器有限公司,CMax Plus),分光光度計(杭州米歐儀器有限公司,ND-100c),梯度PCR儀(杭州米歐儀器有限公司,MV-C155-ov71),RT-PCR儀(北京鯤鵬基因科技有限責任公司,Archimed X6)。
1.4 實驗方法
1.4.1 MIRI模型制備 采用左前降支結扎法制備MIRI模型[7],具體如下:腹腔注射2%戊巴比妥鈉溶液以麻醉大鼠,取仰臥位固定,在其四肢皮下插入針電極并連接心電圖儀,待波形穩定后行氣管插管,然后連接小動物呼吸機(潮氣量5 ml/100 g,頻率60~80次/min)。胸部皮膚消毒備皮,沿胸骨左緣第3~4肋處剪開肋間皮膚,逐層暴露心臟,在左心耳下方約2 mm處穿進6-0帶線縫合針并穿過心肌表層,在肺動脈圓錐旁出針,將直徑1.5 mm的硅膠管放在結扎線與左前降支血管之間。結扎線系緊時,左前降支受硅膠管壓迫而閉塞。心尖及左心室前壁變白,心電圖檢查顯示ST段即刻抬高、T波高聳,結扎線下心肌顏色變暗,左心室發紺蒼白,提示心肌缺血;30 min后松開結扎線,左心室發紺蒼白區出現充血反應,再灌注120 min以制備MIRI模型。
1.4.2 分組與干預方法 采用隨機數字表法將40只大鼠分為假手術組(A組)、模型組(B組)、瓜蔞薤白半夏湯組(C組)、NF-κB抑制劑組(D組),每組10只。采用苦味酸在大鼠頭、四肢部位進行染色標記,四組大鼠在MIRI模型制備前采用藥物灌胃法進行預處理,方法參照文獻[8],并根據實驗動物劑量換算給藥量〔大鼠給藥量(g/kg)=成人給藥量(g/kg)×6.3〕,其中C組、D組給予瓜蔞薤白半夏湯水煎液預處理,給藥劑量為4.05 g/kg,A組、B組給予等量0.9%氯化鈉溶液預處理,均1次/d,連續干預7 d。此外,A組大鼠于末次給藥后1 h開胸并在冠狀動脈處完成穿線,但不結扎;其余三組大鼠于末次給藥后1 h制備MIRI模型,其中D組大鼠于再灌注前10 min腹腔注射PDTC 100 mg/kg。
1.4.3 血清與心肌組織標本采集 再灌注結束后采集四組大鼠腹主動脈血5 ml,4 ℃環境下離心15 min(離心半徑10 cm,離心機轉速3 000 r/min),分離血清待檢。然后結扎大鼠冠狀動脈,在其左頸動脈注射3%伊文思藍2 ml后迅速摘除心臟,洗凈殘血,剪去多余組織,采用濾紙吸干,取部分心肌組織標本置于液氮中,后轉移至-80 ℃低溫冰箱中保存備用;余心肌組織標本固定于4%多聚甲醛溶液中。
1.4.4 TTC法檢測心肌梗死面積百分比 采用0.9%氯化鈉溶液洗凈心臟殘血,將心臟置于-20 ℃環境中冷凍10 min,采用組織切片機沿心臟短軸方向將其切成1.0~1.5 mm薄片,共5片,將切片置于2% TTC磷酸鹽緩沖液(pH=7.3)中,37 ℃避光孵育30 min,加入4%多聚甲醛溶液于室溫固定10 min。拍照記錄并采用Image J軟件計算心肌梗死面積百分比,心肌梗死面積百分比=心肌梗死區面積/心肌切片區面積×100%。
1.4.5 心肌組織病理學檢查 (1)HE染色:將大鼠心臟置于4%多聚甲醛溶液中固定24 h,石蠟包埋,5 μm連續切片,烘干,二甲苯脫蠟,梯度乙醇溶液脫水處理,按照HE染色試劑盒說明書染色。(2)Masson染色:將大鼠心臟置于4%多聚甲醛溶液中固定24 h,石蠟包埋,5 μm連續切片,按照試劑盒說明書進行Masson染色,觀察心肌纖維化情況,其中藍色代表膠原纖維、紅色代表肌纖維。梯度乙醇溶液脫水后采用二甲苯透明、中性樹膠封固,光學顯微鏡下觀察心肌組織形態學變化。
1.4.6 血清炎癥因子、氧化應激指標檢測 取血清,采用ELISA檢測血清IL-1β、TNF-α水平,具體操作嚴格參照ELISA試劑盒說明書進行。采用TBA法檢測血清MDA水平,采用WST-1法檢測血清SOD活性,采用微板法檢測血清LDH活性,具體操作嚴格按照試劑盒說明書進行。
1.4.7 透射電鏡觀察心肌組織超微結構 切取大小約1 mm×1 mm×1 mm的心肌組織,置于2.5%戊二醛中固定2~4 h,采用磷酸漂洗液漂洗3次,采用1%鋨酸于4 ℃環境下固定2 h;采用ddH2O漂洗3次,梯度乙醇溶液脫水,環氧丙烷過渡,812樹脂梯度滲透后包埋,60 ℃聚合,采用Leica UC7型超薄切片機將包埋塊進行半薄定位及超薄切片,采用醋酸雙氧鈾和檸檬酸鉛對切片進行雙染色,在透射電鏡下觀察心肌組織超微結構。
1.4.8 Western blot法檢測心肌組織TLR4、NF-κB p65蛋白表達水平 取心肌組織,沖洗干凈后進行組織勻漿,低溫高速(4 ℃,12 000×g)離心15 min以提取胞質蛋白,采用BCA法在562 nm波長處測定OD值,繪制標準曲線,將樣本測得的OD值帶入曲線,得到蛋白濃度。然后進行SDS-PAGE,將轉膜夾板放入含轉膜緩沖液的轉移電泳槽中轉膜,轉膜后漂洗3次,放入5% BSA后室溫封閉2 h,稀釋一抗至工作濃度(TLR4 1∶4 000,NF-κB p65 1∶2 000,GAPDH 1∶20 000),將膜置于一抗溶液中,于4 ℃環境下搖床、孵育過夜,次日洗滌后加入二抗,室溫孵育2 h,加入顯影液,置于化學發光成像儀中曝光成像,采用Image J軟件分析條帶灰度值。
1.4.9 RT-PCR檢測心肌組織TLR4、NF-κB p65 mRNA相對表達量 稱取100~150 μg心肌組織塊,置于預冷研磨機中進行粉碎(頻率60 Hz,30 s,振動3次),采用RNA提取試劑盒提取樣本組織RNA,取5 μl RNA進行電泳以檢測RNA的完整性,從NCBI數據庫中查找大鼠TLR4、NF-κB基因的mRNA序列,并以相應種屬的GAPDH作為內參基因,根據引物設計原則,采用Primer Premier 5.0設計目標基因和內參基因的特異性引物,引物設計由上海博尚生物工程技術有限公司合成,RTPCR引物序列見表1。將樣本組織RNA反轉錄成cDNA,采用Archimed X6型熒光定量PCR儀進行PCR,反應體系為20 μl,循環40次,每組設3個復孔,采用2-ΔΔCt法計算mRNA相對表達量。

表1 RT-PCR引物序列Table 1 RT-PCR primer sequences
1.5 統計學方法 應用SPSS 26.0統計學軟件進行數據處理。符合正態分布的計量資料以(±s)表示,多組間比較采用單因素方差分析,組間兩兩比較采用LSD檢驗。以P<0.05為差異有統計學意義。
2 結果
2.1 心肌梗死面積百分比 A組、B組、C組、D組大鼠心肌梗死面積百分比分別為(1.2±0.5)%、(28.6±2.2)%、(18.4±2.9)%、(24.4±1.2)%。四組大鼠心肌梗死面積百分比比較,差異有統計學意義(F=232.00,P<0.001);B組大鼠心肌梗死面積百分比高于A組,C組和D組大鼠心肌梗死面積百分比低于B組,D組大鼠心肌梗死面積百分比高于C組,差異有統計學意義(P<0.05),見圖1。
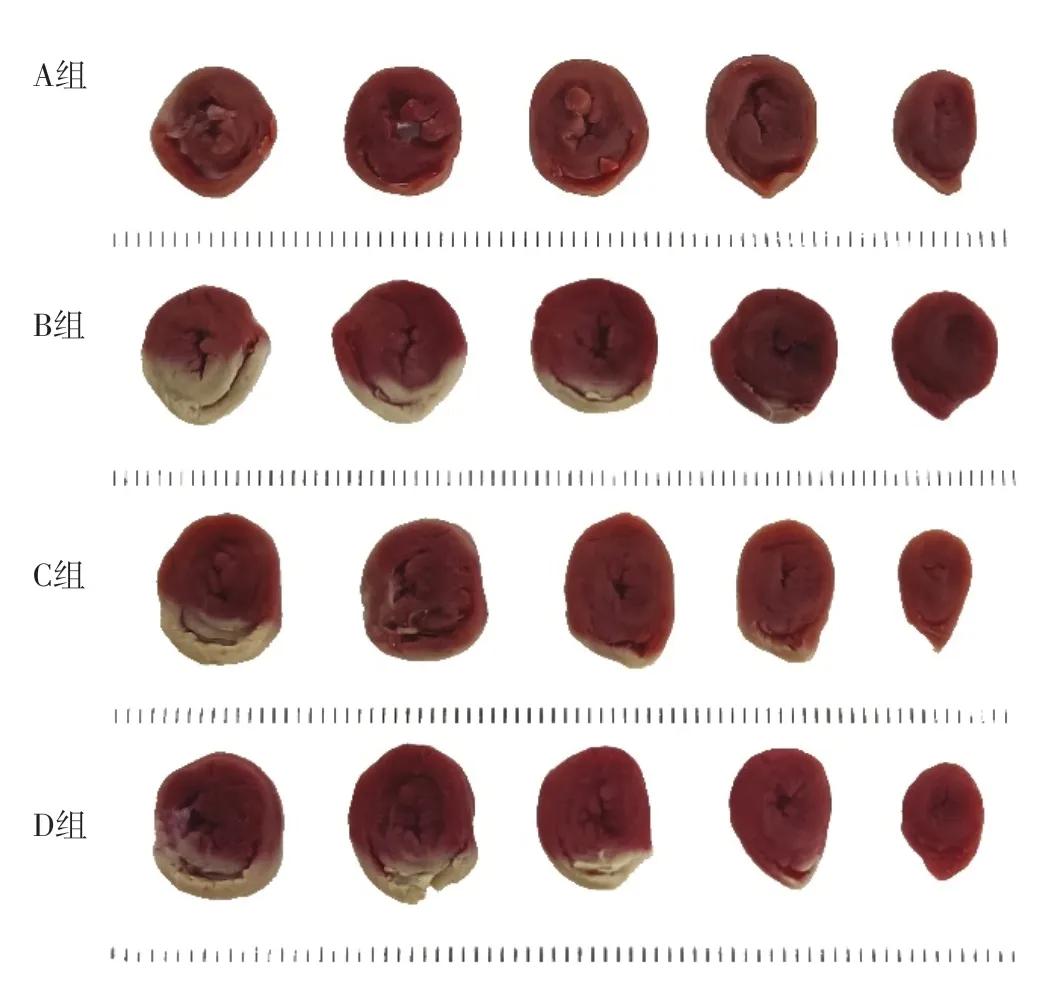
圖1 四組大鼠心肌組織TTC染色結果Figure 1 TTC staining results of myocardial tissue in the four groups of rats
2.2 心肌組織病理學檢查結果 HE染色結果顯示,A組大鼠心肌纖維排列整齊,心肌組織形態正常,可見橫紋結構;B組大鼠心肌纖維呈不規則排列,橫紋斷裂,出現心肌間質水腫且有明顯壞死;C組大鼠心肌組織纖維排列、心肌組織形態改變、橫紋結構改變均優于B組;D組大鼠細胞核散落在外側明顯,見圖2。Masson染色結果顯示,A組大鼠心肌細胞排列有序;B組大鼠心肌細胞排列紊亂,少部分膠原纖維染色陽性;C組和D組大鼠心肌細胞排列較規則,幾乎無膠原纖維染色陽性,見圖3。

圖2 四組大鼠心肌組織HE染色結果(×200)Figure 2 HE staining results of myocardial tissue in the four groups of rats
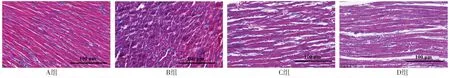
圖3 四組大鼠心肌組織Masson染色結果(×200)Figure 3 Masson staining results of myocardial tissue in the four groups of rats
2.3 血清炎癥因子、氧化應激指標 四組大鼠血清IL-1β、TNF-α、MDA水平及SOD、LDH活性比較,差異有統計學意義(P<0.05);B組大鼠血清IL-1β、TNF-α、MDA水平及LDH活性高于A組,血清SOD活性低于A組,差異有統計學意義(P<0.05);C組和D組大鼠血清IL-1β、TNF-α、MDA水平及LDH活性低于B組,血清SOD活性高于B組,差異有統計學意義(P<0.05);D組大鼠血清IL-1β、TNF-α、MDA水平及LDH活性低于C組,血清SOD活性高于C組,差異有統計學意義(P<0.05),見表2。
表2 四組大鼠血清炎癥因子、氧化應激指標比較(±s,n=10)Table 2 Comparison of serum inflammatory factors and oxidative stress index in the four groups of rats
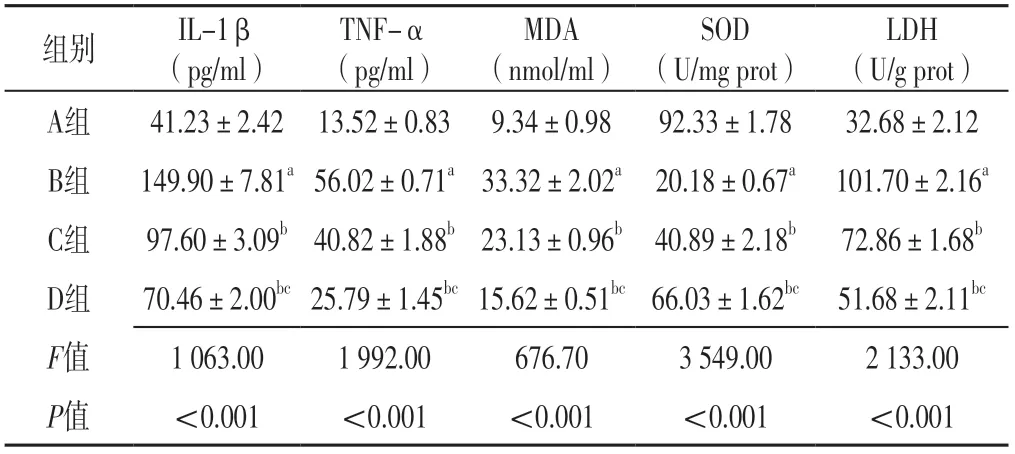
表2 四組大鼠血清炎癥因子、氧化應激指標比較(±s,n=10)Table 2 Comparison of serum inflammatory factors and oxidative stress index in the four groups of rats
注:A組為假手術組,B組為模型組,C組為瓜蔞薤白半夏湯組,D組為核因子κB(NF-κB)抑制劑組;MDA=丙二醛,SOD=超氧化物歧化酶,LDH=乳酸脫氫酶;a表示與A組比較,P<0.05;b表示與B組比較,P<0.05;c表示與C組比較,P<0.05
LDH(U/g prot)A組41.23±2.42 13.52±0.83 9.34±0.9892.33±1.7832.68±2.12 B組149.90±7.81a 56.02±0.71a 33.32±2.02a 20.18±0.67a 101.70±2.16a C組97.60±3.09b 40.82±1.88b 23.13±0.96b 40.89±2.18b72.86±1.68b D組70.46±2.00bc 25.79±1.45bc 15.62±0.51bc 66.03±1.62bc 51.68±2.11bc F值1 063.001 992.00676.703 549.002 133.00 P值<0.001<0.001<0.001<0.001<0.001組別IL-1β(pg/ml)TNF-α(pg/ml)MDA(nmol/ml)SOD(U/mg prot)
2.4 心肌組織超微結構 透射電鏡掃描結果顯示,A組大鼠心肌纖維排列基本規則、整齊,肌絲清晰,線粒體基本完整,線粒體嵴排列整齊、無斷裂,細胞中無明顯自噬泡;B組大鼠心肌纖維排列紊亂、斷裂,線粒體大小不等,可見聚集,線粒體嵴明顯減少、變短,細胞質中存在較多空泡,自噬體較多;C組大鼠心肌纖維排列較整齊,可觀察到部分肌絲,少數線粒體嵴斷裂,可見少數自噬泡;D組大鼠心肌纖維斷裂,線粒體聚集、大小不等,線粒體嵴斷裂現象嚴重,細胞質部分呈空泡化,見圖4。
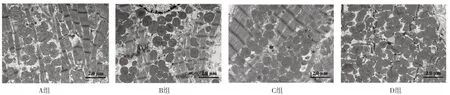
圖4 四組大鼠心肌組織超微結構(×6 000)Figure 4 Ultrastructure of myocardial tissue in the four groups of rats
2.5 心肌組織TLR4、NF-κB p65蛋白表達水平、mRNA相對表達量 四組大鼠心肌組織TLR4、NF-κB p65蛋白表達水平、mRNA相對表達量比較,差異有統計學意義(P<0.05);B組大鼠心肌組織TLR4、NF-κB p65蛋白表達水平、mRNA相對表達量高于A組,C組和D組大鼠心肌組織TLR4、NF-κB p65蛋白表達水平、mRNA相對表達量低于B組,D組大鼠心肌組織TLR4、NF-κB p65蛋白表達水平、mRNA相對表達量低于C組,差異有統計學意義(P<0.05),見表3。
表3 四組大鼠心肌組織TLR4、NF-κB p65蛋白表達水平、mRNA相對表達量比較(±s,n=3)Table 3 Comparison of protein expression level and mRNA relative expression level of TLR4 and NF-κB p65 in myocardial tissue in the four groups of rats

表3 四組大鼠心肌組織TLR4、NF-κB p65蛋白表達水平、mRNA相對表達量比較(±s,n=3)Table 3 Comparison of protein expression level and mRNA relative expression level of TLR4 and NF-κB p65 in myocardial tissue in the four groups of rats
注:a表示與A組比較,P<0.05;b表示與B組比較,P<0.05;c表示與C組比較,P<0.05
TLR4NF-κB p65蛋白表達水平 mRNA相對表達量蛋白表達水平 mRNA相對表達量A組0.35±0.021.00±0.000.57±0.081.00±0.00 B組1.06±0.03a7.54±0.19a1.71±0.04a6.34±0.33a C組0.80±0.11b2.78±0.46b1.26±0.15b2.64±0.18b D組0.42±0.02bc1.14±0.03bc0.92±0.21bc1.17±0.06bc F值101.40442.6538.87502.30 P值0.002<0.0010.001<0.001組別
3 討論
目前,開通狹窄或閉塞血管是心肌梗死患者的首選治療方案,但缺血心肌再灌注可能造成心肌組織二次損傷,進而引起心律失常、心力衰竭等并發癥,故減少MIRI的發生對于挽救梗死心肌組織具有重要意義。MURRY等[9]于1986年首次提出心肌缺血預處理的概念,即血管再通前對心肌預先進行數次短時間的缺血再灌注處理,是延緩后期心肌損傷的一項內源性措施,但該方式對操作者的技術要求較高,在臨床上具有一定操作難度。近年來有關中醫藥防治MIRI的研究較多,一項文獻計量學分析結果顯示,中醫藥在預防MIRI發生和促進經皮冠狀動脈介入治療患者康復方面具有良好作用[10]。如敖玉涵等[11]在常規診療方案基礎上聯用參芪瓜蔞半夏薤白湯治療PCI后患者,結果顯示,治療后患者心絞痛癥狀、中醫證候療效、硝酸甘油用量及血脂指標改善效果均確切。瓜蔞薤白半夏湯出自張仲景《金匱要略·胸痹心痛短氣病脈證并治》,該方主要由栝樓實、薤白、半夏及白酒組成,具有宣痹通陽、祛痰散結之功效,是治療胸陽不振、痰濁痹阻之胸痹的代表方。
本研究旨在探討瓜蔞薤白半夏湯對MIRI模型大鼠的心肌保護作用及機制,結果顯示,B組大鼠心肌梗死面積百分比高于A組,C組大鼠心肌梗死面積百分比低于B組;HE染色結果顯示,C組大鼠心肌組織纖維排列、心肌組織形態改變、橫紋結構改變均優于B組;Masson染色結果顯示,B組大鼠心肌細胞排列紊亂,少部分膠原纖維染色陽性;C組大鼠心肌細胞排列較規則,幾乎無膠原纖維染色陽性。提示瓜蔞薤白半夏湯預處理可有效縮小MIRI模型大鼠心肌梗死面積,保護心肌細胞。目前認為,MIRI的發病機制主要包括線粒體功能障礙、氧化應激、炎癥反應和凋亡級聯反應等,其中炎癥反應和氧化應激貫穿MIRI的全過程[12-13]。炎癥反應是機體對損傷因子的防御行為,適度的炎癥反應可參與組織損傷的修復過程,而過度的炎癥反應可引發嚴重的功能損傷,目前認為心肌二次損傷后的過度炎癥反應是MIRI的重要發病機制之一[14],故抑制炎癥因子過度釋放可保護受損心肌組織,進而減輕MIRI后的心功能障礙[15]。自噬是一種通過自我清除模式使自身細胞得到更新的能力。研究表明,提高自噬水平可提高MIRI病變過程中心肌細胞的生存機會[15]。本研究結果顯示,B組大鼠血清IL-1β、TNF-α、MDA水平及LDH活性高于A組,血清SOD活性低于A組;C組大鼠血清IL-1β、TNF-α、MDA水平及LDH活性低于B組,血清SOD活性高于B組。透射電鏡掃描結果顯示,B組大鼠細胞質中存在較多空泡,自噬體較多,C組大鼠心肌組織可見少數自噬泡。提示瓜蔞薤白半夏湯預處理可減輕MIRI模型大鼠的炎癥反應、氧化應激及抑制心肌細胞自噬小體產生,進而發揮心肌保護作用。
研究表明,NF-κB信號通路作為關鍵炎癥信號通路,在MIRI期間被激活并引發炎癥級聯反應,進而加重心肌損傷程度[16]。Toll樣受體是機體固有免疫的關鍵組成部分,作為炎癥通路中的模式識別受體,其在MIRI發生時可激活下游信號分子,促使TNF-α、IL-1β等促炎因子釋放;此外,作為NF-κB的上游信號,TLR4參與了MIRI的發生過程[17]。且目前TLR4/NF-κB信號通路已成為MIRI的治療靶點,其已引起國內外學者的廣泛關注。本研究結果顯示,B組大鼠心肌組織TLR4、NF-κB p65蛋白表達水平、mRNA相對表達量高于A組,C組和D組大鼠心肌組織TLR4、NF-κB p65蛋白表達水平、mRNA相對表達量低于B組,提示瓜蔞薤白半夏湯預處理可抑制TLR4/NF-κB信號通路。
目前研究認為,抑制NF-κB活性能有效減輕心肌氧化損傷,從而起到心肌保護作用[18],而為了明確瓜蔞薤白半夏湯對TLR4/NF-κB信號通路的調控作用,本研究在瓜蔞薤白半夏湯預處理基礎上加用了NF-κB抑制劑,結果顯示,D組大鼠血清IL-1β、TNF-α、MDA水平及LDH活性低于C組,血清SOD活性高于C組,提示瓜蔞薤白半夏湯預處理可通過抑制NF-κB信號通路而減輕MIRI模型大鼠的炎癥反應、氧化應激。但D組大鼠心肌梗死面積百分比高于C組,D組大鼠細胞核散落在外側明顯、心肌纖維斷裂,線粒體聚集、大小不等,線粒體嵴斷裂現象嚴重,細胞質部分呈空泡化,提示與瓜蔞薤白半夏湯預處理相比,增加NF-κB抑制劑并未發揮更好的心肌保護作用,分析原因可能為:抑制TLR4/NF-κB信號通路雖能減輕炎癥反應及氧化應激,但也可能抑制了機體的正常自我防御功能;而瓜蔞薤白半夏湯是通過調控機體免疫平衡而發揮心肌保護作用的,其除了調控TLR4/NF-κB信號通路外,還可能通過調控其他信號分子而發揮心肌保護作用,這值得進一步探究。因此,在后續實驗中可以加用NF-κB通路激動劑,分析不同劑量瓜蔞薤白半夏湯對MIRI的心肌保護作用,從細胞層面驗證該方對缺血缺氧心肌細胞模型的保護作用機制,以期為臨床防治MIRI提供更可靠的實驗依據。
綜上所述,瓜蔞薤白半夏湯預處理可減輕炎癥反應、氧化應激及抑制心肌細胞自噬小體產生,進而縮小MIRI模型大鼠心肌梗死面積,保護心肌細胞,其機制可能與瓜蔞薤白半夏湯抑制TLR4/NF-κB信號通路有關,這為臨床防治MIRI后的心肌損傷提供了一定的實驗依據。
作者貢獻:翁錦龍進行文章的構思與設計,研究的實施與可行性分析,負責撰寫、修訂論文,負責文章的質量控制及審校,并對文章整體負責、監督管理;翁錦龍、熊尚全、江澍、鄭峰、林超、趙利進行數據收集、整理、分析;翁錦龍、熊尚全、江澍進行結果分析與解釋。
本文無利益沖突。

