急性StanfordA型主動脈夾層患者術后早期死亡的危險因素及應對措施分析
蔡麗霞,王廣闊,汪海芹,張志剛

【摘要】目的 分析急性StanfordA型主動脈夾層(ATAAD)患者術后早期死亡的危險因素,并積極采取針對性應對措施,以降低患者死亡風險。方法 回顧性分析2021年4月至2023年4月江門市中心醫院收治的125例ATAAD患者的臨床資料,統計其術后30 d的死亡率;另收集存活組和死亡組患者的臨床資料,進行單因素及多因素Logistic回歸分析,篩選ATAAD患者術后早期死亡的危險因素。結果 125例ATAAD患者中,術后30 d共有13例死亡,死亡率為10.40%(13/125);單因素分析顯示,死亡組中年齡>60歲、術前腎功能不全、術前心功能不全患者占比均高于存活組;手術時間、體外循環時間均長于存活組;多因素Logistic回歸分析結果顯示,年齡>60歲、術前腎功能不全、術前心功能不全、手術時間長、體外循環時間長均為ATAAD患者術后早期死亡的獨立危險因素(OR=4.800、5.867、5.386、7.135、6.541,均P<0.05)。結論 ATAAD患者術后早期死亡的危險因素具有多樣性,如年齡>60歲、術前腎功能不全、術前心功能不全、手術時間長、體外循環時間長等。因此,臨床需對上述高危人群給予重點關注,并積極地采取針對性措施,以降低患者死亡風險。
【關鍵詞】急性StanfordA型主動脈夾層 ; 死亡 ; 危險因素
【中圖分類號】R714.252【文獻標識碼】A【文章編號】2096-3718.2023.20.0097.03
DOI:10.3969/j.issn.2096-3718.2023.20.032
急性StanfordA型主動脈夾層(acute stanford type a aortic dissection, ATAAD)是一種嚴重的心血管急癥,主要由主動脈中層的夾層血腫誘發。ATAAD患者常表現出突發劇烈刀割樣、撕裂樣疼痛,可累及心臟、消化道等多個組織器官。針對ATAAD患者,現階段臨床常選擇手術進行治療,手術的主要目的是為了預防主動脈破裂與心臟壓塞等情況發生,同時可以矯正主動脈瓣關閉不全、改善血流動力學,繼而控制患者病情。然而,經臨床實踐研究發現,部分患者即使經過規范的手術治療,術后仍然會死亡[1]。現階段,臨床并未完全了解ATAAD患者術后死亡的危險因素,故積極地了解ATAAD患者術后死亡的危險因素,并對此施以針對性的措施,對于降低死亡率意義重大。基于此,本研究回顧性分析2021年4月至2023年4月收治的125例ATAAD患者的臨床資料,探究其術后死亡的危險因素,并積極采取針對性措施,以減少患者死亡風險,現報道如下。
1 資料與方法
1.1 一般資料 回顧性分析2021年4月至2023年4月江門市中心醫院收治的125例ATAAD患者的臨床資料。納入標準:①符合《2014年歐洲心臟病學會:②主動脈疾病診斷及治療指南(部分)》 [2]中ATAAD的診斷標準;③具備手術指征,均在江門市中心醫院行手術治療;④患者病歷資料齊全。排除標準:①存在自身免疫性疾病;②妊娠或哺乳期女性;③伴有血液系統疾病;④合并傳染性疾病;⑤合并嚴重感染性疾病;⑥合并凝血功能異常;⑦伴有惡性腫瘤;⑧存在藥物依賴。本研究經醫院醫學倫理委員會批準。
1.2 研究方法 手術步驟:靜脈吸入復合麻醉,于腋動脈或股動脈建立體外循環;術中在深低溫停循環下行術中象鼻支架置入;置換主動脈弓及其部分支血管;恢復循環后置換升主動脈[3]。收集所有患者的一般資料,包括年齡(>60歲、 ≤ 60歲)、性別(男、女)、吸煙史(有、無)、飲酒史(有、無)、高血壓史(有、無)、糖尿病史(有、無)、胸腔積液(有、無)、心包積液(有、無)、術前腎功能不全(有、無)、術前心功能不全(有、無)、術前神經癥狀(有、無)、低血壓(有、無)、手術時間、體外循環時間。
1.3 觀察指標 ①統計ATAAD患者術后30 d死亡情況。②對所有ATAAD患者一般資料進行單因素分析。③將單因素分析中差異有統計學意義的指標納入多因素Logistic回歸分析,篩選ATAAD患者術后早期死亡的危險因素。
1.4 統計學方法 采用SPSS 20.0統計學軟件分析數據,計量資料經S-W法檢驗證實符合正態分布,以( x ±s)表示,采用t檢驗;計數資料以[ 例(%)]表示,采用χ2檢驗;采用多因素Logistic回歸分析,篩選ATAAD患者術后早期死亡的危險因素。以P<0.05為差異有統計學意義。
2 結果
2.1 ATAAD患者術后30 d死亡情況 125例ATAAD患者,術后30 d共有13例死亡,死亡率為10.40%(13/125)。根據死亡情況將患者分為死亡組(13例)、存活組(112例)。
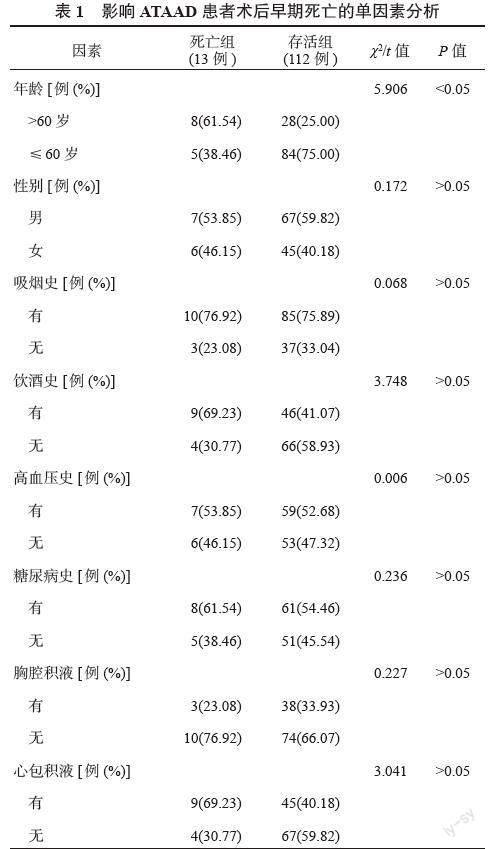
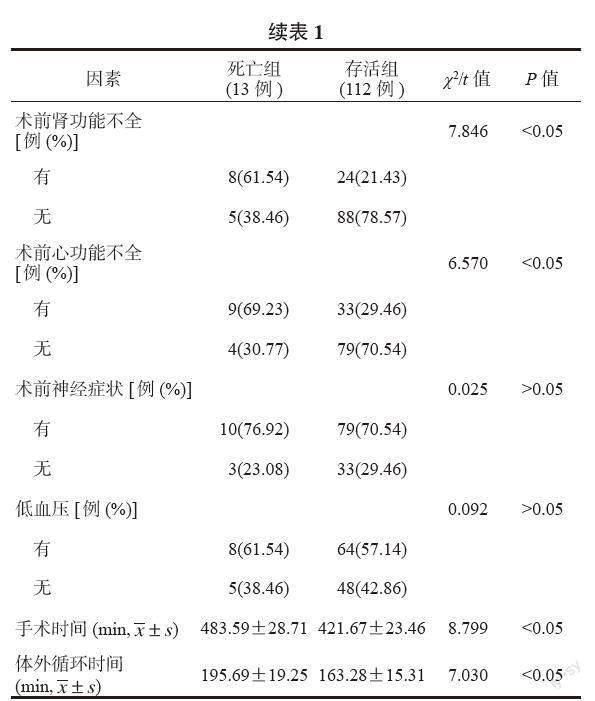
2.2 影響ATAAD患者術后早期死亡的單因素分析 死亡組中年齡>60歲、術前腎功能不全、術前心功能不全患者占比均高于存活組;手術時間、體外循環時間均長于存活組,差異均有統計學意義(均P<0.05),見表1。
2.3 影響ATAAD患者術后早期死亡的多因素Logistic回歸分析 以ATAAD患者術后早期是否死亡為因變量,以單因素分析中差異有統計學意義的指標為自變量,納入多因素Logistic回歸分析,結果顯示,年齡>60歲、術前腎功能不全、術前心功能不全、手術時間長、體外循環時間長均為ATAAD患者術后早期死亡的獨立危險因素,差異均有統計學意義(OR=4.800、5.867、5.386、7.135、6.541,均P<0.05),見表2、表3。
3 討論
ATAAD為臨床常見的心血管疾病之一,具有起病急、病情進展迅速等特征,極易危及患者的生命安全,故需采取積極的治療手段。手術為目前臨床治療ATAAD的重要方式,但因主動脈尤其是主動脈弓部周圍復雜的解剖關系,手術比較困難,尤其是對于夾層累及主動脈根部的患者,往往需要采取深低溫停循環手段,對于腦、心肌保護等要求較高,故此類患者術后仍存在較高的死亡風險[4]。因此,積極地探明ATAAD患者術后死亡的相關危險因素,施以個體化的應對措施,對于改善患者預后十分重要。
本研究結果顯示,125例ATAAD患者,術后30 d共有13例死亡,死亡率為10.40%,說明ATAAD患者在術后存在較高的死亡風險,對此臨床需給予高度重視。另外,多因素Logistic回歸分析結果顯示,年齡>60歲、術前腎功能不全、術前心功能不全、手術時間長、體外循環時間長均為ATAAD患者術后早期死亡的獨立危險因素。分析原因如下:①年齡>60歲。老年患者的自身各項器官功能處于衰退狀態,當夾層剝脫造成腎動脈受累時,將會導致腎素分泌持續上升,繼而導致血壓升高,增加死亡風險。同時,老年患者呼吸、循環等功能較年輕人明顯減弱,故其術后并發癥亦較多,由此將進一步地增加死亡風險[5-6]。②術前腎功能不全。術前腎功能不全表明夾層已累及腎動脈并出現兩側腎動脈灌注不良,由此將會對患者的血流動力學穩定性與水電解質代謝、酸堿平衡造成影響,加之手術創傷因素的影響,術后腎功能容易進一步損傷,由此增加死亡風險[7-8]。③術前心功能不全。術前心功能不全或冠狀動脈受累出現心絞痛表現,加之患者心電圖的改變,容易對病情造成誤診,從而錯失最佳治療時機,影響預后[9-10]。④手術時間長、體外循環時間長。長時間的手術與體外循環時間,會激活補體系統,導致炎癥因子過量釋放,從而增加患者術后的全身炎癥反應綜合征的發生風險,造成死亡[11-12]。因此,對于上述高危因素,可采取如下的應對措施:①對于高齡患者入院后,積極地完善各項常規檢查,密切監測其各項生命體征,嚴格控制血壓。②囑咐患者合理膳食,鼓勵其戒煙,糾正不良生活習慣。③患者入院后立即檢查有無腎功能與心功能不全、神經癥狀等情況,如有上述情況,則予以患者積極的對癥治療,以降低術后死亡風險。④合理控制手術時間及體外循環時間,如提高麻醉醫師與體外循環醫師的配合度,使用先進的外科治療手段,以降低術后死亡率。
綜上,ATAAD患者術后早期死亡的危險因素具有多樣性,如年齡>60歲、術前腎功能不全、術前心功能不全、手術時間長、體外循環時間長等。因此,臨床需對上述高危人群給予重點關注,并積極地采取針對性措施,以降低患者死亡風險。
參考文獻
[1]孫芳, 宋曉春, 陳永銘, 等. 急性Stanford A型主動脈夾層術后早期死亡因素分析[J]. 中國心血管雜志, 2020, 25(2): 156-159.
[2]王端, 張揚春, 王引利. 2014年歐洲心臟病學會: 主動脈疾病診斷及治療指南(部分)[J]. 心血管病學進展, 2014, 35(5): 617-621.
[3]張劍彬, 劉治元, 歐斌, 等. 孫氏手術治療急性Stanford A型主動脈夾層的臨床療效及安全性分析[J]. 中國心血管雜志, 2019, 24(4): 339-342.
[4]李曉南, 喬環宇, 楊波, 等. 急性Stanford A型主動脈夾層術前死亡的危險因素分析[J].心肺血管病雜志, 2020, 39(10): 1225-1229.
[5]李艷麗, 高晴云, 馮俊波, 等. Stanford A型主動脈夾層手術死亡風險因素分析[J]. 中華全科醫學, 2022, 20(1): 18-21, 103.
[6]楚軍民, 衛金花, 常謙, 等. Stanford A型主動脈夾層術后死亡和嚴重并發癥的危險因素[J]. 中國胸心血管外科臨床雜志, 2017, 24(3): 211-216.
[7]李田江, 王莽原, 霍強. 急性Stanford A型主動脈夾層術后患者院內早期死亡危險因素分析[J]. 中國胸心血管外科臨床雜志, 2021, 28(12): 1447-1454.
[8]邢暢暢, 王毅. Standford A型主動脈夾層術后早期死亡危險因素分析[J]. 國際心血管病雜志, 2023, 50(1): 52-56.
[9]李小軍, 劉戈, 孟金金, 等. Stanford A型主動脈夾層術后早期死亡因素分析[J]. 蚌埠醫學院學報, 2021, 46(10): 1372-1375.
[10]左文霞, 胡藝蘭, 宋來春, 等. 急性Stanford A型主動脈夾層患者術后早期發生全身炎癥反應綜合征的危險因素分析及其對預后的影響[J]. 中國心血管病研究, 2023, 21(2): 182-187.
[11]楊志剛, 羅進光. 急性Stanford A型主動脈夾層術后早期死亡危險因素及nomogram模型構建[J]. 中國循證心血管醫學雜志, 2021, 13(7): 799-802.
[12]潘興納, 蒲磊, 梁榮鑫, 等.急性Stanford A型主動脈夾層術后死亡的危險因素分析[J].中國現代藥物應用, 2022, 16(22): 1-4.

