RHO 分子篩空分性能評價
夏海月,胡云峰,包強,孫鵬來,王博萱,梁丹
(東北石油大學 化學化工學院,黑龍江 大慶 163318)
空氣是寶貴的自然氣體資源,其中氮氣和氧氣應用于眾多工程以及制造業,這使得空分在商業上具有重要意義[1]。N2與O2的動力學直徑僅相差0.18?,通常從空氣中將二者分離是利用低溫蒸餾技術,但在冷卻和壓縮空氣的過程中伴隨著高成本的能耗[2]。20世紀70年代變壓吸附(PSA)技術的出現[3],使空氣分離過程變得更加經濟。此外,選取合適的吸附劑也會對吸附分離空氣產生較大的影響。
目前,用于空分的多孔材料分為兩類,即N2選擇性吸附劑和O2選擇性吸附劑。工業上,一些N2選擇性多孔材料如5A 沸石和13X 沸石在PSA空分領域得到了廣泛的研究[4-6]。CHAO[7]等首次發明的Li-LSX 沸石因極化率較大的Li+與具有較高四極矩的N2相互作用,從而獲得了更高的N2吸附容量。YANG[8]等以純Ca-LSX 為例進行研究,發現其N2吸附能力比Li-LSX 更強。但考慮到空氣中N2的體積分數是O2的4倍,如果使用O2選擇性吸附劑,它所需要的工作量是用N2選擇性吸附劑進行相同分離所需要工作量的四分之一[9],可使空分中吸附劑用量最小化。特別是在純N2生產中,可以減少設備投資和能耗。因此,開發具有氧選擇性的吸附劑可以顯著地滿足商業需求。實際上,應用4A 沸石和碳分子篩(CMS)進行空分制氮的工藝已經相對成熟。這類吸附劑進行空氣分離是基于動力學分離的原理,利用混合組分的擴散、吸附速率差來實現的[10-11]。堿金屬離子交換的RHO分子篩是一類新型O2選擇性吸附劑,它是基于分子篩篩分效應對動力學直徑小的O2進行擇形吸附,從而實現空氣分離。
RHO分子篩是一種雙八元環均勻地連接在α籠上的小孔合成沸石,孔道尺寸(3.6 ?×3.6 ?)介于N2和O2的動力學直徑之間[12-13]。RHO結構內有帶負電荷的硅鋁酸鹽骨架,外有帶正電荷的骨架外陽離子,這些框架外陽離子可以優先分布在3個位點上:單八元環(s8r)、雙八元環(d8r)和單六元環(s6r),如圖1所示[14]。

圖1 RHO分子篩籠內陽離子位點
1 實驗部分
1.1 試劑與儀器
主要試劑:18-冠醚-6、氫氧化鈉、氫氧化銫、偏鋁酸鈉,純度≥98%,上海阿拉丁生化科技股份有限公司;硅溶膠,堿性30%,青島海洋化工廠;硝酸鋰、氯化銫 ,純度99%,上海阿拉丁生化科技股份有限公司;硝酸鈉 ,純度≥98.5%,北京化工廠;硝酸鉀,純度99%,遼寧市華東試劑廠;氮氣、氧氣,純度≥99.9%,大慶雪龍石化技術開發有限公司。
主要儀器:電子天平,M204,梅特勒-托利多儀器有限公司; DF-101S 集熱式恒溫加熱磁力攪拌器,上海羌強儀器設備有限公司;動態晶化烘箱;202-1A 電熱恒溫干燥箱,天津是泰斯特儀器有限公司;X 射線衍射儀,DMAX-2000 型,丹東通達科技有限公司;掃描電子顯微鏡,JEX-636OLA,日本JEOL 公司;高溫高壓氣體吸附儀,3H-2000PH,貝士德儀器科技有限公司。
1.2 實驗方法
1.2.1 Na,Cs-RHO 的合成
向燒杯中分別加入有機模板劑18-冠醚-6、去離子水、氫氧化銫和氫氧化鈉,攪拌至完全溶解,然后向上述混合物中加入硅溶膠,繼續在室溫下陳化24 h 得到n(NaO2)∶n(CsO2)∶n(Al2O3)∶n(SiO2)∶n(18-C-6)∶n(H2O)=1.5∶0.8∶3∶25∶0.2∶100 的均勻凝膠[15]。將凝膠轉移至高壓反應釜中,然后在110 ℃的動態晶化箱中晶化96 h。反應停止后將產物抽濾,洗滌,100 ℃干燥12 h。最后放置在550 ℃的馬弗爐中焙燒4 h,得到無水分以及模板劑的原粉Na,Cs-RHO 分子篩。
1.2.2 離子交換
在80 ℃水浴溫度下,將3 g 分子篩原粉與150 mL 0.2 mol·L-1的M(NO3)x(M 代表Li+、Na+、K+和Cs+)進行混合并持續加熱攪拌2 h,分別制備出Li-RHO、Na-RHO、K-RHO 和Cs-RHO。將上述樣品洗滌,抽濾,然后100 ℃干燥12 h,再完成一次以上流程即可得到離子交換形式的 RHO 分子篩[16]。
1.2.3 結構表征
使用內部配有Cu 靶Kα 輻射光源的X 射線衍射儀采集了所有RHO 樣品在2θ=5°~55°范圍內的衍射數據,然后根據XRD 譜圖中衍射峰的位置和強度確定樣品的晶體結構。用掃描電子顯微鏡(SEM)對樣品的晶體形貌進行表征。
1.3 吸附劑性能評價
吸附等溫曲線測定:取1 g 樣品,使用高溫高壓氣體吸附儀測定25 ℃時0~1 000 kPa 壓力下的單組分氣體吸附容量。以壓力為橫坐標、吸附容量為縱坐標繪制吸附等溫曲線,并利用Langmuir 模型方程對曲線進行擬合。
Langmuir 模型方程[17]:
式中:q—吸附劑的吸附容量,mmol·g-1;
qm—吸附劑的飽和吸附容量,mmol·g-1;
p—吸附壓力,kPa;
b—Langmuir 參數。
分離性能參數S:
式中:i—純組分O2;
j—純組分N2;
Δq—對應組分的工作容量,mmol·g-1。
2 結果與分析
2.1 表征分析
2.1.1 X 射線衍射光譜分析
XRD 是測定沸石晶體結構最常用的分析方法,沸石的衍射峰強度可以判斷沸石的結晶度。通過將每個樣品的特征吸收峰強度和位置與標準卡片對照,可以確認沸石合成的準確性。
所有RHO 樣品的XRD 譜圖如圖2 所示,與標準譜圖(PDF#27-0015)的特征峰完全一致,衍射角度2θ均在8.32°、14.42°、18.66°、25.19°、27.85°、30.32°、33.73°、35.87°處呈現RHO 結構的特征峰。盡管陽離子交換后的RHO 分子篩衍射峰強度與Na,Cs-RHO 相比稍弱,但交換后的RHO 沸石衍射峰的衍射角并沒有發生改變,所以陽離子交換并沒有改變分子篩的骨架結構。

圖2 RHO 分子篩XRD 圖
2.1.2 掃描電鏡分析
通過掃描電子顯微鏡對沸石的形貌和尺寸進行分析,圖3 呈現了每個樣品SEM 圖像。從圖像中可以清楚地看到完整的球形晶體顆粒,顆粒尺寸約為1~2μm。在進行陽離子交換后,顆粒形貌依然完整,觀察到分子篩表面微微地被腐蝕,結晶度略低于Na,Cs-RH O。雖然陽離子的引入對結晶度有一定影響,但RHO晶體結構并沒有坍塌,這與XRD 結果一致。

圖3 RHO 分子篩SEM圖
2.2 純組分吸附分離評價
測定單組分氣體的吸附等溫線,來評價不同堿金屬陽離子交換的RHO分子篩的O2/N2分離能力。298K 時0~1000kPa 下分別測定Na,Cs-RHO、Li-RHO、Na-RHO、K-RHO和Cs-RHO對O2和N2的吸附等溫線,如圖4所示。所有實驗吸附數據均采用Langmuir 模型擬合,擬合參數見表1。分離性能參數是衡量混合氣體分離性能的一個重要指標,因此利用Langmuir 模型擬合的吸附數據對分離性能參數進行計算,以便于更精準地對不同樣品進行評價。

圖4 所有RHO分子篩對O2和N2的吸附等溫線

表1 Langmuir模型擬合單組分O2和N2在RHO分子篩上的吸附等溫線以及O2/N2分離性能參數
吸附測試結果表明,原粉Na,Cs-RHO的N2飽和吸附容量明顯高于O2,而通過4種堿金屬陽離子交換的RHO分子篩則體現出對O2的擇形吸附。一般情況下,分子篩主要根據2種吸附分離機理對不同組分進行選擇性吸附[18],其一是擇性吸附,當動力學尺寸小的吸附質分子均可通過沸石孔道時,選擇性吸附主要體現在吸附質分子之間的四極矩、極化率和偶極矩的差異導致與分子篩產生不同強度的作用,分子極性越強越易被吸附;其二是擇形吸附,指的是吸附質分子的動力學尺寸小于沸石孔徑并且形狀適宜,可以自由地擴散到沸石內部,而其它尺寸較大的分子被限制在外面,這是一種尺寸篩分效應[19]。Na,Cs-RHO主要是擇性機理占主導地位,通過對其吸附等溫結果分析,直徑小的兩種分子均可通過Na,Cs-RHO沸石孔道,因此O2和N2的飽和吸附容量較高。
O2和N2的氣體物理參數如表2所示。由表2可知,O2和N2的極化率相似,N2的四極矩是O2的4 倍,因而高的N2飽和吸附容量是Na,Cs-RHO沸石的場梯度與N2的四極矩發生強相互作用的結果。

表2 O2和N2的氣體物理參數
分析圖4 和表1 的數據發現4 種堿金屬陽離子交換的RHO 分子篩對O2和N2的吸附分離機理改變,擇形吸附使得它們的O2飽和吸附容量均高于N2,并且 O2的飽和吸附容量由大到小順序為K-RHO、Na-RHO、Cs-RHO、Li-RHO。由于RHO分子篩原粉中存在一定數量的Na+和Cs+,理論上當交換比它們半徑小的陽離子后,動力學尺寸小的吸附質分子的飽和吸附容量應該增加,反之減少。然而事實并非如此,Li-RHO 和K-RHO 對O2飽和吸附容量出現明顯反常,這可能是由于RHO 的有效孔徑變化不僅與引入的陽離子半徑有關,而且陽離子在分子篩框架中占據的位置也起到決定性的作用。已有研究表明,Li+優先占據s6r位點,Na+優先占據s8r位點,K+優先占據s8r和d8r位點,Cs+優先占據d8r位點[12,20]。RHO 分子篩框架中引入Li+后,沒有與s8r和d8r窗口位置的Na+和Cs+交換,而是直接作用在α 籠內的s6r位點,此時需要電荷平衡這個位點,因而分子篩框架會發生扭曲導致形變,從而使Li-RHO 的窗口有效孔徑明顯減小,擇形性明顯增加。當RHO 分子篩框架中引入K+后,K+同時與s8r位點的Na+和d8r位點的Cs+交換。另外,據K-RHO 對O2和N2的飽和吸附容量數據分析,K+與半徑更大的Cs+交換的數量可能多于Na+,所以導致RHO 分子篩的窗口有效孔徑明顯增大,O2和N2的飽和吸附容量均增加,同時伴隨著O2/N2分離性能參數急劇下降。
2.3 混合組分分離評價
2.3.1 Aspen Adsorption 模擬穿透曲線
一般的O2選擇性吸附劑依據混合組分的擴散、吸附速率差進行分離。因此為了將Li-RHO 分子篩與4A 沸石和碳分子篩(CMS)等傳統O2選擇性吸附劑進行比較,本研究借助Aspen Adsorption 軟件模擬了空氣在3 種吸附劑上的穿透曲線,見圖5。原料氣由79%N2/21%O2組成,進料溫度為298.15 K,吸附壓力為2 bar,解吸壓力為0.3 bar,進料流量為0.4 m3·h-1。
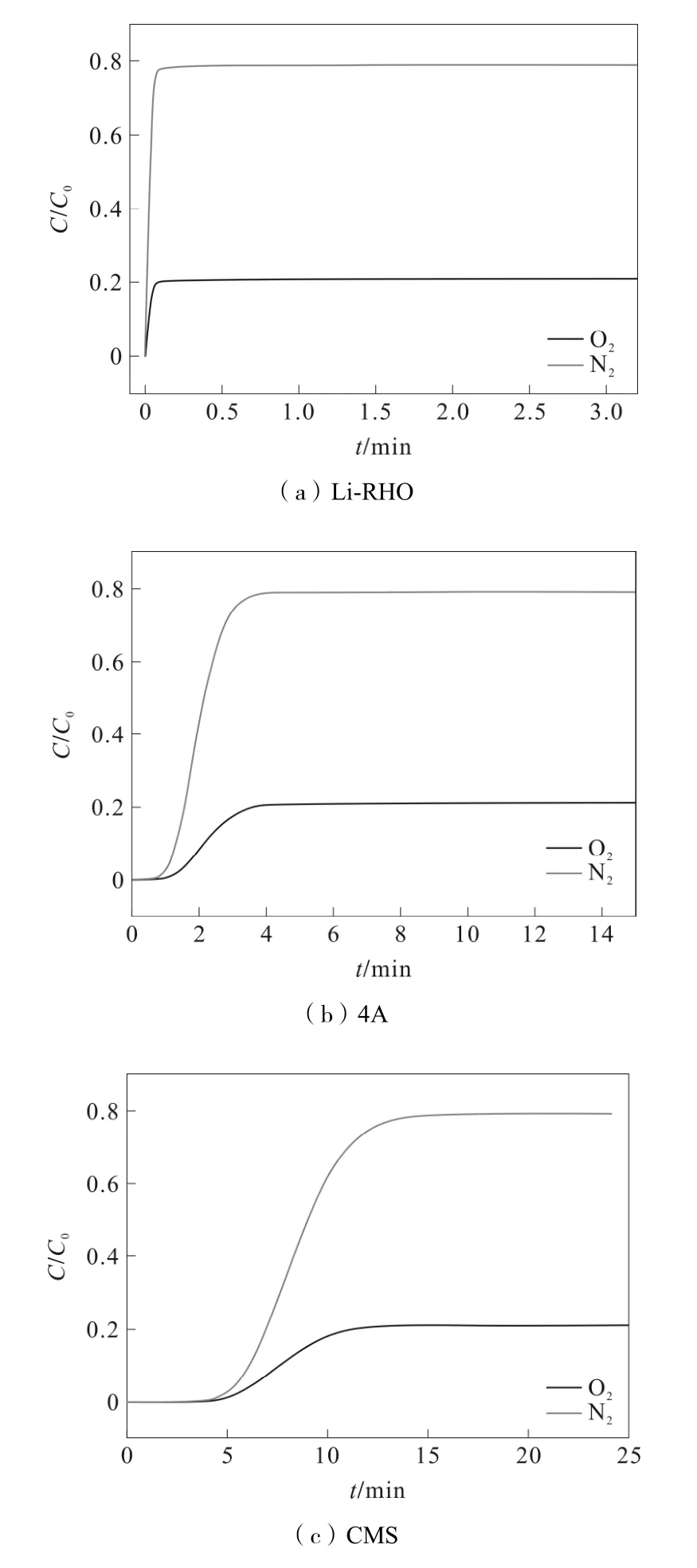
圖5 O2/N2混合組分在3 種分子篩上的穿透曲線
由圖5 可知,弱吸附組分(N2)優先穿透吸附床層,O2因強吸附而后穿出。隨著吸附劑孔徑尺寸的增加,混合組分吸附容量增加,擴散速率減小,因此穿透時間較長。根據混合氣在3 種吸附劑上的穿透曲線,計算了每一組分的擴散速率以及混合組分的動力學分離因子,如表3 所示。

表3 O2/N2混合組分在3 種分子篩上的動力學分離性能
由表3 可知,Li-RHO 的O2和N2擴散速率最小,說明它們的吸附容量不高,但O2/N2分離因子最大,充分體現了Li-RHO 分子篩的有效孔徑對O2的選擇性。這一結果與Li-RHO 的擇形吸附分離機理完全吻合,實驗表明Li-RHO 可能是一種很有應用前景的空分吸附劑。
2.3.2 Aspen Adsorption 模擬雙塔PSA 空氣分離工藝
為了進一步評價Li-RHO 分子篩的性能,再一次借助Aspen Adsorption 軟件進行雙塔PSA 空氣分離模擬,原料氣的組成以及實驗條件同上。將雙塔PSA 空分制氮的能耗、純度和回收率作為評價3 種O2選擇性吸附劑的指標,為了便于比較,將N2的純度最高優化至91%~92%,表4 呈現了模擬結果。實驗表明,3 種吸附劑制得相似純度的N2時,所消耗的能量相近,其中Li-RHO 的N2回收率為95.79%,明顯高于4A 沸石和CMS。此模擬結果進一步驗證Li-RHO 可能是一種新穎的空分吸附劑。

表4 Aspen Adsorption 雙塔PSA 空分模擬結果
3 結 論
Li+交換改性后的RHO 分子篩仍保持原有結構以及晶體形貌。吸附等溫曲線和穿透曲線均體現了Li-RHO 分子篩對O2的擇形吸附作用,O2/N2的分離選擇性參數最大,主要由Li+占據特定的位點使分子篩框架扭曲所致。另外,Aspen Adsorption 軟件模擬Li-RHO 雙塔PSA 空分制得的N2回收率超過已經工業化的CMS。

