蘋果B型細胞分裂素響應因子MdARR11對干旱脅迫的抗性分析
徐蘇蕊 趙文哲 鞏星遙 李 玲,* 肖 偉,*
(1山東農業大學園藝科學與工程學院,山東 泰安 271018;2山東果蔬優質高效生產協同創新中心,山東 泰安 271018)
細胞分裂素(cytokinin,CTK)作為植物生長發育過程中不可或缺的經典激素之一,在植物中的信號傳導由雙組分系統(two-component system,TCS)介導[1]。在擬南芥中,該系統包括細胞分裂素受體組氨酸激酶(Arabidopsis histidine kinase,AHK)、組氨酸磷酸轉移蛋白(Arabidopsis histidine phosphotransfer protein,AHP)以及A 型和B 型反應調節因子(Arabidopsis response regulator,ARR)[2-3]。目前研究表明,細胞分裂素的合成、運輸及信號傳導均受干旱脅迫的影響[4]。
B 型ARRs 作為細胞分裂素信號轉導的正響應因子,在調控植物生長過程中發揮作用。模式植物擬南芥(Arabidopsisthaliana)突變體arr1、arr2、arr10和arr12中均表現為分生障礙和芽再生能力降低[4-6]。研究表明,三重突變體arr1、10、12對細胞分裂素不敏感,且生長受到明顯抑制[7-8]。同時arr1、10、12能夠激活WUS的表達并抑制生長素生物合成基因YUCCAs(YUCs)的表達,從而控制芽再生[9]。隨后在其他植物中也證實了ARRs能夠參與調控植物生長,如RR13能在楊樹(PopulusL.)韌皮部特異性表達,刺激形成層活性的非細胞自主調節[10]。相關研究表明,ARRs能夠在調控根系發育過程中發揮作用。ARR12能夠與PLT(PLETHORA)發生拮抗作用,影響擬南芥根系分生組織的發育[11]。ARR16和ARR17能夠在CTK介導的擬南芥根系促水反應中發揮重要作用[12]。CcRR5通過與克萊門氏小柑橘(C.clementina)中的CcRR14和蔗糖非發酵-1-相關蛋白激酶2(sucrose nonfermenting-1-related protein kinases 2)相關基因CcSnRK2s相互作用,調控根的形態發生[13]。同時,ARRs 也能夠在調控花發育及配子體中發揮作用。ARR10、12、18作用于CKI1 的下游以維持雌配子體的極性[14]。MdRRB11能夠正向參與CTK對蘋果花的誘導[15]。此外,B型ARRs還參與了植物對非生物脅迫響應的應答。TaARR1能夠增強小麥(TriticumaestivumL.)對氮的吸收和同化[16]。B 型細胞分裂素的響應因子ARR1、10、12與有絲分裂原蛋白激酶(mitogen-activated protein kinase)相關蛋白MPK3/6 互作,促進自身磷酸化從而負調控植物耐鹽性[17]。擬南芥arr1、10、12突變體具有明顯的抗旱表型[18]。arr1、11、12三重突變體通過拮抗ABA信號通路,調節植物對干旱脅迫的響應[19]。但在蘋果中,ARR11如何參與非生物脅迫響應仍鮮有報道。
干旱脅迫是農業生產上面臨的主要逆境脅迫[20]。蘋果作為我國農業的支柱產業之一,干旱脅迫通過影響果樹的生長發育,降低果實的產量和品質,嚴重制約我國蘋果產業的發展,增強蘋果對干旱脅迫的耐受性對蘋果產業的發展具有重要意義。因此,本研究通過聚合酶鏈式反應(polymerase chain reaction,PCR)擴增技術獲得MdARR11基因,對比MdARR11與擬南芥等8種不同物種ARR11蛋白序列,分析MdARR11基因在嘎拉蘋果不同組織相對表達量,進一步研究干旱處理(20%PEG6000)下MdARR11基因在嘎拉3 蘋果中的表達水平。通過遺傳轉化,獲得了過表達MdARR11蘋果愈傷組織,并對MdARR11進行抗旱性鑒定,旨在進一步探索B 型細胞分裂素響應因子MdARR11 參與干旱脅迫響應的機理,從而為篩選抗旱品種提供理論參考。
1 材料與方法
1.1 試驗材料
組織特異性表達分析的材料為十年生嘎拉蘋果(MalusdomesticaBorkh.cv.Gala)樹,取自山東農業大學國家蘋果工程技術中心果樹試驗站。干旱處理的蘋果材料為嘎拉3 蘋果組培苗;愈傷材料為王林(Malus domesticaBorkh.Orin)蘋果愈傷組織,均為山東農業大學園藝科學與工程學院設施果樹實驗室保存。遺傳轉化過程中使用的大腸桿菌DH5α 感受態細胞、農桿菌GV4404菌株均購于上海唯地生物技術有限公司。
1.2 試驗方法
1.2.1MdARR11的克隆與進化樹的構建 從GDR(https://www.rosaceae.org/)比對獲得序列號為MD13G1108300 的基因序列,將其命名為MdARR11。根據互補脫氧核糖核酸(complementary DNA,cDS)序列,以嘎拉3 蘋果cDNA 為模板,設計特異引物(表1),PCR 擴增獲得MdARR11基因全長序列。PCR反應體系為25 μL:2×Phanta?Master Mix 12.5 μL,cDNA 2.5 μL,10 μmol·L-1上下游引物各1 μL,蒸餾水補至25 μL。PCR 反應程序為:95 ℃預變性3 min;95 ℃變性30 s;60~65 ℃退火20 s;72 ℃延伸2 min,34 個循環;72 ℃終延伸5 min。對PCR 結果進行電泳檢測,然后用DNA 回收試劑盒(北京天根)對電泳產物進行回收。從NCBI數據庫(http://www.ncbi.nlm.nih.gov/BLAST/)中比對并下載MdARR11的同源基因。使用MEGA 7.0軟件構建進化樹。
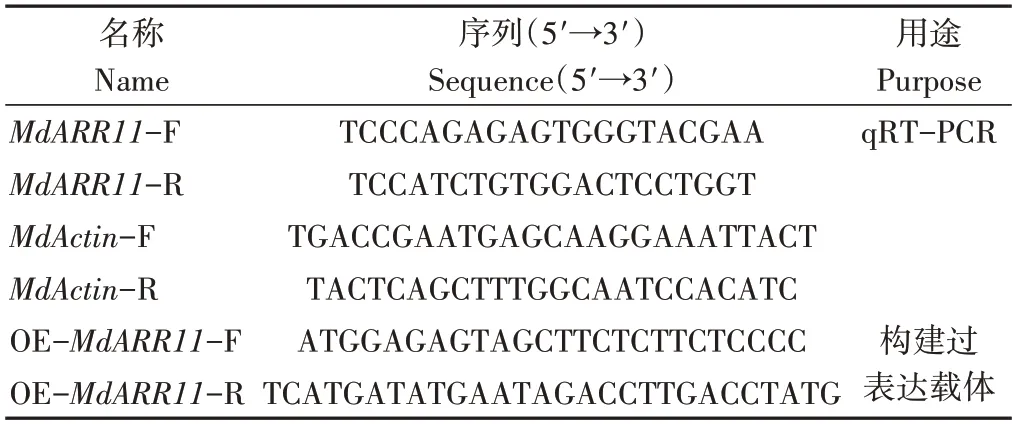
表1 引物信息Table 1 Primer information
1.2.2 MdARR11的理化性質及蛋白結構分析 使用ExPASy 網站(https://web.expasy.org/compute_pi/)分析MdARR11的理化性質。使用NCBI CD-Search(https://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)分析MdARR11 的蛋白結構域。使用PlantCARE(http://bioinformatics.psb.ugent.be/webtools/plantcare/html)檢測MdARR11的順式作用元件。
1.2.3 過表達載體構建和蘋果愈傷組織遺傳轉化 將1.2.1 中得到的目的基因連接過表達載體pBI121::GFP,轉化DH5α 感受態細胞,PCR 鑒定陽性克隆單菌落,送生工生物工程(上海)股份有限公司進行測序。得到的質粒轉化農桿菌GV4404,將繼代10 d左右長勢良好的蘋果愈傷組織與轉化好的農桿菌在室溫孵育20 min,用無菌紗布過濾、無菌濾紙吸干愈傷組織表面的菌液,后平鋪在無抗繼代板上,25 ℃黑暗培養3 d。然后將愈傷組織轉移至抗性繼代板(繼代培養基+100 mg·L-1卡那霉素+250 mg·L-1頭孢霉素),PCR驗證陽性轉基因愈傷組織,后將得到的轉基因愈傷組織在抗性繼代板繼代2代以上,用于后續試驗。
1.2.4 組織特異性及干旱脅迫試驗設計 取十年生嘎拉蘋果的根、莖、葉、花、果皮和果肉,所取樣品置于液氮速凍,后儲存在-80 ℃超低溫冰箱備用。取繼代培養1 個月左右生長狀態良好且長勢一致的嘎拉3 蘋果組培苗用于生根處理[MS培養基+1 mg·L-1吲哚-3-乙酸(indole-3-acetic acid,IAA),pH 值為5.8~6.0],使用含有20%聚乙二醇6000(PEG6000)的Hoagland營養液水培處理組培苗,于0、1、3、6、9、12、24 h后取幼嫩葉片置于液氮速凍,提取RNA進行反轉錄。利用實時熒光定量PCR(quantitative real-time PCR,qRT-PCR)對MdARR11進行干旱處理的表達水平分析。將繼代培養15 d左右生長狀態良好、長勢一致的野生型及過表達愈傷組織團成大小一致的小球。以繼代培養基(MS 培養基+1.5 mg·L-12,4-D+0.4 mg·L-16-BA)作為對照,處理組在繼代培養基中加入6% PEG6000。25 ℃條件下黑暗培養15 d,取樣拍照。所有材料至少取3個重復。
1.2.5 RNA 的提取及qRT-PCR 分析 使用RNAprep Pure 總RNA 提取試劑盒[天根生化科技(北京)有限公司]提取嘎拉蘋果不同組織、嘎拉3蘋果葉片以及愈傷組織總RNA。
以提取的RNA 為模板,用HiScript Ⅱ 1st Strand cDNA Synthesis Kit(+gDNA wiper)試劑盒(南京諾唯贊生物科技股份有限公司)進行反轉錄,以MdActin(GenBank:CN938024)作為內參(表1),使用Ultra SYBR One Step RT-qPCR Kit 試劑盒(江蘇康為世紀生物科技股份有限公司)進行實時熒光定量qRT-PCR 分析,最后采用Ct(2-ΔΔCT)法分析數據。
1.2.6 生理指標的測定 用電導率儀測定蘋果愈傷組織的相對電導率;采用硫代巴比妥酸法測量丙二醛(malonaldehyde,MDA)的含量[21];使用考馬斯亮蘭G-250 法檢測可溶性蛋白的含量[22];使用酸性茚三酮法檢測游離脯氨酸的含量[22];采用相應試劑盒(蘇州科銘生物科技有限公司)分別測定超氧化物歧化酶(superoxide dismutase,SOD)、過氧化物酶(peroxidase,POD)、過氧化氫酶(catalase,CAT)的活性。
1.3 數據處理
每組試驗至少進行3 個生物學重復,數據統計進行3 次重復。采用Excel 2016 進行數據處理,采用GraphPad Prism 6.01進行作圖,采用SPSS 25對數據進行顯著性和差異性分析(P<0.05)。
2 結果與分析
2.1 MdARR11的克隆及同源性分析
以蘋果嘎拉3 的cDNA 為模板,設計引物(表1)進行PCR 擴增,獲得一條長度為2 248 bp 的MdARR11基因片段。
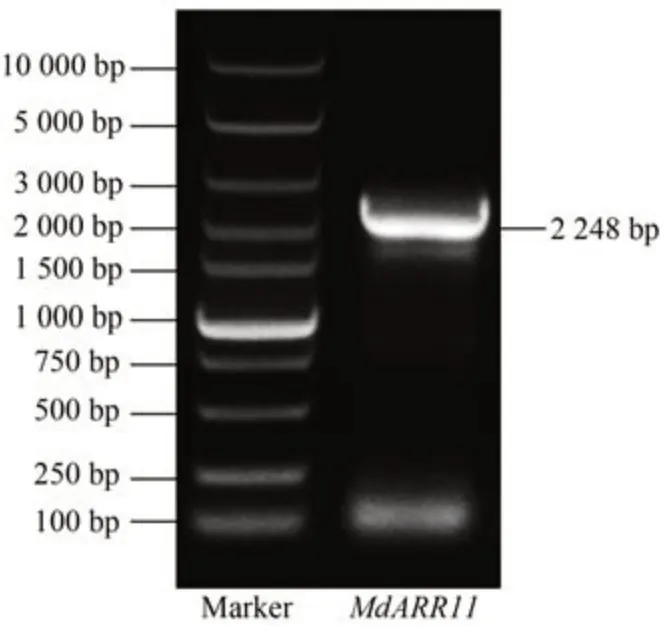
圖1 MdARR11基因PCR擴增Fig.1 PCR production of MdARR11
為研究MdARR11 的親緣關系,將蘋果MdARR11的蛋白序列與白梨(Pyrusbretschneideri)、擬南芥(Arabidopsisthaliana)、月季(Rosachinensis)、野草莓亞種(Fragariavescasubsp.Vesca)、桃(Prunuspersica)、甜杏(Prunusdulcis)、甜櫻桃(Prunusavium)、野大豆(Glycinesoja)8 種不同物種的ARR11 的蛋白序列以及擬南芥AtARR11同源基因AtARR1、ARR10、ARR12的蛋白序列進行比對分析并構建進化樹。由圖2 可知,蘋果MdARR11與白梨PbARR11的親緣關系最近。
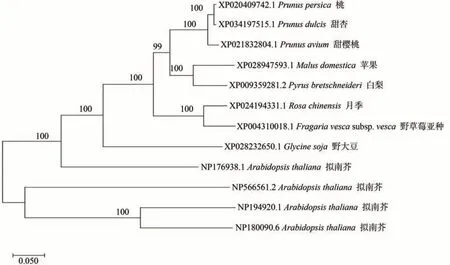
圖2 蘋果MdARR11與其同源基因的進化樹分析Fig.2 Phylogenetic tree analysis of MdARR11 in apple and its homologous genes
2.2 MdARR11蛋白結構以及啟動子順式作用元件分析
用ExPASy 對MdARR11進行理化性質分析,結果顯示MdARR11 編碼613 個氨基酸,相對分子量為68 726.21 kDa,等電點為5.85。對MdARR11蛋白的保守結構域分析,發現在第19~133 位含有1 個typeBARR-like 磷酸接收結構域(receiver domain,REC),第198~251 位含有一個MYB-like DNA 結合域(圖3),表明MdARR11屬于B 型細胞分裂素響應因子。將MdARR11 與白梨、擬南芥等不同物種的ARR11 氨基酸序列進行比對進一步確定,結果如圖4所示。

圖3 MdARR11蛋白的保守結構域Fig.3 Conserved domains of MdARR11 protein

圖4 MdARR11與不同物種的ARR11氨基酸序列比對Fig.4 Comparison of amino acid sequences between MdARR11 and different species of ARR11
使用PlantCARE 分析MdARR11轉錄起始位點上游1 500 bp 序列中的順式作用元件,發現該基因啟動子包含脫落酸響應元件、光響應元件,還包括厭氧誘導、低溫響應和干旱誘導等脅迫應答元件(表2)。推測MdARR11可能參與植物生長發育、干旱脅迫等反應。
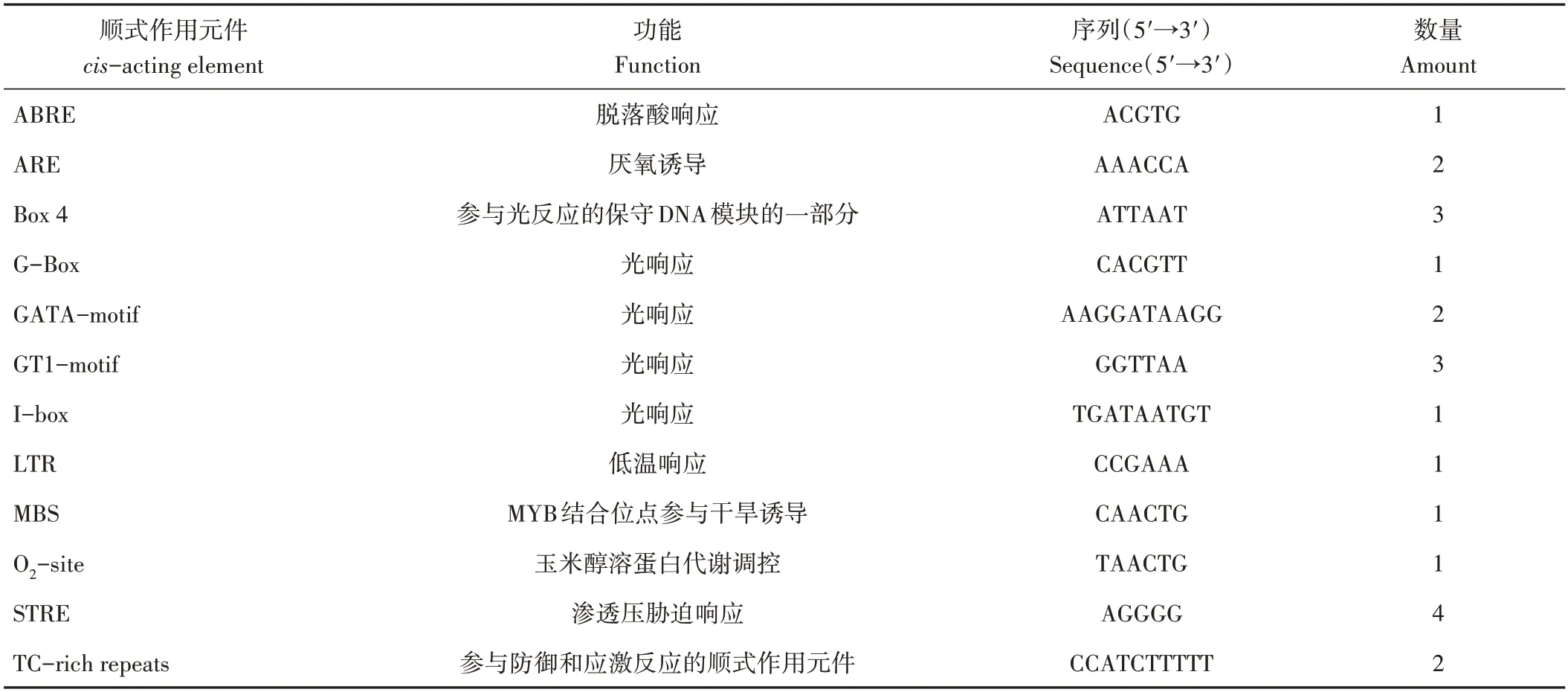
表2 MdARR11啟動子的區域順式作用元件Table 2 The cis-acting elements in promoters of MdARR11
2.3 MdARR11對干旱脅迫的響應
為了驗證MdARR11是否響應干旱脅迫,使用20%PEG6000模擬干旱處理嘎拉3蘋果幼苗。qRT-PCR 分析結果表明,干旱處理后,MdARR11基因表達水平受到抑制,呈現先降低后升高趨勢(圖5)。在處理6 h 后MdARR11基因表達水平達到最低值,與0 h 相比差異顯著,隨著PEG 處理時間的延長,MdARR11基因表達水平逐漸恢復,但仍顯著低于0 h。以上結果表明MdARR11響應干旱脅迫。
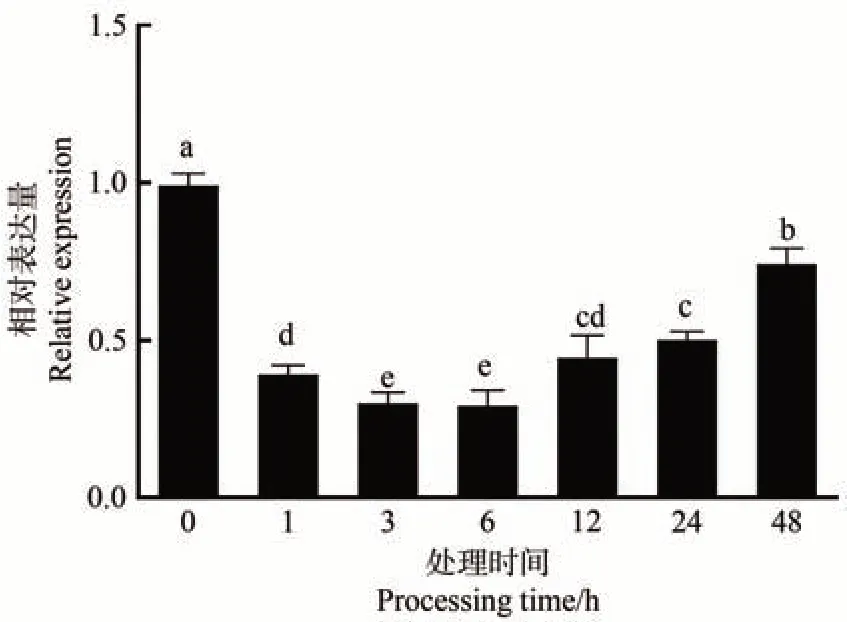
圖5 MdARR11對干旱脅迫的響應模式Fig.5 The expression patterns of MdARR11 under drought stress
2.4 MdARR11表達模式分析
利用qRT-PCR 分析MdARR11在嘎拉蘋果不同組織中的表達水平,結果表明,MdARR11基因在嘎拉蘋果不同組織中均能檢測到表達,其中在莖中表達量最高,在果皮和果肉中的表達量次之,在根中表達量最低(圖6)。以上結果表明,MdARR11可能通過多種器官的協同作用參與干旱脅迫。
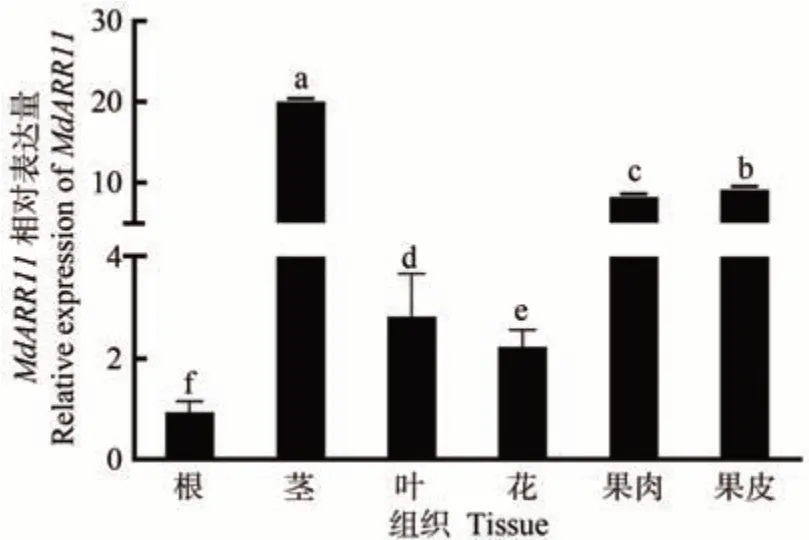
圖6 MdARR11在蘋果不同組織中的表達分析Fig.6 Expression analysis of MdARR11 in different tissues of apple
2.5 MdARR11轉基因蘋果愈傷組織的鑒定
為了進一步探究MdARR11在干旱脅迫中的作用,構建過表達載體MdARR11-pBI121-GFP,通過農桿菌介導法侵染蘋果愈傷組織,獲得了過表達MdARR11蘋果愈傷組織。PCR 結果表明,在過表達愈傷組織中檢測到目的條帶(圖7-A),而在野生型愈傷組織中未見目的基因條帶。qRT-PCR 結果表明,過表達愈傷組織中MdARR11基因的相對表達量與野生型相比差異極顯著,其MdARR11基因的表達量是野生型愈傷的7.62倍(圖7-B)。以上結果表明,MdARR11-pBI121-GFP 成功轉入愈傷組織中。
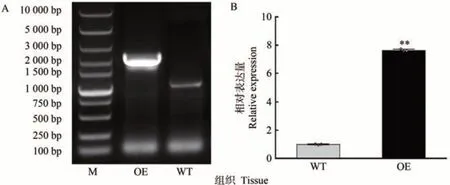
圖7 MdARR11轉基因蘋果愈傷DNA鑒定和定量檢驗Fig.7 Identification and quantitative testing of MdARR11 in transgenic apple calli
2.6 干旱脅迫下MdARR11 轉基因愈傷中滲透調節物質和膜脂過氧化產物含量的變化
選擇繼代培養后10 d生長狀態良好且大小一致的轉基因和野生型愈傷組織轉到新的繼代培養基上作為對照組,轉移到含有6% PEG6000 的繼代培養基上作為處理組,25 ℃下黑暗培養12 d。PEG 模擬干旱脅迫下,轉基因和野生型愈傷組織的生長均受到抑制,其中轉基因愈傷組織的生長勢明顯弱于野生型(圖8-A),鮮重顯著低于WT(圖8-B);脯氨酸和可溶性蛋白的積累量極顯著低于WT(圖8-E、F),而相對電導率和MDA 的含量顯著或極顯著高于WT(圖8-C、D)。上述結果表明,過表達MdARR11會加重干旱脅迫造成的脂膜過氧化損傷,同時減少滲透調節物質的積累。
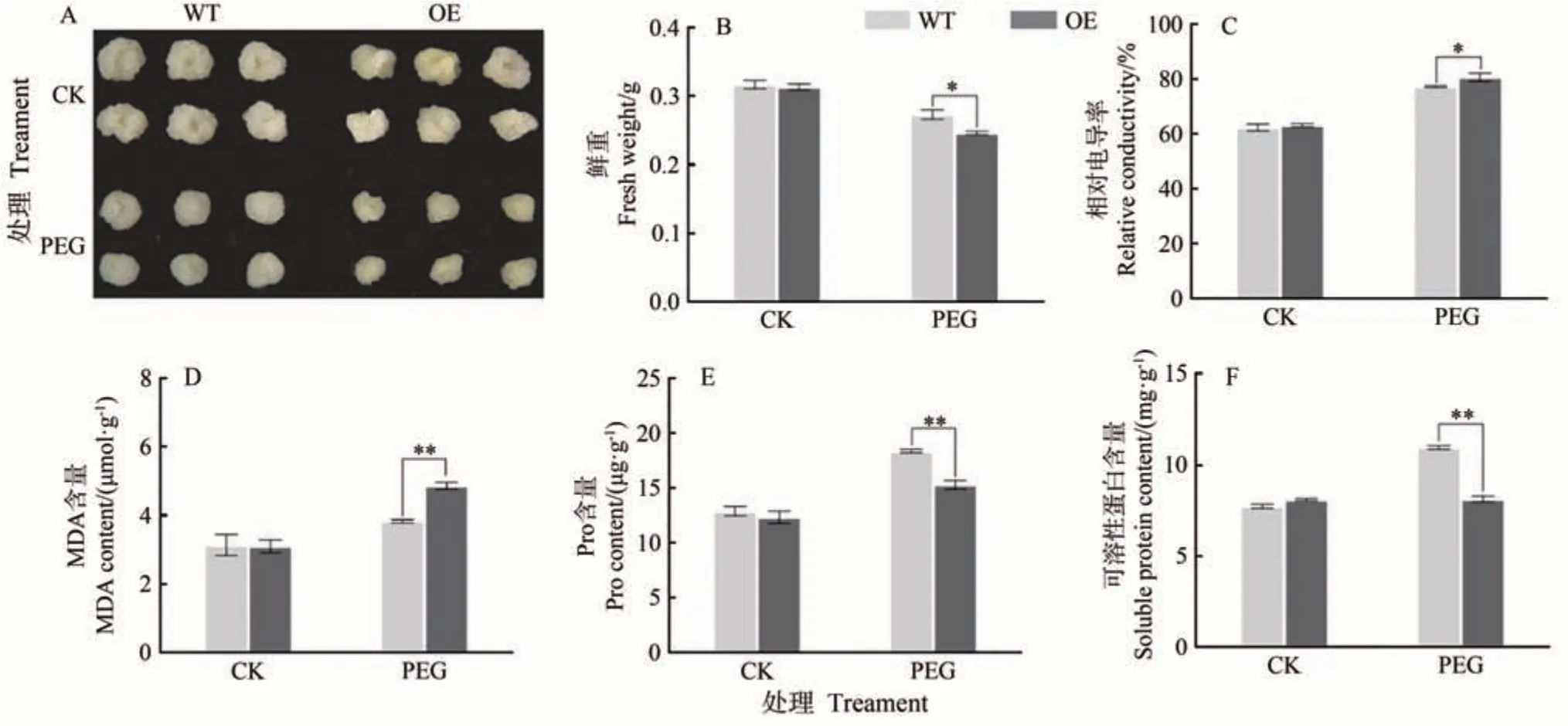
圖8 干旱脅迫處理WT和MdARR11轉基因蘋果愈傷Fig.8 WT and transgenic MdARR11 apple calli under drought stress
2.7 干旱脅迫下MdARR11 轉基因愈傷中抗氧化酶活性的變化
當植物受到干旱脅迫時,體內活性氧含量增加,細胞膜通透性發生改變,從而導致細胞損傷。抗氧化酶系統可以有效清除活性氧并維持其動態平衡,減少活性氧對細胞的損傷。本研究為了檢測干旱脅迫下活性氧的積累情況,測定了轉基因愈傷組織在干旱條件下抗氧化酶活性的變化。結果表明,干旱處理后抗氧化酶的活性顯著提升,其中過表達MdARR11愈傷組織中SOD、POD、CAT 的活性極顯著低于野生型(圖9)。以上結果表明,MdARR11降低了抗氧化酶的活性,減少了對ROS 的清除,增強了愈傷組織對干旱脅迫的敏感性。由此可知,MdARR11在蘋果愈傷組織干旱脅迫響應中可能起到負調節作用。
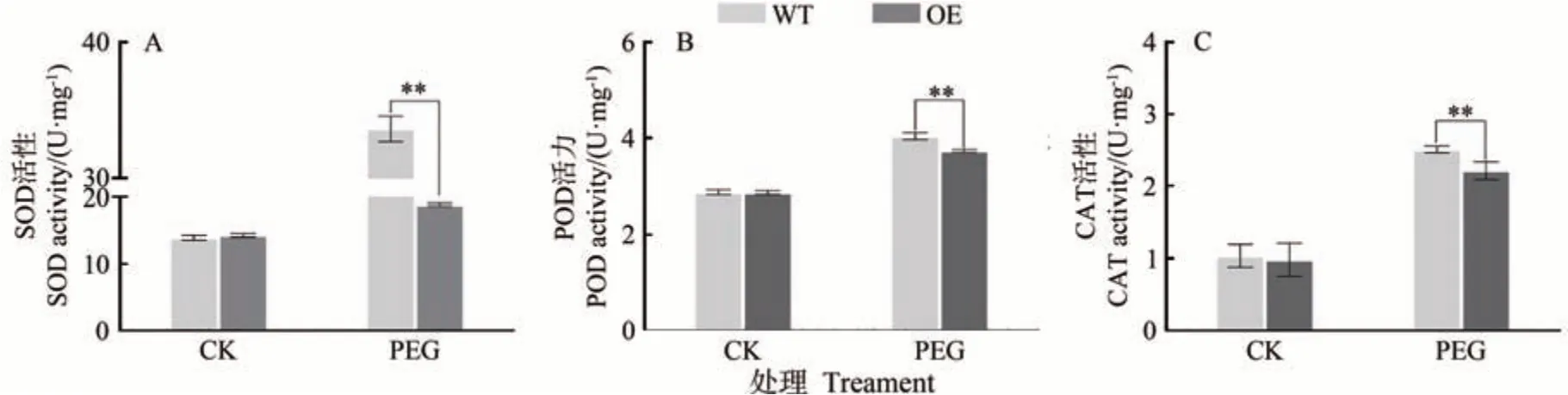
圖9 干旱脅迫下WT和MdARR11轉基因蘋果愈傷抗氧化酶活性Fig.9 Activity of antioxidant enzymes in WT and MdARR11 transgenic apple callus under drought
3 討論
細胞分裂素響應因子是細胞分裂素信號轉導的重要組成部分。研究發現,ARRs在調控植物生長發育和響應非生物脅迫[16-19]中發揮重要作用。本試驗通過克隆MdARR11基因并對干旱脅迫下MdARR11基因的生物學功能進行了相關研究。結果表明,當遭受干旱脅迫時,MdARR11基因的過表達降低了蘋果愈傷組織的耐旱性。
擬南芥中AtARR11主要通過與同源基因ARR1、ARR12之間形成功能冗余,調控細胞分裂素信號與ABA 信號產生拮抗,負向調控植物的抗旱性[18]。本研究中,進化樹分析表明蘋果MdARR11與白梨PbARR11的親緣關系最近,而與擬南芥AtARR11 親緣關系較遠。這表明,MdARR11 的功能可能與PbARR11 相似。推測MdARR11可能通過與互作蛋白的相互作用增強其在干旱脅迫中的功能,從而負調控植物抗旱性。但關于MdARR11基因的調控通路及作用機制還需進一步的研究。
細胞分裂素響應調節因子由于C端結構不同可分為A、B、C三類。其中,B型ARRs除了含有信號接受域外還在C末端含有一個DNA 結合域。在嘎啦3蘋果中克隆得到一個長度為2 248 bp、編碼613個氨基酸的基因MdARR11。氨基酸序列對比分析發現,MdARR11與PbARR11、AtARR11都含有type-B-REC 結構域,C 端都含有一個MYB-like的DNA結合域,表明它們屬于B型細胞分裂素響應因子,這暗示著MdARR11可能在干旱脅迫中同樣發揮重要作用。
TaRR1在小麥的根和葉中表達量最高[16],有助于調節氮的吸收和同化作用。VlRR5在葡萄(VitisviniferaL.)的莖中高表達,有助于提高葡萄坐果率[23]。在本研究中,MdARR11在蘋果不同組織器官中都有表達,但在莖中表達量最高,說明MdARR11可能有助于調節營養器官發育。不同物種間組織特異性表達差異可能是由于小麥為草本植物,莖部不發達,根和葉作為重要營養器官發揮作用,而蘋果、葡萄分別為木本、木質藤本植物,莖部較發達,根莖葉等器官均發揮重要作用。
干旱是影響植物生長發育的重要環境因素[20]。在擬南芥中干旱脅迫能夠誘導A 型ARR 基因ARR5、ARR15、ARR22基因的表達[24],而B 型ARR 基因ARR1、ARR10、ARR12的表達量受到干旱脅迫抑制[18]。在本研究中,通過分析MdARR11轉錄起始位點上游1 500 bp序列中的順式作用元件,發現該基因啟動子包含多個如ARE、MBS等參與厭氧誘導和干旱脅迫的順式元件,推測該基因的表達可能受上述環境因素的影響。使用20% PEG6000 模擬干旱處理蘋果苗,qRT-PCR 分析結果表明MdARR11基因的表達受干旱脅迫抑制,驗證了MdARR11響應干旱脅迫。干旱脅迫下CKs 的含量下降[25],參與CKs合成的基因IPT下調而參與降解的CKX基因上調[26],表明CKs 是干旱脅迫的負調節因子。在本研究中,蘋果愈傷組織在6% PEG6000 處理后長勢明顯變弱,其中過表達MdARR11愈傷組織的長勢弱于野生型。這些結果表明,MdARR11可能負調控蘋果愈傷組織對干旱脅迫的抗性。
干旱脅迫能夠引起滲透脅迫、脂膜過氧化,使細胞膜被破壞,植物不能從外界吸收水分最終導致死亡。植物在干旱脅迫下會積累一些滲透調節物質[27],從而增加胞內溶質增強細胞吸水或保水能力[28]。MDA 作為膜脂過氧化產物,能夠直接導致細胞膜和酶的損傷,其含量高低能夠直接反映細胞質膜過氧化水平。本研究發現,干旱處理后過表達MdARR11蘋果愈傷相對電導率和MDA 的含量均高于野生型;而脯氨酸和可溶性蛋白的積累量均低于野生型。結果表明,MdARR11可以通過減少滲透調節物質的積累和加重細胞膜的脂膜過氧化程度,從而降低愈傷組織對干旱脅迫的抗性。
干旱脅迫會促進植物體內產生大量ROS,導致植株氧化損傷[20]。當植物受到干旱脅迫時,POD、SOD、CAT 的活性增加,三者協同作用抑制ROS 產生,從而抑制干旱引起的脂膜過氧化損傷,最終達到提高植物的抗逆性的目的[29-30]。本研究發現,干旱處理后SOD、POD、CAT 抗氧化酶的活性顯著高于對照,在處理組中過表達MdARR11愈傷組織抗氧化酶的活性明顯低于野生型。結果表明MdARR11能夠通過降低抗氧化酶的活性,減少對ROS 的清除從而降低愈傷組織對干旱脅迫的抗性。
4 結論
本研究通過克隆MdARR11基因,構建過表達載體并遺傳轉化蘋果愈傷組織,在PEG6000 模擬干旱脅迫下研究MdARR11基因功能。結果表明,MdARR11能夠通過降低脯氨酸和可溶性蛋白的積累量,提高MDA 的積累量以及SOD、POD、CAT 抗氧化酶的活性,降低蘋果愈傷組織對干旱脅迫的耐受性。

