基于酪蛋白寡肽的W1/O/W2 雙重乳液體系構建及體外模擬消化特性研究
姚萍,王筠鈉,張書文,逄曉陽,于景華,呂加平*
(1. 天津科技大學食品科學與工程學院,天津 300457;2. 中國農業科學院農產品加工研究所,北京 100193)
0 引 言
在乳液包封過程中,單一乳液通常是不穩定的,對水溶性化合物的封裝能力有限。然而,雙重或多重乳液可以封裝親水和疏水化合物,其中分散相液滴可包含一種或多種更小的分散液滴[1]。雙重乳液包括水包油包水(W/O/W)和油包水包油(O/W/O)2 種包封類型和2 種類型的界面(一級和二級界面)。乳液的穩定通常與親油/親水乳化劑有關,親油乳化劑可以穩定水/油界面的初級相,進一步穩定二級界面的油/水相[2]。W/O/W 是多室液體分散體系,較小的水滴分散在油相(W1/O)中,油相進一步分散在外部水相(W2)中,簡稱為W1/O/W2[3]。雙重乳液體系在食品中應用廣泛,如活性成分的微膠囊化、強化、聚合物囊體的制造和具有改善感官特性的低熱量食品的開發等[4]。生物活性肽功能豐富,但是五肽及以上的小肽在酸性、富含蛋白酶的胃腸道環境中極易被降解,雙重乳液技術在保護小肽的同時,達到在胃腸道中受控釋放,從而提高它們的生物利用率[5]。蛋白質降解過程中,肽的疏水性氨基酸及苦味氨基酸暴露,致使短鏈肽苦味增加,雙乳化技術可以很好地掩蔽苦味。應欣等[6]采用雙重乳液體系技術將大豆苦味低聚肽包封起來,結果顯示,雙乳化技術顯著地降低大豆低聚肽的苦味。
體外模擬消化是在體外環境下,模擬人體口腔、胃腸階段的生理環境,探究食品營養、活性物質及藥物等的吸收利用機制。國際INFOGEST 合作組織提出模擬體外消化方案標準化了電解質、酶和膽汁濃度、稀釋系數、pH 和消化時間等參數[7]。與動物實驗相比,體外模擬消化實驗具有操作簡便,實驗便于控制,成本低及重現性高等優點,已被廣泛應用于食品或藥品吸收利用特性的影響研究[8]。MAGOUZ O 等[9]通過模擬體外消化發酵乳酪表明,在消化過程中血管緊張素轉換酶(ACE) 抑制活性、自由基清除、鐵還原顯著增加,表明胃腸道消化促進了發酵酪乳肽的生物活性。
活性肽是蛋白經酶法水解、化學法水解或微生物發酵后,大分子蛋白質被分解成分子量較小的肽段,進一步與蛋白分離純化后得到的肽混合物[10]。由10 個以上氨基酸殘基組成的肽被稱為多肽,含10 個及以下氨基酸殘基的肽稱為寡肽或短肽[11]。乳源生物活性肽(BAPs)是指乳中蛋白質肽鏈上的某些片段,這些片段在前體蛋白質序列中不具備活性,當被蛋白水解酶作用釋放時,它們可與特定受體相互作用發揮生理功能[12]。活性寡肽在胃腸道酶的作用下可能會被進一步分解而降低其生理活性,為解決這一問題,可以利用油水界面性質制備雙乳液包封緩釋體系,雙乳液體系還可以掩蓋小肽不好的感官風味,如苦味等。目前,國內對雙重乳液體系應用于乳源性蛋白肽的研究較少。
目前,雙重乳液的制備方式主要采用兩步乳化法。在此過程中使用高速均質器和分散器等乳化設備來產生初級乳液。第一步使用均質有效降低乳液的粒徑,易于雙乳體的制備。第二步乳化條件非常重要,處理條件不宜過度劇烈,也不宜過度溫和。過度劇烈的處理條件造成液滴破裂,包封物質溶出;過度溫和條件會致使乳液體系分散不均勻,降低乳液穩定性。因此,本實驗探究不同均質壓力(25、60 MPa)下雙乳體系的穩定性,并模擬體外消化,研究體系穩定性、微觀結構、緩釋過程等,為高活性、高濃度乳源性寡肽的開發利用提供理論指導和技術支持。
1 材料與方法
1.1 材料與試劑
酪蛋白寡肽,本實驗室自制;胃蛋白酶(≥250 U/mg)、胰脂肪酶(≥125 U/mg),Sigma 公司;其他化學試劑均為分析純,國藥集團化學試劑有限公司。
1.2 儀器與設備
K9840 半自動微量凱氏定氮儀,濟南海能儀器股份有限公司;自動電位滴定儀,上海禾工科學儀器;磁力恒溫水浴攪拌鍋,常州金壇良友儀器公司;PHSJ-3F型pH 計,上海雷磁;光學顯微鏡,北京悅昌行科技有限公司;共聚焦激光掃描顯微鏡,德國徠卡Leica 微系統有限公司;均質機,德國APV 公司;高壓微射流均質機,安拓思納米技術有限公司;Mastersizer Malvern Zetasizer Nano ZSE 納米粒度電位儀,英國馬爾文公司;Turbiscan 穩定性分析儀,法國Formulaction 公司。
1.3 實驗方法
1.3.1 雙乳液體系的構建
40% (m/m)酪蛋白寡肽溶液作為內水相(W1),8%(W/W)磷脂溶解在MCT 油中作為油相,在55 ℃水浴磁力攪拌條件下,將W1∶O 按3∶7 (W/W)混合,混合液用高壓均質機(均質壓力25 MPa)均質3 次,獲得W1/O 乳液。將抗性糊精和磷酸酯雙淀粉按4∶1 (W/W)比例混合后在85 ℃下磁力攪拌溶解15 min,使其完全糊化。此溶液作為外水相(W2),W2溶液的固形物含量小于15%。將W1/O 乳液緩慢加入到W2中,采用高壓均質機(均質壓力25 MPa)均質3 次獲得雙重乳液體系。
1.3.2 不同均質條件對W1/O/W2乳液的影響
將W1/O 乳液與外水相相混合,采用以下2 種不同的均質方式制備W1/O/W2乳液:①采用均質壓力25 MPa 均質3 次;②均質機均質3 次后再使用高壓微射流(60 MPa)均質3 次。
1.3.3 W1/O/W2乳液體系性質測定
1.3.3.1 W1/O/W2乳液包埋率的測定
乳液中的包埋率采用內水相中含氮量與整個乳體系中的含氮量的比值表征。用超純水稀釋W1/O/W2乳液后,在4 ℃,5 000 r/min 下離心30 min,收集水層后在4 ℃,12 000 r/min 下離心15 min,收集水層并用0.45 μm 濾膜過濾去除油滴。含氮量采用凱氏定氮法測定。W1/O/W2乳液中酪蛋白寡肽的包埋率按下式計算:
式中:M為W1相中含氮量,Mf為離心后釋放在外水相中的含氮量。
1.3.3.2 W1/O/W2乳液粒徑的測定
采用納米粒度電位儀測定W1/O/W2乳液的粒徑大小和粒度分布。液滴的平均粒徑由體積加權平均直徑(D43)和表面加權平均直徑(Sauter 直徑)(D32)來表征,其定義公式如下:
式中:ni為直徑,di為液滴的數量。
1.3.3.3 W1/O/W2乳液顯微鏡觀察
將乳液稀釋至透明狀,滴在載玻片上后蓋上蓋玻片,先在低倍鏡(10 倍)下找到視野,換成高倍油鏡(100 倍)觀察乳液微觀結構。
1.3.3.4 W1/O/W2乳液流變特性的測定
采用TA 流變儀測定乳液的表觀黏度,樣品在測定前均質2 min。剪切速率范圍每秒0.1~500.0。
1.3.3.5 W1/O/W2乳液穩定性的測定
采用Turbiscan 穩定性分析儀測定乳液的物理穩定性。取20 mL 樣品于樣品瓶中,溫度設定為25 ℃,每1 h 掃描一次,掃描24 h,記錄穩定性指數(TSI)及背散射光強變化(ΔBS)圖譜。
1.3.4 體外消化模擬
1.3.4.1 消化液的制備
胃液消化液(SGF)和腸道消化液(SIF)配置成分參照BRODKORB A[7]等研究。
1.3.4.2 模擬胃腸道消化階段
將SGF 提前置于37 ℃下預熱,取新鮮乳液與SGF 按1∶1 混合,將混合體系的pH 調至3.0,添加胃蛋白酶(2 000 U/mL),再將混合體系置于37 ℃下恒溫振搖2 h,按1∶1 加入已預熱的SIF 液和膽鹽溶液,調整體系pH 為7.0,添加胰酶(100 U/mL),將混合體系置于37 ℃下恒溫振搖2 h,在腸消化過程中用0.1 mol/L NaOH 調整體系使其pH 始終保持7.0。
1.3.5 體外消化產物表征
1.3.5.1 消化過程中粒徑和Zeta 電位的測定
粒徑測定方法同1.3.3.2;Zeta 電位測定選用DTS1060 彎曲式毛細管樣品池測量。
1.3.5.2 微觀結構觀察
胃、腸階段的消化產物微觀結構采用激光掃描共聚焦顯微鏡觀察,先在10 倍鏡下找到視野,后采用63倍油鏡觀看。采用0.1 g/L 尼羅河紅染色乳液中的脂質,激發波長λ=543 nm,掃描范圍560~620 nm,乳液中蛋白質用1 g/L 固綠染色,激發波長λ=633 nm,掃描范圍655~755 nm。
1.3.5.3 酪蛋白寡肽的保留率測定
乳液中的包埋率采用內水相中含氮量與整個乳體系中的含氮量的比值表征。用超純水稀釋W1/O/W2乳液后,在4 ℃,5 000 r/min 下離心30 min,收集水層后在4 ℃,12 000 r/min 下離心15 min,收集水層并用0.45 μm 濾膜過濾去除油滴。含氮量采用凱氏定氮法測定。W1/O/W2乳液中酪蛋白寡肽的包埋率按下式計算:
式中M為W1相中含氮量,Mf為離心后釋放在外水相中的含氮量。
1.3.5.4 游離脂肪酸釋放率測定
采用pH-stat 法[13]。在模擬小腸消化階段,向體系中加入0.1 mol/L NaOH 調整體系使其pH 始終保持7.0,記錄耗堿量,釋放的游離脂肪酸(FAA)可由以下公式計算:
式中:VNaOH為消耗NaOH 的體積(mL);
CNaOH為消耗NaOH 的濃度;
Moil為油的平均分子質量(g/mol),
MCT 油521g/mol;
Woil為消化樣品中油的分子質量(g/mol)。
2 結果與分析
2.1 乳化條件對W1/O/W2 乳液的影響
2.1.1 乳化條件對W1/O/W2乳液粒徑的影響
乳液的粒徑在一定程度上可以表征其穩定性,通常乳液粒徑越小越穩定。如圖1 所示均質壓力對乳液的粒徑影響顯著。在25 MPa 壓力下均質5 次得到的乳液平均粒徑為(715±7.2)nm,經高壓微射流均質處理后乳液平均粒徑顯著降低(571.5±7.3)nm。25 MPa壓力均質的乳液包封率為95.5%,60 MPa 高壓微射流均質處理后包封率為92.3%,而過高的均質壓力會導致第二步乳化過程中液滴破裂,降低包封率。高壓微射流均質的乳液粒徑呈單峰狀,25 MPa 均質的乳液峰略有波動,這可能是因為未包封的物質分散在乳液體系中,與經歷較高壓力后連續破裂的液滴均勻性不一致[14]。

圖1 不同均質壓力對W1/O/W2 乳液粒徑的影響
2.1.2 乳化條件對W1/O/W2乳液微觀結構的影響
使用光學顯微鏡觀察了不同均質壓力下2 種乳液的形態。圖2(a)是25 MPa 壓力均質處理乳液,其液滴大小均勻性不如高壓微射流均質處理樣。如圖2(b)所示,隨著均質壓力的增大,大液滴幾乎都消失了,將25 MPa 均質樣的顯微鏡圖片放大可以清楚地看到其呈“圈套圈”狀態。由此可知,由光學顯微鏡圖像清晰呈現了雙重乳液的微觀形貌。

圖2 不同均質壓力下W1/O/W2 乳液的微觀結構
2.1.3 乳化條件對W1/O/W2乳液流變學特性的影響
雙重乳液的流變行為可以表征系統穩定性[15]。流體可分為剪切稀化(假塑性)流體(0<n<1)和剪切黏稠(擴張性)流體(n>1)。隨著剪切速率的增加,乳化液滴開始拉長,導致體系的黏度下降,這是非牛頓流體的特征[16]。圖3 中2 種加工方式下乳液的表觀黏度在低剪切速率下都較高,隨著剪切速率的增加呈下降趨勢。25 MPa 均質乳液表現出更低的黏度,一般來說,較小的乳液顆粒尺寸會導致較低的黏度和較高的n值,乳液的剪切稀化特性較強[17]。黏度會影響雙重乳液的相分離速率和穩定性,這些發現與FELIX M 等[18]的研究結果一致。

圖3 不同均質壓力對W1/O/W2 乳液流變特性的影響
2.1.4 乳化條件對W1/O/W2乳液穩定性的影響
背散射光強的變化率可以反映乳液系統的穩定性,并有助于解釋其不穩定性的機制。乳液越穩定,反向散射的變化越小,表明液滴的數量、尺寸分布和空間分布隨著時間的推移保持不變[19]。圖4(a)、(b)顯示出了24 h 內2 種均質壓力下雙重乳液的反向散射曲線。從左側到右側的曲線的水平軸分別代表樣品池的底部和頂部。對于2 種雙重乳液,樣品池底部的后向散射強度均低于頂部,這可能導致雙重乳液的乳狀液分層。但均未觀察到明顯的分層現象。

圖4 不同均質壓力對W1/O/W2 乳液穩定性的影響
乳液穩定性也可以通過Turbiscan 穩定性指數(TSI)來表征[20],它描述了多種不穩定現象對光強度的綜合影響。一般來說,TSI 值越高,體系越不穩定[21]。雙重乳液在24 h 內的TSI 數據如圖4(c)所示。可以看出,在中后期,二者TSI 指數差異較大,相較高壓微射流均質乳液,25 MPa 雙乳體系更為穩定。這一結果與粒徑測量和微觀結構觀察的結果相悖,乳液的過度加工可能由于表面積的增加而引起再聚結,從而有利于多分散性,可能導致最終的乳液穩定性較差[22]。
2.2 體外模擬消化產物的表征
2.2.1 體外模擬消化過程對乳液粒徑和Zeta 電位的影響
由于60 MPa 壓力高壓微射流均質處理后的雙重乳液體系穩定性較差,在后續實驗中使用25 MPa 高壓均質處理的W1/O/W2乳液,模擬乳液在胃腸道中的形態變化及釋放特征。因乳液在口腔中停留時間較短,故本實驗主要針對胃階段和小腸階段展開模擬。
當雙乳液通過胃相時,初始平均粒徑較大,如圖5(a)所示。粒徑增大的原因可能是由于酶和pH 值的作用導致界面上靜電相互作用的變化而引起的聚集[23]。胃消化階段40 min 后粒徑變化不顯著,外層水相的親水性乳化劑是抗性糊精和磷酸酯雙淀粉,二者因其耐酸,耐剪切力等特性,在pH 較低的胃液環境下仍可保持W1/O/W2乳液的特殊結構。然而,在腸道階段,W1/O/W2乳液的大小呈先降后增的趨勢,在腸階段60 min 粒徑最小(423 nm),表明酪蛋白寡肽從內部水相中釋放出來。釋放的機制可能是2 種現象的共同作用,一是外部環境中鹽的存在引起了跨膜滲透壓的變化;二是酶的存在和pH 值的變化導致了內部水相和油相的凝聚。淀粉酶作用后暴露油膜,脂肪酶進一步作用釋放寡肽。

圖5 體外模擬消化過程中平均粒徑和Zeta 電位變化
Zeta 電位是表征膠體體系穩定性的重要參數,Zeta 電位代表運動顆粒滑動表面的電動勢[24]。胃消化前期雙重乳液的Zeta 電位變化沒有明顯差異(P>0.05),在胃階段80 min 時Zeta 為-29.55 mV,如圖5(b)所示。腸消化20 min 后,乳液的Zeta 電位值呈下降趨勢,腸消化80 min 時Zeta 電絕位對值最大。通常,絕對值Zeta 電勢值越高,代表體系越穩定。Zeta 電位受pH 值和體系中乳化劑類型的影響較大。由于雙重乳液中pH 值的輕微變化,隨著乳化劑濃度的增加,pH值降低。Zeta 電位作為強靜電斥力反映了雙乳液的穩定性。負電勢值導致顆粒之間的排斥相互作用,從而防止聚集,為體系提供良好的物理和生物化學穩定性。要求電勢的絕對值大于30 mV,以防止液滴聚集,這被稱為靜電穩定[25]。
2.2.2 體外模擬消化過程對乳液微觀結構的影響
CLSM 結果可以直觀地觀察到乳化穩定劑在雙乳化體系中的分布狀態。油相為尼羅紅染色,在圖像中顯示為綠色(圖中圓型區域);內水相為固綠染色,在圖像中顯示為紅色(圖中方型區域),如圖6 所示。這些圖像清楚地表明,較大的油滴(綠色)包裹內水相(紅色),邊緣泛綠色芯呈黃色的球包球形態(圖中三角區域)。本實驗最外層水相為多糖類未被染色。在胃消化階段,60 min 和120 min 的圖像顯示雙重乳液液滴大小結構未發生變化,整個包封液滴呈黃色。在小腸階段,由于脂肪酶的作用,油相層破裂,釋放出更多的酪蛋白寡肽,游離在體系中。在腸階段120 min 時觀察到游離在體系中的酪蛋白寡肽明顯增多,還有部分包埋形態完整的液滴。這一結果與酪蛋白寡肽的釋放率相一致,說明雙重復合乳液的釋放主要發生在小腸階段。這一結果與前人的研究相一致[26]。

圖6 體外模擬消化過程中微觀結構變化
2.2.3 體外模擬消化過程穩定性分析
在模擬人體胃腸階段消化過程中,消化蛋白酶的作用可能會造成W1/O/W2乳液的包封結構破裂,將W1/O 相釋放在體系中。在整個消化模擬過程中,乳液的寡肽釋放率如圖7 所示。經過2 h 胃消化,酪蛋白寡肽的保留率變化不顯著,說明大部分寡肽仍以包封狀態保留在W1/O/W2乳液,這一結果與粒徑及微觀結構的結果相一致。W1/O/W2乳液因其特殊的結構及外壁材,可以抵抗胃消化液中的胃蛋白酶的作用,從而保留較多的寡肽到小腸中進一步消化釋放。在小腸消化階段,由于脂肪酶的存在,寡肽的釋放量顯著增大,這是因為脂肪酶將油相的脂肪分子分解為游離脂肪酸和單酰基甘油,以釋放內水相肽。小腸道階段消化結束,酪蛋白寡肽的保留率為39.64%。為了解釋雙重乳液中酪蛋白寡肽的釋放,將釋放數據擬合到數學模型中,擬合結果顯示一級動力學模型的相關系數最高(R2=0.934)。一級動力學將親水化合物通過基質的釋放速率描述為其濃度的函數[27],表明釋放速率隨著核心物質濃度的降低而降低,從而表明該雙重乳液體系具有緩釋性。
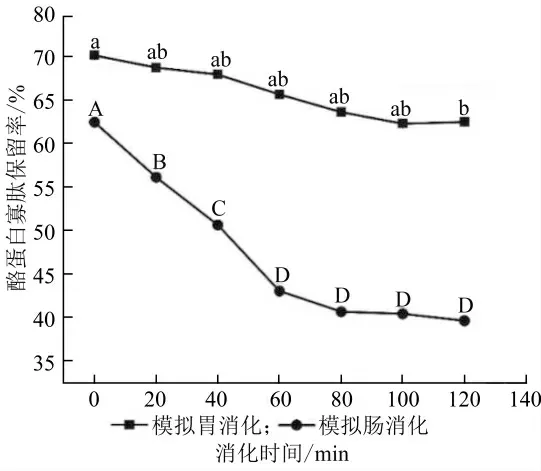
圖7 體外模擬消化過程中酪蛋白寡肽的保留率
2.2.4 體外模擬消化過程中游離脂肪酸的釋放
在模擬小腸消化過程中,脂肪酶將脂肪分解釋放出甘油和游離脂肪酸(FFA)。圖8 顯示了模擬小腸階段游離脂肪酸釋放率的動力學曲線,在消化前期(<40 min),脂肪被迅速分解,生成游離脂肪酸,消化1 h 后,游離脂肪酸的釋放速率減緩,消化末期,FFA 釋放率為53.3%。有研究表明,中鏈脂肪酸的水相分散性比長鏈脂肪酸更高,在消化過程中能快速遷移到周邊的水相中,不會影響界面處脂肪酶的作用。本實驗中MCT 油為中鏈脂肪酸,而磷脂是長鏈脂肪酸,長鏈脂肪酸易積聚在油水界面,降低脂肪酶的酶解能力。實際上,人體能夠調整腸道液體的組成,當攝入高濃度的脂質時,身體會增加小腸中脂肪酶和膽汁的濃度[28]。

圖8 體外模擬消化過程中游離脂肪酸釋放率動力學曲線
采用4 種釋放模型擬合分析游離脂肪酸的動力學釋放曲線。零級模型顯示物質釋放是通過聚合物在界面上的溶解而實現的。本實驗中零級方程的相關系數最差,R2=0.62。Higuchi 模型用于定義通過擴散機制的控制釋放[27],本實驗R2=0.78。Ritger-peppas 方程的相關系數為R2=0.87。一級方程模型與釋放百分比數據吻合良好,一級方程Mt=57.09(1-e-0.03t),R2=0.89。因此表明酪蛋白寡肽的雙重乳液是緩釋體系。
3 討論與結論
以酪蛋白寡肽混合物為芯材,制備W1/O/W2雙重乳液體系,包封率達95.5%。構建乳液緩釋體系時,選用營養較為豐富的磷脂做為親脂性乳化劑制備外水相(W1/O),外水相W2選用磷酸酯雙淀粉做親水性乳化劑。結果表明,25 MPa 壓力下乳液的穩定性較好。高壓微射流使乳液體系分散更均勻,但同時導致內水相液滴的破損,降低包封率。通過體外模擬消化實驗,表明雙重乳液體系能夠抵抗胃酶及較低的pH環境,酪蛋白寡肽的包封率保持在70%以上。在胰酶的作用下,W1/O/W2包封體系遭到破壞,隨著消化進程,游離脂肪酸的釋放量增加,酪蛋白寡肽的保留率降低,從而達到緩釋目的。

