苦參醇F對潰瘍性結腸炎小鼠的干預作用Δ
何旭東,倪皓雨,何金彪,李敏,胡蘊鎧,龔弟鴻,姚金鈴,俞捷 ,楊興鑫 (云南中醫藥大學中藥學院,昆明 650500)
潰瘍性結腸炎(ulcerative colitis,UC)是一種以結腸黏膜連續性炎癥累積為特征的炎癥性腸病,以血性腹瀉為主要臨床癥狀,還包括腹痛、便血、體重減輕、里急后重、嘔吐等其他癥狀[1],嚴重影響患者的生活質量。目前,UC的主要治療藥物是抗炎藥物和免疫調節藥物,這些藥物雖可緩解UC癥狀,但長期服用會導致患者皮膚壞死、血小板減少、造血功能抑制等[2]。因此,有必要尋找新的UC治療策略。
研究表明,抑制炎癥反應、促進腸道黏膜愈合可有效緩解UC[3]。苦參醇F(kushenol F,KSC-F;結構式見圖1)是中藥苦參的特征性成分,屬異戊烯基黃酮類,有抗菌、抗腫瘤、抗炎等藥理活性[4],具有良好的開發前景。研究表明,10 mg/kg的KSC-F可通過降低核因子κB(nuclear factor-κB,NF-κB)的磷酸化水平以及NF-κB抑制因子激酶(inhibitor of NF-κB kinase,IKK)和白細胞介素1β(interleukin-1β,IL-1β)、IL-6的mRNA表達水平來抑制炎癥反應,從而緩解炎癥相關癥狀[5]。UC屬于慢性炎癥性腸道疾病,炎癥反應是其發展和惡化的重要機制之一,抑制炎癥反應、減輕炎癥損傷是治療UC的關鍵,但KSC-F能否通過抑制結腸炎癥相關蛋白的表達來抑制炎癥反應,進而發揮抗UC作用尚不清楚。為此,本研究擬初步探究KSC-F對UC的干預作用,以期為UC治療新藥的先導化合物的開發提供參考。

圖1 KSC-F的結構式
1 材料
1.1 主要儀器
本研究所用主要儀器包括SpectraMax?Plus 384型光吸收酶標儀(美國Molecular Devices公司),Eclipse E100型正置光學顯微鏡、Nikon DS-Ri1-U3型數碼顯微成像系統(日本Nikon公司),LightCycler?96型實時熒光定量(PCR)儀購自瑞士Roche公司,ChemiDoc XRS型化學發光成像系統[賽默飛世爾(中國)科技有限公司],RM2016型病理切片機(上海徠卡儀器有限公司),JB-P5型組織包埋機(武漢俊杰電子有限公司),KD-P型組織攤片機(浙江省金華市科迪儀器設備有限公司),Milli-Q型超純水系統(美國Millipore公司)等。
1.2 主要藥品與試劑
KSC-F對照品(貨號JOT-10801,純度>98%)購自成都普菲德生物技術有限公司;柳氮磺吡啶腸溶片(批號09221203,規格0.25 g)購自上海信誼天平藥業有限公司;葡聚糖硫酸鈉(dextran sulfate sodium,DSS;貨號160110)產自美國MP Biomedicals公司,購自廣州億寧生物技術有限公司;IL-1β、IL-6、IL-8、IL-10、IL-17、腫瘤壞死因子α(tumor necrosis factor-α,TNF-α)酶聯免疫吸附測定(ELISA)檢測試劑盒均購自江蘇酶聯生物科技有限公司;兔源IL-1β、叉頭框蛋白O1(forkhead box O1,FOXO1)、磷脂酰肌醇3激酶(phosphoinositide 3-kinase,PI3K)、p38促分裂原活化的蛋白激酶(p38 mitogenactivated protein kinase,p38 MAPK)、磷酸化p38 MAPK(phosphorylated p38 MAPK,p-p38 MAPK)、磷酸化蛋白激酶B(phosphorylated protein kinase B,p-Akt)、β-肌動蛋白(β-actin)抗體(貨號分別為26048-4-AP、18592-1-AP、20584-1-AP、14064-1-AP、28796-1-AP、66444-1-lg、20536-1-AP)均購自美國Proteintech公司;兔源磷酸化PI3K(phosphorylated PI3K,p-PI3K)抗體(貨號17366S)購自美國Cell Signaling Technology公司;蛋白定量試劑盒(BCA法)、RIPA裂解緩沖液購自上海碧云天生物技術股份有限公司;環保型脫蠟液、通用型組織固定液、蘇木精-伊紅(HE)染液套裝均購自武漢塞維爾生物科技有限公司;實時聚合酶鏈反應(real-time PCR,RT-PCR)檢測試劑盒購自賽默飛世爾(中國)科技有限公司;聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜、5%脫脂奶粉、10×電轉液、10×TBST緩沖液、5×Tris甘氨酸-電泳緩沖液均購自北京索萊寶科技有限公司。
1.3 實驗動物
SPF級雄性C57BL/6J小鼠,體重20~22 g,購自斯貝福(北京)生物技術有限公司,動物生產許可證號為SCXK(京)2019-0010。所有動物均飼養于溫度18~22 ℃、相對濕度50%~60%、每12 h光明/黑暗交替的環境下,自由攝食、飲水,經適應性喂養1周后進行后續實驗。本研究方案經云南中醫藥大學動物實驗倫理審查委員會審批,批件號為R-062023111。
2 方法
2.1 分組、造模與給藥
將30只小鼠隨機分為5組,分別為正常組、模型組、陽性對照組、KSC-F 50 mg/kg組(KSC-F50組)、KSC-F 100 mg/kg組(KSC-F100組),每組6只。除正常組小鼠飲用水外,其余各組小鼠均飲用3%DSS水溶液,連續7 d;與此同時,KSC-F50、KSC-F100組小鼠分別灌胃KSCF 50、100 mg/kg,陽性對照組小鼠灌胃柳氮磺吡啶703 mg/kg,正常組和模型組小鼠灌胃等體積生理鹽水,每天1次,連續10 d。KSC-F的劑量參考Jo等[5]的研究;柳氮磺吡啶的劑量則根據成人(體重70 kg)臨床劑量換算而得;所有灌胃藥液均以N,N-二甲基乙酰胺(2.5%)+吐溫80(2.5%)+生理鹽水(95.0%)的混合溶液為溶劑。
2.2 一般情況觀察及疾病活動指數計算
實驗期間,于每天給藥前稱定并記錄各組小鼠體重,觀察其糞便排泄情況。于末次給藥后、采樣前,參照相關文獻方法[6]計算各組大鼠的疾病活動指數(disease activity index,DAI),DAI=(體重減少比例評分+糞便出血評分+糞便硬度評分)/3。各項具體評分標準如表1所示,DAI評分>0.5表明UC模型復制成功[6]。

表1 DAI評分標準
2.3 樣本采集
末次給藥后,各組小鼠腹腔注射1%戊巴比妥鈉(50 mg/kg)進行麻醉,于眼眶取血,血樣在室溫下放置1 h后,在4 ℃下以3 000 r/min離心15 min,分離上層血清,備用。取血后,各組小鼠以頸椎脫位法處死,打開腹腔,完整取出其結腸組織,測量結腸長度后,部分結腸組織用4%多聚甲醛溶液固定,用于病理形態觀察;另一部分結腸組織于-80 ℃下保存,用于后續指標檢測。
2.4 結腸組織病理形態觀察
取“2.3”項下固定的各組小鼠結腸組織適量,經乙醇逐級脫水、二甲苯透明后,行常規石蠟包埋、切片。切片烘干后行脫蠟及乙醇脫水處理,再依次用蘇木精、伊紅染液染色,經二甲苯透明后,以中性樹膠封片,使用光學顯微鏡進行病理形態觀察及圖像采集。
2.5 血清及結腸組織中炎癥因子水平檢測
取“2.3”項下各組小鼠血清樣品適量,按相應試劑盒說明書方法操作,以酶標儀檢測血清中IL-1β、IL-6、IL-8、IL-10、TNF-α水平。取“2.3”項下各組小鼠凍存的結腸組織適量,加入磷酸鹽緩沖液(pH7.4),勻漿,于4 ℃下以12 000 r/min離心15 min,收集上清液,以BCA法定量后,按相應試劑盒說明書方法操作,以酶標儀檢測結腸組織中IL-1β、IL-6、IL-8、IL-10、IL-17、TNF-α水平。
2.6 結腸組織中炎癥因子mRNA表達水平檢測
采用RT-PCR法檢測。取“2.3”項下凍存的正常組、模型組、KSC-F50組、KSC-F100組小鼠結腸組織各適量,利用Trizol試劑提取其總RNA并逆轉錄為cDNA,再以所得cDNA為模板進行PCR擴增。總反應體積為20 μL,包括SYBR Premix Ex TaqⅡ(9 μL)、上游引物(0.3 μL)、下游引物(0.3 μL)、cDNA模板(2 μL)和ddH2O(8.4 μL)。反應條件如下:95 ℃預變性30 s;95 ℃變性5 s,62 ℃退火和延伸20 s,共40個循環。以甘油醛-3-磷酸脫氫酶(GAPDH)為內參,采用2-ΔΔCt法計算目的基因mRNA的表達水平。各目的基因PCR擴增的引物序列和產物長度見表2。

表2 各目的基因PCR擴增的引物序列和產物長度
2.7 結腸組織中炎癥相關蛋白表達水平檢測
采用Western blot法檢測。取“2.3”項下凍存的正常組、模型組、KSC-F50組、KSC-F100組小鼠結腸組織各適量,加入RIPA裂解液,于4 ℃下研磨后,再于冰上放置30 min,以3 500 r/min離心15 min,收集上清液,以BCA法定量后作變性處理。取變性后的蛋白樣品適量,經十二烷基硫酸鈉-聚丙烯酰胺凝膠電泳分離后,轉至PVDF膜上,以5%脫脂奶粉封閉;洗膜后,加入IL-1β、FOXO1、PI3K、p-PI3K、p38 MAPK、p-p38 MAPK、p-Akt、β-actin一抗(稀釋比例均為1∶1 000),于4 ℃下孵育過夜;洗膜后,加入相應二抗(稀釋比例為1∶5 000),室溫孵育2 h;洗膜3次,利用化學發光酶標底物顯色后,置于化學發光成像系統下成像。以β-actin為內參,使用Image J軟件分析各目的蛋白的條帶灰度值,以目的蛋白與內參的灰度值比值表示目的蛋白的表達水平。
2.8 統計學方法
采用SPSS 21.0軟件對數據進行統計分析。數據均以±s表示,多組間比較采用單因素方差分析,進一步兩兩比較采用LSD-t檢驗。檢驗水準α=0.05。
3 結果
3.1 KSC-F對UC小鼠一般情況及結腸組織病理形態的影響
在飲用DSS水溶液后,模型組小鼠的體重整體呈下降趨勢,DAI評分較正常組顯著升高(P<0.01)且超過0.5;結腸較正常組顯著縮短(P<0.01),結腸組織的隱窩結構大量受損,杯狀細胞明顯減少,炎癥細胞浸潤嚴重。經藥物干預后,各藥物組小鼠體重減輕的情況有所改善,DAI評分均較模型組顯著降低(P<0.01);同時,小鼠結腸均較模型組顯著延長(P<0.01),結腸組織的隱窩結構形態得到明顯改善,且可見大量杯狀細胞,炎癥細胞浸潤情況亦有所減輕。結果見圖2。

圖2 KSC-F對UC小鼠一般情況及結腸組織病理形態的影響
3.2 KSC-F對UC小鼠血清及結腸組織中炎癥因子水平的影響
與正常組比較,模型組小鼠血清促炎因子IL-1β、IL-6、IL-8、TNF-α水平均顯著升高(P<0.01),抗炎因子IL-10雖有下降但差異無統計學意義(P>0.05)。與模型組比較,各藥物組血清IL-1β、IL-6(KSC-F50組除外)、IL-8、TNF-α水平均顯著降低,IL-10水平均顯著升高(P<0.05或P<0.01)。結果見圖3。
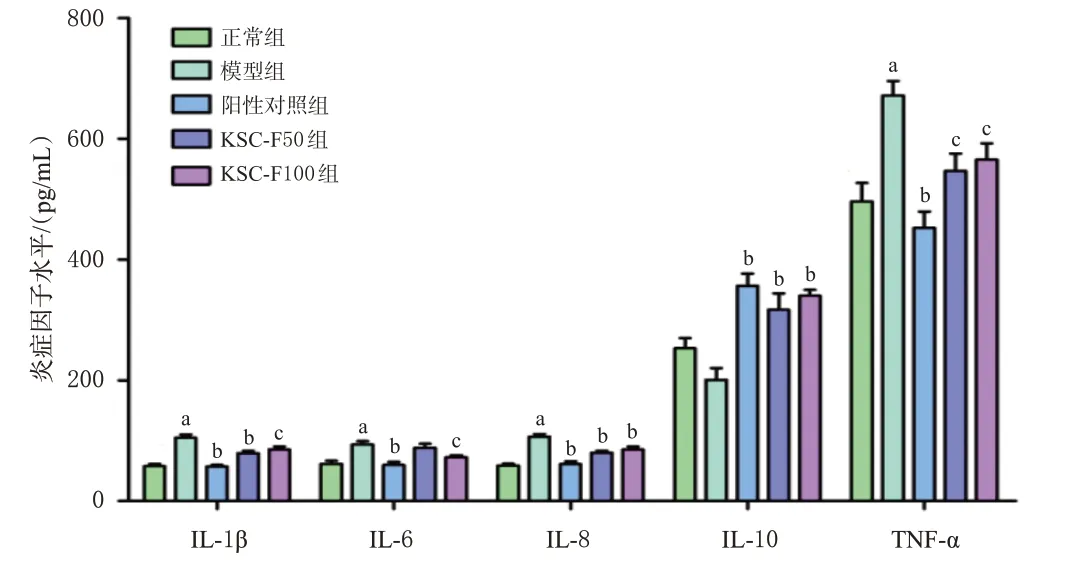
圖3 KSC-F對UC小鼠血清炎癥因子水平的影響(±s,n=6)
與正常組比較,模型組小鼠結腸組織中促炎因子IL-1β、IL-6、IL-8、IL-17、TNF-α水平均顯著升高(P<0.05或P<0.01),抗炎因子IL-10雖有下降但差異無統計學意義(P>0.05)。與模型組比較,各藥物組小鼠結腸組織中IL-1β(陽性對照組除外)、IL-6、IL-17、TNF-α(陽性對照組、KSC-F100組除外)水平均顯著降低,IL-10水平(陽性對照組除外)均顯著升高(P<0.05或P<0.01),IL-8雖有下降但差異均無統計學意義(P>0.05)。結果見圖4。

圖4 KSC-F對UC小鼠結腸組織中炎癥因子水平的影響(±s,n=6)
3.3 KSC-F對UC小鼠結腸組織中炎癥因子mRNA表達的影響
與正常組比較,模型組小鼠結腸組織中IL-1β、IL-17、TNF-α mRNA的表達水平均顯著升高(P<0.01),IL-6 mRNA雖有升高、IL-10 mRNA雖有下降,但差異均無統計學意義(P>0.05)。與模型組比較,各藥物組小鼠結腸中IL-1β(KSC-F50除外)、IL-17、TNF-α(KSC-F50除外)mRNA的表達水平均顯著降低(P<0.01),IL-6、IL-10 mRNA的表達雖有回調但差異均無統計學意義(P>0.05)。結果見圖5。

圖5 KSC-F對UC小鼠結腸組織中炎癥因子mRNA表達的影響(±s,n=6)
3.4 KSC-F對UC小鼠結腸組織中炎癥相關蛋白表達的影響
與正常組比較,模型組小鼠結腸組織IL-1β、p-Akt、PI3K、p-PI3K、p38 MAPK、p-p38 MAPK蛋白的表達水平雖有升高,FOXO1蛋白的表達水平雖有降低,但差異均無統計學意義(P>0.05);與模型組比較,KSC-F100組小鼠結腸組織中p-Akt、p-PI3K、p-p38 MAPK蛋白的表達水平均顯著降低,FOXO1蛋白的表達水平顯著升高(P<0.05或P<0.01)。結果見圖6。

圖6 KSC-F對UC小鼠結腸組織中炎癥相關蛋白表達的影響
4 討論
UC的典型臨床癥狀包括大便出血、腹瀉和體重減輕[1]。目前,UC的發病原因尚不明確,但可能與自身免疫、遺傳、感染和過敏等因素有關[2]。UC的病理特征為存在于結腸黏膜至直腸近端的持續性、彌散性炎癥[7]。此外,在發病過程中,PI3K/Akt信號通路及FOXO-1、IL-1β、p38 MAPK蛋白被激活,進而促進中性粒細胞和巨噬細胞釋放炎癥因子,引發炎癥反應;炎癥反應又導致結腸黏膜血管擴張、血管通透性增加,血液和免疫細胞滲入組織間隙,從而引起組織水腫、纖維化和潰瘍形成[8-11]。可見,控制炎癥反應、減輕炎癥損傷是治療UC的關鍵。柳氮磺吡啶是臨床治療UC的常用藥物,其抗炎活性確切,故被選作本研究的陽性對照藥物。
在結腸炎癥中,促炎因子TNF-α上調會破壞結腸上皮屏障,促進IL-6、IL-1β產生;與此同時,作為抗炎因子的IL-10則可維持胃腸道穩態[12]。KSC-F是從苦參中發現的一種異戊烯基黃酮類成分,已被證實具有抗腫瘤、抗菌、抗炎等藥理活性[4-5]。本研究結果顯示,50、100 mg/kg的KSC-F可改善UC小鼠體重減輕的情況,顯著降低DAI評分,顯著增加結腸長度及結腸組織中杯狀細胞數量,改善隱窩結構形態,減輕炎癥細胞浸潤,能不同程度地降低模型小鼠血清中IL-1β、IL-6、IL-8、TNF-α和結腸組織中IL-1β、IL-6、IL-17、TNF-α水平,以及結腸組織中IL-1β、IL-17、TNF-α mRNA的表達水平,提示KSCF具有改善UC小鼠結腸組織病變和炎癥反應的作用。
PI3K的激活可活化Akt,從而促進炎癥細胞的激活和炎癥因子的產生[8]。此外,活化的Akt可負反饋調節FOXO1的表達,從而進一步增加IL-1β的表達,而IL-1β可進一步激活p38 MAPK,從而加劇炎癥反應[13-15]。研究表明,MHY2013可通過抑制Akt和p38 MAPK的激活,增加FOXO1蛋白的表達,抑制IL-1β的轉錄,從而減輕胰島素抵抗引起的炎癥反應,提示PI3K、Akt、p38 MAPK蛋白的激活與炎癥反應的發生發展密切相關[15]。本研究結果顯示,在DSS誘導的模型組小鼠中,其結腸組織中IL-1β、p-Akt、PI3K、p-PI3K、p38 MAPK、p-p38 MAPK蛋白的表達雖較正常組有所上升,FOXO1蛋白的表達雖有所下降,但差異均無統計學意義。本課題組推測這些蛋白可能參與了UC的發生發展,但可能并非主要機制,有待進一步驗證。本研究結果還顯示,50、100 mg/kg的KSC-F能不同程度地下調p-Akt、p-PI3K、pp38 MAPK蛋白的表達,同時上調FOXO1蛋白的表達,提示KSC-F可通過抑制PI3K、Akt、p38 MAPK蛋白的激活,增加FOXO1蛋白的表達來緩解UC小鼠的炎癥反應。
柳氮磺吡啶已被廣泛應用于UC、克羅恩病和類風濕性關節炎等炎癥性疾病的臨床治療,成人用藥劑量為57 mg/(kg·d),按成人體重70 kg換算,小鼠給藥劑量為703 mg/(kg·d)。本研究結果證實,100 mg/(kg·d)的KSC-F對UC小鼠炎癥反應具有明顯的抑制作用,且劑量低于陽性對照藥,提示KSC-F的臨床有效劑量可能更低。
綜上所述,KSC-F可通過抑制PI3K、Akt、p38 MAPK蛋白的激活,抑制IL-1β、IL-6、TNF-α等促炎因子的釋放,促進抗炎因子IL-10的分泌,減輕結腸組織炎癥損傷,從而改善UC小鼠的相關癥狀。但KSC-F能否通過影響其他機制(如腸道微生物、體內免疫系統)來發揮抗UC作用仍有待后續研究深入探討。

