匝迪-5味丸改善心肌缺血再灌注損傷的作用機制預測及驗證Δ
烏日嘎,威力斯,烏日拉嘎,蘇斯,阿茹罕,佟立軍,布圖雅,呼日樂巴根 (內蒙古醫科大學蒙醫藥學院,呼和浩特 010110)
心血管疾病是導致全球死亡和疾病負擔的最主要原因之一。我國心血管病患病率仍處于持續上升階段,其中缺血性心臟病是導致死亡的主要原因之一[1]。臨床上急性心肌缺血的首選治療策略為及時采取溶栓或介入等再灌注手段快速恢復冠脈血流,但再灌注也容易造成心肌的二次損傷,即心肌缺血再灌注損傷(myocardial ischemia-reperfusion injury,MIRI)。
蒙醫學認為,心肌缺血引起的心肌梗死、心絞痛等冠心病均屬于蒙醫學“心刺痛”范疇,其蒙醫病名為“朱日很·哈特勒嘎”,通過鎮心“赫依”、改善血液“赫依與其蘇”運行,可使病情發展得到控制[2]。匝迪-5味丸是蒙醫臨床常用的經典復方,主治心律失常、心肌梗死、心絞痛等病癥,療效顯著[3]。該方出自蒙醫經典著作《高氏梅林方》,由肉豆蔻50 g,木香、土木香各40 g,廣棗25 g,蓽茇5 g配伍而成,具有鎮心、養心、安神的功效,主治心煩失眠、心神不安、心悸、胸悶氣喘等病癥[4]。已有研究發現,匝迪-5味丸可降低MIRI模型大鼠心肌肌鈣蛋白T(cardiac troponin T,CTn-T)、肌酸激酶(creatine kinase,CK)、天冬氨酸轉氨酶(aspartate aminotransferase,AST)、乳酸脫氫酶(lactate dehydrogenase,LDH)等心肌酶的含量,縮小心肌損傷面積[5-6],但其改善MIRI的作用機制尚未明確。本研究利用網絡藥理學方法篩選匝迪-5味丸的活性成分及作用靶點,并預測其改善MIRI的潛在作用靶點及通路,又通過建立MIRI大鼠模型驗證匝迪-5味丸改善MIRI的作用機制,旨在為闡明該方的藥效機制提供參考。
1 材料
1.1 主要儀器
本研究所用主要儀器包括Synergy H4型酶標儀(美國Bio-Tek公司)、RM2016型病理切片機(德國Leica公司)、XSP-C204型顯微鏡(重慶重光實業有限公司)、D1008E型離心機(武漢賽維爾生物科技有限公司)等。
1.2 藥品與試劑
匝迪-5味丸(內藥制字M13010062,規格為60丸/袋)由內蒙古國際蒙醫醫院國家蒙藥制劑中心提供;復方丹參滴丸(國藥準字Z10950111,規格為每丸重27 mg)購自天力士制藥集團股份有限公司;CTn-T酶聯免疫吸附試驗(ELISA)試劑盒(貨號CSB-E16443r)購自華美生物工程有限公司;CK、LDH、AST ELISA試劑盒(貨號分別為C060-b、C018、C072)均購自長春匯力生物技術有限公司;磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase,PI3K)抗體(貨號bsm-33219M)購自北京博奧森生物技術有限公司;辣根過氧化物酶(horseradish peroxidase,HRP)標記的山羊抗兔二抗、蛋白激酶B(又稱Akt)抗體、HRP標記的驢抗山羊二抗、甘油醛-3-磷酸脫氫酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)抗體、HRP標記的山羊抗大鼠二抗、B淋巴細胞瘤2(B-cell lymphoma-2,Bcl-2)相關X蛋白(Bcl-2 associated X protein,Bax)抗體、HRP標記的山羊抗小鼠二抗、TUNEL檢測試劑盒、DAB顯色劑、抗原修復液(貨號分別為GB23303、GB11689、GB23404、GB12002、GB23302、GB11690、GB23301、GDP1041、G2111、G1202)均購自武漢賽維爾生物科技有限公司;Bcl-2抗體(貨號BF9103)購自江蘇親科生物研究中心有限公司;胱天蛋白酶3(caspase-3)抗體(貨號66470-2-Ig)購自武漢三鷹生物技術有限公司。
1.3 動物
8周齡SPF級SD雄性大鼠72只,體重(200±20)g,購自北京維通利華實驗動物技術有限公司,實驗動物生產許可證號SCXK(北京)2019-0010。所有大鼠飼養于溫度(22±2)℃、相對濕度(50±5)%環境下,適應性飼養7 d。本實驗經內蒙古醫科大學醫學倫理委員會審批通過,倫理批件編號為YKD202001055。
2 方法
2.1 網絡藥理學研究
檢索中藥系統藥理學數據庫和分析平臺(TCMSP,http://tcmspw.com/)和BATMAN-TCM數據庫(http://bionet.ncpsb.org/batman-tcm/),并查閱文獻,獲取匝迪-5味丸的活性成分。以“肉豆蔻”“廣棗”“蓽茇”“木香”“土木香”為關鍵詞,在TCMSP中設置口服生物利用度≥30%、類藥性指數≥0.18進行檢索,在BATMAN-TCM數據庫中設置“藥物-靶點參考值”中靶蛋白提取值≥0.90、P<0.05進行檢索。利用UniProt數據庫(https://www.uniprot.org/)對所得活性成分進行檢索,找出匝迪-5味丸各活性成分的作用靶點。以“myocardial is-chemia”為關鍵詞,從GeneCards數據庫(https://genecards.org/)、Dis-GeNET數據庫(https://www.disgenet.org/)和DrugBank數據庫(https://go.drugbank.com/)中收集心肌缺血的相關靶基因。利用Venn Diagram軟件對匝迪-5味丸活性成分的作用靶點和心肌缺血相關靶基因取交集,獲得共同靶點。將共同靶點導入STRING數據庫(https://string-db.org/),選擇“multiple proteins”,將物種設置為“Homo sapiens”,置信度設置為0.7,進行蛋白相互作用(protein-protein interaction,PPI)網絡構建與數據分析。將分析結果導入Cytoscape 3.9.0軟件,構建PPI網絡圖,分析節點(成分或靶點蛋白)和邊(成分、靶點蛋白和疾病之間的關系),突出關鍵靶點及相關蛋白。將共同靶點導入Metascape分析平臺(https://www.metascape.org),對共同靶點進行基因本體(gene onto-logy,GO)和京都基因和基因組數據庫(Kyoto encyclope-dia of genes and genomes,KEGG)信號通路富集分析。
2.2 動物實驗研究
2.2.1 分組與給藥
將72只SD大鼠隨機分為模型組、假手術組、丹參組(陽性對照組)和匝迪-5味丸高、中、低劑量組,每組12只。模型組和假手術組大鼠灌胃等體積蒸餾水,丹參組大鼠給予復方丹參滴丸80 mg/(kg·d)灌胃,匝迪-5味丸高、中、低劑量組大鼠分別給予匝迪-5味丸藥粉1.6、0.8、0.4 g/(kg·d)灌胃,給藥劑量按前期預實驗結果設置。各組大鼠均按10 mL/kg灌胃,每天1次,連續14 d。
2.2.2 模型建立
末次灌胃后2 h,將各組大鼠麻醉后取仰臥位固定,監測記錄心電圖;剖開左側L3~L4肋間,暴露心臟,結扎左冠狀動脈前降支,使其缺血30 min,再灌注2 h(其中假手術組只穿線不結扎),建模同時記錄其心電圖。當大鼠心肌或心尖蒼白或發紺,心電圖示ST段升高0.1 mV或QRS波提高增粗,則提示缺血建模成功;當大鼠心肌缺血部位充血變紅或ST段緩慢下降約50%,則提示再灌注建模成功[7]。
2.2.3 采樣
大鼠建模完成后,開腹,于腹主動脈采血,待血凝后,于4 ℃下以3 500 r/min離心15 min,取上清液保存待測。采血結束后,摘取各組大鼠結扎部位以下的心肌組織,每組取6只大鼠的心肌組織用磷酸鹽緩沖液洗凈后待測,另6只大鼠的心肌組織用福爾馬林固定待測。
2.2.4 大鼠心肌酶含量檢測
取各組大鼠血清,按照ELISA試劑盒說明書操作,檢測血清中CK、LDH、AST、CTn-T的含量。
2.2.5 大鼠心肌組織形態觀察
將福爾馬林固定的心肌組織梯度脫水,常規石蠟包埋,切片(3.5 μm),用二甲苯脫蠟后進行蘇木精-伊紅(hematoxylin-eosin,HE)染色,中性樹膠封片。應用Image-Pro Plus 6.0軟件采集圖像,觀察大鼠心肌組織的形態變化。
2.2.6 大鼠心肌細胞凋亡檢測
取“2.2.5”項下的心肌組織切片,按照TUNEL檢測方法進行染色,使用光學顯微鏡觀察,正常心肌細胞核呈藍色,凋亡陽性心肌細胞核呈棕黃色。每張陽性切片選取6個陽性細胞最多的視野,計算陽性細胞百分比,即細胞凋亡指數(cell apoptotic index,CAI)。
2.2.7 大鼠關鍵通路和凋亡相關蛋白表達檢測
采用Western blot法進行檢測。取大鼠洗凈的心肌組織,裂解,勻漿,以12 000 r/min離心10 min,取上清液,測定蛋白濃度,煮沸變性。取變性后的蛋白樣品放入凝膠板,電泳,轉膜,封閉,加入PI3K、Akt、Bcl-2、Bax、caspase-3、GAPDH一抗稀釋液(稀釋比例為1∶1 000、1∶1 000、1∶5 000、1∶5 000、1∶500、1∶1 000),4 ℃下孵育過夜;加入二抗稀釋液(稀釋比例為1∶3 000),室溫下孵育30 min;暗室曝光、顯影,將膠片進行掃描存檔,用PhotoShop軟件整理去色,采用AlphaEase FC軟件測定灰度值。以目標蛋白與內參蛋白(GAPDH)的灰度值比值表示目標蛋白的表達水平。
2.2.8 統計學方法
采用SPSS 25.00軟件對數據進行統計分析,數據均以±s表示,多組間比較采用單因素方差分析,組間兩兩比較采用LSD-t檢驗。檢驗水準α=0.05。
3 結果
3.1 網絡藥理學分析結果
3.1.1 匝迪-5味丸的活性成分與心肌缺血的共同靶點
共檢索獲得177個匝迪-5味丸的活性成分及220個作用靶點,501個心肌缺血相關靶基因。將匝迪-5味丸的活性成分作用靶點與心肌缺血相關靶基因進行交叉,共獲得51個共同靶點。所構建的PPI網絡(圖1)中,有51個節點和718條邊,匝迪-5味丸改善MIRI主要以AKT1為核心靶點,協同IL6、PTGS2、EGFR、IL1B、PPARA、PPARG、STAT3、MTOR等多個靶點共同發揮作用。
3.1.2 關鍵通路及其相互作用靶點
GO富集分析結果(圖2)顯示,以P≤0.05為篩選條件,共獲得48個條目,其中生物過程條目20個,主要涉及激素調節、內毒素調節、循環系統、脂質定位調節、蛋白磷酸化等;細胞組分條目11個,主要涉及PI3K復合酶、細胞膜、轉錄調節復合酶等;分子功能條目17個,主要涉及核受體激活、脂質合成、亞鐵血紅素合成、一氧化氮合酶調節等。KEGG通路富集分析共得到20條通路(圖3),與心肌缺血有關的主要涉及PI3K-Akt、內質網、缺氧誘導因子1(hypoxia-inducible factor-1,HIF-1)等信號通路。通過匝迪-5味丸活性成分與PI3K-Akt信號通路網絡分析發現,君藥肉豆蔻的MF10、MF5、MF9和使藥蓽茇的PL1、PL2等活性成分作用顯著,因此,筆者推測匝迪-5味丸的作用機制可能與PI3K-Akt信號通路密切相關(圖4)。
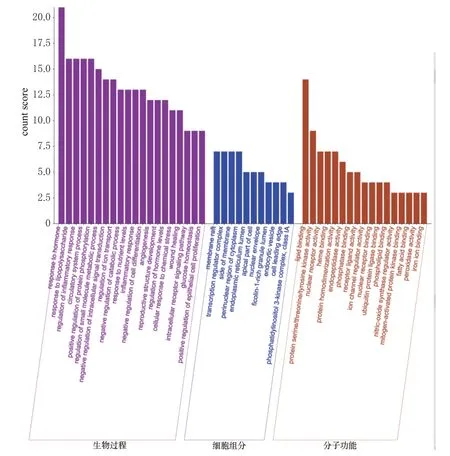
圖2 匝迪-5味丸改善MIRI的GO富集分析結果

圖3 匝迪-5味丸改善MIRI的KEGG通路富集分析結果
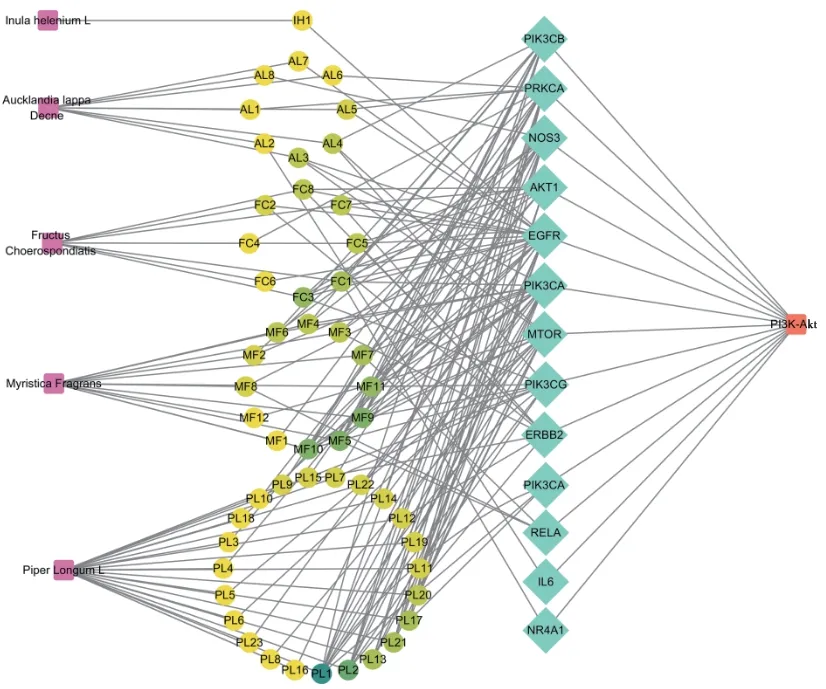
圖4 匝迪-5味丸的MIRI改善作用與PI3K-Akt信號通路的關系網絡圖
3.2 動物實驗驗證結果
3.2.1 大鼠心電圖變化
與大鼠麻醉狀態比較,大鼠心肌缺血時ST段顯著升高(ST段抬高0.1 mV以上);與心肌缺血時比較,大鼠心肌缺血再灌注時ST段下降約50%,表明MIRI模型復制成功。
3.2.2 大鼠血清中心肌酶含量變化
與假手術組比較,模型組大鼠血清中CK、CTn-T、LDH、AST含量均顯著升高(P<0.05或P<0.01)。與模型組比較,丹參組和匝迪-5味丸高劑量組大鼠血清中CK、CTn-T、AST、LDH含量均顯著降低(P<0.05或P<0.01);匝迪-5味丸低、中劑量組大鼠血清中CTn-T和LDH含量均顯著降低(P<0.05或P<0.01),CK和AST含量變化差異無統計學意義(P>0.05)。結果見圖5。

圖5 匝迪-5味丸對MIRI模型大鼠血清中心肌酶CK、CTn-T、LDH、AST的影響(±s,n=12)
3.2.3 大鼠心肌組織形態變化
假手術組大鼠心肌組織染色均勻,形態結構正常,心肌纖維排列整齊,細胞分界清晰,紋理清晰,間質未見明顯異常,局部可見少量肥大細胞浸潤;與假手術組比較,模型組大鼠心肌組織形態結構紊亂,排列疏松,細胞分界不清,間質可見水腫,心肌纖維斷裂、溶解,伴大量炎癥細胞浸潤;與模型組比較,丹參組和匝迪-5味丸各劑量組大鼠心肌組織病理形態均有不同程度改善,細胞分界相對清晰,心肌纖維排列相對規則,炎癥細胞浸潤相對減少。結果見圖6。
3.2.4 大鼠心肌細胞凋亡情況
與假手術組比較,模型組大鼠心肌細胞凋亡率顯著升高(P<0.01);與模型組比較,丹參組和匝迪-5味丸各劑量組大鼠心肌細胞凋亡率均顯著降低(P<0.01)。結果見圖7和圖8。

圖7 匝迪-5味丸對MIRI模型大鼠心肌細胞凋亡的影響(TUNEL染色,×200)

圖8 匝迪-5味丸對MIRI模型大鼠心肌細胞凋亡率的影響(n=6)
3.2.5 大鼠心肌組織中關鍵通路和凋亡相關蛋白的表達變化
與假手術組比較,模型組大鼠心肌組織中PI3K、Akt、Bcl-2蛋白表達水平均顯著降低,Bax、caspase-3蛋白表達水平均顯著升高(P<0.05或P<0.01)。與模型組比較,丹參組和匝迪-5味丸各劑量組大鼠心肌組織中Bcl-2蛋白表達水平均顯著升高,Bax、caspase-3蛋白表達水平顯著降低(P<0.01);丹參組和匝迪-5味丸高、中劑量組PI3K、Akt蛋白表達顯著升高(P<0.05或P<0.01)。結果見圖9和圖10。

圖9 匝迪-5味丸對MIRI模型大鼠心肌組織中關鍵通路蛋白和凋亡相關蛋白表達影響的電泳圖

圖10 匝迪-5味丸對MIRI模型大鼠心肌組織中關鍵通路蛋白和凋亡相關蛋白表達的影響(n=6)
4 討論
心肌缺血的病理過程復雜,具體病理機制尚未明確。但已有研究表明,抑制心肌細胞凋亡是治療MIRI的重要措施[8]。本課題組前期研究發現,匝迪-5味丸能有效縮小MIRI模型大鼠的心肌梗死面積[6],但具體作用機制尚不明確。本研究利用網絡藥理學方法篩選了匝迪-5味丸的活性成分及作用靶點,以及心肌缺血的相關靶基因,預測了匝迪-5味丸改善MIRI的潛在作用靶點和通路。結果,共獲得匝迪-5味丸的活性成分177個,作用靶點220個,參與改善心肌缺血的靶點51個,其中核心靶點為AKT1,涉及PI3K-Akt、內質網、HIF-1等多個通路。結合本課題組前期研究,推測匝迪-5味丸改善MIRI可能與PI3K-Akt通路有關。
本研究建立了MIRI大鼠模型,在蛋白水平上進一步探討了匝迪-5味丸的心肌保護作用機制。在建模過程中,大鼠心肌缺血時,心電圖ST段顯著抬高(ST段抬高0.1 mV以上),再灌注時ST段下降約50%,表明MIRI模型復制成功。已有研究證實,血清中LDH、CK、AST、CTn-T等心肌酶含量異常升高程度可反映心肌受損程度[9]。本實驗結果顯示,與模型組比較,復方丹參滴丸和匝迪-5味丸可不同程度地降低模型大鼠血清中CK、CTn-T、LDH、AST含量,同時改善心肌組織病理形態。
PI3K-Akt是再灌注損傷補救激酶信號通路。研究表明,PI3K-Akt信號通路與心血管疾病關系密切,在MIRI的復雜病理過程中處于核心地位,可減輕心肌細胞凋亡損傷,發揮心肌保護作用[10]。Akt是PI3K-Akt信號通路發揮生物學效應的關鍵分子,具有3種同源性亞型(Akt1、Akt2、Akt3),其中Akt1高表達于心、腦、肺等組織,參與細胞增殖、生長、細胞凋亡[11]。本實驗結果顯示,與模型組比較,復方丹參滴丸和高、中劑量匝迪-5味丸可顯著升高大鼠心肌組織中PI3K、Akt蛋白表達水平,可見匝迪-5味丸改善MIRI的作用機制可能與PI3K-Akt信號通路有關。
MIRI病理機制復雜,涉及通路、途徑眾多,而凋亡是其中最為重要的病理機制之一。本研究TUNEL檢測結果顯示,MIRI會引起心肌細胞凋亡,而匝迪-5味丸可顯著抑制大鼠心肌細胞凋亡率。在分子水平上,抗凋亡蛋白Bcl-2和促凋亡蛋白Bax以相對穩定的比例存在于細胞中,二者的表達失衡是造成細胞凋亡的關鍵因素[12]。在內源性凋亡途徑中,Bax作用于線粒體外膜可促進細胞色素C釋放到細胞質中并活化caspase-3,進而誘導細胞凋亡;在外源性凋亡途徑中,跨膜受體與配體結合形成死亡信號復合物,可激活caspase-3誘導細胞凋亡,因此caspase-3是介導細胞凋亡的關鍵調控因子[13]。而Bcl-2可減少線粒體細胞色素C釋放,從而阻止細胞凋亡[14]。本實驗結果顯示,與模型組比較,匝迪-5味丸可顯著降低大鼠心肌組織中Bax、caspase-3蛋白表達水平,顯著升高Bcl-2蛋白表達水平,表明匝迪-5味丸可能通過PI3K-Akt信號通路調節細胞凋亡相關蛋白,保護心肌損傷。
綜上所述,匝迪-5味丸可能通過激活PI3K-Akt信號通路抑制細胞凋亡,從而發揮改善MIRI的作用。然而,MIRI機制復雜,且匝迪-5味丸具有多成分、多靶點、多通路協同作用特點,作用機制也不只涉及PI3K-Akt信號通路,其他機制有待今后進一步探究。

