綿羊布魯氏菌病抗病育種研究進展
武上杰,欒園園,王明坤,張賀春,于 波,馬月輝,蔣 琳,何曉紅*
(1.中國農業科學院北京畜牧獸醫研究所,北京 100193;2.朝陽市朝牧種畜場有限公司,朝陽 122629)
布魯氏菌病(以下簡稱布病)是一種由布魯氏菌(以下簡稱布菌)感染引起的人畜共患病,具有高度傳染性,在170多個國家和地區流行,每年感染人數逾50萬[1]。根據布菌對宿主的偏好性,一般將其分為羊種(B.melitensis)、牛種(B.abortus)、豬種(B.suis)、鼠種(B.neotomae)、犬種(B.canis)和綿羊附睪種(B.ovis)等[2]。其中,B.melitensis(綿羊和山羊均易感)的毒力和感染性最強,也是人間布病的最主要病原,在我國占據主導地位[3]。此外,B.suis和B.ovis在綿羊群的感染狀況也不容忽視[4]。布病的典型癥狀表現為波浪熱、關節炎和繁殖障礙(公畜睪丸炎和附睪炎,母畜流產和不孕)。我國是綿羊生產大國,存欄量在2022年已達1.86億只。但近年來,綿羊布病疫情在華北和西北等地呈蔓延趨勢[5-6],不僅給我國綿羊養殖業帶來巨大經濟損失,還對公共衛生形成重大安全隱患。
布病是自然疫源性傳染病,提高管理水平、接種疫苗和淘汰染疫動物是部分發達國家防控和凈化布病的成功模式[3,7],但在我國仍面臨巨大挑戰[8]。一方面,布菌是兼性胞內寄生菌,具有免疫逃避能力,布病臨床表現為隱性感染和慢性經過,早期難發現,晚期難控制;另一方面,疫苗作用有限[9],加之我國羊群基數龐大,流動性強,尚未全面形成集約化養殖,疫苗難以完全覆蓋。因此常規措施難以有效控制布病在我國的流行態勢。從長遠來看,開展綿羊抗布病新品種的選育工作,提高宿主動物抗病力,能根本上從動物源頭切斷布病的傳播途徑,真正落實“人病獸防,關口前移”。
1 布菌的致病機制
布菌是兼性胞內寄生菌,能侵入多種細胞,介導凋亡與自噬進程,建立起復制生態位以逃避免疫殺傷,營造出微環境來維持慢性感染[10]。毒力因子的存在對于布菌生存繁殖的維系以及免疫逃避策略的執行不可或缺。如布菌的非典型脂多糖(lipopolysaccharide,LPS)協同外膜蛋白(outer membrane proteins,OMPs),不僅可抑制免疫激活,阻止補體沉積,還能限制溶酶體融合[11-13]。同時,布菌缺少諸如外毒素、菌毛、鞭毛和質粒等強效致病因子,因此其較弱的免疫原性往往不會引起宿主機體強烈的免疫應答[13]。
1.1 感染與侵襲
布菌可經呼吸道、消化道、眼結膜和損傷皮膚感染宿主,侵入吞噬細胞(如巨噬細胞、樹突狀細胞和中性粒細胞)以及非吞噬細胞(如上皮細胞、成纖維細胞和滋養層細胞)[14]。脂筏(lipid raft)存在于質膜表面,富含膽固醇和鞘磷脂,是參與細胞膜內外信號傳導和物質傳遞的專門膜微區[15],能介導巨噬細胞以內吞的方式攝取布菌[16]。布菌的環β-1,2-葡聚糖(cyclic β-1, 2-glucan,CβG)能擾亂脂筏中的膽固醇組分[17-18]。發動蛋白(dynamin)和網格蛋白(clathrin)共同作用于布菌內化過程中包被囊泡的再分配和重排[19]。發動蛋白具有GTP酶活性,可選擇性地調節囊泡的組裝[20];網格蛋白匯聚于脂筏,招募發動蛋白富集,擠壓質膜內陷形成小窩,進而包被囊泡[21]。至此,布菌被質膜裹入細胞內部。
1.2 運輸與定位
巨噬細胞既是布菌侵入的主要靶細胞,又是先天免疫的重要功能細胞。90%的內化布菌在感染前期會被清除,余下部分則遷移到內質網處建立起復制生態位[22]。布菌內化后形成的囊泡結構統稱布氏小體(Brucellacontaining vacuoles,BCVs),是布菌進行胞內運輸與定位的載體。在轉運初始階段,由BCVs形成的初級內體(early endosome)短暫接觸溶酶體,獲得其表面標記分子而成為eBCVs(early BCVs)[23],布菌CβG可阻止eBCVs被溶酶體深度融合[17-18]。同時,這種有限融合產生的酸化環境提供了激活布菌IV型分泌系統(type IV secretion system,T4SS)的信號[24],T4SS分泌的效應子重定向eBCVs的胞內運輸途徑,以阻止其與溶酶體過分接觸而被消化[13,25]。少數(約10%)逃避降解的布菌脫離內體,驅動效應子截獲由內質網出芽向高爾基體轉運的囊泡[26]。BCVs與內質網融合形成rBCVs(replicative BCVs)區隔,并帶有內質網的特異標記[22,27]。另外,雙組分調控系統(two-component regulatory system,TCS)時刻調控布菌對環境信號刺激的感知、傳遞和反應[28]。BCVs的胞內運輸與定位伴隨著分子標記的更新,內體特征的成熟標志著復制生態位的建立。
1.3 繁殖與擴散
在感染后期,rBCVs參與巨噬細胞的自噬途徑而轉化為aBCVs(autophagy BCVs),布菌完成胞內循環后開始胞間傳播[29]。巨噬細胞的裂解焦亡引發布菌的外流逸散,Hiyoshi等[30]發現布菌可利用T4SS穿透BCVs膜形成PIT(pore-induced intracellular trap)結構,誘使補體沉積其中,產生補體依賴的find-me信號,啟動中性粒細胞對PIT的胞吞攝取,而留存于PIT中的布菌得以逃避呼吸爆發。
2 綿羊布病的抗病育種研究進展
畜禽抗病育種,簡言之就是通過定向選擇或改變特定基因型來培育具有抗病能力的畜禽新品種,主要分為3個方向:家系群體選育、基因工程選育和標記輔助選育。
2.1 抗病性與遺傳基礎
2.2 家系群體選育
群體選育指從畜禽種群挑選抗病力突出的個體作為親本建立家系,再通過對子代逐代選擇純化目的基因,獲得穩定遺傳抗病性狀的新品種。這種傳統的育種方式實際上是對基因型的直接選擇,耗時、費力和成本高的缺點突出,因此往往應用于世代間隔短、群體規模大的家禽研究中,如雞抗沙門菌[35]和鴨抗肝炎病毒[36]等,而在綿羊的抗病研究中應用較少。
2.3 基因工程選育
基因工程選育指利用鋅指核酸酶(ZFNs)、轉錄激活因子樣效應物核酸酶(TALENs)和成簇規律間隔短回文重復序列及其相關蛋白(CRISPR/Cas9)等基因編輯技術對畜禽基因組敲除受體基因或轉入目的基因[37]。相較于其它基因編輯技術,CRISPR/Cas9因其高效、穩定和廉價的優點而被廣泛應用于轉基因動物生產中。
Toll樣受體4(TLR4)能識別布菌的脂多糖成分,激活炎癥反應和免疫反應。2012年,中國農業大學的研究團隊對薩福克綿羊受精卵微量注射線性化的pTLR4-3S載體,借助胚胎移植技術,成功構建了過表達TLR4的轉基因綿羊。進一步的攻毒試驗結果顯示,IL-6、IL-8和TNF-α的表達水平提高,炎癥細胞的凋亡增加,機體的抗布菌感染能力明顯增強[38]。在此基礎上,該團隊改進方法,在綿羊非繁殖季也能通過微量注射原核胚胎生產轉基因綿羊,并且發現TLR4的過表達對綿羊的生長無不良影響[39]。
褪黑素(melatonin,MT)是由松果體分泌的神經類激素,作為一種抗氧化劑,可緩解氧化應激和促進免疫系統成熟,N-乙酰基-5-羥色胺-O-甲基轉移酶(N-acetylserotonin O-methyltransferase,ASMT)是其合成過程中的關鍵限速酶[40]。2017年,中國農業大學的研究團隊選用杜泊綿羊作為供受體,利用CRISPR/Cas9、微量注射和胚胎移植技術成功構建出過表達ASMT的轉基因綿羊[41]。布菌攻毒試驗發現轉基因綿羊均未患病,并且差異表達基因顯著富集在自然殺傷細胞介導的相關通路,這表明轉基因綿羊抗布病能力強于野生型[42]。
2.4 標記輔助選育
標記輔助選擇(marker-assisted selection,MAS)指利用育種性狀相關標記代替表型層次的選擇,抗病性狀標記輔助選擇可分為免疫遺傳學標記輔助選擇和分子標記輔助選擇[43]。其中,分子標記輔助選擇指從分子水平利用與目標基因緊密連鎖的遺傳標記直接選擇基因型,可在遺傳本質上選育綿羊抗布病新品種。與家系群體選育相比,標記輔助選育可有效縮短世代間隔、增大選擇強度、提高選種準確性和降低育種成本;與基因工程選育相比,標記輔助選育可避免生物安全、倫理道德和動物福利等方面的諸多限制。主效基因的挖掘是標記輔助選擇的基礎工作,以下從免疫和炎癥反應的激活和效應兩個階段介紹布病相關基因和非編碼RNA(non-coding RNAs,ncRNAs)。另外,如表1和表2所示,大多數研究選用B.abortusS2308經典菌株驗證基因功能,不同菌株與宿主之間作用機制的比較還未見文獻報道。
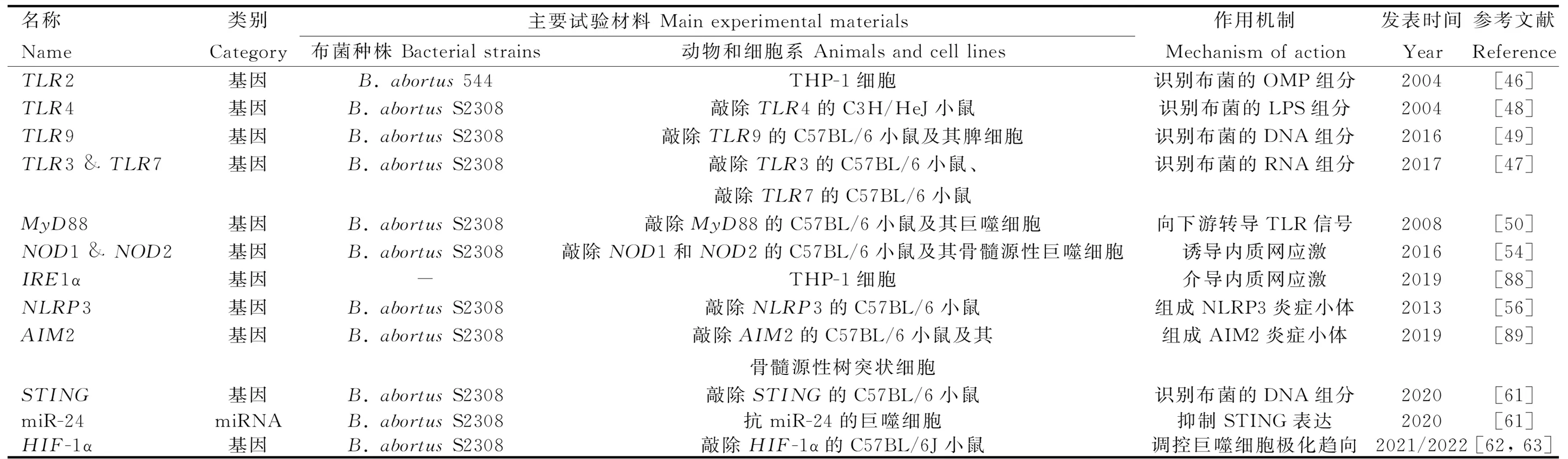
表1 參與免疫和炎癥反應激活階段的基因或ncRNA
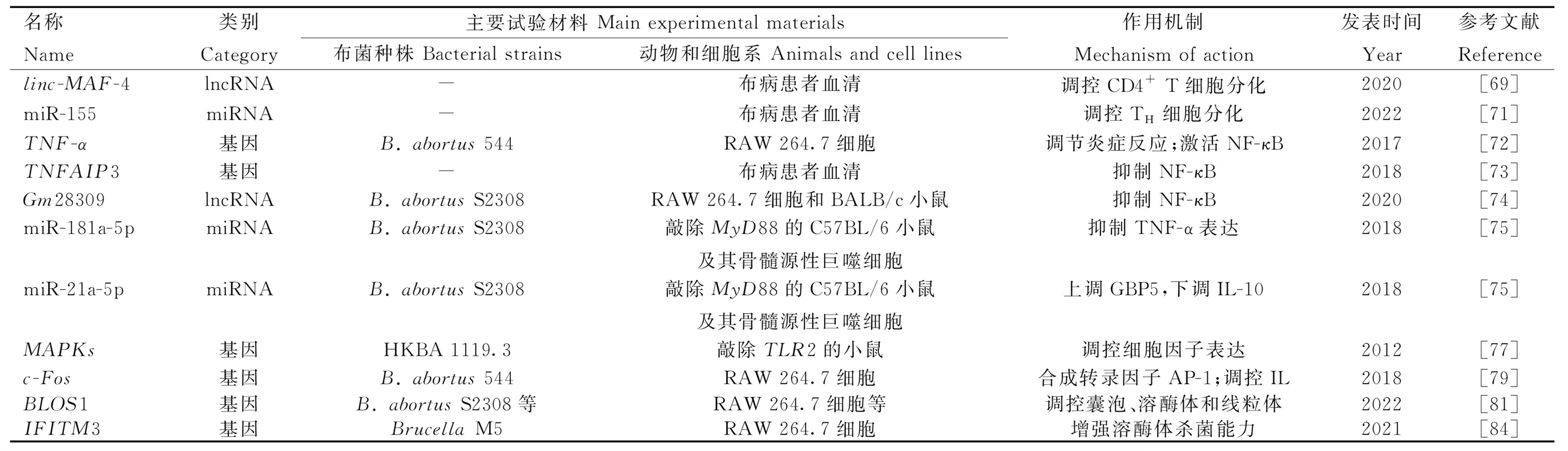
表2 參與免疫和炎癥反應效應階段的基因或ncRNA
2.4.1 參與免疫和炎癥反應激活階段的基因或ncRNA 免疫和炎癥反應的激活依賴于模式識別受體(pattern recognition receptors,PRRs)結合病原相關分子模式(pathogen-associated molecular patterns,PAMPs)或損傷相關分子模式(damage-associated molecular patterns,DAMPs)。能識別布菌的PRRs主要分為Toll樣受體(toll-like receptors,TLRs)和NOD樣受體(NOD-like receptors,NLRs)。
2.4.1.1 Toll樣受體:TLRs是跨膜蛋白受體,其抗菌作用最早在1996年被發現于果蠅的真菌感染試驗中[44]。迄今為止,在哺乳動物中共鑒定到13種TLRs,能監測多種PAMPs組分[45]。其中,TLR2駐留于質膜,能識別布菌的OMP[46];TLR3和TLR7駐留于內體膜,能識別布菌的RNA[47];TLR4駐留于質膜,能識別布菌的LPS[48];TLR9駐留于內體膜,能識別布菌的DNA[49]。除TLR3外,活化的TLRs均可募集髓樣分化因子88(myeloid differentiation factor 88,MyD88)。MyD88是一種胞質可溶性的接頭蛋白(adaptor),能將TLR信號向下游的IκB激酶(IKK)復合物和MAPK激酶激酶(MAP3K)轉導,促進炎癥介質和細胞因子的釋放。若敲除小鼠的MyD88,則在感染布菌時,其巨噬細胞產生的TNF-α和IL-12顯著減少[50],TNF-α和IL-12是首要的促炎癥因子。由B.Melitensis分泌的TIR結構域蛋白(TIR domain-containing proteins,Tcps)稱TcpB,TcpB可直接結合MyD88,阻礙TLR依賴于MyD88介導的NF-κB激活,還能誘導未折疊蛋白反應的靶基因表達[51-52]。
2.4.1.2 NOD樣受體:NLRs家族是定位于胞漿的模式識別受體,其中,NOD1和NOD2可識別布菌胞壁的肽聚糖組分,通過結合接頭蛋白RIP2激活IKK復合物和MAP3K[53]。此外,NOD1和NOD2還是誘導內質網應激的重要介質:布菌在侵入宿主細胞后會通過T4SS釋放效應子VceC,觸發由內質網應激傳感器IRE1α介導的未折疊蛋白反應。其中,IRE1α是內質網跨膜蛋白,可募集TRAF2(TNF-receptor associated factor 2),依賴于NOD1和NOD2激活NF-κB受體[54]。布菌能通過IRE1α軸抑制宿主細胞的自噬[55]。NLRs家族的NLRP3受體蛋白在抗布菌感染中同樣發揮重要作用。一般地,NF-κB信號的激活促進NLRP3的表達,NLRP3與凋亡相關斑點樣蛋白(ASC)和半胱氨酸天冬氨酸蛋白酶1前體(pro-caspase-1)組裝形成的NLRP3炎癥小體,同源活化的caspase-1剪切促炎細胞因子IL-1β和IL-18的前體,使其成熟并釋放到胞外,增強機體免疫能力[56]。最近的研究完善了該通路,在布菌感染時,IRE1α可誘導活性氧(ROS)依賴性的NLRP3易位到內質網與線粒體連接處,激活caspase-2和BID之間的信號軸,導致線粒體的損傷相關分子模式(DAMP)釋放,刺激NLRP3炎癥小體合成[57]。這一發現整合了布菌感染過程中內質網應激、線粒體損傷與先天免疫之間的聯系。另外,黑色素瘤缺乏因子2(absent in melanoma 2,AIM2)是最近發現的胞內PRR,可識別布菌DNA,由其組裝的AIM2炎癥小體,同樣能增進IL-1β和IL-18的產生[56,58]。
2.4.1.3 其他模式識別受體:除TLRs和NLRs外,在2008年,首次發現了干擾素基因刺激蛋白(stimulator of interferon genes,STING)參與固有免疫應答的信號轉導作用[59]。STING位于內質網膜,不僅能作為PRR行使區別于TLR9的“布菌DNA識別作用”,還能充當接頭蛋白發揮二級受體結合cGAMP的“布菌DNA傳感作用”,激活I型IFN的產生,調控促炎細胞因子通過NF-κB途徑介導巨噬細胞的自噬,支持CD8+T細胞的適應性免疫[59-60]。最近,Khan等[61]發現布菌可在感染早期抑制宿主細胞編碼STING的Tmem173基因表達,并能誘導靶作用于STING的miR-24產生,增加免疫激活的成本,破壞胞漿監測的機制。在此基礎上,Oliveira團隊[62-63]的兩項研究接連報道了STING通過缺氧誘導因子1α(HIF-1α)調控巨噬細胞在抗布菌感染中的代謝重編程,驅動其向促炎的M1型或抗炎的M2型極化,并指出該過程與IRE1α所介導的內質網應激緊密聯系。有關HIF的發現已獲得2019年的諾貝爾生理學和醫學獎,但其在布病上的研究較少。
只聽張小飛大喊一聲:“教練,接好了!”他猛地飛起一腳,只見足球在空中翻轉了360度,又向下45度直沖過來,最后準確無誤地擊中了一名高年級同學的腿,那位同學疼得嗷嗷直叫,全場隊員卻笑得人仰馬翻。
2.4.2 參與免疫和炎癥反應效應階段的基因或ncRNA
2.4.2.1 免疫應答:主要組織相容性復合物(major histocompatibility complex,MHC)主要分為MHC I、MHC II和MHC III。經巨噬細胞處理的布菌肽段可由MHC II遞呈給CD4+T淋巴細胞中的輔助性T細胞(helper T cell,TH),促進特異性TH的增殖及其淋巴因子(如IFN-γ)的表達,IFN-γ能激活巨噬細胞的殺菌作用,在抗布菌的細胞因子中發揮首要作用;也可由MHC I遞呈給CD8+T淋巴細胞,使其活化成細胞毒性T淋巴細胞,殺傷感染布菌的靶細胞[64]。TH細胞包含TH1亞型和TH2亞型,它們分別是介導布菌感染前期細胞免疫和后期體液免疫的優勢亞群[65-66]。而控制TH細胞分化方向的關鍵是cMAF。cMAF是促進CD4+T細胞依賴IL-4向TH2亞型分化的特異性轉錄因子[67]。在2015年,Ranzani等[68]首次發現linc-MAF-4可抑制cMAF活性。最近,布病患者的血清學檢測結果證實,過表達的linc-MAF-4調控CD4+T細胞在感染早期趨向TH1亞型分化[69]。另外,miR-155最近也被證實可調控TH細胞的發育分化來應對布菌感染[70-71]。
2.4.2.2 NF-κB信號通路:由接頭蛋白MyD88或RIP2激活的IKK復合物促使NF-κB與抑制因子IκB解聚,暴露出核定位序列,由胞漿轉運至核內,啟動細胞因子表達。若阻斷NF-κB,則顯著抑制腫瘤壞死因子α(tumor necrosis factor alpha,TNF-α)的表達和分泌。同時,TNF-α也是一種具有調節作用的促炎細胞因子,其與受體TNFR-1的結合能導致IκB泛素化,正反饋于NF-κB途徑,減少抗炎細胞因子(如IL-10),增加促炎細胞因子(如活性氧和一氧化氮)[72]。但是,由TNF-α所誘導表達的一種泛素編輯酶A20,也稱腫瘤壞死因子α誘導蛋白3(tumor necrosis factor alpha-induced protein 3,TNFAIP3),它能抑制NF-κB活化,該基因座的相關風險變異能增進IL-6和IL-1β產生,在應對布菌感染中發揮保護作用[73]。布菌通過影響巨噬細胞ncRNA的表達可抑制炎癥反應的進行。比如,上調的Gm28309(競爭性內源RNA)能充當分子海綿富集miR-3068-5p,以阻止κB-Ras2蛋白的降解,抑制NF-κB的激活[74];miR-181a-5p和miR-21a-5p依賴于MyD88變化,前者上調,抑制TNF-α表達,后者下調,導致抗菌的鳥苷酸結合蛋白5(GBP5)減少和抗炎的IL-10增加[75]。
2.4.2.3 MAPK信號通路:絲裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)信號通路包括MAPK激酶激酶(MAP kinase kinase kinase,MAP3K)、MAPK激酶(MAP kinase kinase,MAP2K)和MAPK。由接頭蛋白MyD88或RIP2激活的MAP3K逐級激活MAP2K和MAPK,MAPK家族成員包括ERK1/2、JNK和p38。MAPK級聯系統調控免疫和炎癥反應,或還影響BCVs的轉運與定位。早先,在小鼠巨噬細胞中發現布菌LPS通過限制MAPK信號通路(p38、ERK1/2和JNK)的激活,抑制TNF-α等細胞因子的合成[76]。隨后的研究指出,由TLR2誘導的MAPK信號通路(p38和ERK1/2)激活能抑制由TLR9介導的IL-12產生[77]。布菌在人單核細胞內的維持與復制反而依賴于由TLR2介導的MAPK信號通路(p38和JNK)延遲激活[78]。MAPK信號通路可激活轉錄因子激活蛋白-1(activator protein-1,AP-1),有效促進炎癥反應清除布菌。AP-1是由原癌基因c-Fos和c-Jun所編碼的蛋白二聚體,其中,c-Fos可通過抑制促炎因子IL-10的產生來限制布菌的生存,但也會負調控TNF-α、IL-6和IL-10等抗炎因子,并且c-Fos還負反饋于TLR4[79]。綜上,在響應布菌刺激時,NF-κB與MAPK通路之間密切聯系,信號串擾(crosstalk)。
2.4.2.4 其他細胞因子:在布菌胞內寄生的各環節,某些炎癥因子可作用于囊泡、溶酶體和內質網來控制感染。例如:1)溶酶體相關細胞器生物發生復合物-1亞基1(biogenesis of lysosome-related organelles complex-1 subunit 1,BLOS1)在線粒體和溶酶體的功能行使以及囊泡和內體的胞內運輸中承擔重要功能[80]。Wells等[81]發現BLOS1是防御布菌感染的新型免疫因子,而布菌能通過內質網應激途徑的IRE1α-RIDD軸定向降解翻譯BLOS1的mRNA。 2)干擾素刺激基因家族(interferon-stimulated genes,ISGs)表達的干擾素誘導跨膜蛋白(IFITM3)是先天免疫的關鍵效應器[82],可介導溶酶體pH降低,有效抑制布菌等多種胞內病原體[83]。經布菌刺激的小鼠巨噬細胞能分泌包含IFITM3的外泌體,廣泛地增強微環境中未感染細胞的免疫能力[84]。3)天然抗性相關巨噬蛋白1(natural resistance associated macrophage protein 1,NRAMP1)通過競爭性消耗布菌[85-86]和分枝桿菌[87]等胞內寄生菌繁殖所必需的鐵、鎂等二價金屬離子而發揮抗菌作用。
3 綿羊抗布病育種研究存在的問題
目前,綿羊抗布病育種工作還處于研究階段,正面臨許多問題,如: 1)遺傳機制復雜,易受環境因素影響,目前綿羊抗布病性狀的遺傳力及其與生產性狀的相關作用有待評估; 2)篩選指標不明確,目前抗布病性狀主要用免疫指標表征,如血清抗體滴度,但將其視作閾性狀抑或數量性狀還有待研究; 3)主效基因稀缺,目前國內外挖掘出的抗布病候選基因均非主效基因,不足以支撐分子標記輔助選擇工作的展開; 4)功能驗證困難,布病為二類動物疫病,布菌攻毒試驗要求在三級及以上生物安全實驗室進行,增加了候選基因下游驗證的難度。
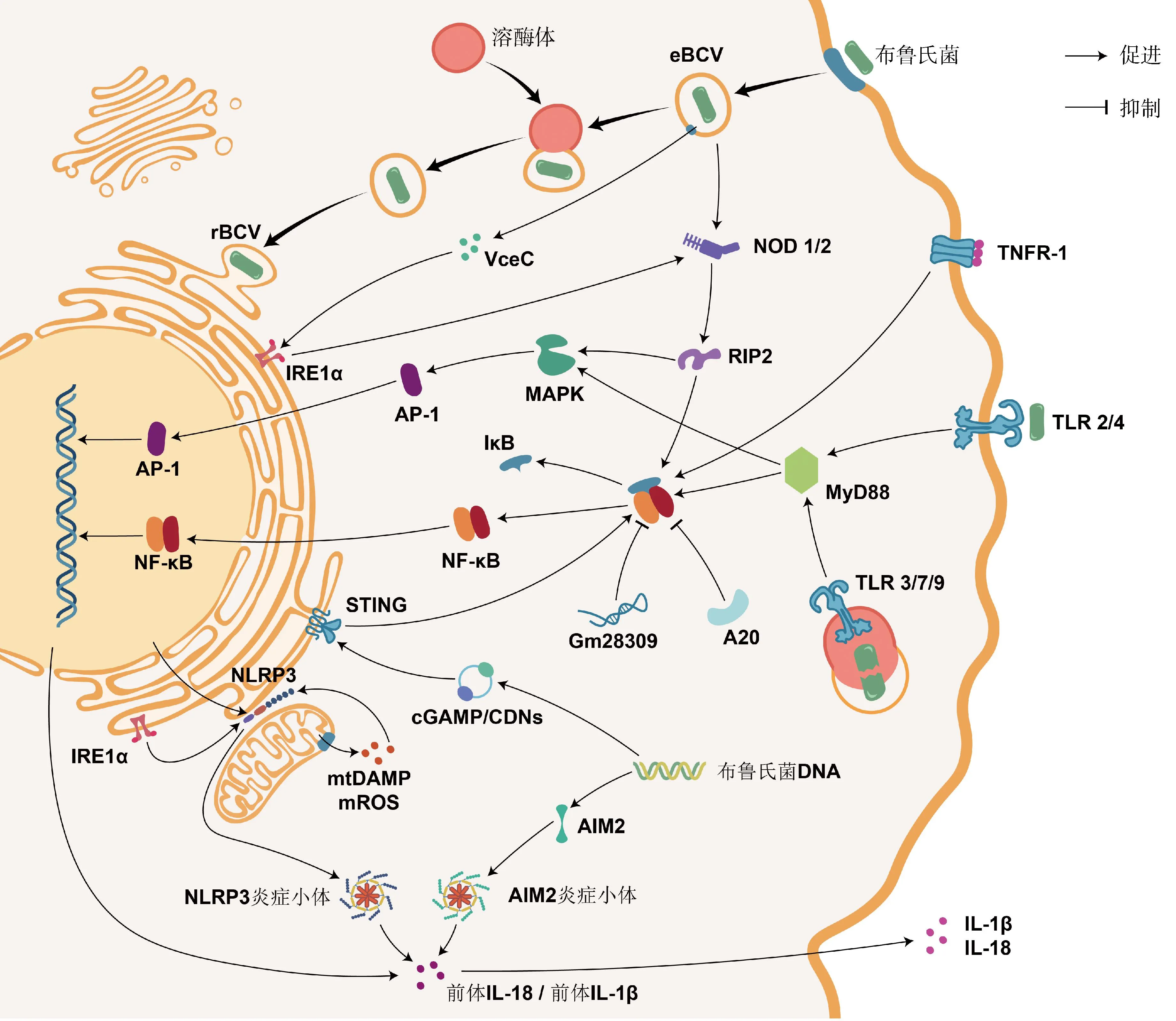
圖1 參與免疫和炎癥反應的基因或ncRNA及其通路Fig.1 Genes or ncRNAs involved in immune and inflammatory responses and their pathways
4 展 望
機器學習(mechine learning,ML)是人工智能領域近年新興的分支,適用于數據驅動的科學,能有效處理基因組高維數據信息,在生物育種研究中展現出巨大潛力,為基因挖掘工作提供了全新視角。基于監督機器學習算法,例如決策樹(decision tree,DT)、隨機森林(random forest,RF)、支持向量機(support vector machines,SVM)和神經網絡(neural network,NN)等[90],輸入訓練集、驗證集和測試集數據的基因型特征與抗布病表型標簽,建立結合年齡、性別和品種等效應的“基因多態性-抗布病性能”預測模型,以達到根據綿羊基因分型信息預測其抗布病能力表型的目的,實現依據特征值貢獻比例篩選有效抗布病突變位點的目標。總之,隨著布病研究的深入,布菌的毒力因子作用和免疫逃避機制日漸明晰,越來越多的研究者加入抗布病位點基因的挖掘和驗證工作中,相信終將培育出兼顧優良經濟性狀的抗布病新品種綿羊。

