米托蒽醌甲磺酸鹽預處理脂肪間充質干細胞對犬糖尿病的治療效果評價
譚 寧,李巴侖,韓 苗,李琛琛,景遠翔,寇 正,李 娜,彭 莎,趙獻軍,2,華進聯*
(1.西北農林科技大學動物醫學院 陜西省干細胞工程技術研究中心,楊凌 712100;2.百歐派(天津)生物技術有限公司,天津 300350)
糖尿病(diabetes mellitus,DM)是一種由于遺傳、生活方式及外界刺激等多種因素導致胰島β細胞受損無法正常產生胰島素,或者靶組織細胞對胰島素敏感性降低而引發系列代謝紊亂的綜合征,通常表現為機體血糖水平升高且無法自行恢復[1]。隨著人們物質和精神需求的日益增長,犬、貓等伴侶動物已經成為許多家庭的重要“成員”,且因為犬、貓等的生存環境、飼養方式及生活模式也頗為“擬人化”,完全按照人類慣用的模式進行,所以犬、貓等伴侶動物中糖尿病的患病率、發病率及死亡率也在逐年增加。作為一種臨床常見、容易誘導并發癥的內分泌代謝類疾病,犬糖尿病的常用治療方式與人類相似,多為胰島素注射搭配降糖藥物口服,但是存在操作難度大、無法給予有效反饋、治療效果無法穩定維持、降糖藥物存在一定毒性等問題,無法對犬類糖尿病起到很好的控制或者從根本上治療等作用。所以尋找一種安全、方便且高效的治療方式可謂是迫在眉睫。
間充質干細胞(mesenchymal stem cells,MSCs)是一類組織來源十分廣泛的成體干細胞,具有干細胞的所有共性,即自我更新和多向分化能力,且增殖能力強、免疫原性小,極具臨床應用價值。在臨床中,MSCs在血液系統、心血管系統、神經系統,內分泌代謝系統等多方面的疾病治療中發揮極大的潛力[2-4]。對于糖尿病及其相關疾病,MSCs能夠通過多種途徑起到良好的治療作用,其途徑主要包括:緩解胰島素抵抗[5-7]、促進胰島再生[8-11]、減輕炎癥[12-14]、分泌營養因子[15-17]、減少細胞凋亡[18-20]。但是MSCs仍存在體外培養時間過長易衰老、移植到體內后作用時間短等問題,所以探索一種能夠提高ADMSCs治療效果的新方法十分必要。
米托蒽醌甲磺酸鹽(mitoquinone mesylate,MitoQ)是由劍橋大學和奧塔哥大學的科學家于2000年最先發現的一種泛醌衍生物,其由三苯基磷陽離子(triarylphosphines,TPP+)與輔酶Q 10(CoQ 10)的苯醌部分通過1個十碳脂肪鏈共價結合構成[21-22]。MitoQ的分子式是C37H46O4PBr,其分子量為665.65[23]。CoQ 10作為一種內源性合成的脂溶性抗氧化劑,是組成呼吸鏈的必需成分,在線粒體內參與機體所有細胞產生能量的過程,保護細胞免受自由基的氧化損傷[24]。MitoQ作為一種強大的抗氧化劑,在前期研究中已被證明能夠有效減輕氧化應激,應用潛力大,能夠對細胞損傷、組織損傷及各類疾病起到很好的治療和恢復作用[25-30]。然而其研究尚缺乏一些關鍵的體內模型試驗以及特異性的關鍵作用通路,針對MitoQ進行進一步探索,可以為由于氧化應激和線粒體功能障礙而導致的各類疾病治療提供科學依據,同時,為各種重大疾病提供有效的防控措施。總之,MitoQ的相關研究已經證明了它的強大應用前景,將MitoQ與間充質干細胞相結合,可能極大促進臨床中的應用,為疾病治療提供新對策和新方案。
1 材料與方法
1.1 細胞復蘇傳代
取出ADMSCs,置于15 mL離心管中,1 500 r·min-1離心5 min,棄上清,加入新鮮配置的α-MEM+培養液,移入培養皿,“十”字法混勻,置于37 ℃恒溫培養箱中培養。
鏡下觀察,待細胞貼壁培養增殖至80%時,加入胰蛋白酶,37 ℃恒溫培養箱靜置5 min,待ADMSCs形狀變圓且飄起時,終止消化,1 500 r·min-1離心3 min,觀察到細胞團塊后,棄上清,按照所需接種比例轉移至新的培養皿中,并按照不同培養皿的規格添加不同劑量的培養液,繼續進行細胞培養。
本試驗中,MitoQ-ADMSCs為P3代ADMSCs,經正常復蘇后,待培養至80%時,按照1∶6比例傳代至新的培養基中,并使用含MitoQ的α-MEM+培養基進行后續培養,MitoQ在培養基中的濃度為1 μmol·L-1。
1.2 姬姆薩(Giemsa)染色
去除培養液,使用PBS清洗2次;加入新鮮的甲醇固定5 min;取Giemsa原液與PBS按照1∶9比例進行充分混合,作為工作液備用,待固定后,棄甲醇,加入Giemsa工作液,染色20 min;使用PBS清洗,鏡下觀察拍照,正常可見細胞核被染成紫紅色或藍紫色,細胞質則被染成淺紅色。
1.3 細胞生長曲線繪制
取正常培養的ADMSCs和MitoQ-ADMSCs,使用0.25%胰蛋白酶進行消化,后取細胞計數板進行計數,將ADMSCs和MitoQ-ADMSCs以每孔5×103個的密度接種于24孔板進行培養,每24 h隨機抽取2孔細胞進行消化、離心、重懸、計數,每孔重復2次,連續7 d。細胞計數結果以培養時間為橫軸,細胞數為縱軸,描繪后連成曲線即為兩種細胞的生長曲線。
1.4 乙基脫氧尿苷(EdU)染色
取正常培養的ADMSCs和MitoQ-ADMSCs,吸取1×105個細胞接種于96孔板中;EdU溶液稀釋后,進行染色,孵育2 h,PBS清洗;細胞固定液孵育30 min,清洗后加入2 mg·mL-1甘氨酸,孵育5 min,PBS清洗;加入Apollo染色液,避光孵育30 min,棄液;加入滲透劑清洗,棄液;按照100∶1的比例稀釋Hoechst 33342避光孵育1 h,PBS清洗;觀察、拍照、數據分析。
1.5 細胞遷移試驗
取生長狀態良好的ADMSCs和MitoQ-ADMSCs,接種于6孔板中培養至正常生長狀態;觀察細胞增殖至90%左右時,進行劃痕制作確保劃到底壁,PBS洗滌,確保劃痕區域無殘留;繼續培養,分別在12和24 h進行顯微鏡下拍照記錄。
1.6 細胞總RNA提取、cDNA合成及real-time PCR
取生長狀態良好的ADMSCs和MitoQ-ADMSCs,用Trozol法進行細胞RNA的提取。吸棄細胞中的α-MEM+培養基,加入1 mL Trizol后立刻進行混勻;吸取200 μL三氯甲烷充分混合,靜置5 min,4 ℃、12 000 r·min-1離心15 min,吸取無色上清;加入異丙醇,上下翻轉后靜置10 min,4 ℃、12 000 r·min-1離心10 min,吸棄上層液體,保留下層沉淀;加入75%乙醇,4 ℃、7 500 r·min-1離心5 min,去除殘存液體;RNA干燥后,加入DEPC水,進行濃度檢測,測定結果濃度偏高且無RNA降解時置于-80 ℃冰箱保存;按照cDNA反轉錄試劑盒得到cDNA,-20 ℃冰箱中保存。qRT-PCR體系按照說明書進行配制,相關引物見表1。

表1 qRT-PCR引物
1.7 活性氧(ROS)檢測
根據試劑說明書,稀釋活性氧熒光探針(2′,7′-dichlorodihydrofluorescein diacetate, DCFH-DA),并加入到培養基中,細胞濃度為1×106·mL-1,37 ℃恒溫培養箱內孵育20 min。每隔3~5 min吹打混勻1次。洗滌3次后,熒光顯微鏡下觀察、拍照。
1.8 動物試驗及處理
選用48只8周齡雄性昆明(KM)小鼠及12只中華田園犬。經1周適應性飼喂后,對所有小鼠及犬進行隨機分組:1)正常對照組(NC組);2)糖尿病模型組(Diabetes組);3)ADMSCs單獨治療組(ADMSCs組);4)MitoQ-ADMSCs聯合治療組(MitoQ-ADMSCs組)。每組12只小鼠或3只犬。NC組全程使用普通飼料飼喂,其他三組均改用高糖高脂飼料進行為期3周的飼喂,后對其進行為期16 h的禁食,并注射鏈脲佐菌素(streptozotin,STZ),其中小鼠腹腔注射劑量為40 mg·kg-1,1次·周-1,連續3周;犬皮下注射劑量為20 mg·kg-1,1次·d-1,連續3 d。注射1周后,對動物血糖水平進行為期3 d的連續監測,3次空腹血糖測量值均高于7.6 mmol·L-1,隨機血糖測量值高于11.1 mmol·L-1,視為糖尿病動物模型成功建立,若未成功建立,重復STZ注射,直至成功建立。后進行細胞移植治療,ADMSCs及MitoQ-ADMSCs聯合治療組(MitoQ處理ADSMCs劑量為1 μmol·L-1)注射劑量:小鼠尾靜脈注射2×106個,犬前肢靜脈注射1×107個。NC組和Diabetes組則注射同等劑量的PBS,連續治療3周。詳見表2。在此過程中,持續監測動物模型精神狀態、體重、采食量、飲水量、血糖水平、葡萄糖耐量等變化。治療結束1周后,禁食16 h,使用鹽酸賽拉嗪注射液對犬進行肌肉注射麻醉、采血、靜推氯化鉀注射處死、采集樣本。

表2 動物試驗
1.9 血糖監測
在動物糖尿病模型的制作過程及細胞移植治療期間,使用血糖儀對血糖水平進行監測。
葡萄糖耐量(OGTT)試驗可以正確反映動物對血糖的調節能力,經12 h禁食,在葡萄糖水溶液灌注前進行空腹血糖檢測,記為0 h血糖水平,之后對小鼠進行葡萄糖水溶液的灌胃,對犬進行誘導使其主動喝下,在2 h內進行4次檢測,繪制OGTT曲線。
1.10 體重監測
在動物糖尿病模型的制作過程及細胞移植治療期間,對小鼠和犬的體重進行持續監測,小鼠使用高精準度克重量器,犬使用小型臺稱,由人保定進行稱量。
1.11 采血與血清分離
小鼠摘除眼球采血;犬后心采血,收集血清備用。
1.12 肝和脂質代謝及氧化應激指標測定
按照南京建成公司生化檢測試劑盒的說明書步驟,分別測定標準品及血清樣品在試劑盒對應的波長下的吸光度OD值,首先按照標準品的結果制作標準曲線,后將樣品的OD值帶入標準曲線進行計算,從而計算樣品的實際濃度。血清肝代謝指標測定包括天門冬氨酸氨基轉移酶(AST)、丙氨酸氨基轉移酶(ALT);脂質代謝指標包括總膽固醇(TC)和甘油三酯(TG);胰腺組織氧化應激指標包括過氧化氫(H2O2)、超氧化物歧化酶(SOD)、丙二醛(MDA)、過氧化氫酶(CAT)。
1.13 組織樣采集、石蠟切片制備與HE染色
所有實驗動物在試驗結束1 周后處死,小鼠使用頸部脫臼方式,犬通過靜脈注射氯化鉀方式安樂死,采集胰腺、肝、腎、腹部皮下脂肪組織,置于4%多聚甲醛溶液(4% PFA)中固定,留存備用。固定好的組織塊標記,送至西安依科生物技術有限公司包埋,切成5 μm厚度的組織切片。
進行常規HE組織染色。
1.14 免疫熒光染色
通風櫥內,石蠟切片常規脫蠟至水;微波爐中使用pH 9.0的抗原修復液修復;1%牛血清白蛋白(1% BSA)室溫孵育2 h;胰島素抗體,按照1∶100比例用1% BSA進行稀釋4 ℃孵育過夜,PBS清洗;熒光二抗37 ℃避光孵育1 h,PBS洗滌(5 min×3次);Hoechst33342適量處理,熒光顯微鏡下觀察、拍照。
1.15 免疫組化染色
通風櫥內,石蠟切片常規脫蠟至水;微波爐中使用pH 9.0的抗原修復液修復;內源性過氧化物酶阻斷劑處理;滴加適量一抗,放置于37 ℃恒溫條件下孵育1 h,PBS洗滌(5 min×3次);滴加增強酶標羊抗小鼠/兔lgG聚合物于組織表面,室溫條件下孵育;PBS洗滌(5 min×3次);新鮮配制DAB顯色液孵育5~10 min;蘇木素染色液,分化2 min、沖洗返藍;二甲苯Ⅱ和二甲苯Ⅰ分別浸泡2 min;風干,中性樹脂封片,拍照。
1.16 過碘酸雪夫(PAS)染色
通風櫥內,石蠟切片常規脫蠟至水;將過碘酸溶液平衡至室溫,吸取過碘酸溶液滴加于組織上,避光反應8 min,轉移至蒸餾水中洗滌10 min;擦拭掉多余的液體,吸取Schiff試劑滴加在組織上,置于37 ℃黑暗環境中1 h,去除染色液,浸泡于蒸餾水中并置于搖床洗滌5 min;取出切片,滴加100 μL蘇木素染色液,待顏色發生變化時用自來水進行沖洗;將切片按照與水化階段完全相反的順序進行浸泡,每個濃度3 min后,在二甲苯Ⅱ和二甲苯Ⅰ分別浸泡2 min;風干,中性樹脂封片,拍照。
1.17 馬松(Masson)染色
石蠟切片常規脫蠟至水;Weigert氏鐵蘇木素染5 min,自來水沖洗;1%鹽酸酒精分化;麗春紅酸性復紅染色液 8 min;0.2%冰醋酸溶液2 min,甩干重復3次;適量的磷鉬酸水溶液2 min;冰醋酸水溶液處理,觀察切片;將切片按照與水化階段完全相反的順序進行浸泡,每個濃度3 min,二甲苯Ⅱ和二甲苯Ⅰ分別浸泡2 min;風干切片,中性樹脂封片,拍照。
1.18 代謝組學檢測
收集犬NC組、Diabetes組、ADMSCs組和MitoQ-ADMSCs組血清,送至上海中科新生命生物科技有限公司進行代謝組學檢測,數據分析使用XCMS軟件。
1.19 數據處理
選用GraphPad Prism 9軟件對數據進行整理、分析,顯著性差異分析選用T檢驗,各數據結果均為“平均值±標準差”,差異顯著性表示:*.P<0.05,**.P<0.01,***.P<0.001,ns表示無顯著差異。
2 結 果
2.1 MitoQ-ADMSCs和ADMSCs形態、生長、增殖及遷移能力差異
與同時復蘇的ADMSCs相比,MitoQ-ADMSCs形態未發生明顯變化,均為立體的梭狀結構,且細胞邊緣清晰可見(圖1a);對ADMSCs和MitoQ-ADMSCs進行為期7 d的細胞計數,結果顯示,MitoQ-ADMSCs的生長速度顯著優于ADMSCs,MitoQ-ADMSCs的群體倍增時間短于ADMSCs,且兩種細胞增長速度的差異在第3~5天最為明顯(圖1b);通過EdU細胞增殖試驗觀察到MitoQ-ADMSCs的增殖速率遠高于ADMSCs,可以看到同面積內MitoQ-ADMSCs處于增殖階段的細胞(紅色)更多(圖1c);此外,對二組在24 h內的遷移速度進行觀察,發現MitoQ-ADMSCs遷移速度顯著快于ADMSCs,尤其在12 h時最為明顯,MitoQ-ADMSCs具有明顯的遷移優勢(圖1d)。
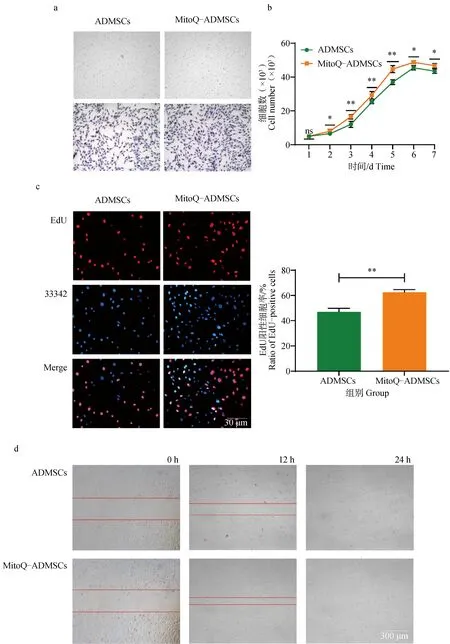
A. Giemsa染色; b.細胞生長曲線; c.EdU染色; d.細胞遷移試驗。*.P<0.05,**.P<0.01,***.P<0.001,ns.P>0.05a. Giemsa staining; b. Cell growth curve; c. EdU staining; d. Cell migration test.*.P<0.05, **.P<0.01, ***.P<0.001, ns.P>0.05
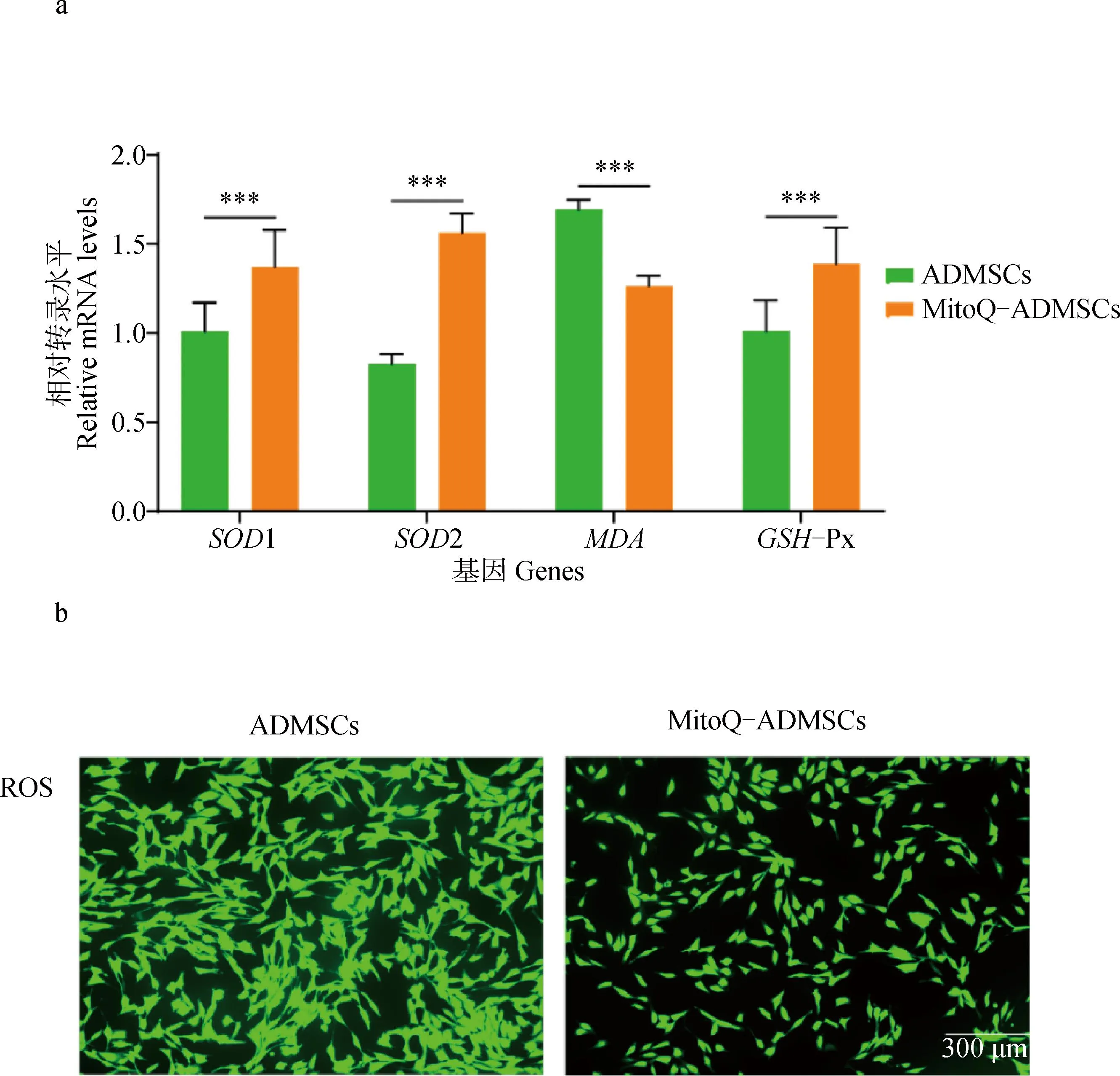
A. qRT-PCR試驗; b. ROS染色。*.P<0.05,**.P<0.01,***.P<0.001,ns.P>0.05a. qRT-PCR experiment; b.ROS staining. *.P<0.05,**.P<0.01,***.P<0.001, ns.P>0.05
2.2 MitoQ-ADMSCs和ADMSCs抗氧化、抗衰老能力差異
qRT-PCR技術檢測MitoQ-ADMSCs和ADMSCs中SOD1、SOD2、MDA、GSH-Px的相對表達量發現:MitoQ-ADMSCs與ADMSCs相比,抗氧化相關的超氧化物歧化酶(SOD1、SOD2)、谷胱甘肽過氧化物酶GSH-Px轉錄量顯著升高,氧化損傷相關的丙二醛(MDA)轉錄量顯著下降,提示MitoQ預處理提升了ADMSCs在體外培養過程中的抗氧化能力(圖2a);利用熒光探針DCFH-DA對MitoQ-ADMSCs和ADMSCs進行檢測,活性氧可以氧化DCFH變成有熒光的DCF,觀察可見同一視野中ADMSCs的熒光量顯著多于MitoQ-ADMSCs,證明ADMSCs中的活性氧水平更高,提示MitoQ處理減少了ADMSCs活性氧水平,抗氧化能力顯著提升(圖2b)。
2.3 小鼠糖尿病模型的建立及治療期間臨床指標變化
對8周齡昆明(KM)小鼠進行1周適應性飼喂后,除NC組外的所有小鼠均改用高糖高脂飼料進行為期3周的飼喂,觀察到小鼠體重顯著上升,但血糖水平沒有明顯的變化,后對達到40 g以上的小鼠使用STZ連續3周注射,1次·周-1,在此過程中可觀察到小鼠的體重水平呈現出明顯的下降趨勢,血糖水平則呈現出明顯的上升趨勢,且多飲多食現象逐漸加劇,被毛也變得粗糙凌亂,墊料中尿液和糞便味道極大,甚至有幾只出現了便血,注射結束后1周,即在第7周時對小鼠進行了再次的檢測,結果發現造模的小鼠空腹血糖水平穩定維持在11.1 mmol·L-1以上,表明成功建立小鼠糖尿病模型。在第8周時,對ADMSCs組和MitoQ-ADMSCs小鼠進行細胞移植治療,連續3周,1次·周-1在治療過程后,發現經細胞移植的小鼠血糖水平顯著下降,采食和飲水量也有所下降,體重水平則有所回升,且MitoQ-ADMSCs的細胞移植效果要優于ADMSCs移植組(圖3a~d),可見MitoQ促進了ADMSCs對小鼠糖尿病臨床癥狀的恢復作用。為檢查小鼠機體血糖調節能力是否有所恢復,在治療的第1、3 周分別對小鼠進行了葡萄糖耐量的檢測,發現NC組的小鼠在葡萄糖灌注后的2 h內血糖雖然升高,但是不顯著;而Diabetes組小鼠的血糖水平顯著升高,在30 min時甚至達到了20 mmol·L-1;ADMSCs移植治療的小鼠血糖水平雖然沒有恢復到正常情況,但是相較于模型組小鼠其下降效果明顯,且MitoQ-ADMSCs組小鼠的血糖變化幅度低于ADMSCs組,說明MitoQ可能促進了糖尿病小鼠胰島β細胞功能和機體血糖調節能力的恢復(圖3e、f)。
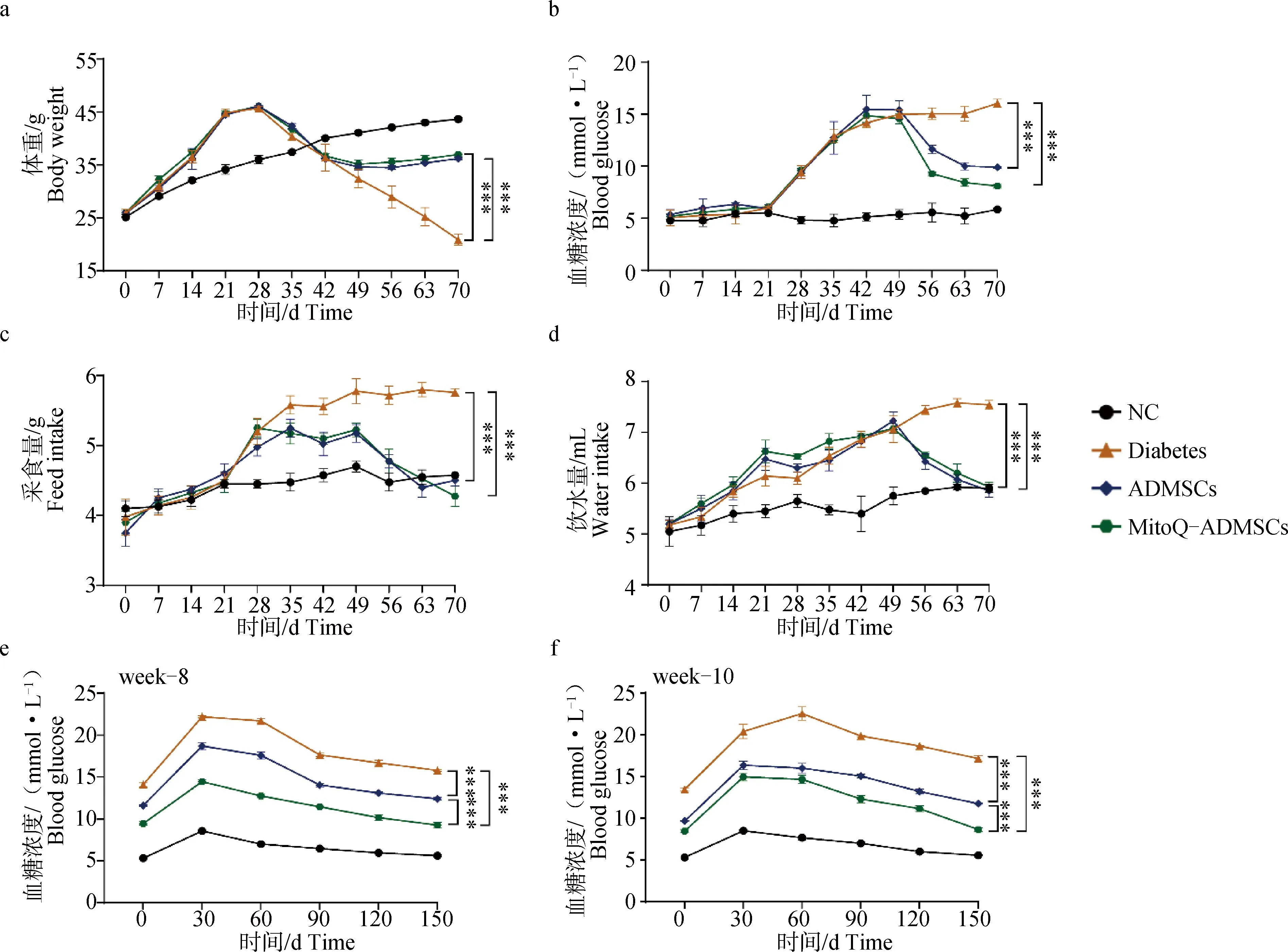
A.體重變化;b.空腹血糖變化;c.采食量變化;d.飲水量變化;e.治療第1周葡萄糖耐量;f.治療第3周葡萄糖耐量。*.P<0.05,**.P<0.01,***.P<0.001,ns表示無顯著差異a. Weight change; b. Changes in fasting blood glucose; c. Changes in food intake; d. Changes in water consumption; e. Glucose tolerance in the first week of treatment; f. Glucose tolerance at the third week of treatment. *.P<0.05,**.P<0.01,***P<0.001, ns.P>0.05
2.4 MitoQ預處理ADMSCs對糖尿病小鼠胰腺組織損傷的影響
對NC組、Diabetes組、ADMSCs組、MitoQ-ADMSCs組小鼠進行胰腺組織取樣后,HE染色,結果表明,NC組的胰島邊界清晰可見,而Diabetes組小鼠胰腺中胰島結構受損,呈現出破損狀態;經ADMSCs和MitoQ-ADMSCs移植治療后,胰島結構有所恢復,除小部分胰島因破壞嚴重較難修復外,有正常結構、邊界清晰的胰島結構存在(圖4a);對小鼠的胰腺進行胰島素的免疫熒光染色,可見NC組小鼠的胰島能夠正常分泌胰島素,Diabetes組小鼠胰島結構內胰島素熒光只能在小部分碎片化的胰島結構中觀察到,而ADMSCs和MitoQ-ADMSCs則明顯改善了這一效果,可見胰島結構胰島素的分泌量增加,且MitoQ-ADMSCs胰島素分泌基本恢復到正常水平,揭示ADMSCs能夠促進胰島結構中β細胞的功能恢復,且MitoQ能夠促進ADMSCs的這一效果(圖4b、c)。
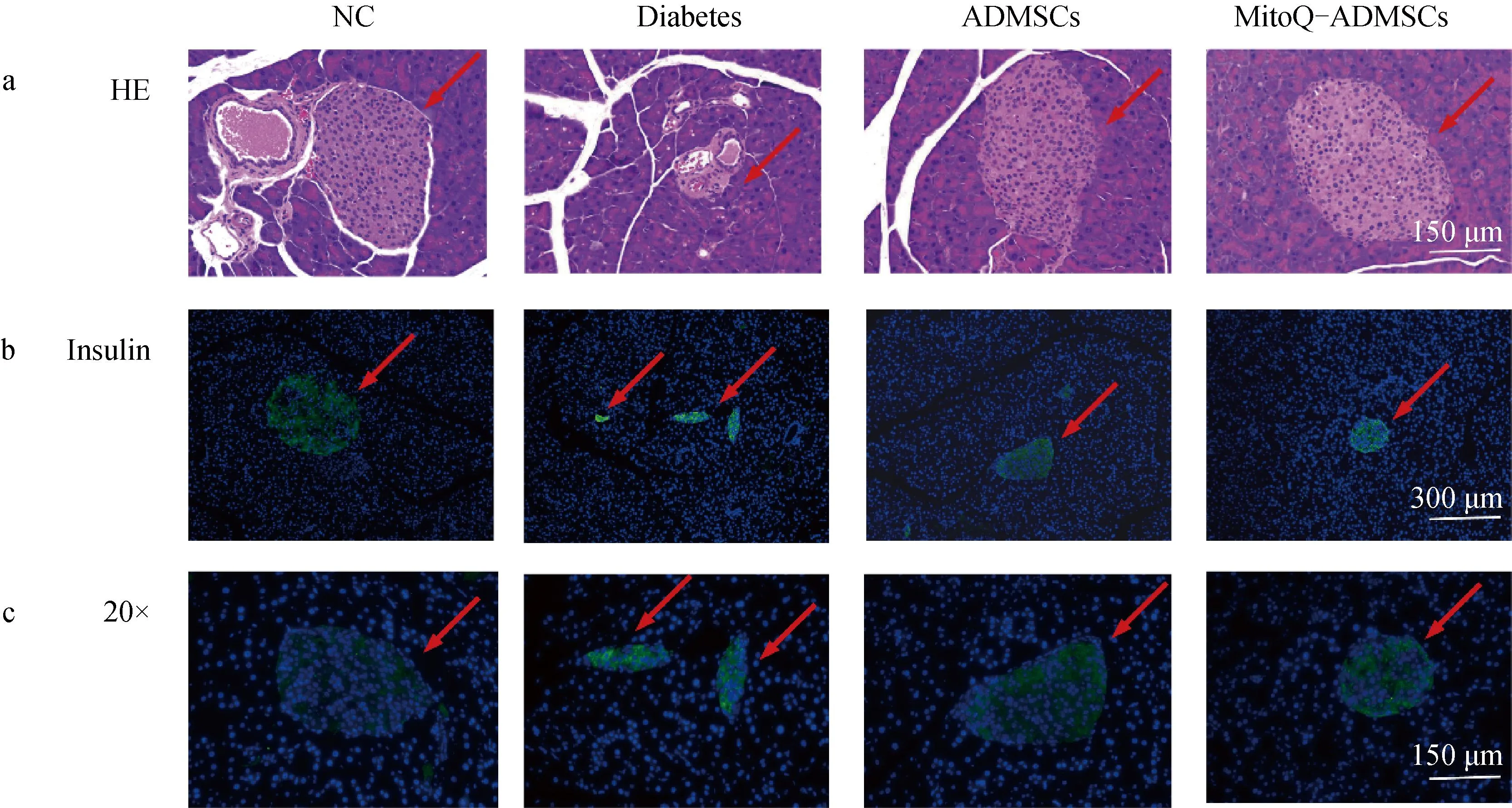
A.胰腺HE染色(20×);b.胰腺組織胰島素免疫熒光染色(10×);c.胰腺組織胰島素免疫熒光染色(20×)a. HE staining of pancreas (20×); b. Pancreatic tissue Insulin immunofluorescence staining (10×); c. Pancreatic tissue Insulin immunofluorescence staining (20×)
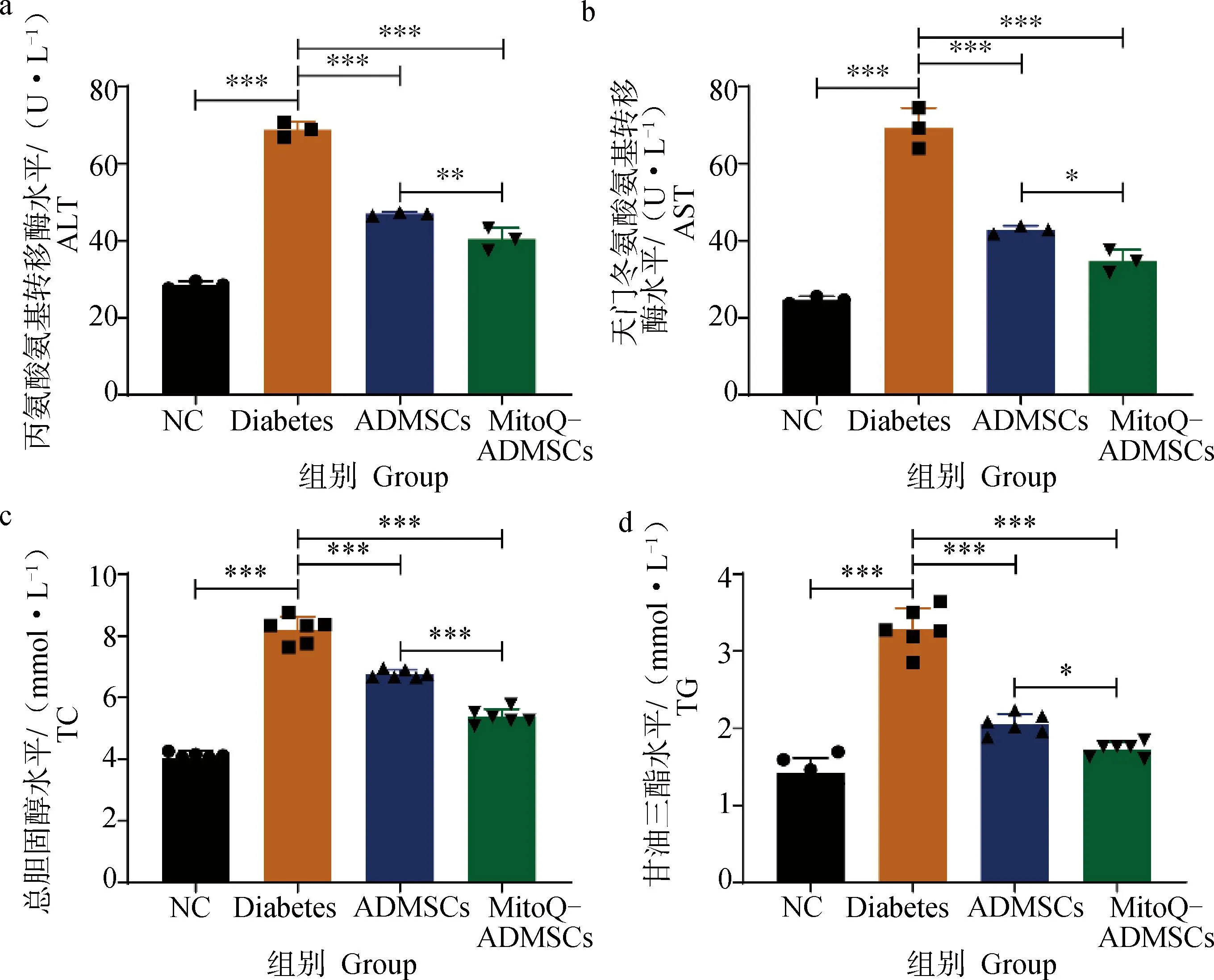
A.丙氨酸氨基轉移酶;b.天門冬氨酸氨基轉移酶;c.總膽固醇; d.甘油三酯。*.P<0.05,**.P<0.01,***.P<0.001,ns.P>0.05a. ALT; b. AST; c. TC; d.TG. *.P<0.05,**.P<0.01,***.P<0.001, ns.P>0.05
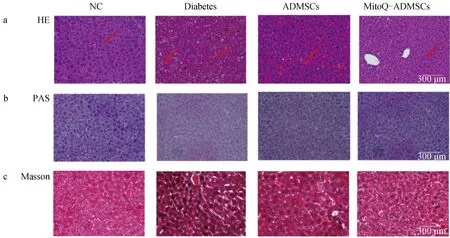
A. HE染色(10×);b. PAS染色(10×);c. Masson染色(20×)a. HE staining (10×); b. PAS staining (10×); c. Masson staining (20×)
2.5 MitoQ預處理ADMSCs對糖尿病小鼠肝和脂質代謝的影響
作為機體內調節血糖的有效器官,肝在葡萄糖的吸收、儲存、生產和代謝方面起重要作用,當糖尿病發生時,葡萄糖代謝紊亂會導致繼發性肝損害。相關血清學檢測顯示,Diabetes組小鼠的血清ALT和AST明顯高于NC組,經細胞移植治療后,ALT和AST的檢測結果均有所下降,且MitoQ顯著促進ADMSCs降低AST和ALT水平的能力,結果顯示,ADMSCs具有減輕肝代謝障礙的作用,而MitoQ能夠進一步增強這一效果(圖5 a、b);當糖尿病發生時,脂肪的分解和代謝會明顯快于正常水平,加重肝等的負擔,使脂質代謝相關的指標有所上升,對小鼠TC和TG水平進行檢測后,可見ADMSCs移植促進了血清中TC和TG水平的恢復,MitoQ-ADMSCs則進一步增強了這一作用,證明ADMSCs能夠減輕因糖尿病造成的高脂血癥,而MitoQ能夠進一步促進ADMSCs的治療效果(圖5c、d)。
2.6 MitoQ預處理ADMSCs對糖尿病小鼠氧化應激指標的影響
為了進一步驗證MitoQ和ADMSCs聯合治療對糖尿病小鼠氧化應激代謝指標的影響,作者進行了相關試驗。發現Diabetes組小鼠的MDA和H2O2水平遠高于NC組,而CAT和SOD水平明顯低于NC組,ADMSCs雖然在一定程度上恢復因糖尿病導致的機體抗氧化能力的下降及氧化應激損傷,但是效果十分有限,而MitoQ則能夠進一步提高機體的抗氧化能力,使其基本恢復到正常水平,避免因氧化應激導致疾病的進一步加重(圖6 a~d)。綜上所述,ADMSCs可以一定程度恢復因糖尿病導致的氧化損傷,而MitoQ能夠極大促進ADMSCs對糖尿病小鼠的氧化損傷修復作用,使得機體的抗氧化能力基本恢復到正常水平。
2.7 MitoQ預處理ADMSCs對糖尿病小鼠肝組織損傷的影響
肝組織H&E結果顯示,NC組肝組織細胞索結構排列較為規整,形態完整且清晰,Diabetes組小鼠的肝則呈現出明顯的壞死,可見組織呈現出彌漫性出血、炎性細胞浸潤及較大面積肝細胞呈現空泡化變性,經細胞移植后,可見細胞空泡化情況顯著減少、組織彌漫性出血減少,形態結構有所恢復,且MitoQ-ADMSCs相比于ADMSCs組肝細胞排列更加整齊,炎性細胞浸潤程度減輕(圖7 a);除此之外,為檢測肝組織糖原積累、纖維化程度,進行系列染色,包括PAS染色和Masson染色,肝經PAS染色后糖原呈紫紅色,經Masson染色肌纖維呈紅色、膠原纖維為藍色,結果顯示,ADMSCs組移植恢復了糖尿病誘發的糖原合成障礙,降低了肝纖維化程度,而MitoQ能夠進一步促進這些治療作用的提升(圖7 b、c)。這些結果表明,ADMSCs可減輕糖尿病引起的肝纖維化,減輕糖原合成障礙,而MitoQ可以更好地促進相關指標的改進。MitoQ預處理ADSMCs可通過減輕糖原合成障礙和肝纖維化,從而為維持血糖平衡提供有效支持。
2.8 MitoQ預處理ADMSCs對糖尿病犬臨床癥狀的影響
經過1周適應性飼喂后,開始相關試驗,NC組試驗犬全程使用普通飼料飼喂,其他三組選用普通犬糧搭配饅頭、米飯等含糖量較高的食物飼喂3周,禁食16 h后進行STZ注射,20 mg·kg-1,1次·d-1,連續3 d,1 周后,也就是試驗的第31天時進行血糖水平的檢測,犬出現嘔吐、被毛粗糙、精神沉郁和個別體重下降的情況,但是血糖水平變化不明顯,未達到造模標準,所以繼續進行為期3 d的STZ注射,1周后,即第42天,再次進行血糖水平的檢測,隨機血糖水平基本維持在11.1 mmol·L-1以上,且各組的體重水平均呈現出明顯的下降趨勢,視為成功建立糖尿病模型;后對犬進行為期3周的細胞移植,移植劑量為1×107·只-1,可見血糖水平隨著細胞移植時間的延長,呈現明顯的下降趨勢,其中,MitoQ-ADMSCs組犬的血糖水平基本恢復到糖尿病初期的水平,且體重水平也隨著細胞移植治療有所恢復,糖尿病相關的臨床癥狀有所恢復,犬在治療期間生命體征平穩,未出現死亡、暈厥及精神沉郁狀況,結果表明,細胞移植后,犬的臨床癥狀得到改善,體重和血糖水平也得到恢復,特別是經MitoQ預處理的ADMSCs進一步促進了治療效果(圖8 a、b);對治療后第1、3周犬的葡萄糖耐量水平進行檢測,可見細胞移植后葡萄糖耐量的變化幅度有所下降,但是ADMSCs和MitoQ-ADMSCs之間的差異不是很明顯(圖8 c、d)。
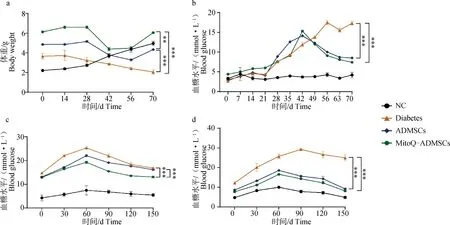
A.體重變化;b.隨機血糖變化;c.治療第1周葡萄糖耐量;d.治療第3周葡萄糖耐量。*.P<0.05,**.P<0.01,***.P<0.001,ns.P>0.05a. Weight change; b. Changes in blood glucose; c. Glucose tolerance in the first week of treatment; d. Glucose tolerance at week 3 of treatment. *.P<0.05,**.P<0.01,***.P<0.001, ns.P>0.05
2.9 MitoQ預處理ADMSCs對糖尿病犬胰腺及肝組織的影響
對NC組、Diabetes組、ADMSCs組、MitoQ-ADMSCs組犬進行胰腺組織取樣后,進行了HE染色,可見NC組胰腺結構十分健全,胰島可見,Diabetes組犬的胰腺觀察到組織受損、胰島破碎、炎癥浸潤及彌漫性出血,ADMSCs移植后可以觀察到胰島出現重建跡象,但是受損嚴重的胰島修復效果不明顯,而MitoQ-ADMSCs對于胰島結構修復效果較好,除小部分胰島因破壞嚴重修復較難外,可以看見有正常結構、邊界清晰的胰島結構存在(圖9 a);除此之外,還進行了胰島素的免疫熒光染色,可見NC組犬的胰島能夠正常分泌胰島素,Diabetes組犬的胰島素熒光只能在小部分碎片化的胰島結構中觀察到,而ADMSCs和MitoQ-ADMSCs則改善了這一效果,可見到胰島結構中胰島素的分泌量增加,且MitoQ-ADMSCs組胰島素分泌基本恢復到正常水平,揭示ADMSCs能夠促進胰島結構中β細胞的功能恢復,且MitoQ能夠促進ADMSCs的這一效果(圖9 b)。肝組織HE染色結果顯示,NC組肝組織細胞索結構排列較為規整,形態完整且清晰,Diabetes組的肝則呈現出明顯的壞死,可見組織呈現出彌漫性出血、炎性細胞浸潤及較大面積肝細胞呈現空泡化變性,經ADMSCs移植后,可見彌漫性出血情況雖然有所改善,但是空泡化情況改善并不明顯,而MitoQ-ADMSCs顯著提升了這一修復作用;除此之外,為檢測肝組織糖原積累、纖維化程度,進行了系列染色,包括PAS染色、Masson染色,結果顯示,ADMSCs移植雖然在一定程度上恢復了糖尿病引起的糖原合成障礙,降低了肝纖維化程度,促進了血糖平衡的維持,但是治療效果不明顯,而MitoQ-ADMSCs治療效果極大提升(圖9 c~e)。這些結果表明,ADMSCs可減輕糖尿病引起的肝損傷,增強肝的糖代謝和脂質代謝功能,而MitoQ可以更好地促進相關指標的改善。MitoQ預處理ADSMCs可通過修復肝損傷,有效減少糖脂代謝紊亂,從而為維持血糖平衡提供有效支持。
2.10 MitoQ預處理ADMSCs對糖尿病犬肝、脂質代謝及氧化應激指標的影響
糖尿病發生時,除胰腺組織的結構和功能會受損外,對其他靶組織也會造成損傷,尤其肝損傷較為嚴重。對血清學中與肝臟和脂質代謝相關的指標進行檢測,結果顯示,Diabetes組犬血清的ALT和AST水平明顯高于NC組,經細胞移植治療后,ALT和AST的檢測結果均有所下降,且MitoQ進一步促進了ADMSCs降低AST和ALT水平的能力(圖10 a、b);除此之外,對犬脂質代謝相關的指標TC和TG水平進行檢測,可見ADMSCs移植促進了血清中TC和TG水平的恢復,MitoQ則進一步增強了這一作用,證明ADMSCs能夠有效減輕因糖尿病造成的肝和脂質代謝障礙,恢復肝組織對葡萄糖調節的協助作用,而MitoQ能夠進一步促進ADMSCs的治療作用,以達到更好的治療效果(圖10 c、d);對糖尿病的靶組織胰腺中的氧化應激相關指標進行檢測,可見Diabetes組犬的MDA和H2O2的水平遠高于NC組,而SOD水平明顯低于NC組,ADMSCs在一定程度上恢復因糖尿病導致的機體抗氧化能力的下降及氧化應激損傷,但MitoQ能夠更進一步減輕機體的氧化應激,使得幾項指標基本恢復到正常水平,并且避免因氧化應激導致疾病的進一步加重(圖10 e~g)。綜上所述,MitoQ預處理ADMSCs可減輕糖尿病引起的肝損傷和脂質代謝紊亂,有效保護機體免受氧化應激損傷。
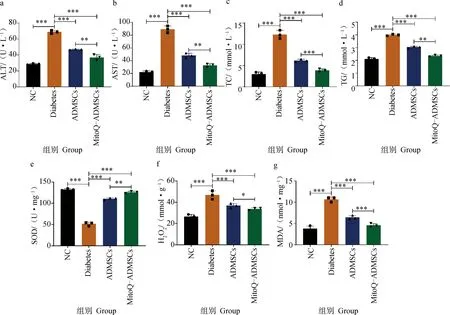
A.丙氨酸氨基轉移酶;b.天門冬氨酸氨基轉移酶;c.總膽固醇;d.甘油三酯;e.超氧化物歧化酶;f.過氧化氫;g.丙二醛。*.P<0.05,**.P<0.01,***.P<0.001,ns.P>0.05a. ALT; b. AST; c.TC; d. TG; e. SOD; f. H2O2; g. MDA. *.P<0.05,**.P<0.01,***.P<0.001, ns.P>0.05
2.11 MitoQ預處理ADMSCs治療犬糖尿病的代謝組學分析
對12個血清樣本和QC樣本進行PCA分析,可見正、負離子模式下QC樣本均呈聚集狀態,證明各試驗組內差異較小,結果可靠(圖11 a、b);針對差異代謝物的化學分類進行了分析并制成餅圖,共13個分類,其中,脂質分子類別占比最多(圖11 e);針對正負離子模式下篩選到的各組之間差異代謝物的重疊情況,進行了Venn圖展示,可觀察到不同對比組之間顯著性差異代謝物的變化(圖11 c、d);對各組間的差異代謝物進行對比后,觀察到其中有10個顯著變化的代謝物與氧化應激存在較大關聯,分別是琥珀酸鹽(succinate)、帽柱木堿(mitragynine)、肌酸(creatine)、N-乙酰-L-亮氨酸(L-leucine,n-acetyl)、尿囊素(allantoin)、奧昔嘌醇(oxypurinol)、海藻糖(trehalose)、龍膽苦苷(gentiopicroside)、環鳥甘酸(3′,5′-cyclic inosine monophosphate)、蓖麻油酸(ricinoleic acid),除琥珀酸鹽外,其余代謝物均與氧化損傷減少、抗氧化能力加強相關,在MitoQ-ADMSCs組和NC組中表現出相似水平,而Diabetes組犬血清中相關代謝物則呈現出顯著下調的趨勢,且ADMSCs治療并未對相關指標產生明顯的上調影響,所以MitoQ促進ADMSCs對糖尿病治療效果的提升可能是促進了ADMSCs抗氧化能力的提升,使得機體中的相關代謝物能夠恢復到正常水平,從而有效減少疾病發展過程中因氧化應激造成的損傷。
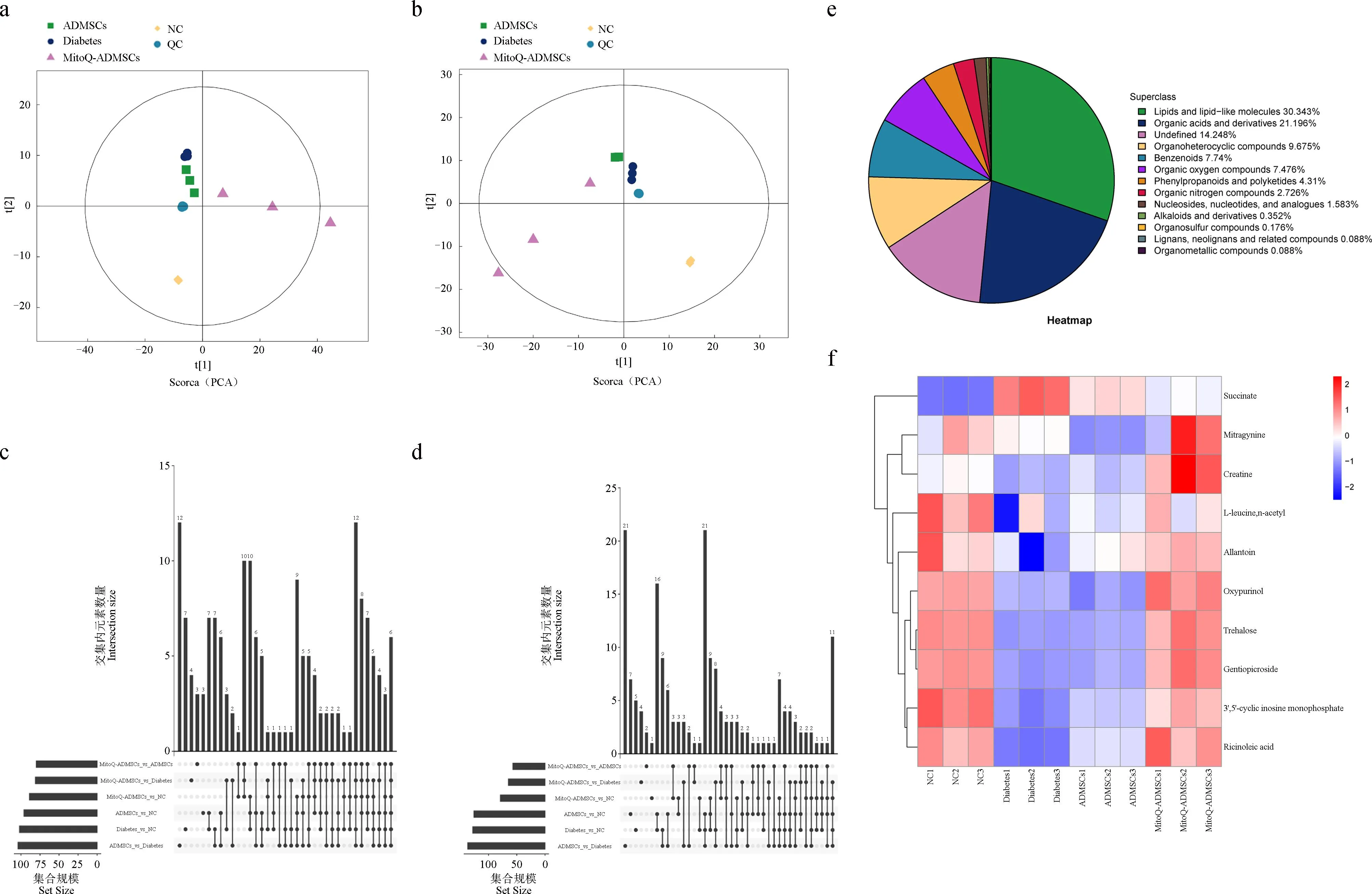
A.正離子模式總體樣本PCA分析;b.負離子模式總體樣本PCA分析;c.正離子模式Venn圖;d.負離子模式Venn圖;e.鑒定的代謝物在各化學分類的數量占比;f.差異代謝物聚類熱圖a. PCA analysis of positive ion mode population samples; b. PCA analysis of negative ion mode population samples; c. Positive ion mode Venn diagram; d. Negative ion mode Venn diagram; e. The proportion of identified metabolites in each chemical classification; f. Differential metabolite clustering heat map
3 討 論
糖尿病在犬等伴侶動物中的發生率逐年上升,對犬的健康造成極大威脅,有時還會因為嚴重的并發癥導致重度疾病的發生,甚至死亡。究其原因,目前認為犬糖尿病的發生原因主要包括1)畜主的不正確飼喂方式,在飼養過程中給予過多高糖高脂食物;2)犬本身就存在糖脂代謝障礙等方面的疾病,先天出生時就缺乏胰島素的生成能力[31]。雖然目前寵物糖尿病的診斷技術發展十分迅速,當犬出現癥狀時能夠及時判定并進行干預治療,但是治療方式仍較為局限,主要還是胰島素注射配以常規降糖藥物,然而這些治療方式無法起到控制疾病發展或者根治的效果,除此之外,多數降糖藥物還會對肝、腎等器官造成負擔。
干細胞療法已成為當今醫學領域備受關注的研究內容,并被廣泛應用于臨床治療。MSCs是目前應用最為廣泛的干細胞,除了具備多向分化和自我更新等共同特征外,還具有造血支持、免疫調節等特性。間充質干細胞的來源十分廣泛,臨床試驗中常用的多為臍帶、骨髓、脂肪等組織來源的細胞,在使用骨髓間充質干細胞(bone marrow derived mesenchymal stem cells, BMSCs)進行治療時,發現外源性因素對細胞形態影響很大,導致細胞在體外培養階段易發生變形、衰老和死亡。臍帶間充質干細胞(umbilical cord mesenchymal stem cells,UCMSCs)雖然在體外培養狀態較穩定,但是存在一定的倫理和法律糾紛。而ADMSCs,相對于其他組織來源的成體干細胞來說,分離方式極其方便,不會對動物機體造成很大損傷,且定向分化和恢復能力強、免疫原性低,無社會倫理問題等優點使得其成為MSCs臨床試驗中最為常見的類型[32-33]。
然而ADMSCs在臨床治療中仍存在一些不足,如在體外培養時間過長時,仍舊會發生形態改變、結構受損、衰老和凋亡情況的發生,細胞移植到機體內后無法保持長期有效的治療作用,探索提高ADMSCs對糖尿病治療潛力的方式十分重要。MitoQ作為一種強有用的抗氧化劑,已被大量試驗證明可以延緩細胞衰老,減輕細胞氧化應激造成的損傷。所以探究MitoQ是否能夠通過增強ADSMCs的抗氧化能力從而更好地治療糖尿病十分重要。
本研究選用MitoQ對ADMSCs進行預處理,并進行細胞移植,在試驗期間對動物模型的臨床癥狀、肝脂質代謝水平、氧化應激指標、組織學水平、代謝組水平等進行檢測。結果表明,MitoQ-ADMSCs與ADMSCs無顯著形態差異,但MitoQ能夠促進ADMSCs的生長速度、增殖效率及遷移能力的提升,并且能夠提高ADMSCs的抗氧化和抗衰老能力,減緩細胞衰老;ADMSCs能夠降低血糖、恢復體重、減少采食量和飲水量,恢復精神狀態,且MitoQ能夠進一步促進ADMSCs的治療效果;MitoQ預處理ADMSCs能夠有效恢復機體的血糖調節能力,促進胰島素分泌量的增加;ADMSCs和MitoQ-ADMSCs均具有改善糖尿病相關肝和脂質代謝指標的作用,且MitoQ-ADMSCs的效果更勝一籌;針對胰腺氧化應激指標進行檢測,可見抗氧化能力在MitoQ-ADMSCs組顯著增加,且氧化損傷顯著減輕;細胞移植后因糖尿病導致的組織損傷、胰島結構破壞、肝纖維化等均有所恢復,且MitoQ能夠進一步促進ADMSCs的治療作用;代謝組學分析結果顯示,MitoQ能夠進一步促進ADMSCs治療效果與抗氧化能力提升有關。因此,將MitoQ-ADMSCs可能會是寵物臨床治療的可靠手段和新制劑。
4 結 論
米托蒽醌甲磺酸鹽能夠通過提高脂肪間充質干細胞的抗氧化能力、加速組織損傷修復,從而更好地治療小鼠及犬糖尿病。

