磷添加對棉田土壤理化性質及其細菌多樣性的影響
張 曼,侯天鈺,張應榕,王娟紅,陳波浪, 2
(1. 新疆農業大學資源與環境學院,烏魯木齊 830052;2. 新疆土壤與植物生態過程重點實驗室,烏魯木齊 830052)
【研究意義】新疆是我國重要的優質棉生產基地,新疆棉花生產面積、單產和調出量居全國首位,占全球棉花總產量的20%[1]。在農業生產系統中,磷是棉花產量提高的重要物質保證,由于磷在土壤中易被固定,其有效性往往較低。近30年來,盡管我國農田土壤有效磷水平通過施用磷肥得到了顯著提高,全國平均耕層土壤速效磷含量 (24.7 mg/kg) 是20世紀80年代的3倍多[2],但當季磷肥利用率僅有10%~15%[3],絕大多數肥料磷以累積態磷存在,作物可利用的有效磷含量仍然不足。因此,如何提高作物對土壤累積態磷的活化利用以及提高磷肥的利用效率是保障我國作物高產與資源高效的重大問題。【前人研究進展】微生物在土壤磷循環和調節磷有效性中起著重要作用[4],尤其是在積累磷的再循環中。Dinesh等[5]發現微生物具有將土壤中有機磷轉化成可供植物吸收的無機磷的能力;張玲玉等[6]研究發現微生物在促進土壤有機磷和不溶性磷向有效磷轉化中起著積極作用。另外,施用磷肥對土壤微生物群落結構具有反饋作用。已有研究表明,施用磷肥可以增加土壤有效磷含量,從而改變土壤微生物群落結構和組成,促進某些特定微生物的生長[7]。廖朝選等[8]通過研究發現,短期施用磷肥可以顯著增加土壤細菌、真菌和放線菌數量。羅明等[9]通過對灰漠土棉花試驗地土壤連續2年進行觀測,發現適宜的磷肥用量可促進微生物數量顯著增加。Shi等[10]發現經過17年不同水平施磷梯度 (P2O50、17.5和35 kg/hm2) 后,土壤細菌群落結構并未發生顯著改變。Tan等[11]研究發現,經過42年不同磷肥施用梯度處理后,土壤細菌多樣性和土壤中溶磷性細菌的相對豐度隨著磷肥施用量的增加而增加,但酸桿菌門 (Acidobacteria) 和假單胞菌屬 (Pseudomonas) 等細菌相對豐度隨之降低。綜上,關于磷肥施用對土壤微生物群落的影響機制仍存在廣泛的不確定性[12]。【本研究切入點】目前,關于施磷調控棉田土壤理化性質影響細菌群落結構的研究鮮有報道。因此,本研究通過6年定位磷添加的田間試驗,采用Illumina MiSeq高通量測序技術手段,探討不同磷添加量對棉田土壤細菌多樣性及群落組成的變化,闡述環境因子對土壤細菌群落結構的影響。【擬解決的關鍵問題】明確調節棉田理化性質、優化土壤細菌群落結構的最佳磷添加量,以期為科學施磷、改善土壤理化性質和維持土壤微生物群落結構等提供一定理論依據。
1 材料與方法
1.1 試驗地概況
試驗地點位于新疆昌吉回族自治州瑪納斯縣新湖農場 (44°79′ E,86°44′ N),該地區屬于溫帶大陸性干旱半干旱氣候,日照充足,最高氣溫40 ℃,年降雨量237.7 mm。土壤類型為灰漠土。試驗田塊已經連續6年進行不同磷添加梯度的定位試驗。棉花品種為新陸早57號,播前土壤 (0~20 cm) 的基本理化性質見表1。

表1 土壤基本理化性質Table 1 Basic physical and chemical properties of soil
1.2 試驗設計
在新湖農場一連四隊棉花種植區域內進行田間試驗,試驗地采用隨機區組設計,小區總面積為1936 m2。不同磷(P2O5)添加量分別為0、75、150、300、450 kg/hm2,記為P0、P1、P2、P3和P4,每個處理3個重復,共15個小區。施用磷肥品種為重過磷酸鈣,作為基肥一次性施入,尿素(N) 300 kg/hm2,氮肥施用方式為40%播前施入,其余60%分8~10次在棉花不同生育期隨水滴施,硫酸鉀(K2O) 75 kg/hm2,鉀肥也一次性在播前做基肥施用,其他田間管理同當地農戶常規管理。
1.3 土壤樣品采集
棉花根際土樣于2021年8月花鈴期進行采集,每個小區用抖根法采集根際土,保存于無菌的自封袋中。每個地塊按“S”型隨機抽取5個點,并將5個點的土樣混合放入無菌袋作為1個樣品,每個處理5個重復。將所采集的土樣放入冰盒內冷藏帶回實驗室,從土樣中取出30 g左右新鮮土樣混勻后過2 mm篩,無菌袋封好放入-80 ℃冰箱用于土壤微生物群落結構的測定。剩下部分自然風干,研磨過1.00和0.25 mm土篩,用于測定土壤基本理化指標。用100 cm3的環刀采集0~20 cm土層土壤樣品,用于土壤容重和含水量測定。
1.4 測定方法
1.4.1 土壤理化性質測定 土壤pH采用1.0∶2.5土水比,在振蕩箱振蕩30 min后直接用pH計測量,全鹽采用1.0∶5.0土水比,通過電導率計算求得。土壤有機質采用重鉻酸鉀外加熱法[13]測定,土壤容重和含水量采取環刀烘干法[14]測定,土壤溫度采用土壤溫度記錄儀 (JL-04) 自動采集,每隔30 min采集記錄1次數據。
1.4.2 土壤DNA提取及高通量測序 提取DNA采用MoBio/QIAGEN公司的DNeasy Power Soil Kit進行,并對抽提的DNA進行檢測。采用熒光分光光度計(Quantifluor ST fluorometer, Promega,E6090 Quant iT PicoGreen dsDNA Assay Kit,Invitrogen, P7589)在260 和280 nm 處分別測定DNA的吸光值,檢測DNA濃度,并用1%的瓊脂糖凝膠電泳檢測DNA質量。調整DNA溶液濃度,DNA工作液保存于4 ℃,儲存液保存于20 ℃。
使用通用引物5’-CAGTGGGACGACCACGAGGT-3’和5’-GAGGCCGATCGGCATGTCG-3’對細菌16S rRNA基因的 V3~V4 可變區域進行PCR擴增;然后進行膠回收純化,針對目標條帶進行割膠回收,得到純化樣本,然后進行各樣本定量,利用BioTek酶標儀對各個樣品定量 (BioTek Flx800酶標儀;Quant-iT PicoGreen dsDNA Assay Kit, Invitrogen, P7589),最后采用標準的Illumina TruSeq DNA文庫制備實驗流程構建所需的上機文庫。利用Pico green和熒光分光光度計方法定量文庫,并使用安捷倫 (Agilent 2100) 對PCR富集片段進行質量控制,驗證DNA文庫的片段大小及分布。均一化并混合文庫:多樣品DNA文庫 (Multiplexed DNA libraries) 均一化至10 nmol/L后等體積混合。將混合好的文庫 (10 nmol/L) 逐步稀釋定量至45 pmol/L后進行上機測序。
1.5 數據處理
土壤理化性質使用Microsoft Excel 2010進行數據整理,利用SPSS 20.0統計軟件進行單因素方差分析 (ANOVA),采用Origin Pro 2018軟件進行作圖。
土壤細菌群落結構數據選用Silva數據庫,后續基于OTU分析,進行分類組成學分析實現各樣本在門、綱、目、科、屬、種6個分類水平上的組成分布。還可獲得樣本內α-多樣性指數、樣本間β-多樣性指數。α-多樣性指數包含Chao1指數、Observed species指數、Shannon指數、Simpson指數和覆蓋度 (Good’s coverage) 指數,β多樣性分析包括冗余分析。
冗余分析是一種最經典的非約束排序分析方法,通過將樣本距離矩陣經過投影后,在低維度空間進行展開,并最大限度地保留原始樣本的距離關系。常用的β多樣性距離包括Jaccard距離、Bray-Curtis距離、unweighted UniFrac距離和weighted UniFrac距離等。
2 結果與分析
2.1 磷添加對土壤理化性質的影響
由圖1-a和1-b可知,不同磷添加處理對土壤容重和含水量影響較小,各處理間無顯著差異。由圖1-c可知,不同施肥處理對耕層土壤溫度產生顯著影響。隨著磷添加水平的升高,土壤溫度呈先增加后降低趨勢,P4處理的土壤溫度顯著低于P1和P2處理,分別降低11.05%和11.80% (P<0.05)。由圖1-d可知,不同磷添加處理對土壤pH有較大影響(P<0.05)。隨著磷添加水平的增加,pH呈先減小后增加趨勢;與P0處理相比,P2處理平均顯著降低0.2。由圖1-e可知,不同磷添加處理對土壤電導率值變化影響顯著 (P<0.05),整體呈下降趨勢,其中P1和P2處理土壤電導率下降較為明顯,與P0處理相比分別下降27.05%和35.19%。由圖1-f可以看出,土壤有機質含量隨著磷添加的升高先升高后降低,整體顯著高于P0處理,增幅為1.95%~19.05%,不同磷添加間差異顯著。P2處理土壤有機質含量達到峰值,P4處理的有機質含量與P0處理差異不大。由圖1-g可知,隨著磷添加水平的增加,有效磷含量呈先增加后降低趨勢,P3處理的土壤有效磷含量最高,與P0處理相比,P3處理的土壤有效磷含量增加30.92%。由圖1-h可知,P2和P3處理的土壤全磷含量較P0處理土壤全磷含量分別增加33.14%和34.91%。
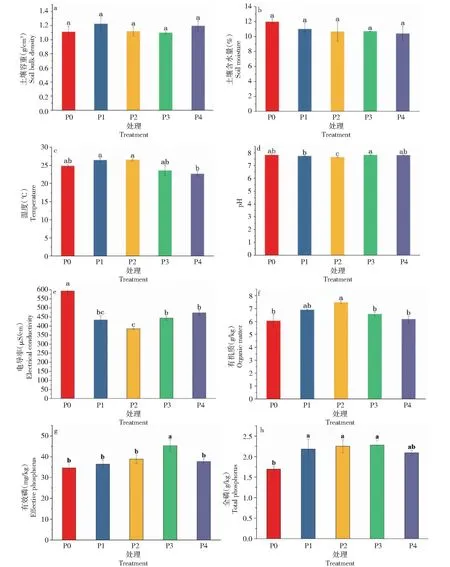
柱上不同小寫字母表示處理間差異達到0.05 顯著水平。Different lowercase letters on the bar indicate a significant level of 0.05 difference between treatments.圖1 不同磷添加條件下棉田土壤理化性質的變化Fig.1 Changes in soil physicochemical properties of cotton field under different phosphorus addition conditions
2.2 磷添加對土壤細菌群落結構的影響
稀釋曲線能反應樣品文庫測序數據量的合理性。由圖2可知,5種不同磷添加處理的稀釋曲線均平緩,表明當前測序深度足以反映樣本所包含微生物多樣性,說明測序數據量合理。從OTU數量可以看出,P2處理的OTU數量最多,P3次之,P1最少。Chao1指數能體現微生物群落豐富度,而Shannon和Simpson指數能夠體現微生物群落多樣性。由表2可知,P2、P3和P4處理的Chao1指數較P0處理分別增加13.82%、9.55%和12.48%,說明實用施磷為150 kg/hm2的菌群最豐富;而與對照相比,施磷對Shannon指數和Simpson指數無顯著影響。
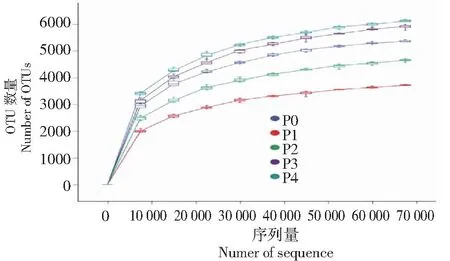
圖2 OTUs稀疏曲線Fig.2 Sparse curves of OTUs

表2 不同磷添加處理下土壤細菌α多樣性Table 2 α diversity of soil bacteria under different phosphorus addition treatments
圖3~7分別挑選豐度TOP10的細菌菌門、綱、目、科和豐度TOP50的細菌菌屬來分析土壤細菌群落組成的變化。由圖3可知,不同磷添加下土壤細菌在門水平上的優勢類群為變形菌門(Proteobacteria,53.71%) 和放線菌門 (Actinobacteria,9.08%) 的相對豐度最高,浮霉菌門 (Planctomycetes) 的平均相對豐度為0.45%,而其余相對豐度較小,在0.01%~0.11%。P2處理明顯降低放線菌門的相對豐度,較P0處理下降25.44%,變形菌門的相對豐度無顯著變化。由圖4可知,在綱水平上以γ-變形菌綱、α-變形桿菌綱、β-變形菌綱為主,平均相對豐度分別為36.69%、28.79%和1.08%。較P0處理,P2處理中α-變形桿菌綱的相對豐度明顯增加,增加11.66%。P4處理中γ-變形菌綱的相對豐度明顯增加,增加36.40%,而α-變形桿菌綱的相對豐度明顯降低,降低51.83%。 說明磷添加會改變綱分類水平下土壤中細菌群落結構分布和相對豐度。由圖5可知,在目水平的優勢類群為假單胞菌目、根瘤菌目、放線菌目和假諾卡式菌目,相對豐度分別為36.32%、24.20%、7.78%和6.08%,與P0相比,P1和P2根瘤菌目增加6.75%和17.38%,但假單胞菌目明顯降低24.53%和13.35%,P3和P4假單胞菌目明顯增加30.30%和36.86%,根瘤菌目明顯降低52.76%和58.28%。由圖6可知,在科水平的優勢類群為假單胞菌科、慢生根瘤菌科、鏈霉菌科、根瘤菌科和假諾卡氏菌科,相對豐度分別為36.33%、20.40%、3.70%、2.87%和2.10%,其他不足1%。與P0相比,P3和P4假單胞菌科明顯增加30.32%和36.85%,慢生根瘤菌科明顯降低56.31%和68.27%,P1和P2慢生根瘤菌科明顯增加8.22%和23.36%,假單胞菌科明顯降低24.53%和13.35%。由圖7可知,在屬水平上相對豐度大于1%的屬共有4個,分別為中華根瘤菌屬、慢生根瘤菌屬(Bradyrhizobium)、鏈霉菌屬和糖多孢菌屬,在P4處理的相對豐度分別為3.13%、1.43%、1.11%和1.16%,從菌屬的變化可以看出在不同磷添加下,細菌菌屬豐度大多數存在顯著差異。
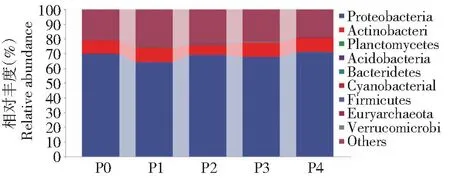
圖3 不同磷添加條件下棉田土壤中細菌門水平群落組成變化Fig.3 Changes in the community composition of bacterial phylum in the cotton field soil under different phosphorus addition conditions
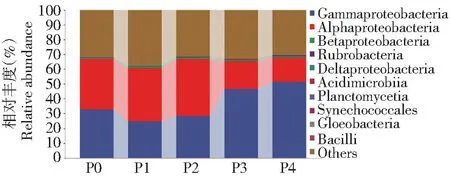
圖4 不同磷添加條件下棉田土壤中細菌綱水平群落組成變化Fig.4 Changes in the community composition of bacterial class in cotton field soil under different phosphorus addition conditions
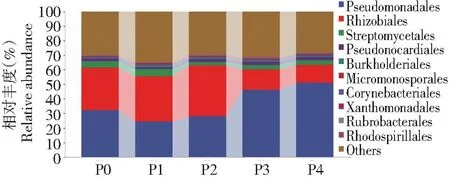
圖5 不同磷添加條件下棉田土壤中細菌目水平群落組成變化Fig.5 Changes in the community composition of bacterial order in the cotton field soil under different phosphorus addition conditions
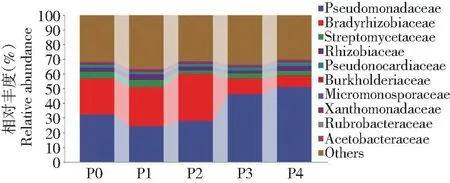
圖6 不同磷添加條件下棉田土壤中細菌科水平群落組成變化Fig.6 Changes in the community composition of bacterial family in cotton field soil under different phosphorus addition conditions
圖7 不同磷添加條件下棉田土壤中細菌屬水平群落組成變化Fig.7 Changes in the community composition of bacterial genus in cotton field soil under different phosphorus addition conditions
2.3 土壤細菌TOP8優勢菌門與土壤理化性質冗余分析
如圖8所示,紅色箭頭代表細菌TOP8優勢菌門,黑色箭頭代表土壤理化性質 (SOM、T、pH、EC、MS和BD)。結果表明,RDA1和RDA2兩個排序軸共解釋細菌群落結構62.23%的變化,土壤pH、電導率、有機質和容重與放線菌門的相對豐度呈顯著正相關 (P<0.05),與廣古菌門、厚壁菌門和疣微菌門的相對豐度呈正相關,與變形菌門的相對豐度呈負相關;含水率與放線菌門呈正相關,而與變形菌門、酸桿菌門和浮霉菌門呈負相關;土壤溫度與變形菌門呈正相關,而與浮霉菌門、酸桿菌門和放線菌門呈負相關;土壤pH與浮霉菌門和酸桿菌門呈正相關;土壤溫度和pH均與其他8種細菌菌門呈正相關。
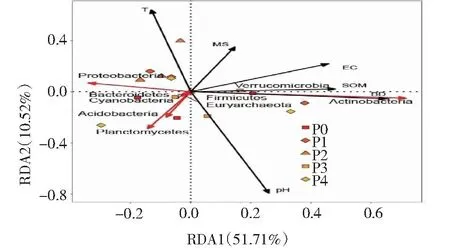
圖8 土壤細菌優勢菌門的相對豐度與土壤理化性質的冗余分析(RDA)Fig.8 Redundancy analysis (RDA) of the relative abundance of dominant bacteria and physicochemical properties of soil bacteria
3 討 論
3.1 磷添加對土壤理化性質的影響
土壤溫度不僅影響土壤中碳氮等物質的化學和生物學過程,還決定土壤資源質量高低,從而影響植物的生長發育和產量等[15-17]。不同磷添加下土壤溫度在同一生育時期內,P1和P2處理的土壤溫度顯著高于P0處理,平均分別高1.5和2.3 ℃。P3和P4處理的土壤溫度顯著低于P0處理,平均分別低1.3和2.2 ℃。有研究表明,土壤溫度1 ℃的差異也將顯著影響作物生長[18-19]。本研究中施用磷肥條件下0~20 cm 土壤的溫度在P2處理下達最高,隨著磷添加量過高后會促進棉花生長尤其是地上部冠層覆蓋度顯著增加,減少到達地面的有效太陽輻射,從而降低土壤溫度,這與前人研究結果一致[20]。
土壤pH影響土壤養分的存在狀態,同時也決定肥料的施用效果,對植物的生長發育有直接影響[21]。土壤電導率是土壤的電化學特征,可表征土壤的鹽分狀況,是判斷土壤是否鹽漬化的重要指標[22]。前人研究指出,鹽堿地施用磷肥可顯著降低土壤pH[23]和電導率[24]。本研究結果表明,磷添加量在P2處理下最能顯著降低pH和電導率,這與前人的結論基本一致,即合理的施肥量可降低土壤pH和電導率,緩解土壤鹽堿壓力。
土壤有機質是植物有機營養的供給源,是土壤結構形成的驅動者[1]。盧九斤等[25]認為,磷添加可提高土壤有機質含量,改善土壤養分狀況。本研究中,磷添加提高了土壤有機質含量,P1、P2、P3和P4處理分別提高0.843、1.420、0.523和0.120 g/kg。在0~20 cm土層,磷添加處理土壤有機質含量均顯著高于對照處理,適量磷添加能增加土壤微生物活性,促進微團聚體形成,從而提高土壤有機質含量[26]。土壤有機質含量總體低于6年前的基本值,這可能是因為無外源有機質的補充,隨著種植年限的增加棉田土壤有機質礦化作用增強,其礦化產物被棉花吸收帶走而消耗,而且無機養分充足更利于有機質的礦化[27]。
磷在棉花生產中起著至關重要的作用,而有效磷和全磷含量則能很好地反映出土壤供磷能力。本研究結果中,P3處理顯著提高土壤有效磷含量。大量研究表明,磷添加能有效提高土壤磷水平[28]。趙亮等[29]研究結果表明,與不施磷肥或低施磷肥(75 kg/hm2)相比,施磷量為150 kg/hm2時土壤有效磷含量變化不顯著,基本保持平衡;當施磷量較高(300 kg/hm2)時,土壤有效磷水平顯著升高,這與本研究結果一致。本研究結果表明,P3和P4處理可顯著提高土壤全磷含量,隨著磷添加水平的增加,全磷含量呈先增加后降低趨勢。有研究顯示,土壤全磷在長期施用磷后均有一定積累,而不施磷土壤的全磷含量處于枯竭狀態[22]。
3.2 施磷對土壤細菌群落組成及細菌α-多樣性的影響
細菌是土壤微生物的重要組成,參與土壤養分循環,且對維持整個土壤生態系統的穩定性起著重要作用[30]。本研究從門、綱、目、科和屬5個分類水平選取TOP10優勢菌門、菌綱、菌目和菌科以及TOP50優勢菌屬進行探究。結果表明,不同處理門、綱、目、科和屬水平上優勢類群的相對豐度差異較顯著。土壤細菌群落中變形菌門占比最大,平均豐度為55.61%,與孫瑞波等[31]對長期施肥條件下砂姜黑土細菌群落變化的研究中得到的優勢菌門相同,但在相對豐度上差異較大,這可能是因為農田土壤質地、施肥類型與數量以及作物類型的不同所致[32]。在細菌門水平上,P2處理明顯降低了變形菌門的相對豐度,這可能是因為向土壤中添加磷可能會降低土壤的滲透勢,導致土壤微生物生長受到阻礙[33]。在細菌綱水平上,γ-變形菌綱、α-變形桿菌綱和β-變形菌綱的相對豐度較高,其中最優勢的菌綱是γ-變形菌綱,平均相對豐度在35.47%,李明等[34]在研究黃瓜根際微生物群落中發現,γ-變形菌綱能夠分解各類物質,是一種適應能力很強的微生物類群,從而成為大多作物根際微生物的優勢種群。隨著磷添加量的增加,α-變形桿菌綱的相對豐度呈先增加后降低趨勢,在P2處理達到最大,說明較高的施磷水平會抑制α-變形桿菌綱的相對豐度[35]。在目水平上,主要由假單胞菌目、根瘤菌目、放線菌目、假諾卡式菌目和伯克氏菌目和細菌組成,該結果與前人報道基本一致[36-37]。有研究表明,假單胞菌目是參與磷循環的主要細菌[38],與促進植物生長緊密相關。在科水平上,磷添加對棉田土壤根際微生物影響最大的是假單胞菌科和慢生根瘤菌科。在屬水平上相對豐度大于1%的屬共有4個,分別為中華根瘤菌屬、慢生根瘤菌屬、鏈霉菌屬和糖多孢菌屬,其中慢生根瘤菌是土壤中常見的解磷微生物,幫助植物完成磷循環。本研究中,具有溶磷作用的浮霉菌門、慢生根瘤菌屬和鏈霉菌屬相對豐度隨磷肥施入而明顯升高。
以往有研究表明,磷添加可顯著增加土壤細菌多樣性[11]。Zhong和Cai[39]認為磷添加后土壤養分增加,尤其是有機質含量的增加是細菌多樣性增加的主要原因。本研究中,P2處理下的OTU 數和 Chao1 指數均最高,說明磷添加可以增加物種豐富度,這與前人的研究結果一致。Islam等[40]對不同施肥措施的水稻土研究發現施用NPK肥對土壤細菌群落多樣性影響較小,這與本試驗研究結果一致,施磷增加了Shannon指數和Simpson指數,但無顯著影響。這可能是受本試驗土壤養分和質地的影響。
3.3 土壤細菌TOP8優勢菌門與土壤理化性質冗余分析
本研究對細菌TOP8優勢菌門與土壤理化性質進行冗余分析。研究表明,土壤理化性狀能顯著影響微生物的群落組成[41]。本研究中土壤pH、電導率、有機質、容重是影響土壤細菌群落豐度的主要因素。放線菌門與土壤pH、電導率、有機質、容重和含水率呈顯著正相關,土壤溫度與變形菌門呈正相關,土壤pH與浮霉菌門和酸桿菌門呈正相關,而土壤溫度與放線菌門、浮霉菌門和酸桿菌門呈負相關,這與孫冰潔等[42]研究結果一致,土壤溫度過高會抑制放線菌和霉菌的生長;而含水率與變形菌門、浮霉菌門和酸桿菌門呈負相關,有研究表明,隨土壤含水率增加,土壤中變形菌門的相對豐度逐漸升高[43],這可能是因為在不同的土壤環境條件下,變形菌門對含水量的需求不同。本研究表明施用磷肥后土壤環境變化是導致細菌群落結構差異的主要原因。
4 結 論
磷添加可顯著提高土壤有機質、降低土壤pH和電導率。磷添加能夠增加細菌多樣性,改變土壤細菌群落結構;土壤中具有溶磷作用的浮霉菌門、慢生根瘤菌屬和鏈霉菌屬相對豐度在施磷處理中明顯升高。土壤理化性狀能顯著影響細菌的群落組成,土壤pH、電導率、有機質和容重均為影響土壤細菌群落結構的重要環境因素。

