基于網(wǎng)絡(luò)藥理學(xué)與分子對(duì)接技術(shù)探究炙甘草湯抗心肌缺血再灌注損傷的作用機(jī)制
任海云 蔚蓁

摘要 目的:運(yùn)用網(wǎng)絡(luò)藥理學(xué)方法和分子對(duì)接技術(shù)探討炙甘草湯減輕心肌缺血再灌注損傷(MIRI)的作用機(jī)制。方法:利用中醫(yī)藥系統(tǒng)藥理學(xué)數(shù)據(jù)庫(kù)與分析平臺(tái)(TCMSP)與中藥分子機(jī)制生物信息學(xué)分析工具(BATMAN-TCM)獲取炙甘草湯有效成分并預(yù)測(cè)其作用靶點(diǎn),然后應(yīng)用人類基因綜合(GeneCards)與人類疾病相關(guān)基因和突變信息的綜合平臺(tái)(DisGeNET)數(shù)據(jù)庫(kù)預(yù)測(cè)MIRI靶點(diǎn),通過Venny在線繪圖軟件獲取炙甘草湯抗MIRI潛在作用靶點(diǎn)。利用蛋白質(zhì)相互作用分析數(shù)據(jù)庫(kù)(STRING數(shù)據(jù)庫(kù))平臺(tái)構(gòu)建蛋白互作(PPI)網(wǎng)絡(luò),并通過Cytoscope 3.9.1軟件可視化、篩選出核心靶點(diǎn),利用Metascape 基因功能分析平臺(tái)對(duì)篩選出的核心靶點(diǎn)進(jìn)行基因本體(GO)富集分析與京都基因與基因組百科全書(KEGG)信號(hào)通路富集分析,探究炙甘草湯抗MIRI機(jī)制,再次利用Cytoscape 3.9.1軟件構(gòu)建活性成分-疾病-核心靶點(diǎn)-通路網(wǎng)絡(luò)。最后利用分子對(duì)接程序AutoDock vina對(duì)炙甘草湯主要活性成分與其核心靶點(diǎn)結(jié)合活性進(jìn)行驗(yàn)證。結(jié)果:經(jīng)篩選獲得炙甘草湯147個(gè)活性成分、865個(gè)基因靶點(diǎn),MIRI 144個(gè)靶標(biāo),通過Venny數(shù)據(jù)庫(kù)獲取炙甘草湯抗MIRI潛在作用靶點(diǎn)79個(gè);經(jīng)PPI網(wǎng)絡(luò)分析并篩選出40個(gè)關(guān)鍵靶點(diǎn),其中腫瘤壞死因子(TNF)、白細(xì)胞介素-6(IL-6)、蛋白激酶B(AKT1)、血管內(nèi)皮生長(zhǎng)因子 A(VEGFA)、一氧化氮合酶3(NOS3)、過氧化氫酶(CAT)、CC趨化因子配體 2(CCL2)、髓過氧化物酶(MPO)均與炎癥反應(yīng)或氧化應(yīng)激有關(guān)。經(jīng)GO富集分析發(fā)現(xiàn)氧化應(yīng)激、炎癥反應(yīng)與此生物學(xué)過程密切相關(guān);經(jīng)KEGG分析探究炙甘草湯抗MIRI的通路,共映射出178條信號(hào)通路。將炙甘草湯活性成分-疾病-核心靶點(diǎn)-通路網(wǎng)絡(luò)中排名居前3位的成分及其關(guān)鍵靶點(diǎn)進(jìn)行驗(yàn)證,結(jié)果顯示炙甘草湯主要活性成分與關(guān)鍵作用靶點(diǎn)結(jié)合活性很強(qiáng),能形成穩(wěn)定的化合物。結(jié)論:甘草查爾酮A、人參皂苷Rh2、6-醛基異麥冬黃酮B、山柰酚、芒柄花黃素、麥冬皂苷C等為炙甘草湯抗MIRI的主要成分,通過TNF、IL-6、AKT1、VEGFA、NOS3、CAT、CCL2、MPO等核心靶點(diǎn)調(diào)控絲裂原活化蛋白激酶(MAPKs)、TNF、Toll樣受體-4(TLR4)、缺氧誘導(dǎo)因子-1(HIF-1)、磷脂酰肌醇-3激酶/蛋白激酶B(PI3K/AKT)、雷帕霉素靶蛋白(mTOR)、轉(zhuǎn)化生長(zhǎng)因子-β(TGF-β)、核轉(zhuǎn)錄因子-κB(NF-κB)等信號(hào)通路,減輕改善MIRI,體現(xiàn)出炙甘草湯多成分-多靶點(diǎn)-多途徑的作用優(yōu)勢(shì),為進(jìn)一步深入動(dòng)物學(xué)實(shí)驗(yàn)與臨床試驗(yàn)提供了數(shù)據(jù)與理論支持。
關(guān)鍵詞 心肌缺血再灌注損傷;炙甘草湯;網(wǎng)絡(luò)藥理學(xué);分子對(duì)接;作用機(jī)制
doi:10.12102/j.issn.1672-1349.2024.03.003
The Mechanism of Anti-myocardial Ischemia-reperfusion Injury of Honey-fried Licorice Decoction Based on Network Pharmacology and Molecular Docking
REN Haiyun, WEI Zhen
College of Traditional Chinese Medicine and Food Engineering, Shanxi University of Chinese Medicine, Jinzhong 030619, Shanxi, China, E-mail: renhy1119@sxtcm.edu.cn
Abstract Objective:To explore the mechanism of action of Honey-fried Licorice Decoction on myocardial ischemia/reperfusion injury(MIRI) based on network pharmacology and molecular docking.Methods:The active components of Honey-fried Licorice Decoction were obtained and its target was predicted by the Traditional Chinese Medicine System Pharmacology Database and Analysis Platform(TCMSP) and the Traditional Chinese Medicine Molecular mechanism bioinformatics analysis tool(BATMAN-TCM).The target of MIRI was predicted by the integrated platform of human Gene Synthesis(GeneCards) and human disease-related gene and mutation information(DisGeNET) database,and the potential target of Honey-fried Licorice Decoction anti-MIRI was obtained by Venny online software.The protein interaction(PPI) network was constructed using the Protein Interaction Analysis Database(String database) platform,and the core targets were screened and visualized by Cytoscope 3.9.1 software.The anti-MIRi mechanism of Honey-fried Licorice Decoction was investigated by Gene ontology(GO) enrichment analysis and Kyoto Encyclopedia of Genes and Genomes(KEGG) signaling pathway enrichment analysis for the selected core targets by Metascape gene function analysis platform.The molecular docking program AutoDock vina was used to verify the binding activity of the main active ingredients of Honey-fried Licorice Decoction and its core target.Results:After screening,147 active ingredients,865 gene targets,and 144 MIRI targets of Honey-fried Licorice Decoction were selected.Seventy-nine potential anti-MIRI targets were obtained through Venny database.Forty core targets were screened by PPI network analysis,which showed that tumor necrosis factor(TNF),interleukin-6(IL-6),protein kinase B-α(AKT1),vascular endothelial growth factor A(VEGFA),endothelial nitric oxide synthetase(NOS3),catalase(CAT),CC chemokine ligand 2(CCL2),and myeloperoxidase(MPO) were related to inflammatory response or oxidative stress.GO enrichment analysis showed that oxidative stress and inflammation were closely related to this biological process.The anti-MIRI pathways of Honey-fried Licorice Decoction were explored by KEGG analysis,and 178 signal pathways were mapped.The top 3 components and their key targets in the active ingredient-disease-core target-pathway network of Honey-fried Licorice Decoction were verified.The results showed that the main active components of Honey-fried Licorice Decoction showed strong binding activity with the key targets to form stable compounds.Conclusion:Glycyrrhizin A,ginsenoside Rh2,6-aldehyde isophiopogon flavonoid B,kaempferol,ononcetin,and ophiopogon saponin C were the main anti-MIRI components of Honey-fried Licorice Decoction.Mitogen-activated protein kinases(MAPKs),TNF,Toll-like receptors,hypoxia-inducing factor-1(HIF-1),and phosphatidylinosito-3 kinase/protein kinase B(PI3K/AKT) were regulated through core targets such as TNF,IL-6,AKT1,VEGFA,NOS3,CAT,CCL2,and mammalian target of rapamycin(mTOR),transforming growth factor-β(TGF-β),nuclear transcription factor-κB(NF-κB),and other signaling pathways to alleviate and improve MIRI,reflecting the advantages of Honey-fried Licorice Decoction′s multi-component,multi-target,multi-pathway action,which would provide data and theoretical support for further zoological experiments and clinical trials.
Keywords myocardial ischemia-reperfusion injury; Honey-fried Licorice Decoction; network pharmacology; molecular docking; mechanism
基金項(xiàng)目 山西省基礎(chǔ)(自由探索類)研究項(xiàng)目(No.202203021221203);山西省重點(diǎn)實(shí)驗(yàn)室項(xiàng)目(No.04010910029);山西中醫(yī)藥大學(xué)博士科研啟動(dòng)基金(No.2020BK03)
作者單位 山西中醫(yī)藥大學(xué)中藥與食品工程學(xué)院(山西晉中 030619),E-mail:renhy1119@sxtcm.edu.cn
引用信息 任海云,蔚蓁.基于網(wǎng)絡(luò)藥理學(xué)與分子對(duì)接技術(shù)探究炙甘草湯抗心肌缺血再灌注損傷的作用機(jī)制[J].中西醫(yī)結(jié)合心腦血管病雜志,2024,22(3):402-409.
急性心肌梗死是目前致死和致殘率極高的病理變化。國(guó)內(nèi)臨床主要采用經(jīng)皮冠狀動(dòng)脈介入或溶栓治療及時(shí)恢復(fù)冠狀動(dòng)脈血流[1],再灌注損傷嚴(yán)重影響病人預(yù)后。如何在恢復(fù)冠狀動(dòng)脈血流的同時(shí)減少再灌注損傷已成為心肌梗死治療的重點(diǎn)。中藥在我國(guó)資源豐富,具有多成分、多靶點(diǎn)、多通道的作用優(yōu)勢(shì),從中尋找改善心肌缺血再灌注損傷(MIRI)的理想方案成為近幾年國(guó)內(nèi)外研究焦點(diǎn)。炙甘草湯是治療“脈結(jié)代,心動(dòng)悸”的經(jīng)典名方。據(jù)文獻(xiàn)記載炙甘草湯對(duì)缺血再灌等原因所致的心律失常有明顯防治作用[2-6]。然而,炙甘草湯抗MIRI作用機(jī)制尚未明確。因此,深入研究炙甘草湯抗MIRI的主要藥效物質(zhì)及作用機(jī)制具有重要意義。基于網(wǎng)絡(luò)藥理學(xué)和分子對(duì)接技術(shù),本研究構(gòu)建炙甘草湯成分、MIRI、靶點(diǎn)及信號(hào)通路的互作網(wǎng)絡(luò),系統(tǒng)探索炙甘草湯改善MIRI的作用機(jī)制。
1 資料與方法
1.1 中藥有效成分及其作用靶點(diǎn)的收集與篩選
將炙甘草湯中人參、甘草、大棗、生姜、火麻仁、桂枝這六味藥,基于中醫(yī)藥系統(tǒng)藥理學(xué)數(shù)據(jù)庫(kù)與分析平臺(tái)(TCMSP,https://old.tcmsp-e.com/tcmsp.php)[7]檢索有效成分及作用靶點(diǎn),設(shè)置口服生物利用度(OB)≥30%,類藥性(DL)≥0.18。另外,麥冬、地黃、阿膠三味藥則選擇中藥分子機(jī)制生物信息學(xué)分析工具BATMAN-TCM[8](http://bionet.ncpsb.org.cn/batman-tcm/)獲取其有效化學(xué)成分及相應(yīng)基因靶點(diǎn),以可靠性>20%及P<0.05為條件篩選。檢測(cè)發(fā)現(xiàn)這兩種數(shù)據(jù)庫(kù)中查詢所得的基因靶點(diǎn)名稱不一致,因此,通過蛋白質(zhì)數(shù)據(jù)庫(kù)UniProt(https://www.uniprot.org/)限定Human 物種,檢索并驗(yàn)證靶點(diǎn),然后轉(zhuǎn)化為標(biāo)準(zhǔn)基因名稱。
1.2 疾病靶點(diǎn)的收集與篩選
借助人類基因綜合GeneCards數(shù)據(jù)庫(kù)(https://www.genecards.org/)與人類疾病相關(guān)基因和突變信息的綜合平臺(tái)(DisGeNET,https://www.disgenet.org/home/)數(shù)據(jù)庫(kù),輸入“myocardial reperfusion injury”檢索MIRI作用靶點(diǎn),基于相關(guān)評(píng)分,整合并去重,選擇與MIRI密切相關(guān)的靶點(diǎn)作為研究對(duì)象。
1.3 中藥成分與疾病靶點(diǎn)交互網(wǎng)絡(luò)的構(gòu)建
利用在線Venny繪圖軟件(https://bioinfogp.cnb.csic.es/tools/venny/)將炙甘草湯活性成分與MIRI作用靶點(diǎn)分別導(dǎo)入其中,獲取炙甘草湯活性成分抗MIRI潛在作用靶點(diǎn),并繪制韋恩圖。
1.4 炙甘草湯抗MIRI蛋白互作(PPI)網(wǎng)絡(luò)構(gòu)建與分析篩選
通過蛋白質(zhì)相互作用分析STRING數(shù)據(jù)庫(kù)(https://string-db.org/)[9]創(chuàng)建PPI網(wǎng)絡(luò)。將獲取的炙甘草湯活性成分抗MIRI潛在作用靶點(diǎn)導(dǎo)入SRING數(shù)據(jù)庫(kù),限定Homo sapiens物種,中等置信度,獲得炙甘草湯活性成分抗MIRI靶點(diǎn)的PPI網(wǎng)絡(luò)。將PPI網(wǎng)絡(luò)導(dǎo)入Cytoscope 3.9.1軟件中,并采用插件Analyze network分析PPI網(wǎng)絡(luò),基于度值(Degree值)大小(Degree值≥中位數(shù))過濾出核心作用靶點(diǎn)。
1.5 核心靶點(diǎn)的生物功能及通路富集分析
將篩選出的炙甘草湯活性成分抗MIRI核心靶點(diǎn)通過Metascape基因功能分析平臺(tái)(https://metascape.org/gp/index.html)[10],限定物種H.sapiens,在Custom analysis模式下,設(shè)置Min Overlap≥3,P Value Cut off≥0.01,進(jìn)行基因本體(GO)富集分析與京都基因與基因組百科全書(KEGG)信號(hào)通路富集分析,并將其結(jié)果進(jìn)行可視化。
1.6 活性成分-疾病-核心靶點(diǎn)-通路網(wǎng)絡(luò)的構(gòu)建
將篩選出的炙甘草湯成分抗MIRI核心靶點(diǎn)分別與炙甘草湯活性成分、MIRI及其關(guān)鍵通路進(jìn)行對(duì)應(yīng),將得到的文件導(dǎo)入Cytoscope 3.9.1軟件中構(gòu)建活性成分-疾病-核心靶點(diǎn)-通路網(wǎng)絡(luò)。
1.7 分子對(duì)接
首先,利用TCMSP數(shù)據(jù)庫(kù)下載篩選出Degree值排名居前3位的中藥核心成分結(jié)構(gòu)式(mol2格式)。其次,通過PDB蛋白質(zhì)數(shù)據(jù)庫(kù)獲取核心靶點(diǎn)的3D蛋白結(jié)構(gòu)(pdb格式),用Pymol軟件消去其溶劑分子和配體等,并保存其蛋白受體三維結(jié)構(gòu),再用AutoDock軟件對(duì)其加氫及加電子等操作。最后利用AutoDock vina程序?qū)诵陌械鞍着c中藥核心成分做分子對(duì)接驗(yàn)證,并通過Pymol可視化。
2 結(jié) 果
2.1 炙甘草湯活性成分及預(yù)測(cè)靶點(diǎn)
在TCMSP數(shù)據(jù)庫(kù)中獲得人參、甘草、大棗、生姜、火麻仁、桂枝的活性成分共161個(gè),對(duì)應(yīng)2 716個(gè)靶點(diǎn)。在BATMAN-TCM數(shù)據(jù)庫(kù)中得到麥冬、地黃、阿膠的活性成分共43個(gè),對(duì)應(yīng)930個(gè)靶點(diǎn)。詳見圖1。合并結(jié)果得到炙甘草湯活性成分共184個(gè)、靶點(diǎn)3 691個(gè)。去重得到147個(gè)活性成分、943個(gè)靶點(diǎn)。將得到的預(yù)測(cè)靶點(diǎn)導(dǎo)入U(xiǎn)niProt數(shù)據(jù)庫(kù)中,以Human 為限定物種基因進(jìn)行驗(yàn)證,并將其名稱轉(zhuǎn)化為Gene symbol,最終得到基因靶點(diǎn)865個(gè)。詳見表1。
2.2 MIRI靶點(diǎn)的獲取篩選
借助GeneCards數(shù)據(jù)庫(kù)與DisGeNET數(shù)據(jù)庫(kù)對(duì)數(shù)據(jù)進(jìn)行整理分析得到1 027個(gè)與MIRI有關(guān)的靶點(diǎn)基因,以與MIRI相關(guān)度≥20為篩選條件,整合去重,篩選出144個(gè)疾病靶點(diǎn)。取炙甘草湯活性成分作用靶點(diǎn)與MIRI作用靶點(diǎn)繪制韋恩圖,獲取炙甘草湯活性成分抗MIRI潛在作用靶點(diǎn)79個(gè)。詳見圖2。
2.3 PPI網(wǎng)絡(luò)的構(gòu)建與分析
將79個(gè)炙甘草湯活性成分抗MIRI潛在作用靶點(diǎn)導(dǎo)入STRING數(shù)據(jù)庫(kù)進(jìn)一步評(píng)估其表達(dá)特性,以Homo sapiens為限定物種,中等置信度>0.4為條件,獲取到炙甘草湯成分靶點(diǎn)79個(gè)節(jié)點(diǎn)、2 876條邊的PPI網(wǎng)絡(luò),這79個(gè)節(jié)點(diǎn)Degree值均大于4。詳見圖3。節(jié)點(diǎn)表示基因靶點(diǎn),節(jié)點(diǎn)越大顏色越深,說明其在炙甘草湯抗MIRI方面發(fā)揮著越關(guān)鍵的調(diào)控作用。以Degree值≥中位數(shù)為篩選條件獲得40個(gè)核心作用靶點(diǎn)。詳見表2。
2.4 炙甘草湯抗MIRI核心靶點(diǎn)富集分析
利用Metascape網(wǎng)站,對(duì)炙甘草湯抗MIRI的40個(gè)核心靶點(diǎn)進(jìn)行富集分析,依據(jù)P<0.01篩選標(biāo)準(zhǔn)共得到GO富集分析功能條目1 171條,涉及1 099個(gè)生物過程(BP),22個(gè)細(xì)胞組分(CC)、50個(gè)分子功能(MF)。主要包括細(xì)胞遷移的正向調(diào)控、細(xì)胞運(yùn)動(dòng)的正調(diào)控、對(duì)氧化應(yīng)激的反應(yīng)、細(xì)胞組分運(yùn)動(dòng)的正向調(diào)控、對(duì)活性氧物種的反應(yīng)等;CC主要包括膜筏、膜微結(jié)構(gòu)域、細(xì)胞質(zhì)膜微囊、轉(zhuǎn)錄調(diào)節(jié)復(fù)合物、質(zhì)膜筏等;MF主要包括受體配體活性、信號(hào)受體激活活性、信號(hào)受體調(diào)節(jié)活性、抗氧化活性等。P值越小,富集程度越高,對(duì)炙甘草湯抗MIRI影響越顯著。以P<0.01的篩選標(biāo)準(zhǔn)分別選出BP、CC、MF中影響顯著性居前10位靶點(diǎn)進(jìn)行可視化分析。詳見圖4。
KEGG信號(hào)通路富集分析共映射出178條信號(hào)通路,以P<0.01為篩選條件,根據(jù)P值大小選取居前20條進(jìn)行可視化展示。詳見圖5。氣泡越大,顏色越紅,代表P值越小,該信號(hào)通路在炙甘草湯抗MIRI機(jī)制中發(fā)揮越關(guān)鍵作用,影響越顯著。主要涉及的信號(hào)通路包括脂質(zhì)和動(dòng)脈粥樣硬化、流體剪切應(yīng)力和動(dòng)脈粥樣硬化、糖尿病并發(fā)癥中的糖基化終產(chǎn)物-受體(AGE-RAGE)信號(hào)通路、癌癥相關(guān)通路、腫瘤壞死因子信號(hào)通路、白細(xì)胞介素(IL)-17信號(hào)通路、查加斯病、卡波西肉瘤相關(guān)皰疹病毒感染、缺氧誘導(dǎo)因子-1(HIF-1)信號(hào)通路,并與非酒精性脂肪肝、乙型肝炎、百日咳、弓形體病、瘧疾、松弛素信號(hào)通路、內(nèi)分泌的阻力、利什曼病、麻疹、肺結(jié)核、沙門氏菌感染等通路有相關(guān)性。以上分析結(jié)果顯示炙甘草湯活性成分靶點(diǎn)分布于不同路徑,主要通過多通路協(xié)同抗MIRI。
2.5 炙甘草湯抗MIRI活性成分-疾病-核心靶點(diǎn)-通路網(wǎng)絡(luò)的構(gòu)建
運(yùn)用Cytoscape 3.9.1,將炙甘草湯活性成分抗MIRI中的多成分-多靶點(diǎn)-多通路的作用特點(diǎn)更直觀地展示在活性成分-疾病-核心靶點(diǎn)-通路網(wǎng)絡(luò)圖中。圖中紅色倒三角為影響最顯著的前20條作用通路,紫色菱形為基因靶點(diǎn),綠色三角形為炙甘草湯活性成分,黃色圓形為疾病即MIRI。詳見圖6。利用軟件插件 Network Analyzer 計(jì)算網(wǎng)絡(luò)參數(shù),得到的Degree值越大,節(jié)點(diǎn)越大,在活性成分-疾病--核心靶點(diǎn)-通路網(wǎng)絡(luò)圖中其影響越顯著,Degree值為1的則舍棄。其中絲裂原激活化蛋白激酶8(MAPK8)、原癌基因蛋白/活化蛋白1抗體(JUN)、原癌基因(FOS)、腫瘤壞死因子(TNF)、胱天蛋白酶3抑制劑(CASP3)、白細(xì)胞介素-1β(IL-1β)、白細(xì)胞介素-6(IL-6)、Toll樣受體-4(TLR4)、CXC趨化因子配體8(CXCL-8)、干擾素基因(IFNG)均為抗MIRI的關(guān)鍵靶點(diǎn)。炙甘草湯活性成分通過關(guān)鍵靶點(diǎn)調(diào)控相關(guān)信號(hào)通路改善MIRI。
2.6 炙甘草湯活性成分與核心作用靶點(diǎn)的分子對(duì)接驗(yàn)證
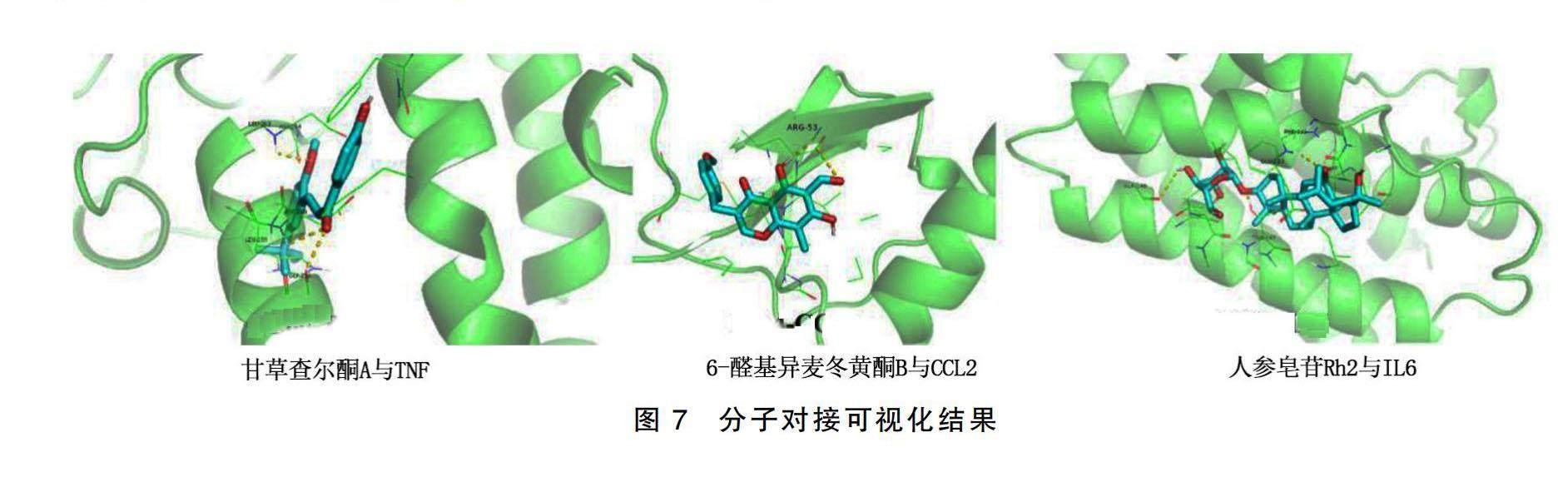
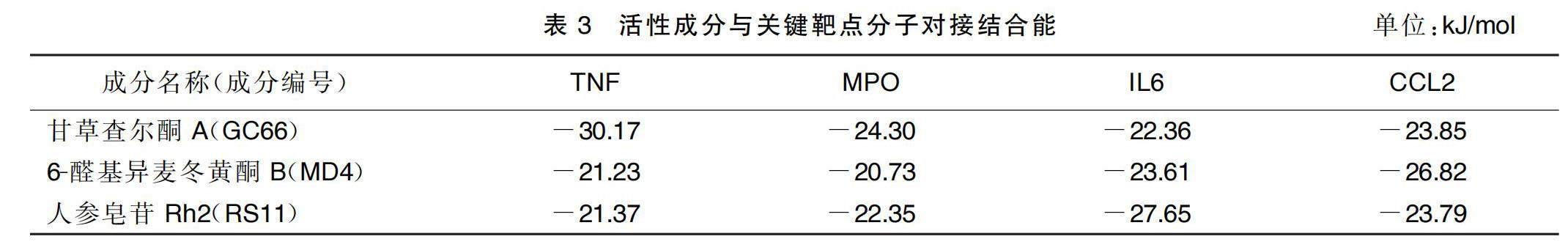
利用分子對(duì)接技術(shù),將活性成分-疾病-核心靶點(diǎn)-通路網(wǎng)絡(luò)中連接度排名居前3位的炙甘草湯活性成分甘草查爾酮A、人參皂苷Rh2、6-醛基異麥冬黃酮B分別與其作用的關(guān)鍵靶點(diǎn)TNF、MPO、IL6、CC趨化因子受體2(CCL2)進(jìn)行驗(yàn)證。據(jù)文獻(xiàn)報(bào)道,對(duì)接結(jié)合能≤-20.92 kJ/mol時(shí),中藥成分作為配體與蛋白受體結(jié)合具有良好活性;當(dāng)對(duì)接結(jié)合能≤-29.29 kJ/mol時(shí),中藥成分作為配體與蛋白受體結(jié)合具有較強(qiáng)活性[11-12]。甘草查爾酮A與關(guān)鍵靶點(diǎn)結(jié)合形成的復(fù)合物中,與TNF結(jié)合能(-30.17 kJ/mol)最小且小于-29.29 kJ/mol,說明甘草查爾酮A與TNF具有更強(qiáng)的結(jié)合活性。甘草查爾酮A通過與蛋白氨基酸LEU-263、ASP-264、ASP-260、LEU-259、GLY-256、TNF形成多個(gè)氫鍵,由此也可以證明其較強(qiáng)的結(jié)合活性。甘草查爾酮A與MPO也具有較強(qiáng)的結(jié)合活性,也能形成較為穩(wěn)定的復(fù)合物。此外,通過比較發(fā)現(xiàn),6-醛基異麥冬黃酮B與CCL2結(jié)合能更強(qiáng),而人參皂苷Rh2則與關(guān)鍵靶點(diǎn)IL6結(jié)合能更強(qiáng),均可形成較為穩(wěn)定的復(fù)合物。詳見圖7及表3。
3 討 論
基于網(wǎng)絡(luò)藥理學(xué)與分子對(duì)接技術(shù),探究炙甘草湯抗MIRI作用機(jī)制,本研究發(fā)現(xiàn)炙甘草湯共有147個(gè)活性成分、865個(gè)潛在靶點(diǎn)可能與抗MIRI相關(guān),其中人參皂苷Rh2、山柰酚、芒柄花黃素、甘草查爾酮A、麥冬皂苷C、6-醛基異麥冬黃酮B等為炙甘草湯抗MIRI的主要活性成分。人參皂苷Rh2是人參關(guān)鍵活性成分,能明顯抑制腫瘤、改善免疫功能以及減輕心肌缺血損傷。現(xiàn)有文獻(xiàn)證明人參皂苷Rh2通過抑制NLRP3、IL-1β、TNF-α炎性相關(guān)因子表達(dá),提高超氧化物歧化酶(SOD)活性可以實(shí)現(xiàn)對(duì)缺血再灌注心肌的保護(hù)作用[13]。山柰酚作為人參與甘草的共有成分屬于黃酮類化合物,可以顯著降低心肌細(xì)胞過氧化氫所致的乳酸脫氫酶(LDH)釋放,具有很好的抗氧化損傷能力,能明顯減輕缺氧復(fù)氧對(duì)心肌細(xì)胞的損傷[14]。芒柄花黃素是炙甘草的主要成分之一,為黃酮類化合物,通過抑制氧化、炎癥和凋亡,促進(jìn)自噬,保護(hù)心肌細(xì)胞,能明顯降低心肌細(xì)胞內(nèi)丙二醛(MDA)、LDH和肌酸激酶(CK)的含量,通過自噬增強(qiáng)改善缺血再灌注誘發(fā)的衰老細(xì)胞凋亡的問題,最終達(dá)到加強(qiáng)保護(hù)心肌細(xì)胞的目的[15]。甘草查爾酮 A是甘草主要活性成分,屬新型黃酮類物質(zhì),能通過抗病毒、抗氧化、抗炎等作用,有效防治心血管疾病。據(jù)文獻(xiàn)報(bào)道甘草查爾酮A可通過激活過氧化物酶體增殖物激活受體(PPAR)/ 核因子E2相關(guān)因子2(Nrf2)/血紅素加氧酶-1(HO-1)通路,減緩線粒體的氧化應(yīng)激,有效改善H2O2誘發(fā)的心肌細(xì)胞損傷[16]。麥冬皂苷C是麥冬的活性成分,屬甾體皂苷,可顯著降低心肌缺氧小鼠垂體后葉激素引起的T波變化及小鼠血清中LDH、CK活性,可有效抑制心肌缺血引起的MDA含量升高,明顯保護(hù)心肌細(xì)胞缺氧復(fù)氧損傷,從而使其壽命得到顯著性延長(zhǎng)[17]。6-醛基異麥冬黃酮B屬于高異黃酮類化合物,亦為麥冬活性成分,可以通過多通路對(duì)心肌形成保護(hù)作用,具有抗炎、抗腫瘤以及抗氧化等多方面的功效[18]。
綜上所述,炙甘草湯中主要活性成分人參皂苷Rh2、山柰酚、芒柄花黃素、甘草查爾酮A、麥冬皂苷C、6-醛基異麥冬黃酮B等能綜合調(diào)節(jié)核心靶點(diǎn)抑制氧化應(yīng)激、炎癥反應(yīng)、細(xì)胞凋亡等,改善MIRI。
經(jīng)蛋白互作PPI網(wǎng)絡(luò)分析,共篩選出40個(gè)核心作用靶點(diǎn),其中TNF、IL6、CCL2、VEGFA、NOS3、CAT、MPO、SOD2、NOS2均與炎癥反應(yīng)或氧化反應(yīng)有關(guān)[19]。結(jié)合分子對(duì)接驗(yàn)證結(jié)果,本研究發(fā)現(xiàn)甘草查爾酮A與關(guān)鍵靶點(diǎn)TNF、MPO均能結(jié)合形成穩(wěn)定性較強(qiáng)的復(fù)合物。人參皂苷Rh2與6-醛基異麥冬黃酮B與關(guān)鍵靶點(diǎn)IL6、CCL2也能形成較為穩(wěn)定的復(fù)合物。推測(cè)炙甘草湯可能通過這些靶點(diǎn)抑制炎癥或氧化應(yīng)激反應(yīng),從而發(fā)揮抗MIRI作用。據(jù)文獻(xiàn)調(diào)研,在MIRI早期,大量活性氧的產(chǎn)生與炎癥介質(zhì)的釋放很可能會(huì)促發(fā)體內(nèi)氧化應(yīng)激加劇MIRI[20]。TNF、IL6為關(guān)鍵炎性因子,可誘導(dǎo)心肌細(xì)胞CD11b/CD18表達(dá)黏附因子和中性粒細(xì)胞損傷心肌[21]。在心肌內(nèi)SOD和過氧化氫酶(CAT)為關(guān)鍵的抗氧化酶,屬于天然的活性氧清除劑,其中SOD可以將氧自由基·O2-轉(zhuǎn)化成較低活性的H2O2,然后在CAT的催化作用下進(jìn)一步分解成H2O2與O2,從而使心肌組織與血脂質(zhì)氧化反應(yīng)減弱,在一定程度上減輕了再灌注損傷。SOD、CAT在MIRI中還起到了減輕心肌缺血的作用[22]。有研究發(fā)現(xiàn)缺乏CCL2可有效降低小鼠MIRI引發(fā)的氧化應(yīng)激,梗死面積明顯回縮[23]。MPO作為溶酶體酶存在于中性粒細(xì)胞等細(xì)胞中,可誘發(fā)炎癥、血管炎和動(dòng)脈粥樣硬化等疾病,在炎癥部位其可催化H2O2生成活性氧,而活性氧水平超出機(jī)體氧化防御范圍時(shí),則會(huì)誘發(fā)氧化應(yīng)激導(dǎo)致組織損傷[24]。有研究證明MPO水平的升高明顯增加了心血管發(fā)病風(fēng)險(xiǎn)[25]。因此有效的抗炎、抗氧化應(yīng)激有利于減輕緩解MIRI,并具有很重要的臨床價(jià)值。
根據(jù)GO和KEGG富集分析結(jié)果顯示,炙甘草湯通過膜筏、膜微結(jié)構(gòu)域、細(xì)胞質(zhì)膜微囊、轉(zhuǎn)錄調(diào)節(jié)復(fù)合物、質(zhì)膜筏等細(xì)胞組成,經(jīng)過正向調(diào)控細(xì)胞遷移、細(xì)胞運(yùn)動(dòng)、細(xì)胞組分運(yùn)動(dòng)、對(duì)氧化應(yīng)激的反應(yīng)以及對(duì)活性氧物種的反應(yīng)等生物過程,發(fā)揮受體配體活性、信號(hào)受體激活活性、信號(hào)受體調(diào)節(jié)活性、抗氧化活性、蛋白質(zhì)均二聚活性等分子功能,再通過調(diào)控 MAPKs 、TNF、Toll樣受體-4、HIF-1、PI3K-AKT、mTOR、TGF-β、NF-κB等信號(hào)通路等,減輕改善MIRI。NF-κB在炎癥早期發(fā)揮著核心作用[26],MAPKs轉(zhuǎn)導(dǎo)途徑通過激活 NF-κB,造成NF-κB核轉(zhuǎn)位轉(zhuǎn)移到核內(nèi)調(diào)節(jié)炎癥介質(zhì),促進(jìn)下游炎性因子表達(dá)[27]。
4 小 結(jié)
本研究基于網(wǎng)絡(luò)藥理學(xué)從炙甘草湯的活性成分、抗疾病關(guān)鍵作用靶點(diǎn)以及重要調(diào)控通路入手,探討炙甘草湯抗MIRI作用機(jī)制,并利用分子對(duì)接技術(shù)驗(yàn)證炙甘草湯主要活性成分與相應(yīng)關(guān)鍵蛋白的結(jié)合情況,揭示了其多成分、多靶點(diǎn)、多通路協(xié)同作用優(yōu)勢(shì)。研究還發(fā)現(xiàn)減輕炎癥、氧化應(yīng)激對(duì)心肌細(xì)胞的損害作用對(duì)治療MIRI非常關(guān)鍵。這些發(fā)現(xiàn)為深入研究炙甘草湯抗MIRI作用機(jī)制提供了理論依據(jù)。由此篩選出來(lái)的核心靶點(diǎn)與調(diào)控通路將有待于進(jìn)一步的體內(nèi)外實(shí)驗(yàn)驗(yàn)證,為炙甘草湯的臨床應(yīng)用提供數(shù)據(jù)與理論支持。
參考文獻(xiàn):
[1] LV Z Q,YANG C Y,XING Q S.TRIM59 attenuates inflammation and apoptosis caused by myocardial ischemia reperfusion injury by activating the P13K/Akt signaling pathway[J].European Review for Medical and Pharmacological Sciences,2020,24(7):4005-4015.
[2] 包宇,胡宇才,黃金雨,等.炙甘草湯調(diào)控離子通道對(duì)室性快速性心律失常作用機(jī)制的研究進(jìn)展[J].中華中醫(yī)藥學(xué)刊,2022,40(8):100-102.
[3] 金星.分析炙甘草湯治療心律失常的進(jìn)展[J].中國(guó)實(shí)用醫(yī)藥,2021,16(33):198-200.
[4] 韓紅,張洪霞,魏紅玲.炙甘草湯加減治療冠心病心律失常的臨床價(jià)值探討[J].中國(guó)現(xiàn)代藥物應(yīng)用,2021,15(12):206-209.
[5] 朱若凱,陳奇,畢明.炙甘草湯及有效成分配伍對(duì)貓缺血再灌注心臟觸發(fā)活動(dòng)及心肌損傷影響[J].中國(guó)實(shí)驗(yàn)方劑學(xué)雜志,2001,7(6):27-29.
[6] 連曉媛,陳奇,畢明.炙甘草湯對(duì)心肌缺血再灌注損傷的保護(hù)作用[J].中藥藥理與臨床,1994,10(5):6-8.
[7] RU J L,LI P,WANG J N,et al.TCMSP:a database of systems pharmacology for drug discovery from herbal medicines[J].Journal of Cheminformatics,2014,6:13-18.
[8] LIU Z Y,GUO F F,WANG Y,et al.BATMAN-TCM:a bioinformatics analysis tool for molecular mechanism of traditional Chinese medicine[J].Scientific Reports,2016,6:21146-21157.
[9] SZKLARCZYK D,MORRIS J H,COOK H,et al.The STRING database in 2017:quality-controlled protein-protein association networks,made broadly accessible[J].Nucleic Acids Research,2017,45(D1):D362-D368.
[10] ZHOU Y Y,ZHOU B,PACHE L,et al.Metascape provides a biologist-oriented resource for the analysis of systems-level datasets[J].Nature Communications,2019,10(1):1523-1532.
[11] 單麗芳,康國(guó)嬌,張超,等.基于網(wǎng)絡(luò)藥理學(xué)和分子對(duì)接探討四物湯抗乳腺癌的作用機(jī)制[J].中草藥,2021,52(13):3943-3953.
[12] 管慶霞,楊芳芳,楊志平,等.基于網(wǎng)絡(luò)藥理學(xué)與分子對(duì)接技術(shù)探究逍遙丸治療乳腺增生的作用機(jī)制[J].糧油食品科技,2022,30(1):134-149.
[13] 范致星,張偉,唐艷紅,等.人參皂苷Rh2對(duì)大鼠心肌缺血再灌注損傷中NLRP3、IL-1β、TNF-α表達(dá)及SOD活性的影響研究[J].中國(guó)中醫(yī)急癥,2021,30(9):1541-1544;1549.
[14] 于雪,付幫澤,郭淑貞,等.山奈酚和芒柄花黃素對(duì)缺氧/復(fù)氧條件下H9c2心肌細(xì)胞活性氧水平的影響[J].遼寧中醫(yī)雜志,2017,44(1):111-113;222.
[15] 于雪,蘇聰平,王旭,等.山奈酚和芒柄花黃素對(duì)H9c2細(xì)胞缺氧損傷的保護(hù)作用[J].遼寧中醫(yī)雜志,2020,47(3):154-156.
[16] 凌珅,吳夢(mèng)瑋.甘草查爾酮A對(duì)H2O2所致心肌細(xì)胞損傷的保護(hù)作用研究[J].世界中西醫(yī)結(jié)合雜志,2018,13(11):1544-1548.
[17] 高龍龍,尹麗君,孟祎凡,等.麥冬及其有效成分抗心腦血管疾病的藥理研究進(jìn)展[J].中國(guó)中醫(yī)藥現(xiàn)代遠(yuǎn)程教育,2021,19(13):182-185.
[18] 王學(xué)耀.麥冬高異黃酮和杜仲生物堿的研究[D].杭州:浙江大學(xué),2011.
[19] 李堯鋒,楊欣,朱璨,等.基于網(wǎng)絡(luò)藥理學(xué)和分子對(duì)接分析薤白治療心肌缺血再灌注損傷的作用機(jī)制[J].中國(guó)醫(yī)院藥學(xué)雜志,2020,40(8):885-891.
[20] 呂儀,陳蓉,鄭雯婧,等.基于氧化應(yīng)激的心肌缺血再灌注損傷研究進(jìn)展[J].中國(guó)中醫(yī)藥雜志,2020,35(2):815-819.
[21] 張慶成,汪承煒.炎性介質(zhì)在冠狀動(dòng)脈斑塊形成中的作用機(jī)制研究[J].武警醫(yī)學(xué),2007,18(8):600-602.
[22] GUO H C,ZHANG Z,ZHANG L N,et al.Chronic intermittent hypobaric hypoxia protects the heart against ischemia/reperfusion injury through upregulation of antioxidant enzymes in adult Guinea pigs[J].Acta Pharmacologica Sinica,2009,30(7):947-955.
[23] HAYASAKI T,KAIKITA K,OKUMA T,et al.CC chemokine receptor-2 deficiency attenuates oxidative stress and infarct size caused by myocardial ischemia-reperfusion in mice[J].Circulation Journal,2006,70(3):342-351.
[24] 高小文,孫安平,陳建華,等.抗凝劑對(duì)髓過氧化物酶檢測(cè)結(jié)果影響的分析[J].標(biāo)記免疫分析與臨床,2014,21(4):458-461.
[25] 陳雪斌.急性心肌梗死患者經(jīng)皮冠狀動(dòng)脈介入術(shù)后血清成纖維細(xì)胞生長(zhǎng)因子21和髓過氧化物酶水平與預(yù)后的關(guān)系[J].中國(guó)動(dòng)脈硬化雜志,2020,28(6):513-517.
[26] 陳文妹,鄺繼孫,邱敏霞,等.基于TLR4/MyD88/NF-κB信號(hào)通路觀察維生素D3對(duì)大鼠炎癥性腸病的改善作用[J].免疫學(xué)雜志,2022,38(7):581-589.
[27] 王曉明,羅佳波.基于MAPKs和NF-κB信號(hào)通路的麻黃-桂枝藥對(duì)抗炎作用機(jī)制研究[J].中藥藥理與臨床,2020,36(3):148-154.
(收稿日期:2022-09-16)
(本文編輯 王雅潔)

