急性心肌梗死外周血單個核細胞中CUX1、CTSD表達水平及其對預后的診斷價值
宋寧 石楊 蔡建葉 張曉荷 靳蕊 張秀英 馬培梁
基金項目?甘肅省衛生行業科研計劃項目(No.GSWSKY-201920)
作者單位?1.中國人民解放軍聯勤保障部隊第九四醫院(蘭州 730050);2.甘肅省人民醫院(蘭州 730000)
通訊作者?馬培梁,E-mail:mpl1232@163.com
引用信息?宋寧,石楊,蔡建葉,等.急性心肌梗死外周血單個核細胞中CUX1、CTSD表達水平及其對預后的診斷價值[J].中西醫結合心腦血管病雜志,2024,22(7):1296-1300.
摘要?目的:探討急性心肌梗死(AMI)病人外周血單個核細胞(PBMC)中剪樣同源盒1(CUT1)、組織蛋白酶D(CTSD)表達及兩者對AMI預后的診斷價值。方法:選取2019年2月—2020年2月我院診治的96例AMI病人為研究對象,根據隨訪1年內AMI病人是否發生主要不良心血管事件(MACE),將AMI病人分為預后不良組(32例)和預后良好組(64例)。以同期我院進行健康體檢的60名健康者為對照組。應用熒光定量聚合酶鏈式反應(PCR)檢測各組病人PBMC中CUX1、CTSD的表達。比較各組CUX1、CTSD水平、臨床生化指標及心功能指標。采用Pearson相關分析法分析AMI病人CUX1、CTSD表達與臨床生化指標及心功能的相關性。采用多因素Logistic回歸分析AMI病人MACE發生的影響因素。受試者工作特征(ROC)曲線分析CUX1、CTSD對AMI病人MACE發生的診斷效能。結果:與對照組比較,AMI預后良好組及預后不良組病人PBMC中CUX1、CTSD表達明顯升高,差異均有統計學意義(P<0.05)。與預后良好組比較,預后不良組AMI病人PBMC中CUX1、CTSD表達及超敏肌鈣蛋白T(hs-cTnT)、N末端腦鈉肽前體(NT-proBNP)明顯升高,左室射血分數(LVEF)、左室短軸縮短率(LVFS)及心排血量(CO)明顯降低,差異均有統計學意義(P<0.05)。AMI病人PBMC中CUX1、CTSD表達與hs-cTnT、NT-proBNP呈正相關,與LVEF、LVFS及CO呈負相關(P<0.05)。hs-cTnT升高、LVEF降低、CUX1升高及CTSD升高是AMI病人MACE發生的獨立危險因素(P<0.05)。CUX1、CTSD及二者聯合檢測預測AMI病人MACE的曲線下面積(AUC)分別為0.776、0.874及0.910。二者聯合檢測預測AMI病人MACE的AUC顯著高于單一指標檢測。結論:AMI病人PBMC中CUX1、CTSD表達升高,是影響AMI病人不良預后的獨立危險因素,兩者聯合檢測有助于判斷AMI病人臨床預后。
關鍵詞?急性心肌梗死;外周血單個核細胞;剪樣同源盒1;組織蛋白酶D;預后
doi:10.12102/j.issn.1672-1349.2024.07.025
急性心肌梗死(acute myocardial infaction,AMI)是常見的心血管系統危急重癥。我國AMI的發病率為45/10萬,死亡率為32/10萬,且AMI發病呈年輕化趨勢[1]。AMI可引起乳頭肌功能失調、心力衰竭、惡性心律失常及心源性死亡等并發癥,導致病人預后不良。深入研究AMI的疾病機制,尋找能夠評估AMI的預后標志物,積極采取個體化的防治措施,對改善病人預后意義重大。剪樣同源盒1(cut like homeobox 1,CUX1)編碼基因位于7號染色體,編碼蛋白屬于DNA結合蛋白同源域家族成員,在調節基因表達、細胞形態發生和分化及細胞周期進程中發揮重要作用[2]。有研究對AMI病人外周血單個核細胞(peripheral blood mononuclear cells,PBMC)基因表達進行高通量篩選,發現CUX1表達上調可能是預測AMI后發生心力衰竭的潛在生物標志物[3]。組織蛋白酶D(cathepsin D,CTSD)是多肽酶A1家族的成員,成熟的CTSD能夠蛋白水解激素和生長因子等多種蛋白質產物,參與惡性腫瘤及神經退行性疾病等的發生發展過程[4-5]。研究發現,CTSD表達能夠通過激活心肌細胞自噬,促進心臟結構重塑,與ST段抬高型心肌梗死(STEM)病人早期發生心功能障礙密切相關[6]。因此,本研究通過檢測AMI病人PBMC中CUX1、CTSD的表達,分析兩者與AMI預后的關系。
1?對象與方法
1.1?研究對象
選取2019年2月—2020年2月我院診治的96例AMI病人為研究對象。納入標準:1)AMI的診斷結合病人臨床表現、心電圖檢查、心肌損傷標志物及冠狀動脈造影等。STEMI的診斷符合2019年中華醫學會心血管病學分會制定的《急性ST 段抬高型心肌梗死診斷和治療指南(2019)》[7],非STEMI的診斷符合2016年制定的《非ST段抬高型急性冠狀動脈綜合征診斷和治療指南(2016)》[8]。2)臨床及實驗室檢查資料完整。3)病人及家屬對本研究知情同意,能夠配合相關檢查及隨訪。排除標準:1)伴有先天性心臟病或心肌炎等疾病;2)伴有惡性腫瘤、肝腎功能障礙等疾病;3)伴有自身免疫性疾病或感染性疾病。以同期進行健康體檢的60名健康者作為對照組。本研究經本院倫理委員會審核批準。
1.2?隨訪及預后分組
所有AMI病人確診后開始進行隨訪,每個月隨訪1次,連續隨訪1年,隨訪內容為主要不良心血管事件(major adverse cardiovascular events,MACE)的發生情況,包括心力衰竭、心源性死亡、再發性心肌梗死及靶血管血運重建。發生MACE的AMI病人納入預后不良組(32例),未發生MACE的AMI病人納入預后良好組(64例)。
1.3?研究方法
1.3.1?資料收集
1)收集研究對象的臨床資料,包括性別、年齡、體質指數、高血壓病史、糖尿病病史、吸煙史。2)收集實驗室檢查指標及心肌損傷指標,包括肌酸激酶同工酶(CK-MB)、超敏肌鈣蛋白T(hs-cTnT)、N-末端腦鈉肽前體(NT-proBNP)、三酰甘油、總膽固醇、高密度脂蛋白膽固醇和低密度脂蛋白膽固醇。收集心臟彩超檢查結果包括左室射血分數(LVEF)、左室短軸縮短率(LVFS)及心排血量(CO)。
1.3.2?PBMC中CUX1、CTSD表達檢測
收集研究對象入院后靜脈血5mL,肝素抗凝,2 500 r/min離心5 min,將下層血細胞轉入15 mL無菌離心管,加入外周血淋巴細胞分離液3 mL(購自上海愛必信公司,貨號abs930),梯度密度離心法進行離心,2000 r/min,離心20min,吸取中間PBMC層細胞。應用Trizol法提取PBMC中的總RNA。采用NaroDrop1000(美國賽默飛公司)檢測總RNA的濃度和純度,OD260/OD280比值為1.8~2.1。應用逆轉錄試劑盒(日本TAKARA公司)將總RNA逆轉錄為cDNA。然后進行實時熒光定量聚合酶鏈式反應(qRT-PCR)。引物由上海生工公司設計合成。CUX1正向引物為5′-GAAGAACCAAGCCGAAACCAT-3′,反向引物為5′-?AGGCTCTGAACCTTATGCTCA-3′;CTSD正向引物為5′-TGCAAAGGCCGACGAGATT-3′,反向引物為5′-GGTCTCCGCCTCTCTCTGAG-3′;以甘油醛-3-磷酸脫氫酶(GAPDH)為內參,正向引物為5′-TGCTCAAGAACTACATGGACGC-3′ ,反向引物為5′-CGAAGACGACTGTGAAGCACT-3′。反應體系包括cDNA 2 μL,正反向引物2 μL和SYBR Premix 10 μL,雙蒸水6 μL。反應條件:95 ℃ 5 min,95 ℃ 15 s,62 ℃ 5 s,70 ℃ 10 s,重復40個循環。PBMC中CUX1、CTSD的相對表達量采用2-ΔΔCT法表示。
1.4?統計學處理
應用SPSS 22.0統計軟件進行數據分析。定量資料經K-S正態性檢驗,符合正態分布的定量資料以均數±標準差(x±s)表示,兩組間比較采用兩獨立樣本t檢驗,3組比較采用單因素方差分析,組間兩兩比較采用SNK-q檢驗。定性資料以例數、百分比(%)表示,組間比較采用χ2檢驗。采用Pearson相關分析法分析指標之間的相關性。多因素Logistic回歸分析影響AMI病人MACE發生的因素。采用受試者工作特征(ROC)曲線分析CUX1、CTSD對AMI病人MACE發生的診斷效能。以P<0.05為差異有統計學意義。
2?結?果
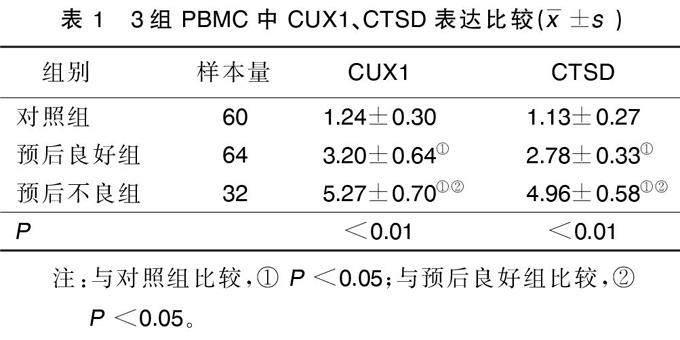
2.1?3組PBMC中CUX1、CTSD表達比較
與對照組比較,預后良好組及預后不良組PBMC中CUX1、CTSD表達明顯升高,差異均有統計學意義(P<0.05)。與預后良好組比較,預后不良組AMI病人PBMC中CUX1、CTSD表達明顯升高,差異均有統計學意義(P<0.05)。詳見表1。
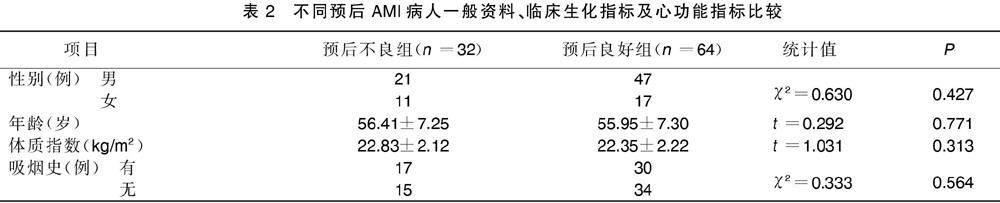
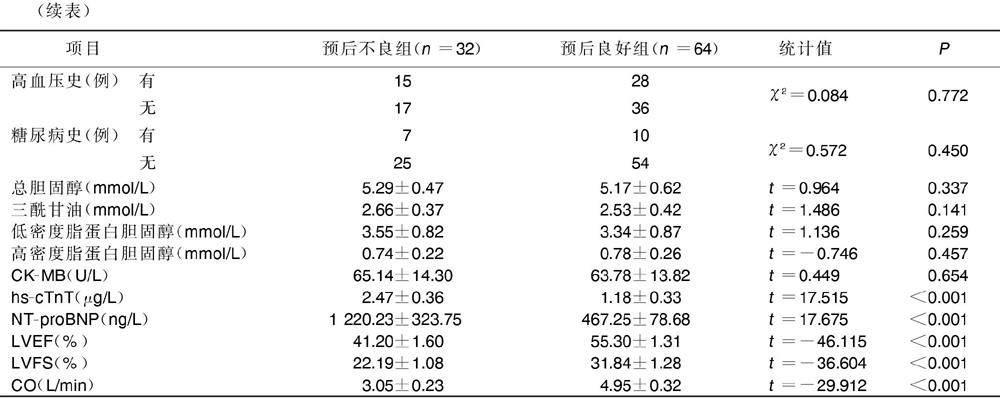
2.2?不同預后AMI病人一般資料、臨床生化指標及心功能指標比較
預后良好組與預后不良組AMI病人年齡、性別、體質指數、吸煙史、高血壓史、糖尿病史、三酰甘油、總膽固醇、低密度脂蛋白膽固醇、高密度脂蛋白膽固醇及CK-MB比較,差異均無統計學意義(P>0.05)。與預后良好組比較,預后不良組hs-cTnT、NT-proBNP水平明顯升高,LVEF、LVFS及CO明顯降低,差異均有統計學意義(P<0.05)。詳見表2。
2.3?AMI病人PBMC中CUX1、CTSD表達與臨床生化指標及心功能指標的相關性
AMI病人PBMC中CUX1、CTSD表達與hs-cTnT、NT-proBNP呈正相關,與LVEF、LVFS及CO呈負相關,與CK-MB無明顯相關性。詳見表3。
以AMI病人是否發生MACE為因變量(發生MACE=1,未發生MACE=0),將hs-cTnT、NT-proBNP、LVEF、LVFS、CO、CUX1及CTSD作為自變量,進行多因素Logistic回歸分析。結果顯示:hs-cTnT升高、LVEF降低、CUX1升高及CTSD升高是AMI病人MACE發生的獨立危險因素(P<0.05)。詳見表4。
2.5?AMI病人PBMC中CUX1、CTSD表達對MACE的預測價值
ROC曲線顯示,PBMC中CUX1、CTSD及二者聯合檢測預測AMI病人MACE的曲線下面積(AUC)分別為0.776(0.705,0.846)、0.874(0.827,0.921)及0.910(0.879,0.941)。二者聯合檢測預測AMI病人MACE的AUC顯著高于單一指標(Z值分別為4.186,3.469,P均<0.001)。詳見表5、圖1。
3?討?論
早期識別具有較高MACE風險的AMI病人是改善病人臨床預后的有效策略。近年來,有學者報道,檢測外周血血小板、缺血修飾白蛋白
等有助于判斷AMI后心力衰竭等MACE的發生[9-10]。但目前臨床尚無有效的早期生物標志物用于預測AMI病人的臨床預后。PBMC的主要細胞成分為單核細胞,是AMI后心臟重塑的重要調節因子[11]。研究表明,在心肌損傷后數小時以內,單核細胞能夠迅速從骨髓和脾臟轉移到外周血中并浸潤心肌梗死區域,參與炎癥反應,雖然單核細胞有利于促進新生血管生成,但單核細胞/巨噬細胞能夠激活心肌細胞心臟重塑相關基因的表達,引起心臟重塑[12],還可加重斑塊負荷,降低斑塊穩定性。因此,通過檢測PBMC中基因表達可能有助于早期識別MACE風險較高的AMI病人,并作為新的判斷AMI病人預后的生物標志物。
CUX1作為一種轉錄因子,具有DNA結合結構域,能夠促進DNA糖基化酶-1的表達。研究表明,CUX1的表達缺失會導致細胞DNA損傷修復延遲并增強輻射敏感性,在腫瘤中發揮腫瘤抑制因子的作用[13]。研究發現,CUX1表達異常下調抑制心肌細胞分化過程,與先天性心臟病埃博斯坦畸形的發生有關[14]。近年來,有學者利用高通量二代測序發現,CUX1在AMI繼發心力衰竭病人PBMC中表達明顯升高,可能是一種新的提示AMI病人預后的生物標志物[3]。本研究發現,AMI病人PBMC中CUX1表達明顯升高,并且其表達水平與心肌損傷指標hs-cTnT、NT-proBNP呈正相關,與心功能指標LVEF、LVFS及CO呈負相關,提示CUX1表達升高可能加重AMI心肌損傷,降低病人心功能。分析其原因,與CUX1對炎癥微環境的調節有關。研究表明,CUX1的表達能夠通過結合IκBζ,促進巨噬細胞中腫瘤壞死因子和白細胞介素17A等細胞因子及趨化因子如趨化因子配體1(CXCL1)、趨化因子配體2(CXCL2)等的表達,招募中性粒細胞及單核巨噬細胞的募集,促進局部組織的炎癥損傷反應,并激活基質成纖維細胞,促進心肌重塑[14]。本研究中,CUX1升高是AMI病人MACE發生的獨立危險因素,提示檢測CUX1有助于預測AMI病人不良心血管事件的發生。研究發現,CUX1的表達上調能夠激活Jacus相關激酶2/信號傳導和轉錄激活因子3通路,誘導心肌細胞肥大[15]。因此,PBMC中CUX1的表達升高可通過加重AMI病人的心肌損害,降低斑塊穩定性,導致AMI后缺血事件和再梗死事件的發生。
CTSD編碼蛋白是一種溶酶體天冬氨酰蛋白酶,參與蛋白質的代謝分解。CTSD不僅參與生長因子、激素和酶前體的激活、抗原的加工和細胞凋亡的調節等多種生理過程,還參與包括動脈粥樣硬化、癌癥、心血管疾病等的發生過程[16-17]。本研究結果顯示,AMI病人PBMC中CTSD表達明顯升高。分析其原因,AMI發生后單核/巨噬細胞聚集到動脈粥樣硬化斑塊區域,在氧化的低密度脂蛋白或7β-羥基膽固醇作用下,巨噬細胞發生細胞凋亡,同時氧化的脂質會導致溶酶體不穩定,溶酶體酶CTSD滲漏到細胞質中,引起CTSD表達水平明顯增加[18]。本研究中,CTSD的表達與hs-cTnT、NT-proBNP呈正相關,與LVEF、LVFS及CO呈負相關,提示CTSD的表達與AMI的疾病嚴重程度有關。研究表明,缺血再灌注損傷后心肌細胞CTSD表達升高,誘導心肌細胞自噬的發生,細胞內磷脂酰肌醇3激酶/自噬基因BeclinⅠ途徑顯著激活,加重心肌細胞的損傷和心肌重塑,促進AMI的進展[19-20]。本研究結果顯示,CTSD升高是AMI病人MACE發生的獨立危險因素,表明CTSD有助于預測AMI病人不良心血管事件的發生。其原因一方面是CTSD可通過誘導巨噬細胞凋亡,進而增加動脈粥樣硬化斑塊易損性[18];另一方面,CTSD表達水平升高能夠直接降解纖維帽的細胞外基質蛋白成分,增加AMI病人再次發生急性冠脈綜合征的風險[21]。
本研究進一步利用ROC曲線分析發現,PBMC中CUX1、CTSD及二者聯合檢測預測AMI病人MACE發生的AUC顯著高于單一指標,二者聯合診斷的敏感度和特異度分別為0.831,0.802。表明二者聯合檢測對AMI病人MACE具有較高的預測價值,可能是新的預后判斷的生物標志物。臨床醫師可根據PBMC中CUX1、CTSD水平,對AMI病人的預后進行評估,以采取相應的診治措施,改善AMI病人的臨床預后。
綜上所述, AMI病人PBMC中CUX1、CTSD表達升高,兩者表達與心肌損傷指標hs-cTnT、NT-proBNP呈正相關,與心功能指標LVEF、LVFS及CO呈負相關,是AMI病人MACE預后的獨立危險因素。CUX1、CTSD聯合檢測對AMI病人MACE具有較高的診斷效能。但由于本研究樣本量有限,未能對AMI病人進行分層分析,有待今后設計多中心的臨床試驗擴大樣本量,深入評估CUX1、CTSD在AMI診斷及預后評估中的臨床應用價值。
參考文獻:
[1]?中國心血管健康與疾病報告編寫組.中國心血管健康與疾病報告2020概要[J].中國循環雜志,2021,36(6):521-545.
[2]?DERMAWAN J K,WENSEL C,VISCONTE V,et al.Clinically significant CUX1 mutations are frequently subclonal and common in myeloid disorders with a high number of co-mutated genes and dysplastic features[J].American Journal of Clinical Pathology,2022,157(4):586-594.
[3]?CHEN Q X,YIN Q J,SONG J X,et al.Identification of monocyte-associated genes as predictive biomarkers of heart failure after acute myocardial infarction[J].BMC Medical Genomics,2021,14(1):44.
[4]?SECOMANDI E,SALWA A,VIDONI C,et al.High expression of the lysosomal protease cathepsin D confers better prognosis in neuroblastoma patients by contrasting EGF-induced neuroblastoma cell growth[J].International Journal of Molecular Sciences,2022,23(9):4782.
[5]?BUNK J,PRIETO HUARCAYA S,DROBNY A,et al.Cathepsin D variants associated with neurodegenerative diseases show dysregulated functionality and modified α-synuclein degradation properties[J].Frontiers in Cell and Developmental Biology,2021,9:581805.
[6]?YAMAC A H,SEVGILI E,KUCUKBUZCU S,et al.Role of cathepsin D activation in major adverse cardiovascular events and new-onset heart failure after STEMI[J].Herz,2015,40(6):912-920.
[7]?中華醫學會心血管病學分會,中華心血管病雜志編輯委員會.急性ST段抬高型心肌梗死診斷和治療指南(2019)[J].中華心血管病雜志,2019,47(10):766-783.
[8]?中華醫學會心血管病學分會,中華心血管病雜志編輯委員會.非ST段抬高型急性冠狀動脈綜合征診斷和治療指南(2016)[J].中華心血管病雜志,2017,45(5):359-376.
[9]?閆潔,袁森.急性心肌梗死PCI術后近期MACE的危險因素及血小板功能參數的預測作用[J].中國動脈硬化雜志,2020,28(12):1065-1072.
[10]?鄭志遠,張從艷,鄭志霞.血清IMA、miR-1聯合HEART評分對急性心肌梗死病人診斷及PCI術后預后評估的價值[J].中西醫結合心腦血管病雜志,2022,20(11):2037-2040.
[11]?ZIMMER A,BAGCHI A K,VINAYAK K,et al.Innate immune response in the pathogenesis of heart failure in survivors of myocardial infarction[J].American Journal of Physiology Heart and Circulatory Physiology,2019,316(3):H435-H445.
[12]?SAGER H B,KESSLER T,SCHUNKERT H.Monocytes and macrophages in cardiac injury and repair[J].Journal of Thoracic Disease,2017,9(Suppl 1):S30-S35.
[13]?ALY M,RAMDZAN Z M,NAGATA Y,et al.Distinct clinical and biological implications of CUX1 in myeloid neoplasms[J].Blood Advances,2019,3(14):2164-2178.
[14]?SLOWIKOWSKI K,NGUYEN H N,NOSS E H,et al.CUX1 and IκBζ (NFKBIZ) mediate the synergistic inflammatory response to TNF and IL-17A in stromal fibroblasts[J].Proceedings of the National Academy of Sciences of the United States of America,2020,117(10):5532-5541.
[15]?GAN X T,ZHAO G J,HUANG C X,et al.Identification of fat mass and obesity associated(FTO) protein expression in cardiomyocytes:regulation by leptin and its contribution to leptin-induced hypertrophy[J].PLoS One,2013,8(9):e74235.
[16]?LIU L,DORAY B.Elevated mRNA expression and defective processing of cathepsin D in HeLa cells lacking the mannose 6-phosphate pathway[J].FEBS Open Bio,2021,11(6):1695-1703.
[17]?DI Y Q,HAN X L,KANG X L,et al.Autophagy triggers CTSD(cathepsin D) maturation and localization inside cells to promote apoptosis[J].Autophagy,2021,17(5):1170-1192.
[18]?LI W,YUAN X M.Increased expression and translocation of lysosomal cathepsins contribute to macrophage apoptosis in atherogenesis[J].Annals of the New York Academy of Sciences,2004,1030:427-433.
[19]?ZHANG X,WEI M P,FAN J H,et al.Ischemia-induced upregulation of autophagy preludes dysfunctional lysosomal storage and associated synaptic impairments in neurons[J].Autophagy,2021,17(6):1519-1542.
[20]?BA L N,GAO J Q,CHEN Y P,et al.Allicin attenuates pathological cardiac hypertrophy by inhibiting autophagy via activation of PI3K/Akt/mTOR and MAPK/ERK/mTOR signaling pathways[J].Phytomedicine,2019,58:152765.
[21]?GONALVES I,HULTMAN K,DUNR P,et al.High levels of cathepsin D and cystatin B are associated with increased risk of coronary events[J].Open Heart,2016,3(1):e000353.
(收稿日期:2022-08-26)
(本文編輯王麗)

