Hh信號(hào)通路分子TPX2對(duì)口腔鱗癌增殖的作用探討
張洪瑞,蘇本香,龐艷,孫月茹
呼倫貝爾職業(yè)技術(shù)學(xué)院口腔教研室,內(nèi)蒙古呼倫貝爾 021000
口腔癌是發(fā)生于口腔黏膜的惡性腫瘤,主要包括唇頰黏膜、舌前2/3、硬腭、牙齦以及口底等部位,其中病理類型以鱗癌最常見。印度、東南亞為口腔癌的高發(fā)區(qū),男性發(fā)病率約為女性的2倍[1]。目前口腔鱗癌的治療方案多為以手術(shù)為主的放化療等綜合治療,但是很難持續(xù)改善患者的預(yù)后,并且大多數(shù)進(jìn)展期患者在治療后仍然復(fù)發(fā)[2]。因此需要識(shí)別促進(jìn)口腔鱗癌增殖的分子,從而研制有效的靶向治療藥物治療口腔鱗癌,降低疾病的復(fù)發(fā)率和病死率[3]。口腔鱗癌發(fā)生的分子機(jī)制仍然不清楚,有研究表明叉頭盒M1(Forkhead Box Protein M1,FOXM1)是癌胚轉(zhuǎn)錄因子及細(xì)胞周期的調(diào)節(jié)因子,靶向Xklp2靶蛋白(Targeting Protein for Xenopus Kinesin-like Protein 2, TPX2)是有絲分裂的關(guān)鍵癌基因,但是如何促進(jìn)口腔鱗癌發(fā)生與發(fā)展仍不明確[4-5]。本研究選取2022年1月—2023年7月呼倫貝爾職業(yè)技術(shù)學(xué)院口腔教研室培養(yǎng)的6株CAL-27人口腔鱗癌細(xì)胞株為研究對(duì)象,旨在探討與分析Hedgehog(Hh)信號(hào)通路分子TPX2對(duì)口腔鱗癌增殖的作用,以明確TPX2的作用機(jī)制。現(xiàn)報(bào)道如下。
1 材料與方法
1.1 材料與試劑
CAL-27人口腔鱗癌細(xì)胞株(美國ATCC);DMEM培養(yǎng)基(美國Gibco);GANT61及cyclopamine(美國Sigma-Aldrich);Puromycin(北京Solarbio);轉(zhuǎn)染試劑lipofectamine 2000 transfection reagent和總RNA提取試劑(美國Thermo Fisher Scientific);DMEM細(xì)胞培養(yǎng)基(美國Gibco);FOXM1抗體、TPX2抗體(英國Abcam)。
1.2 方法
1.2.1 TPX2 shRNA獲取及RT-qPCR Genbank數(shù)據(jù)庫確定人TPX2的基因序列,針對(duì)TPX2的基因序列設(shè)計(jì)1條shRNA,shTPX2序列:5'-AGCCAAGTTGTGCAATGTTC-3',由蘇州吉瑪基因公司設(shè)計(jì)合成。采用TRIzol法提取試劑盒對(duì)細(xì)胞總RNA進(jìn)行提取,RNA的純度和濃度的測定應(yīng)用紫外分光光度計(jì),取2 μl RNA,在反轉(zhuǎn)錄酶作用下合成cDNA,再取2 μl反轉(zhuǎn)錄產(chǎn)物PCR擴(kuò)增,以磷酸甘油醛脫氫酶(Glyceraldehyde 3-Phosphate Dehydrogenase, GAPDH)為內(nèi)參照,PCR反應(yīng)條件:①95℃ 5 min,②95℃ 30 s,③60℃ 30 s,④72℃ 30 s,⑤72℃ 5 min;其中②、③、④為40個(gè)循環(huán)。
1.2.2 細(xì)胞分組與轉(zhuǎn)染 把CAL-27細(xì)胞隨機(jī)分為兩組:對(duì)照組與Lv-shTPX2組。取對(duì)數(shù)生長期細(xì)胞,待細(xì)胞融合度達(dá)到70.0%~80.0%后,對(duì)照組與Lv-shTPX2組分別用lipofectamine 2000細(xì)胞轉(zhuǎn)染試劑轉(zhuǎn)染Lv-pc3.0 vector與Lv-pc3.0-shTPX2,轉(zhuǎn)染終濃度為10 nmol/L,轉(zhuǎn)染后12 h更換培養(yǎng)液。
1.2.3 細(xì)胞增殖 將轉(zhuǎn)染后培養(yǎng)48 h的細(xì)胞消化離心,顯微鏡下計(jì)數(shù),以細(xì)胞5 000個(gè)/孔的密度接種于96孔板,24 h后培養(yǎng)基中加入50 μmol/L Edu再孵育1~4 h,每次實(shí)驗(yàn)每孔重復(fù)3次,只顯示1個(gè)有代表性的區(qū)域。
1.2.4 流式細(xì)胞儀分析細(xì)胞周期 將細(xì)胞消化、傳代、培養(yǎng)24 h后換液,繼續(xù)培養(yǎng)至72 h,0.25%胰酶消化成單細(xì)胞懸液,磷酸緩沖生理鹽水(Phosphate Buffer Saline, PBS)洗滌2次,1 000 r/min離心5 min,棄去上清,緩慢加入-20℃預(yù)冷的75%乙醇,4℃保存,取細(xì)胞懸液,PBS洗滌,2 000 r/min離心5 min后,棄去上清液,碘化丙啶(Propidium Iodide, PI)染液1 mL,染30 min,每樣本收集10 000個(gè)熒光信號(hào),得出各期細(xì)胞數(shù)占細(xì)胞總數(shù)的百分率,每組重復(fù)3次。
1.2.5 蛋白印跡法檢測目的蛋白的表達(dá) 培養(yǎng)細(xì)胞經(jīng)預(yù)冷的PBS漂洗2次,吸凈PBS,加入預(yù)冷的裂解液置于冰上。將研磨液置于離心管中震蕩,間斷吹打,共約30 min,反復(fù)吹打,超聲破碎,置于4℃離心機(jī)中,以13 000 r/min的轉(zhuǎn)速離心15 min,取上清液置于新的EP管中,加入蛋白上樣緩沖液,反復(fù)吹打,利用BCA法定量蛋白,制備10%SDS-PAGE凝膠,上樣,轉(zhuǎn)膜,5%牛奶在室溫孵育2 h,TBST洗3次,10 min/次,單克隆抗體GLI2、FOXM1以及TPX2(1 ∶ 3 000),GAPDH(1 ∶ 5 000),在4℃搖床過夜,TBST洗3次,10 min/次。二抗孵育:膜與相應(yīng)的二抗在室溫下孵育2 h。顯色劑混合,滴于膜上。
1.3 觀察指標(biāo)
比較兩組細(xì)胞的TPX2表達(dá)水平、細(xì)胞增殖指數(shù)、細(xì)胞周期(G1期、S2期、G+M期)相對(duì)比例、目的蛋白(GLI2、FOXM1)相對(duì)表達(dá)水平。
1.4 統(tǒng)計(jì)方法
使用SPSS 24.0統(tǒng)計(jì)學(xué)軟件進(jìn)行數(shù)據(jù)分析。符合正態(tài)分布的計(jì)量資料(TPX2表達(dá)水平、細(xì)胞增殖指數(shù)、細(xì)胞周期相對(duì)比例、目的蛋白相對(duì)表達(dá)水平)用(±s)表示,行t檢驗(yàn)。P<0.05為差異有統(tǒng)計(jì)學(xué)意義。
2 結(jié)果
2.1 兩組細(xì)胞TPX2表達(dá)水平對(duì)比
轉(zhuǎn)染后24、48 h,Lv-shTPX2組的TPX2 mRNA與蛋白相對(duì)表達(dá)水平低于對(duì)照組,差異有統(tǒng)計(jì)學(xué)意義(P均<0.05)。見表1。
表1 兩組細(xì)胞TPX2表達(dá)水平對(duì)比(±s)
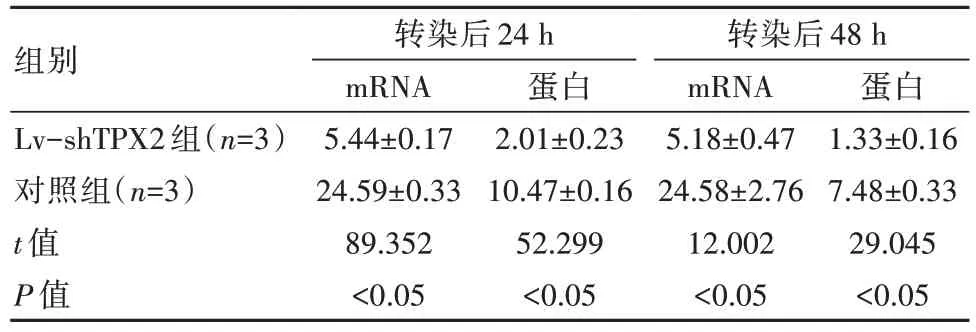
表1 兩組細(xì)胞TPX2表達(dá)水平對(duì)比(±s)
組別Lv-shTPX2組(n=3)對(duì)照組(n=3)t值P值轉(zhuǎn)染后24 h mRNA 5.44±0.17 24.59±0.33 89.352<0.05蛋白2.01±0.23 10.47±0.16 52.299<0.05轉(zhuǎn)染后48 h mRNA 5.18±0.47 24.58±2.76 12.002<0.05蛋白1.33±0.16 7.48±0.33 29.045<0.05
2.2 兩組細(xì)胞增殖指數(shù)對(duì)比
轉(zhuǎn)染后24、48 h,Lv-shTPX2組的細(xì)胞增殖指數(shù)低于對(duì)照組,差異有統(tǒng)計(jì)學(xué)意義(P均<0.05)。見表2。
表2 兩組細(xì)胞增殖指數(shù)對(duì)比[(±s),%]
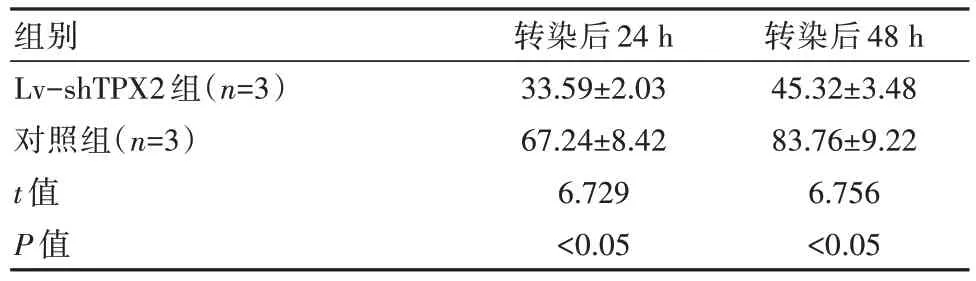
表2 兩組細(xì)胞增殖指數(shù)對(duì)比[(±s),%]
組別Lv-shTPX2組(n=3)對(duì)照組(n=3)t值P值轉(zhuǎn)染后24 h 33.59±2.03 67.24±8.42 6.729<0.05轉(zhuǎn)染后48 h 45.32±3.48 83.76±9.22 6.756<0.05
2.3 兩組細(xì)胞周期相對(duì)比例對(duì)比
轉(zhuǎn)染48 h后,Lv-shTPX2組的G2+M期細(xì)胞相對(duì)比例高于對(duì)照組,S期細(xì)胞相對(duì)比例低于對(duì)照組,差異有統(tǒng)計(jì)學(xué)意義(P均<0.05)。見表3。
表3 兩組細(xì)胞周期相對(duì)比例對(duì)比[(±s),%]
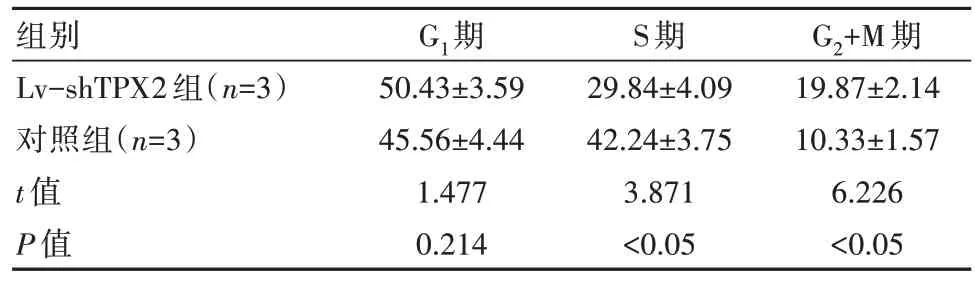
表3 兩組細(xì)胞周期相對(duì)比例對(duì)比[(±s),%]
組別Lv-shTPX2組(n=3)對(duì)照組(n=3)t值P值G1期50.43±3.59 45.56±4.44 1.477 0.214 S期29.84±4.09 42.24±3.75 3.871<0.05 G2+M期19.87±2.14 10.33±1.57 6.226<0.05
2.4 兩組細(xì)胞目的蛋白相對(duì)表達(dá)水平對(duì)比
轉(zhuǎn)染48 h后,Lv-shTPX2組的GLI2、FOXM1蛋白相對(duì)含量低于對(duì)照組,差異有統(tǒng)計(jì)學(xué)意義(P均<0.05)。見表4。
表4 兩組細(xì)胞目的蛋白相對(duì)表達(dá)水平對(duì)比[(±s),%]
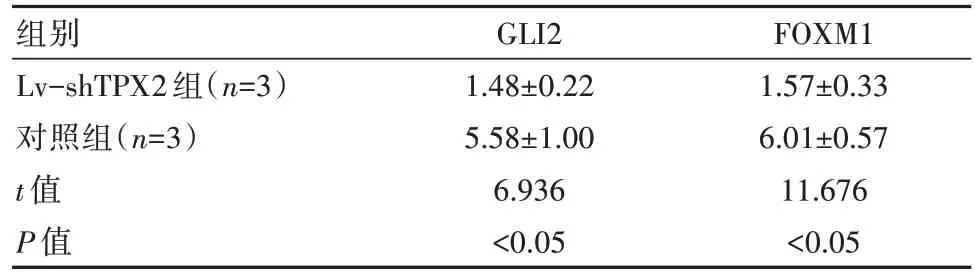
表4 兩組細(xì)胞目的蛋白相對(duì)表達(dá)水平對(duì)比[(±s),%]
組別Lv-shTPX2組(n=3)對(duì)照組(n=3)t值P值GLI2 1.48±0.22 5.58±1.00 6.936<0.05 FOXM1 1.57±0.33 6.01±0.57 11.676<0.05
3 討論
口腔鱗癌是頭頸部最常見的惡性腫瘤之一,80.0%發(fā)生于口腔黏膜的癌癥為鱗癌[5]。口腔鱗癌患者的預(yù)后比較差,5年生存率不到50.0%[6-7],腫瘤轉(zhuǎn)移和放化療耐受是口腔鱗癌致死的主要原因,為此需要為治療口腔鱗癌尋找一條新的途徑。有研究證實(shí)口腔鱗癌中Hh信號(hào)通路處于異常激活狀態(tài),但Hh信號(hào)通路如何調(diào)節(jié)腫瘤生長需要進(jìn)一步研究[8]。同時(shí)目前有多種靶向抑制Hh通路的藥物,主要為環(huán)靶明,但研究報(bào)道腫瘤細(xì)胞對(duì)環(huán)靶明產(chǎn)生耐藥,因此需要進(jìn)一步研究Hh信號(hào)通路下游分子,尋找直接導(dǎo)致口腔鱗癌細(xì)胞增殖和生長的原因,從而針對(duì)性研制出靶向治療藥物[9]。
TPX2是一種在多種腫瘤中呈高表達(dá)的癌基因,可促進(jìn)有絲分裂紡錘體的形成,在細(xì)胞分裂及腫瘤的形成中也發(fā)揮有重要的作用,然而TPX2的表達(dá)調(diào)節(jié)機(jī)制仍不清楚[10]。本研究結(jié)果顯示,轉(zhuǎn)染后24、48 h,Lv-shTPX2組的TPX2 mRNA[(5.44±0.17)、(5.18±0.47)]與蛋白相對(duì)表達(dá)水平[(2.01±0.23)、(1.33±0.16)]低于對(duì)照組的TPX2 mRNA[(24.59±0.33)、(24.58±2.76)]與蛋白相對(duì)表達(dá)水平[(10.47±0.16)、(7.48±0.33)](P均<0.05);在尹頌豪等[11]的相關(guān)研究中顯示,在轉(zhuǎn)染TPX2-siRNA后,TPX2 mRNA在48 h后表達(dá)下調(diào)(F=224.8,P<0.001);TPX2蛋白質(zhì)在72 h后表達(dá)下調(diào)(F=10.69,P=0.022)。Lv-shTPX2組的細(xì)胞增殖指數(shù)低于對(duì)照組(P<0.05),表明抑制Hh信號(hào)通路分子TPX2的表達(dá)可抑制口腔鱗癌細(xì)胞增殖。當(dāng)前也有研究顯示,TPX2持續(xù)高表達(dá)后,Edu染色、細(xì)胞增殖曲線及克隆形成實(shí)驗(yàn)證實(shí)口腔鱗癌細(xì)胞生長加速,sonic hedgehog (Shh)信號(hào)通路通過TPX2促進(jìn)口腔鱗癌細(xì)胞增殖[12]。
在口腔鱗癌所有異常調(diào)節(jié)的信號(hào)通路中,Hh信號(hào)通路對(duì)腫瘤的增殖有重要的作用,TPX2是Hh信號(hào)通路的下游的靶基因[8]。GLI是重要的轉(zhuǎn)錄因子,調(diào)控Hh信號(hào)由胞質(zhì)到胞核中,敲除GLI,TPX2的表達(dá)下降,GLI異常激活,TPX2的表達(dá)升高。激活Hh配體,Shh、TPX2表達(dá)亦升高[13]。FOXM1在高度分化和未分化的組織細(xì)胞中沒有表達(dá),而在增殖的上皮細(xì)胞和間充質(zhì)細(xì)胞表現(xiàn)出高度活性,加速細(xì)胞周期進(jìn)程,在正常組織受到損傷后,F(xiàn)OXM1的表達(dá)直接參與損傷后修復(fù),為此異常激活的FOXM1作為癌基因而促進(jìn)癌癥的發(fā)生發(fā)展[14]。本研究結(jié)果顯示,轉(zhuǎn)染48 h后,Lv-shTPX2組的G2+M期細(xì)胞相對(duì)比例高于對(duì)照組,S期細(xì)胞相對(duì)比例低于對(duì)照組,Lv-shTPX2組的GLI2、FOXM1蛋白相對(duì)含量更低,(P均<0.05),表明抑制Hh信號(hào)通路分子TPX2的表達(dá)可抑制GLI2、FOXM1蛋白表達(dá),還可調(diào)節(jié)細(xì)胞周期狀況。
綜上所述,抑制Hh信號(hào)通路分子TPX2的表達(dá)可抑制口腔鱗癌細(xì)胞增殖,也可抑制GLI2、FOXM1蛋白表達(dá),還可調(diào)節(jié)細(xì)胞周期狀況,可為治療口腔鱗狀細(xì)胞癌提供新的途徑。

