鹿茸多肽通過SDF-1α/CXCR4軸調控PI3K/AKT信號通路促進下肢動脈硬化性閉塞癥大鼠血管新生的作用機制
丁愛國,王雁彬,李廷荃,李子娟,王繼堯,曹佳穎
摘要目的:探索鹿茸多肽通過基質細胞衍生因子(SDF-1α)/趨化因子受體(CXCR4)軸對磷脂酰肌醇-3-激酶(PI3K)/蛋白激酶B(AKT)通路促進下肢動脈硬化性閉塞癥(PAD)大鼠血管新生的作用機制。方法:采用結扎并離斷大鼠股動脈及分支造成肢體缺血、給予高脂飼料喂養制作大鼠下肢動脈硬化閉塞癥模型。將100只雄性Sprague Dawley(SD)大鼠隨機分為10組,分別為空白組、模型組、假手術組,鹿茸多肽低劑量組、鹿茸多中劑量肽組、鹿茸多肽高劑量組、抑制劑LY294002組、鹿茸多肽低劑量+抑制劑LY294002組、鹿茸多肽中劑量+抑制劑LY294002組、鹿茸多肽高劑量+抑制劑LY294002組。將空白組、模型組及假手術組灌胃等容量蒸餾水。鹿茸多肽低、中、高劑量組+抑制劑LY294002組先行腹腔注射再灌胃,于造模完第1天開始給藥,每日1次,28 d后處死。采用流式細胞術檢測給藥后外周血、骨髓中造血干細胞(CD34+細胞)比例;免疫熒光法檢測給藥后患側腓腸肌SDF-1α、PI3K的陽性細胞數比例。結果:造血干細胞(CD34+細胞)比例模型組均顯著高于空白組(P<0.05);其中鹿茸多肽低劑量組較鹿茸多肽低劑量+抑制劑LY294002組陽性細胞比例升高,鹿茸多肽中劑量組較鹿茸多肽中劑量+抑制劑LY294002組陽性細胞比例升高,鹿茸多肽高劑量組較鹿茸多肽高劑量+抑制劑LY294002組陽性細胞比例升高(P<0.05);給藥組SDF-1α、PI3K的陽性細胞數高于模型組及抑制組(P<0.05),鹿茸多肽中劑量組高于鹿茸多肽低劑量組(P<0.05),鹿茸多肽高劑量組高于鹿茸多肽高劑量組+LY294002組(P<0.05)。結論:鹿茸多肽通過SDF-1α/CXCR4軸影響PI3K/AKT信號通路促進了內皮祖細胞的增殖及分化、PAD血管新生。
關鍵詞下肢動脈硬化性閉塞癥;鹿茸多肽;內皮祖細胞;血管新生;實驗研究
doi:10.12102/j.issn.1672-1349.2024.08.012
The? Mechanism of Antler Polypeptide? Regulating PI3K/AKT Signaling Pathway through SDF-1α/CXCR4 Axis Promotes Angiogenesis on Rats with Lower Extremity Arteriosclerotic Obliterans
DING Aiguo, WANG Yanbin, LI Tingquan, LI Zijuan, WANG Jiyao, CAO Jiaying
Shuozhou People′s Hospital, Shuozhou 036000, Shanxi,China
Corresponding AuthorWANG Yanbin, E-mail: 416210959@qq.com
AbstractObjective:To explore the effect of antler polypeptides on phosphatidylinoinosidine-3-kinase(PI3K)/protein kinase B(AKT) pathway through stromal cell derived factor(SDF-1α)/receptor(CXCR4) axis,and to promote angiogenesis on rats with lower limb arteriosclerotic obliterans(PAD).Methods:The rats model with lower extremity arteriosclerosis obliterans were established by ligation and severing of femoral artery and branches to construct limb ischemia and feeding with high fat diet.One hundred male SD rats were randomly divided into blank group,model group and sham operation group; antler polypeptide low dose group,medium dose antler polypeptide medium dose group,antler polypeptide high dose group,inhibitor LY294002 group,LY294002+antler polypeptide low dose group,LY294002+antler polypeptide medium dose group,LY294002+antler polypeptide high dose group.The blank group,model group and sham group were gavaged equal volume of distilled water.LY294002+antler polypeptide low dose group,LY294002+antler polypeptide medium dose group,LY294002+antler polypeptide high dose group were first injected intraperitoneally and then gavaged with intragastric administration,once a day? after modeling,and rats,were executed after 28 days.Flow cytometry was used to detect the proportion of hematopoietic stem cells(CD34+cells) in peripheral blood and bone marrow after administration.The proportion of SDF-1α and PI3K positive cells in gastrocnemius muscle was detected by immunofluorescence assay.Results:The proportion of hematopoietic stem cells(CD34+cells) in model group was higher than that in blank group(P<0.05).The proportion of positive cells in antler polypeptide low dose group was higher than that in LY294002+antler polypeptide low dose group,the proportion of positive cells in antler polypeptide medium dose group was higher than that in LY294002+antler polypeptide medium dose group,and the proportion of positive cells in antler polypeptide high dose group was higher than that in LY294002+antler polypeptide high dose group(P<0.05).The proportion of positive cell number of SDF-1α and PI3K in administration group was significantly higher than that in model group and inhibition group(P<0.05),the antler polypeptide medium dose group was higher than that in LY294002+antler polypeptide medium dose group group,and the antler polypeptide medium dose group was higher than that in antler polypeptide low dose group group(P<0.05),antler polypeptide high dose group was higher than LY294002+antler polypeptide high dose group(P<0.05).Conclusion:Antler polypeptide affected the PI3K/AKT signaling pathway through SDF-1α/receptor(CXCR4) axis thereby promoting the proliferation and differentiation of endothelial progenitor cells,and facilitating the angiogenesis of PAD.
Keywordsarteriosclerotic obliterans of lower extremity; antler polypeptide; endothelial progenitor cells; angiogenesis; experimental study
下肢動脈硬化性閉塞癥(peripheral artery disease in the lower extremity,PAD)是我國老年人的常見病、多發病[1]。研究表明,有癥狀的PAD是全身血管系統硬化的重要標志,在早期以肢體發涼、怕冷及間歇性跛行為主[2-3],發展到后期常出現肢體末端壞疽而面臨截肢,其病理特點往往表現為動脈粥樣硬化導致的動脈狹窄、閉塞、局部缺血,所以該病治療集中在缺血部位的血管再通和血管新生方面[4]。
鹿茸能夠補腎、填精、益髓,其核心成分是鹿茸多肽,探究鹿茸多肽調控內皮祖細胞(EPCs)動員、歸巢及促進PAD缺血區血管新生的機制意義重大。本課題組前期動物實驗已經證實,鹿茸能夠改善內皮細胞,通過磷脂酰肌醇-3-激酶(PI3K)/蛋白激酶B(AKT)信號通路調控EPCs的動員及歸巢,促進PAD大鼠的血管新生[5-7]。鹿茸主要成分是鹿茸多肽,鹿茸多肽對成纖維細胞及表皮細胞有顯著促進增殖作用,可以加速瘡面的愈合,促進其血管內皮細胞增殖分化及遷移[8],對EPCs的特征和鹿茸多肽信號傳導途徑的充分理解更有利于研究PAD的分子生物學機制。本研究旨在分析鹿茸多肽通過基質細胞衍生因子(SDF-1α)/趨化因子受體4(CXCR4)軸對PI3K/AKT通路的影響,探討促進PAD大鼠血管新生的作用機制。
1材料與方法
1.1實驗材料
1.1.1實驗動物
100只2月齡雄性Sprague Dawley(SD)大鼠,清潔級,體質量250~300 g,由山西省中醫藥研究院提供,實驗動物合格證號:1103221911003889[9]。
1.1.2飼料制備
高脂飼料:80.3%基礎飼料+15%豬油+0.5%淡黃色膽酸鈉+0.2%丙硫氧嘧啶+4%膽固醇。
1.1.3藥物與試劑
鹿茸多肽采用馬鹿茸多肽,鹿茸多肽凍干粉購于陜西斯諾特生物科技技術有限公司,儲存于室溫,鹿茸多肽凍干粉溶于去離子水,配置為濃度 4.5 mg/mL的溶液,置于 EP 管中,儲存在 2~6 ℃冰箱中[9];PI3K抑制劑LY294002采購于美國輝瑞公司,用非質子溶劑二甲基亞砜(DMSO)配置母液(10 mg PI3K抑制劑溶于6.507 5 mL二甲基亞砜中)在-20 ℃冰箱保存,每日所配置的當日所需工作液由10%母液+40%PEG300+5%Tween-80+45%生理鹽水組成,即用即配[9];維生素針劑D3購于哈爾濱摩天農科獸藥有限公司;造血干細胞CD34抗體及同型對照抗體購于BD公司;SDF-1α、PI3K購于英國 Abcam 公司。
1.1.4儀器
德國EPPENDORF移液器;電子天平購于瑞士METTER公司;中國中衫金橋有限公司微量加樣吸頭;法國Froilabo烘箱;日本OLYMPUS顯微鏡;脫水機、包埋機及凍臺購于武漢俊杰電子公司;病理切片機購于上海徠卡科技公司;烤箱、微波爐及冰箱購于美的電器制造有限責任公司;流式細胞儀購于美國貝克曼庫爾特公司;恒溫水浴箱購于江蘇太倉醫用儀器廠;高速攪拌器為德國Fluko公司。
1.2實驗方法
1.2.1分組
按隨機數字表法將100只大鼠分為10組:空白組、模型組、假手術組、給藥組(包括鹿茸多肽低劑量組、鹿茸多肽中劑量組、鹿茸多肽高劑量組、鹿茸多肽低劑量+抑制劑LY294002組、鹿茸多肽中劑量+抑制劑LY294002組、鹿茸多肽高劑量+抑制劑LY294002組)、抑制劑LY294002組,每組10只。
1.2.2PAD模型制作
將SD雄性大鼠,腹腔麻醉(5%水合氯醛溶液7 mL/kg),取平臥位,固定于手術臺中央,左腹股溝區域碘消毒,縱向切口約1.5 cm,暴露血管鞘,分離其股動脈及其分支,齒鑷鉗夾約30 s,結扎并離斷左側股動脈的分支;用0號線縫合皮膚及皮下組織,在SD大鼠背部皮下注射生理鹽水10 mL補液抗休克治療,觀察大鼠各項生命體征,平穩后放回鼠籠;肌肉注射30×104 U青霉素3 d,預防感染;飼料為高脂飼料并且喂養12周[8-9];給予維生素D3(30×104 U/kg),右下肢肌肉注射,每月1次[10]。
1.2.3給藥方法
鹿茸多肽低、中、高劑量組分別灌胃給藥0.143 g/(kg·d)、0.286 g/(kg·d)、0.572 g/(kg·d)。抑制劑LY294002組腹腔注射LY294002 1 mg/(kg·d);空白組、模型組和假手術組灌胃等容量蒸餾水;鹿茸多肽低中、高劑量+抑制劑LY294002組先進行腹腔注射然后再灌胃;在造模后的第1天給藥,連續28 d,每日1次,28 d后處死大鼠[9]。
1.2.4采集標本及處理方法
將大鼠麻醉,用小鑷子摘去其中一只眼球,收集外周血到微量離心管(EP)管中;取大鼠結扎及分離后術側的下肢股骨,用注射器抽吸磷酸緩沖鹽溶液(PBS)反復沖洗下肢股骨骨髓腔,過濾、離心及吹打后制成密度均勻的骨髓懸液,收集到EP管中,溫度調至-70 ℃凍存[9]。
1.2.5檢測指標
1.2.5.1一般狀態
觀察SD大鼠的一般狀態,包括大鼠的精神狀態和毛色,大鼠的皮溫和活動靈敏度等。
1.2.5.2大鼠血脂水平
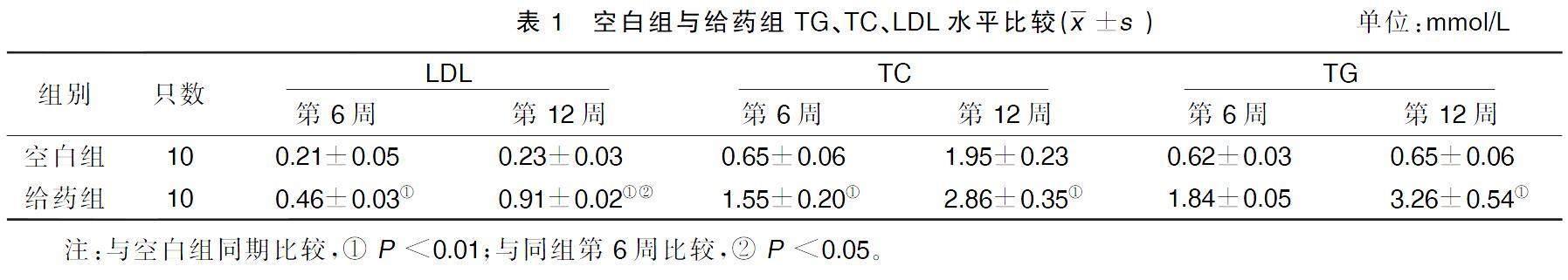
分別于手術后第6周、12周時測量與記錄空白組和給藥組大鼠體質量,用乙醇棉球擦拭固定好的大鼠尾部,將尾靜脈血抽取作為標本,用生化分析儀檢測空白組和給藥組低密度脂蛋白(LDL)、總膽固醇(TC)、三酰甘油(TG)水平[9]。
1.2.5.3采用流式細胞術檢測外周血、骨髓中CD34+細胞比例
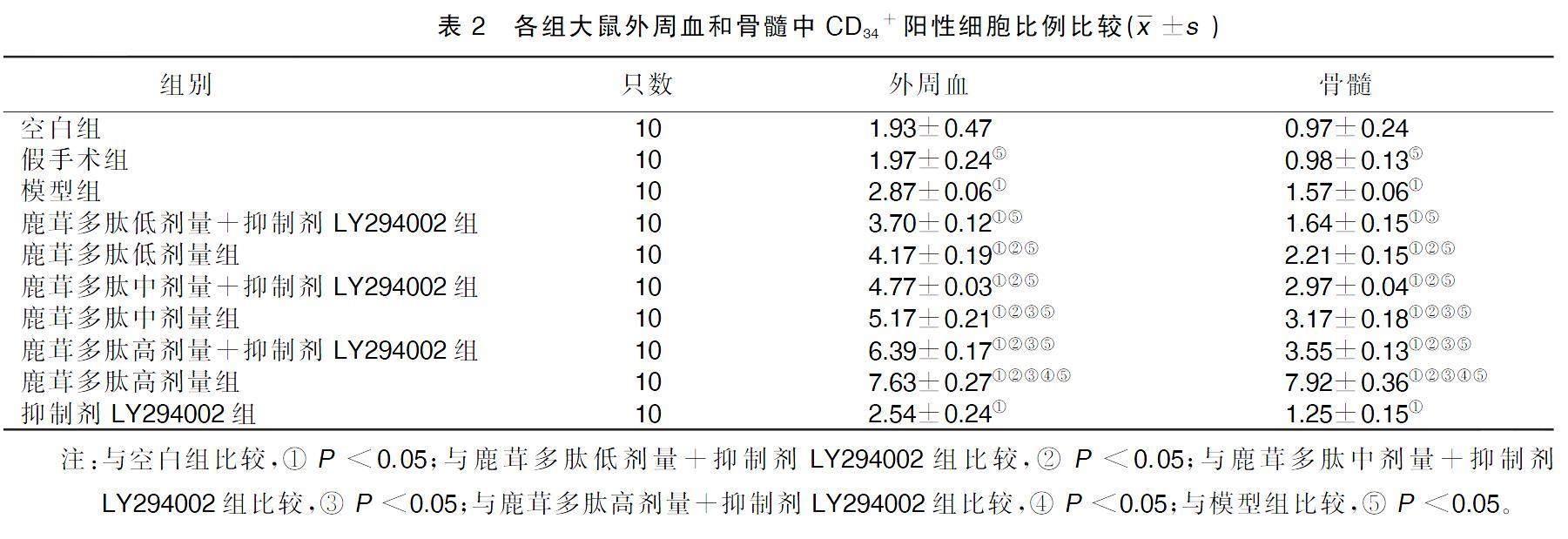
將每只大鼠各設置5個測定管,2個單染管及同型對照管,另加1個三染測定管,在抗凝管中加入紅細胞裂解液5 mL,放入37 ℃恒溫水溫箱中,避光孵育10 min,1 500 r/min離心5 min,棄上清,在抗凝管中加紅細胞裂解液5 mL,再次放入37 ℃恒溫水溫箱中避光孵育10 min,1 500 r/min離心5 min,棄上清后加PBS 350 μL,將每個樣品分裝到5個1.5 mL的離心管中,每管給予50 μL,按CD34檢測、 CD34對照及三色檢測順序標明各管,將各管中加入所對應的抗體,放入4 ℃恒溫水溫避光孵育20~25 min,各管加1 mL PBS緩沖液洗滌1次,再以1 500 r/min離心5 min,棄上清液,加入PBS緩沖液定容至500 μL,樣本按CD34檢測、CD34對照、三色檢測移至流式管中備用,最后將樣品重懸,按CD34檢測、CD34對照、三色檢測順序上機檢測,軟件分析各管雙陽性細胞所占比例[12]。
1.2.5.4免疫熒光技術檢測下肢腓腸肌中SDF-1α、PI3K的陽性細胞數
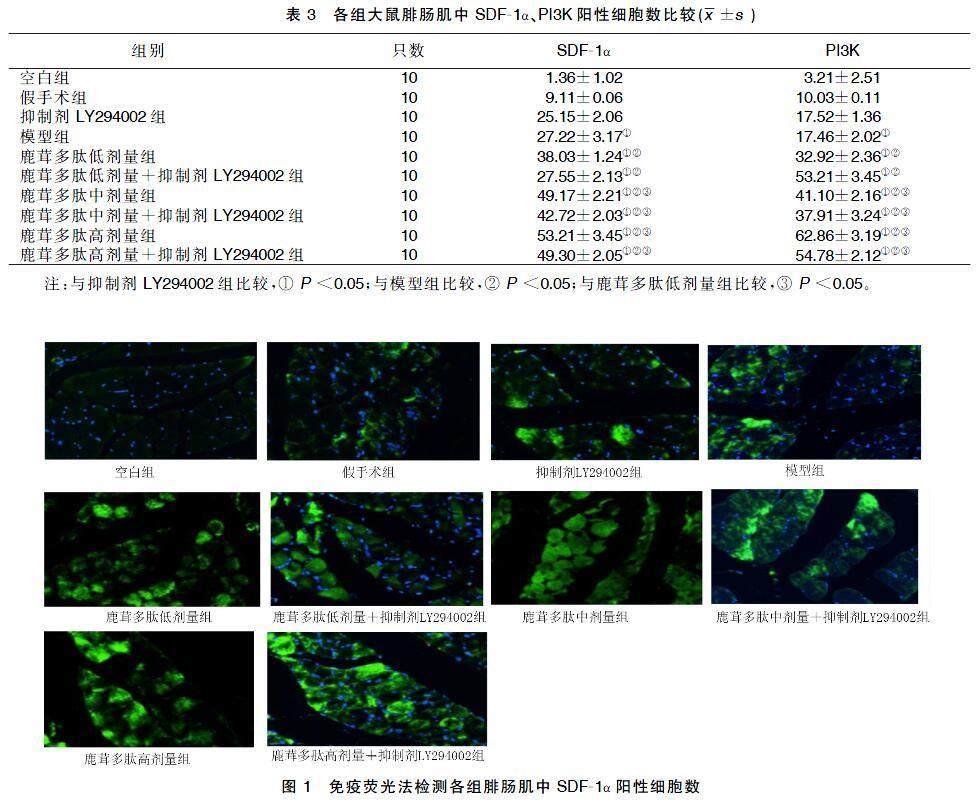
將樣本涂片后用多聚甲醛固定10 min;PBS溶液微振蕩洗滌5 min×2次,加0.4%裂解緩解液Triton-X100破膜5~10 min,然后用PBS微振蕩洗滌3 min×3次;再用1% PBS溶液封閉30 min至1 h;給予0.5% PBS溶液稀釋一抗,比例為1∶100;4 ℃過夜;冰箱取出后需37 ℃ 復溫45 min;或在室溫下2~3 h;或37 ℃ 1 h,用0.5% PBS溶液稀釋二抗,比例為1∶400;室溫30 min至1 h;孵育后洗滌5 min×3次;熒光染料DAPI原液為1 g/mL,將其稀釋為1∶1 000濃度,快速染色10 s,再用蒸餾水沖洗和用防淬滅的封片劑封片,在熒光顯微鏡高倍視野下觀察[9]。
1.3統計學處理
應用SPSS 25.0軟件進行統計分析,定量資料符合正態分布且方差齊時用獨立樣本t檢驗,以均數±標準差(x±s)表示;不符合正態分布時用秩和檢驗,方差不齊時用校正t檢驗。以P<0.05為差異有統計學意義。
2結果
2.1大鼠一般狀態
空白組和假手術組大鼠毛色光澤,活動靈敏,下肢溫度正常;模型組和給藥組大鼠毛色暗淡,活動欠靈敏,下肢溫度降低。
2.2空白組與給藥組大鼠血脂水平變化
空白組的LDL、TC、TG在實驗第6周與第12周比較,差異均無統計學意義(P>0.05)。給藥組各時期TC及LDL與空白組比較,差異有統計學意義,LDL第12周較第6周上升(P<0.05)。詳見表1。
2.3流式細胞術檢測給藥后外周血和骨髓中CD34+細胞比例
與空白組比較,模型組外周血和骨髓中CD34+陽性細胞比例升高;與鹿茸多肽低劑量+抑制劑LY294002組比較,鹿茸多肽低劑量組、鹿茸多肽中劑量組、鹿茸多肽中劑量+抑制劑LY294002組、鹿茸多肽高劑量組、鹿茸多肽高劑量+LY294002組外周血和骨髓中CD34+陽性細胞比例升高;鹿茸多肽中劑量組較鹿茸多肽中劑量+抑制劑LY294002組外周血和骨髓中CD34+陽性細胞比例升高;鹿茸多肽高劑量組、鹿茸多肽高劑量+抑制劑LY294002組較鹿茸多肽中劑量+LY294002組外周血和骨髓中CD34+陽性細胞比例升高;鹿茸多肽高劑量組較鹿茸多肽高劑量+抑制劑LY294002組外周血和骨髓中CD34+陽性細胞比例升高;與模型組比較,假手術組、給藥組外周血和骨髓中CD34+陽性細胞比例升高。詳見表2。
2.4免疫熒光法檢測給藥后腓腸肌中SDF-1α、PI3K陽性細胞數
與抑制劑LY294002組比較,模型組及給藥組抑制劑LY294002組SDF-1α、PI3K陽性細胞數增加(P<0.05);與模型組比較,給藥組、模型組SDF-1α、PI3K陽性細胞數增加(P<0.05);與鹿茸多肽低劑量組比較,鹿茸多肽中劑量組、鹿茸多肽中劑量+抑制劑LY294002組、鹿茸多肽高劑量組、鹿茸多肽高劑量+抑制劑LY294002組較鹿茸多肽低劑量組陽SDF-1α、PI3K陽性細胞數增加(P<0.05)。詳見表3及圖1、圖2。
3討論
PAD的病理特點往往表現為動脈狹窄、閉塞、局部缺血,所以該病治療集中在缺血部位的血管再通和血管新生方面[9]。外科手術和介入難以從根本上解決術后再狹窄和術后血管遠期通暢率。有文獻報道,在膝上股-腘動脈人工血管移植后3年的通暢率為60%~80%,膝下3年通暢率僅20%~30%,并且外科治療在基層醫療機構推廣應用困難[10]。血管新生的研究為臨床治療PAD提供了新的思路,是指通過藥物促進缺血組織在原有微血管基礎上形成新毛細血管與原有血管網相交匯,通過加速和增加側支動脈發育來治療血管狹窄、阻塞引起的缺血[11]。EPCs源于骨髓,具有調控缺血區定向歸巢的作用,成熟的內皮細胞與血管新生有密切關系,直接參與血管新生。中藥干預在治療PAD方面有極大潛力。鹿茸能夠補腎、填精、益髓,其核心成分是鹿茸多肽,探究鹿茸多肽調控EPCs動員、歸巢及促進PAD缺血區血管新生的機制意義重大。
PAD病本在腎,病位在脈,補腎是關鍵。中醫學將PAD歸為“脈痹”“陰疽”“脫疽”范疇,其病本在腎,病位在脈。本病的發生多與腎虛血瘀有關。人到老年,隨著年齡的增長,腎精漸虧,腎陽漸衰,導致氣血虧虛,運行無力,脈絡不通,筋脈痹阻,肢體缺乏血液的濡養,故出現發涼、麻木、間歇性跛行等。《景岳全書》:“血即精之屬也”,精髓是化生血液的基本物質。清代王士雄《溫熱經緯》曰:“人體血生于脾,藏于肝,脈源于腎而主于心”,也就是說其資始于腎,即脈形成的物質基礎是腎精,所以脈絡生成受到“腎”的調控。鹿茸補腎生髓,鹿茸中含有大量的氨基酸、蛋白質、糖類化合物、多肽,其中鹿茸多肽為其主要成分[12]。鹿茸多肽含有許多細胞生長因子和內生的抗氧化酶,如血管內皮生長因子(VEGF)、谷胱甘肽過氧化物酶(GPX)和過氧化氫酶(CAT)等多種在疾病治療中起主要作用的生物活性成分[13-15]。
SDF-1α/CXCR4軸在EPCs 歸巢到缺血組織過程中起著重要作用。基質細胞衍生因子-1α(stromal cell derived factor-1,SDF-1α),屬于CXC型趨化因子,參與缺血誘導的EPCs動員及介導EPCs在缺血組織中趨化和歸巢[16]。CXCR4作為SDF-1α的唯一受體,是一種具有7個跨膜結構域的G蛋白偶聯受體[17],研究證明,缺血組織SDF-1α表達增強,進而導致外周血SDF-1α水平升高,組織缺血同時誘導骨髓SDF-1α表達下調,骨髓對EPCs的滯留作用減弱,外周血對EPCs的趨化作用增強,從而導致骨髓源性EPCs動員到外周血,參與缺血組織新生血管的形成[18]。PI3K/AKT信號轉導通路處于SDF-1α/CXCR4軸的下游,調控EPCs的遷移及歸巢,抑制受體CXCR4可顯著降低SDF-1α誘導的骨髓EPCs歸巢到下肢缺血區域的數量[19-20]。鹿茸多肽促進外周血及骨髓EPCs缺血區血管新生。本實驗通過SDF-1α/CXCR4軸調控PI3K/AKT信號通路促進EPCs的動員及歸巢,促進血管新生。因此,本實驗檢測CD34+陽性細胞比例、SDF-1α、PI3K的陽性細胞數,結果顯示CD34+細胞比例模型組高于空白組(P<0.05);其中鹿茸多肽低劑量組較鹿茸多肽低劑量+抑制劑LY294002組陽性細胞數升高,鹿茸多肽中劑量組較鹿茸多肽中劑量+抑制劑LY294002組陽性細胞數升高,鹿茸多肽高劑量組較鹿茸多肽高劑量+抑制劑LY294002組陽性細胞數升高(P<0.05);給藥組SDF-1α、PI3K的陽性細胞數數高于模型組及抑制劑組(P<0.05),鹿茸多肽中劑量組高于鹿茸多肽低劑量組(P<0.05),表明大鼠下肢動脈硬化閉塞缺血激活了SDF-1α/CXCR4軸從而調控PI3K/AKT信號通路,在鹿茸多肽干預下促進了EPCs的增殖及分化,影響下肢動脈硬化閉塞癥大鼠,促進PAD大鼠血管新生[9]。
綜上所述,鹿茸多肽可以促進PAD大鼠血管新生,通過SDF-1α/CXCR4軸調控PI3K/AKT信號通路促進了EPCs的增殖及分化,鹿茸多肽提高外周血及骨髓CD34+細胞比例,給藥后提高腓腸肌中SDF-1α、PI3K陽性細胞數比例。
參考文獻:
[1]徐義巖,王海洋.下肢動脈硬化閉塞癥的治療進展[J].醫學論述,2020,26(24):4892-4895.
[2]TICKNER A,KLINGHARD C,ARNOLD J F,et al.Total contact cast use in patients with peripheral arterial disease:a case series and systematic review[J].Wounds,2018,30(2):49-56.
[3]GIANNOPOULOS G,ANGELIDIS C,VOGIATZI G,et al.Antioxidant treatment in peripheral artery disease:the rationale is there,but what about clinical results?[J].Curr Opin Pharmacol,2018,39:53-59.
[4]LEE S C,JOH J H,CHANG J H,et al.Hybrid treatment of multilevel revascularization in patients with peripheral arterial disease--a multi-centre study in Korea[J].Vasa,2018,47(3):235-241.
[5]王雁彬,化金鳳,張曉園,等.鹿茸對大鼠下肢缺血模型CD34+、FLK-1+陽性細胞比例影響[J].遼寧中醫藥大學學報,2015,17(1):24-26.
[6]化金鳳,索煒,李廷荃.鹿茸對大鼠缺血下肢骨骼肌毛細血管密度的影響[J].中西醫結合心腦血管病雜志,2014,12(1):80-81.
[7]化金鳳,索偉,李廷荃.鹿茸對大鼠下肢缺血模型VEGF表達的影響[J].遼寧中醫藥大學學報,2014,16(2):34-36.
[8]李琳,葉彤,陳文鳳,等.鹿茸多肽功能的研究進展[J].吉林醫藥學院學報,2020,41(1):54-56.
[9]李子娟,李廷荃,王雁彬,等.鹿茸通過PI3K/AKT信號通路促進下肢動脈硬化性閉塞癥大鼠血管新生的作用機理[J].時珍國醫國藥,2021,32(9):2061-2066.
[10]MINGOLI A,SAPIENZA P,FELDHAUS R J,et al.Comparison of femorofemoral and aortofemoral bypass for aortoiliac occlusive disease[J].J Cardiovasc Surg(Torino),2001,42(3):381-387.
[11]MANUNEEDHI CHOLAN P,CARTLAND S P,KAVURMA M M.NADPH oxidases,angiogenesis,and peripheral artery disease[J].Antioxidants (Basel),2017,6(3):E56.
[12]GILBEY A,PEREZGONZALEZ J D.Health benefits of deer and elk velvet antler supplements:a systematic review of randomised controlled studies[J].N Z Med J.2012,125(1367):80-86.
[13]CHENG S L,JIAN Y L,CHEN C M,et al.Relationships between antioxidants and quality characteristics from velvet antlers of formosan sambar deer[J].Korean J Food Sci Anim Resour,2017,37(4):542-551.
[14]PITA-THOMAS W,NIETO-SAMPEDRO M,MAZA R M,et al.Factors promoting neurite outgrowth during Deer antler regeneration[J].J Neurosci Res,2010,88(14):3034-3047.
[15]XIAO X,XU S,LI L,et al.The effect of velvet antler proteins on cardiac microvascular endothelial cells challenged with ischemia-hypoxia[J].Front Pharmacol,2017,8:601.
[16]DE FALCO E,PORCELLI D,TORELLA A R,et al.SDF-1 involvement in endothelial phenotype and ischemia-induced recruitment of bone marrow progenitor cells[J].Blood,2004,104(12):3472-3482.
[17]TARASOVA N I,RICE W G,MICHEJDA C J.Inhibition of G-protein-coupled receptor function by disruption of transmembrane domain interactions[J].J Biol Chem,1999,274(49):34911-34915.
[18]WALTER D H,HAENDELER J,REINHOLD J,et al.Impaired CXCR4 signaling contributes to the reduced neovascularization capacity of endothelial progenitor cells from patients with coronary artery disease[J].Circ Res,2005,97(11):1142-1151.
[19]CHAVAKIS E,CARMONA G,URBICH C,et al.Phosphatidylinositol-3-kinase-gamma is integral to homing functions of progenitor cells[J].Circ Res.2008,102(8):942-949.
[20]ZHENG H,FU G,DAI T,et al.Migration of endothelial progenitor cells mediated by stromal cell-derived factor-1αlpha/CXCR4 via PI3K/Akt/eNOS signal transduction pathway[J].J Cardiovasc Pharmacol,2007,50(3):274-280.
(收稿日期:2023-11-27)
(本文編輯王雅潔)

