原發(fā)性肝癌診療指南(2024年版)
中華人民共和國國家衛(wèi)生健康委員會
關鍵詞: ?肝腫瘤; ?診斷; ?治療學; ?診療準則
Standard for diagnosis and treatment of primary liver cancer ?(2024 edition)
National Health Commission of the People s Republic of China
Key words: ?Liver Neoplasms; ?Diagnosis; ?Therapeutics; ?Practice Guideline
1 ?概述
根據(jù)中國國家癌癥中心發(fā)布的數(shù)據(jù), 2022年全國原發(fā)性肝癌發(fā)病人數(shù)36. 77萬, 位列各種癌癥新發(fā)病人數(shù)第4位 (肺、 結直腸、 甲狀腺、 肝), 發(fā)病率位列第5位 (肺、 女性乳腺、 甲狀腺、 結直腸、 肝); 2022年因原發(fā)性肝癌死亡人數(shù)31. 65萬, 死亡人數(shù)和死亡率均位列第2位 (肺、 肝) [1-2] 。原發(fā)性肝癌主要包括肝細胞癌 (hepatocellular carcinoma,HCC)、 肝內膽管癌(intrahepatic cholangiocarcinoma, ICC)和混合型肝細胞癌-膽管癌(combined hepatocellular-cholangiocarcinoma, cHCC-CCA)3 種不同病理學類型,三者在發(fā)病機制、 生物學行為、 病理組織學、 治療方法以及預后等方面差異較大, 其中HCC占75%~85%、 ICC占10%~15%[3-4] 。本指南中的 “肝癌” 僅指HCC。為進一步規(guī)范我國肝癌診療行為, 2017年6月原國家衛(wèi)生和計劃生育委員會醫(yī)政醫(yī)管局主持制定并頒布了《原發(fā)性肝癌診療規(guī)范 (2017年版)》, 之后國家衛(wèi)生健康委員會醫(yī)政醫(yī)管局于2019年12月和2021年12月分別進行了2次更新, 并最終修訂頒布了 《原發(fā)性肝癌診療規(guī)范(2019年版)》 和 《原發(fā)性肝癌診療指南 (2022年版)》。 《原發(fā)性肝癌診療指南 (2022年版)》 反映了當時我國肝癌診斷和多學科綜合治療以及研究的狀況, 對規(guī)范肝癌的診療行為、 改善肝癌患者預后、 保障醫(yī)療質量和醫(yī)療安全以及優(yōu)化醫(yī)療資源發(fā)揮了重要作用。自 《原發(fā)性肝癌診療指南 (2022年版)》 發(fā)布后, 國內、 外在肝癌的診斷、 分期及治療方面出現(xiàn)了許多符合循證醫(yī)學原則的高級別證據(jù), 尤其是適應中國國情的研究成果相繼問世。為此, 國家衛(wèi)生健康委員會醫(yī)政司委托中華醫(yī)學會腫瘤學分會, 聯(lián)合中國抗癌協(xié)會肝癌專業(yè)委員會、 中國醫(yī)師協(xié)會介入醫(yī)師分會、 中國醫(yī)師協(xié)會外科醫(yī)師分會和中華醫(yī)學會超聲醫(yī)學分會等組織全國肝癌領域的多學科專家,結合肝癌臨床診治和研究的最新實踐, 再次修訂并更新形成 《原發(fā)性肝癌診療指南 (2024年版)》(以下簡稱指南), 以更好地規(guī)范肝癌的診療行為, 反映肝癌診治的最新進展, 提升肝癌患者的總體生存率, 進一步推動落實并達成中國政府 《“健康中國2030” 規(guī)劃綱要》 中實現(xiàn)總體癌癥5年生存率提高15%的目標。
證據(jù)評價與推薦意見分級、 制定和評價方法學(grading of recommendations, assessment, development and evaluation, GRADE) 是目前使用最廣泛的證據(jù)評價和推薦意見分級系統(tǒng)[5] 。GRADE系統(tǒng)包括兩部分, 第一部分為證據(jù)評價, 根據(jù)證據(jù)中的偏倚風險、 不一致性、 間接性、 不精確性和發(fā)表偏倚, GRADE系統(tǒng)將證據(jù)質量分為高、 中、低和極低4個水平[6] 。第二部分為推薦意見分級, GRADE系統(tǒng)考慮醫(yī)學干預的利弊平衡、 證據(jù)質量、 價值觀念與偏好, 以及成本與資源耗費等因素來制定推薦意見, 并且將推薦意見分為強推薦和弱推薦 (有條件推薦) 2種[7] 。醫(yī)學干預的利弊差別越大, 證據(jù)質量越高、 價值觀念與偏好越清晰越趨同、 成本與資源耗費越小, 則越應該考慮強推薦。反之, 則應考慮弱推薦 (有條件推薦)。本指南中的循證醫(yī)學證據(jù)等級評估參照了上述GRADE分級的指導原則, 采用了 《牛津循證醫(yī)學中心分級2011版》(OCEBM levels of evidence) 作為輔助工具來具體執(zhí)行證據(jù)分級 (證據(jù)等級1~5)(附錄A)。在從證據(jù)轉換成推薦意見的方法上, 指南專家組主要參考了上述的GRADE對推薦意見分級的指導原則, 同時結合了ASCO指南的分級方案[8] 對推薦意見分級做了相應的修改 (附錄B)。最終將推薦強度分為3個等級, 分別是強推薦、 中等程度推薦和弱推薦 (指南正文中分別用推薦A、 推薦B和推薦C表示)。強推薦 (推薦A) 代表專家組對該推薦意見反映了最佳臨床實踐有很高的信心, 絕大多數(shù)甚至所有的目標用戶均應采納該推薦意見。中等程度推薦 (推薦B) 代表專家組對該推薦意見反映了最佳臨床實踐有中等程度的信心, 多數(shù)目標用戶會采納該推薦意見, 但是執(zhí)行過程中應注意考慮醫(yī)患共同決策。弱推薦 (推薦C) 代表專家組對該推薦意見反映了最佳臨床實踐有一定的信心, 但是應該有條件地應用于目標群體, 強調醫(yī)患共同決策。
2 篩查和診斷
2. 1 肝癌高危人群的篩查與監(jiān)測 對肝癌高危人群的篩查與監(jiān)測 [超聲顯像聯(lián)合血清甲胎蛋白 (alpha-fetoprotein,AFP) 檢測], 有助于肝癌的早期發(fā)現(xiàn)、 早期診斷和早期治療[9] , 同時可以顯著降低患者的死亡風險[10] (證據(jù)等級1,推薦A)。肝癌高危人群的快速、 便捷識別是實施大范圍肝癌篩查的前提, 而對人群肝癌風險的分層評估是制定不同肝癌篩查策略的基礎。在我國, 肝癌高危人群主要包括: 具有乙型肝炎病毒 (hepatitis B virus, HBV) 和/或丙型肝炎病毒 (hepatitis C virus, HCV) 感染、 過度飲酒、 肝脂肪變性或代謝功能障礙相關性肝病、 飲食中黃曲霉毒素B1的暴露、 其他各種原因引起的肝硬化及有肝癌家族史等人群, 尤其年齡>40歲的男性。目前, 抗HBV和抗HCV治療可顯著降低肝癌的發(fā)生風險, 但仍無法完全避免肝癌的發(fā)生[11] 。由我國學者研發(fā)的適用于多種慢性肝病和各種族的肝癌風險評估模型 aMAP 評分(age-male-albi-platelets score), 可便捷地將肝病人群分為肝癌低風險 (aMAP評分0~50分)、 中風險 (aMAP評分50~60分)和高風險(aMAP 評分 60~100 分)人群, 各組人群肝癌的年發(fā)生率分別為0~0. 2%、 0. 4%~1. 0%和1. 6%~4. 0%[12] (證據(jù)等級2, 推薦B)。此外, 基于多變量縱向數(shù)據(jù) (aMAP、 AFP) 和循環(huán)游離DNA (cell-free DNA, cfDNA)特征構建的兩種新型肝癌預測模型aMAP-2和aMAP-2 Plus, 可進一步識別出肝癌發(fā)生率高達12. 5%的超高風險人群[13] 。肝癌篩查應重視將肝癌風險預測評分作為有效工具, 開展社區(qū)、 醫(yī)院一體化的精準篩查新模式[14] ,從而有效提高肝癌早期診斷率, 降低病死率。高危人群至少每隔6個月進行1次篩查[9] (證據(jù)等級2, 推薦A)。
2. 2 肝癌的影像學檢查
不同影像學檢查手段各有特點, 應該強調綜合應用、 優(yōu)勢互補、 全面評估。
2. 2. 1 超聲顯像 超聲顯像具有便捷、 實時、 無創(chuàng)和無輻射等優(yōu)勢, 是臨床上最常用的肝臟影像學檢查方法。
常規(guī)灰階超聲顯像可以早期、 敏感地檢出肝內占位性病變, 鑒別其是囊性或實性, 初步判斷良性或惡性。典型肝癌灰階超聲表現(xiàn)為肝內實性占位, 圓形或橢圓形, 周邊常可見低回聲的聲暈。內部多為低回聲, 也可表現(xiàn)為等回聲、 高回聲或不均勻回聲。灰階超聲還可觀察到合并肝硬化的表現(xiàn), 如肝臟回聲增粗、 肝臟體積縮小、 肝表面凸凹不平、 門靜脈高壓等。少數(shù)彌漫型肝癌與肝硬化難以區(qū)分。
同時, 灰階超聲顯像可以初步篩查肝內或腹腔內其他臟器是否有轉移灶、 肝內血管及膽管侵犯情況等。肝內轉移灶多表現(xiàn)為肝內腫塊周邊或肝內其他部位出現(xiàn)大小不等的實性結節(jié), 數(shù)目不定, 直徑多<3 cm, 周邊可見聲暈。門靜脈、 肝靜脈及膽管癌栓表現(xiàn)為管腔內低回聲。癌栓完全充滿門靜脈管腔時周邊可出現(xiàn)細小側支循環(huán)形成, 呈蜂窩樣改變。肝靜脈癌栓可以延續(xù)至下腔靜脈甚至右心房。肝癌直接侵犯周鄰臟器如膽囊、 右腎等, 灰階超聲也可觀察到腫瘤與上述結構分界不清。
彩色多普勒血流成像可以觀察病灶血供狀況, 輔助判斷病灶良惡性, 顯示病灶與肝內重要血管的毗鄰關系以及有無肝內血管侵犯, 也可以初步判斷肝癌局部治療后的療效情況。肝癌在彩色多普勒血流成像上表現(xiàn)為病灶內部血流信號增加, 呈點狀、 短線狀、 樹枝狀、 網(wǎng)籃狀、 周邊環(huán)狀等多種形態(tài), 病灶周圍血管可見繞行或受壓。脈沖多普勒檢測在病灶內部可見動脈性血流信號,阻力指數(shù)多>0. 6。門靜脈、 肝靜脈及膽管出現(xiàn)癌栓時偶可在癌栓內檢出動脈性血流信號。
超聲造影檢查可以實時動態(tài)觀察肝腫瘤血流灌注的變化, 鑒別診斷不同性質的肝臟腫瘤, 術中應用可敏感檢出隱匿性小病灶、 實時引導局部治療, 術后評估肝癌局部治療的療效等[15-23] (證據(jù)等級2, 推薦A)。超聲對比劑多經(jīng)外周靜脈注射, 采用超聲造影特異成像技術可追蹤對比劑在瘤內、 瘤周成像的動態(tài)變化。
超聲對比劑多使用微泡對比劑, 微泡內部為惰性氣體,其安全性高, 過敏反應極少見。目前常用超聲對比劑有注射用六氟化硫微泡和注射用全氟丁烷微球。前者為純血池對比劑, 可用于血管期成像; 后者可被Kupffer細胞吞噬, 形成血管后期成像。血管期包括動脈期 (注射對比劑30 s以內)、 門靜脈期 (31~120 s)、 延遲期 (>120 s)。血管后期一般定義為對比劑注射8 min后。典型肝癌超聲造影多表現(xiàn)為病灶動脈期快速高增強, 增強時間早于病灶周圍肝實質, 門靜脈及延遲期快速減退為低回聲,即 “快進快出” [22-23] 增強模式 (證據(jù)等級1, 推薦A)。超聲造影表現(xiàn)與病灶大小相關, 直徑>3. 0 cm的肝癌多表現(xiàn)為上述典型增強模式, 但少數(shù)<2. 0 cm者超聲造影表現(xiàn)趨于不典型。門靜脈及延遲期對比劑消退速度與腫瘤分化程度有關, 高分化者消退慢而低分化者消退較快。
由于超聲造影對微細血流的高敏感性, 可用于觀察肝癌發(fā)生發(fā)展不同階段, 如再生結節(jié)、 低度異型增生、 高度異型增生、 高度異型增生合并局部癌變、 早期肝癌、 進展期肝癌等的血流變化并輔助診斷, 因此超聲造影還可用于肝癌高危人群的篩查以及用于監(jiān)測肝內結節(jié)的演變情況[18] 。有肝癌高危風險的患者可以考慮采用超聲造影肝臟影像報告與數(shù)據(jù)系統(tǒng)(liver imaging reporting and data system, LI-RADS) 提高肝癌診斷的特異性 (證據(jù)級別3, 推薦B)。
腫瘤在超聲造影延遲期或血管后相多表現(xiàn)為低增強, 與周圍肝實質分界明顯, 因此超聲造影尤其適用于肝內多發(fā)微小病灶的檢出、 消融或手術后監(jiān)測以早期發(fā)現(xiàn)復發(fā)灶。當肝內病灶延遲期或血管后期表現(xiàn)為低增強時, 可在10 min后再次注射超聲對比劑, 觀察病灶動脈期有無增強, 進而判斷病灶的有無及性質。血管后期對比劑 (如注射用全氟丁烷微球) 因為顯影時間長 (30~120 min), 適合用于病灶的檢出[23] 。
超聲造影可用于腫瘤消融的術前規(guī)劃、 穿刺引導、 消融后即刻評估和追蹤隨訪; 消融即刻評估有助于及時發(fā)現(xiàn)未完全消融的殘留病灶, 及時補充治療。定量超聲造影可測量對比劑到達時間、 達峰時間、 渡越時間、 峰值強度、 血流灌注量等指標, 可用于評估系統(tǒng)抗腫瘤治療 (化療、 靶向治療、 免疫治療等) 后的療效以及在早期預測患者對系統(tǒng)抗腫瘤治療的反應性, 輔助臨床決策[24-25] 。
超聲聯(lián)合動態(tài)增強CT、 MRI掃描的影像導航技術為肝癌, 尤其是常規(guī)超聲顯像無法顯示的隱匿性肝癌的精準定位提供了有效的技術手段[26-28] (證據(jù)等級3, 推薦B)。超聲融合影像導航在肝癌消融術前計劃、 術中監(jiān)測及安全邊緣判斷、 術后即刻評估療效中具有一定價值。融合導航中使用超聲造影能進一步提高準確性, 特別是針對微小病灶、 等回聲病灶和較大病灶的消融范圍的評估[28-29] 。
超聲剪切波彈性成像可以定量評估肝腫瘤的組織硬度及周邊肝實質的纖維化/硬化程度, 為規(guī)劃合理的肝癌治療方案提供有用的信息[30-31] (證據(jù)等級3, 推薦B)。定量超聲技術可測量非酒精性脂肪性肝病肝內脂肪含量, 為非酒精性脂肪性肝病相關肝癌的預警提供輔助信息[32-33] 。多模態(tài)超聲顯像技術的聯(lián)合應用, 為肝癌精準的術前診斷、 術中定位、 術后評估起到了重要作用。術中超聲 (超聲造影)、 腹腔鏡超聲 (超聲造影) 在肝外手術中的應用也越來越普及, 能幫助檢出隱匿性微小病灶、判斷手術切除范圍和切緣情況[34] 。高頻超聲有助于發(fā)現(xiàn)肝包膜下或位置較表淺的隱匿病灶[16] 。超聲影像組學對肝癌的鑒別診斷、 預測肝癌微血管浸潤等生物學行為、 選擇治療手段等有一定的意義[35] 。隨著人工智能技術發(fā)展, 通過融合患者臨床信息和腫瘤影像信息建立肝癌智能預測模型, 精準預測肝癌的復發(fā)轉移, 有望為臨床選擇消融或手術治療提供科學、 合理決策[36-37] 。
2. 2. 2 CT和MRI 動態(tài)增強CT、 MRI掃描是肝臟超聲和/或血清AFP篩查異常者明確肝癌診斷的首選影像學檢查方法。肝臟動態(tài)增強MRI具有無輻射、 組織分辨率高、 多方位多序列動態(tài)增強成像等優(yōu)勢, 且具有形態(tài)結合功能 (包括彌散加權成像等) 綜合成像能力, 成為肝癌臨床檢出、 診斷、 分期和療效評價的優(yōu)選影像技術。動態(tài)增強MRI對直徑≤2. 0 cm肝癌的檢出和診斷能力優(yōu)于動態(tài)增強CT[38-39] (證據(jù)等級1, 推薦A)。動態(tài)增強MRI在評價肝癌是否侵犯門靜脈、 肝靜脈主干及其分支, 以及腹腔或腹膜后間隙淋巴結轉移等方面, 較動態(tài)增強CT具有優(yōu)勢。采用動態(tài)增強MRI掃描評價肝癌治療療效時, 可使用實體瘤臨床療效評價標準 (modified response evaluation criteria in solid tumor, mRECIST) 加T2加權成像及彌散加權成像進行綜合判斷。
CT/MRI (非特異性釓類對比劑) 動態(tài)增強三期掃描包括: 動脈晚期 (門靜脈開始強化, 通常注射對比劑后約35 s掃描)、 門靜脈期 (門靜脈已完全強化, 肝靜脈可見對比劑充盈, 肝實質通常達到強化峰值, 通常注射對比劑后60~90 s掃描)、 延遲期 (門靜脈、 肝靜脈均有強化但低于門脈期, 肝實質可見強化但低于門脈期, 通常注射對比劑后3 min掃描)。肝細胞特異性MRI對比劑 (釓塞酸二鈉, Gd-EOB-DTPA) 動態(tài)增強四期掃描包括: 動脈晚期 (同上)、 門靜脈期 (同上)、 移行期 (肝臟血管和肝實質信號強度相同, 肝臟強化是由細胞內及細胞外協(xié)同作用產生, 通常在注射Gd-EOB-DTPA 2~5 min后掃描)、 肝膽特異期 (肝臟實質信號高于肝血管, 對比劑經(jīng)由膽管系統(tǒng)排泄, 通常在注射釓塞酸二鈉12~20 min后掃描;肝功能正常者, 一般肝膽特異期12~15 min掃描, 而肝功能明顯降低者, 一般只需延遲20 min即可)。
肝癌影像學診斷主要根據(jù)為動態(tài)增強掃描的 “快進快出” 強化方式[40-42] (證據(jù)等級1, 推薦A)。動態(tài)增強CT和MRI動脈期 (主要在動脈晚期) 肝腫瘤呈均勻或不均勻明顯強化, 門靜脈期和/或延遲期肝腫瘤強化低于肝實質。“快進” 為非環(huán)形強化,“快出” 為非周邊廓清。“快進” 在動脈晚期觀察,“快出” 在門靜脈期及延遲期觀察。Gd-EOB-DTPA通常在門靜脈期觀察 “快出” 征象, 但移行期及肝膽特異期 “快出” 征象可以作為輔助惡性征象。
Gd-EOB-DTPA增強MRI檢查顯示: 肝腫瘤動脈期明顯強化, 門靜脈期強化低于肝實質, 肝膽特異期常呈明顯低信號。但仍有5%~12%分化較好的肝癌, 尤其是小肝癌 (直徑≤2. 0 cm), 肝膽特異期可見腫瘤部分呈吸收對比劑的稍高信號[43] 。
動態(tài)增強MRI掃描, 尤其用于診斷腫瘤直徑≤2. 0 cm肝癌, 強調尚需要結合其他征象 (如包膜樣強化、 T2加權成像中等信號和彌散受限等) 及超閾值增長 (6個月內病灶最大直徑增大50%) 進行綜合判斷[44] (證據(jù)等級3, 推薦B)。包膜樣強化的定義為: 光滑, 均勻, 邊界清晰, 大部分或全部包繞病灶, 特別在門靜脈期、 延遲期或移行期表現(xiàn)為環(huán)形強化。
直徑≤1. 0 cm的肝癌定義為亞厘米肝癌 (subcentimeter hepatocellular carcinoma, scHCC)。根據(jù)文獻報道, scHCC局部切除術后5年生存率為98. 5%, 明顯高于直徑1. 0~2. 0 cm的小肝癌 (5年生存率為89. 5%) [45]。在高危人群中, 排除確定的良性病變后, 推薦使用Gd-EOB-DTPA增強MRI來診斷scHCC[46-51] (證據(jù)等級2, 推薦B), 尤其適用于合并肝硬化的患者, 同時有助于與高度異型增生結節(jié)等癌前病變相互鑒別[52] 。
目前CT平掃及動態(tài)增強掃描除常應用于肝癌的臨床診斷及分期外, 也應用于肝癌局部治療的療效評價,特別是觀察經(jīng)導管動脈化療栓塞 (transcatheter arterial chemoembolization, TACE) 后碘油沉積狀況及腫瘤存活有一定優(yōu)勢, 特別是有助于決定是否需要再次TACE治療[53-55] 。基于術前CT的影像組學技術也可以用于預測首次TACE治療的療效[56] 。同時, 借助CT后處理技術可以進行三維血管重建、 肝臟體積和肝腫瘤體積測量。三維可視化重建技術可以進行肝臟分葉分段處理, 術前模擬手術, 輔助醫(yī)生制定最優(yōu)手術方案。
基于肝癌動態(tài)增強CT和/或MRI信息的臨床數(shù)據(jù)挖掘建立融合模型有助于改善臨床決策 (患者治療方案選擇、 療效評價及預測等) [57] 。對于術前預測肝癌微血管侵犯 (microvascular invasion, MVI), 影像學征象特異性高但敏感性較低, 人工智能 (包括影像組學和深度機器學習模型) 是術前預測MVI的可能突破點[58-60] (證據(jù)等級3, 推薦B)。
2. 2. 3 數(shù)字減影血管造影 數(shù)字減影血管造影 (digital subtraction angiography, DSA) 是肝癌患者血管內介入治療前必須進行的檢查, 常采用經(jīng)選擇性或超選擇性肝動脈插管進行。DSA檢查可以清楚顯示肝動脈解剖和變異以及腫瘤血管、 染色, 明確腫瘤數(shù)目、 大小及其血供豐富程度[61] 。DSA聯(lián)合錐形線束CT (cone beam computed tomograph, CBCT) 可更清楚顯示腫瘤病灶、 提高小肝癌的檢出率, 明確腫瘤供血動脈分支的三維關系、 指導腫瘤供血動脈分支的超選擇性插管[62] (證據(jù)等級2, 推薦A)。經(jīng)腸系膜上動脈或脾動脈的間接門靜脈造影, 可以評價門靜脈血流和門靜脈主干或一級分支癌栓栓塞等情況。
2. 2. 4 核醫(yī)學影像學檢查
(1)正電子發(fā)射計算機斷層成像(positron emission tomography and computed tomography, PET/CT): 18F-氟代脫氧葡萄糖 (18F-flurodeoxyglucose, 18F-FDG) PET/CT全身顯像的優(yōu)勢在于: ①對腫瘤進行分期, 通過1次檢查能夠全面評價有無淋巴結轉移及遠處器官的轉移[63-64] (證據(jù)等級1, 推薦A); ②再分期, 因PET/CT功能影像不受解剖結構的影響, 可以準確顯示解剖結構發(fā)生變化后或者解剖結構復雜部位的復發(fā)轉移灶[65] (證據(jù)等級2, 推薦B);③對于抑制腫瘤活性的靶向藥物的療效評價更加敏感、準確[66-67] (證據(jù)等級2, 推薦A); ④指導放射治療生物靶區(qū)的勾畫、 確定穿刺活檢部位[65] ; ⑤評價腫瘤的惡性程度和預后[68-70] (證據(jù)等級2, 推薦B)。PET/CT對肝癌的診斷靈敏度和特異度有限, 可作為其他影像學檢查的輔助和補充, 在肝癌的分期、 再分期和療效評價等方面具有優(yōu)勢。采用碳-11標記的乙酸鹽 (11C-acetate) 或膽堿 (11C-choline) 等對比劑PET顯像可以提高對高分化肝癌診斷的靈敏度, 與18F-FDG PET/CT顯像具有互補作用[71-72] 。鎵-68或氟-18標記的成纖維激活蛋白抑制劑- 04(68Ga-DOTA-FAPI-04/18F-NOTA-FAPI-04)PET/CT 可有效提高癌原發(fā)灶、 轉移灶的診斷靈敏度, 尤其是中高分化肝細胞癌及肝內膽管癌, 補充18F-FDG PET/CT顯像的不足 (證據(jù)等級3, 推薦C) [73-74] 。
(2)單光子發(fā)射計算機斷層成像(single photon emission computed tomography and computed tomography,SPECT/CT): SPECT/CT已逐漸替代SPECT成為核醫(yī)學單光子顯像的主流設備, 選擇全身平面顯像所發(fā)現(xiàn)的病灶, 再進行局部SPECT/CT融合影像檢查, 可以同時獲得病灶部位的SPECT和診斷CT圖像, 診斷準確性得以顯著提高[75] (證據(jù)等級3, 推薦B)。
(3)正電子發(fā)射計算機斷層磁共振成像(positron emission tomography and magnetic resonance imaging, PET/MRI): 1次PET/MRI檢查可以同時獲得解剖結構、 動態(tài)增強MRI信息及PET功能代謝信息, 提高肝癌診斷的靈敏度[76] (證據(jù)等級4, 推薦C)。
2. 3 肝癌的血液學分子標志物 血清AFP是當前診斷肝癌和療效監(jiān)測常用且重要的指標。血清AFP≥400 ?g/L,在排除妊娠、 慢性或活動性肝病、 生殖腺胚胎源性腫瘤以及其他消化系統(tǒng)腫瘤后, 高度提示肝癌; 而血清AFP輕度升高者, 應結合影像學檢查或作動態(tài)觀察, 并與肝功能變化對比分析, 有助于診斷。異常凝血酶原 [protein induced by vitamin K absence/antagonist-Ⅱ(PIVKA Ⅱ)或des-gamma carboxyprothrombin (DCP)]、 血漿游離微小核糖核酸 (microRNA) [77] 和血清甲胎蛋白異質體 (lens culinaris agglutinin-reactive fraction of AFP, AFP-L3) 也可以作為肝癌早期診斷標志物, 特別是對于血清AFP陰性人群。基于性別、 年齡、 AFP、 PIVKA Ⅱ和AFP-L3構建的GALAD模型在診斷早期肝癌的靈敏度和特異度分別為85. 6%和93. 3%, 有助于AFP陰性肝癌的早期診斷[78] (證據(jù)等級1,推薦A)。目前已有基于中國人群大樣本數(shù)據(jù)的優(yōu)化的類GALAD模型 (C-GALAD、 GALAD-C、 C-GALAD Ⅱ等)用于肝癌的早期診斷。另外, 基于性別、 年齡、 AFP、PIVKA Ⅱ構建的簡化的GAAD模型[79] 及ASAP模型[80]與GALAD模型診斷效能類似 (證據(jù)等級1, 推薦A)。基于7個microRNA組合的檢測試劑盒診斷肝癌的靈敏度和特異度分別為86. 1%和76. 8%, 對AFP陰性肝癌的靈敏度和特異度分別為77. 7%和84. 5%[77] (證據(jù)等級1, 推薦A)。
近年來,“液體活檢” 包括循環(huán)游離microRNA、 循環(huán)腫瘤細胞 (circulating tumor cell, CTC) [81]、 cfDNA[82]、 循環(huán)腫瘤DNA (circulating tumor DNA, ctDNA) [83-84]、 游離線粒體DNA、 游離病毒DNA和細胞外囊泡等, 在腫瘤早期診斷和療效評價等方面展現(xiàn)出重要價值 (附錄C)。
2. 4 肝癌的穿刺活檢 具有典型肝癌影像學特征的肝占位性病變, 符合肝癌臨床診斷標準的患者, 通常不需要以診斷為目的的肝病灶穿刺活檢[41, 85-87] (證據(jù)等級1,推薦A), 特別是對于具有外科手術指征的肝癌患者。能夠手術切除或準備肝移植的肝癌患者, 不建議術前行肝病灶穿刺活檢, 以減少肝腫瘤破裂出血、 播散風險。對于缺乏典型肝癌影像學特征的肝占位性病變, 肝病灶穿刺活檢可獲得明確的病理診斷。肝病灶穿刺活檢可以明確病灶性質及肝癌分子分型[88] , 為明確肝病病因、 指導治療、 判斷預后和進行研究提供有價值的信息, 故應根據(jù)肝病灶穿刺活檢的患者受益、 潛在風險以及醫(yī)師操作經(jīng)驗綜合評估穿刺活檢的必要性。
肝病灶穿刺活檢通常在超聲或CT引導下進行, 可以采用18G或16G肝穿刺空芯針活檢獲得病灶組織。其主要風險是可能引起出血和腫瘤針道種植轉移。因此,術前應檢查血小板和出凝血功能, 對于有嚴重出血傾向的患者, 應避免肝病灶穿刺活檢。穿刺路徑應盡可能經(jīng)過正常肝組織, 避免直接穿刺肝臟表面結節(jié)。穿刺部位應選擇影像檢查顯示腫瘤活躍的腫瘤內和腫瘤旁, 取材后肉眼觀察取材的完整性以提高診斷準確性。另外, 受病灶大小、 部位深淺等多種因素影響, 肝病灶穿刺病理學診斷也存在一定的假陰性率, 特別是對于直徑≤2 cm的病灶, 假陰性率較高。因此, 肝病灶穿刺活檢陰性結果并不能完全排除肝癌的可能, 仍需觀察和定期隨訪。對于活檢組織取樣過少、 病理結果不支持但臨床上高度懷疑肝癌的患者, 可以重復進行肝病灶穿刺活檢或者密切隨訪。
要點論述:
(1) 借助肝臟超聲顯像聯(lián)合血清AFP進行肝癌的早期篩查, 建議高危人群至少每隔6個月進行1次篩查。
(2) 動態(tài)增強CT、 MRI掃描、 Gd-EOB-DTPA動態(tài)增強MRI檢查以及超聲造影是肝臟超聲顯像和/或血清AFP篩查異常者明確診斷的首選影像學檢查方法。
(3) 肝癌影像學診斷依據(jù)主要根據(jù) “快進快出” 的強化方式。
(4) 肝臟動態(tài)增強MRI檢查是肝癌臨床診斷、 分期和療效評價的優(yōu)選影像手段。
(5)PET/CT 掃描有助于對肝癌進行分期及療效評價。(6) 血清AFP是診斷肝癌和療效監(jiān)測常用且重要的指標。對血清AFP陰性人群, 可以借助DCP、 基于7個microRNA組合的檢測試劑盒、 AFP-L3進行早期診斷。
(7) 具有典型肝癌影像學特征的肝占位性病變, 符合肝癌臨床診斷標準的患者, 通常不需要以診斷為目的的肝病灶穿刺活檢。
2. 5 肝癌的病理學診斷
2. 5. 1 肝癌病理學診斷術語
原發(fā)性肝癌: 統(tǒng)指起源于肝細胞和肝內膽管上皮細胞的惡性腫瘤, 主要包括HCC、 ICC和cHCC-CCA。
(1) HCC: 是指肝細胞發(fā)生的惡性腫瘤。不推薦使用 “肝細胞肝癌” 或 “肝細胞性肝癌” 的病理學診斷名稱。
(2) ICC: 是指肝內膽管襯覆上皮細胞和膽管旁腺發(fā)生的惡性腫瘤, 以腺癌最為多見。2019版 《WHO消化系統(tǒng)腫瘤分類》 已不推薦對ICC使用膽管細胞癌 (cholangiocellular carcinoma) 的病理學診斷名稱, 且不推薦對細膽管癌使用細膽管細胞癌 (cholangiolocellular carcinoma) 的病理學診斷名稱[89] 。組織學上可以分為: ①大膽管型ICC: 起源于肝小葉隔膽管以上至鄰近肝門區(qū)之間較大的膽管,腺管口徑大而不規(guī)則, 周圍可見黏液腺體; ②小膽管型ICC: 起源于小葉間膽管及隔膽管, 腺管口徑較小, 排列較規(guī)則; ③細膽管癌: 起源于肝閏管或細膽管, 癌細胞呈小立方形, 在透明變性的膠原纖維間質內呈松散的成角小導管或分枝狀排列; ④膽管板畸形型ICC: 腫瘤腺管呈不規(guī)則囊狀擴張, 管腔內含乳頭狀突起。有研究顯示,大膽管型ICC的生物學行為和基因表型特點與其他類型ICC有所不同, 臨床預后更差[90] 。
關于HCC和ICC分子分型的臨床和病理學意義多處在研究和論證階段。新近研究表明, EB病毒相關的ICC具有特殊的臨床病理、 免疫微環(huán)境及分子特征, 并對免疫檢查點抑制劑治療有較好的獲益, 推薦采用EB病毒編碼小核糖核酸 (Epstein-Barr virus encoded ribonucleic acid, EBER) 原位雜交檢測來篩選免疫檢查點抑制劑治療獲益人群[91]; 而丙糖磷酸異構酶1(triose phosphate isomerase 1, TPI1) 在ICC組織中高表達是評估術后復發(fā)轉移風險的有用指標[92] 。
(3) cHCC-CCA: 是指在同一個腫瘤結節(jié)內同時出現(xiàn)HCC和ICC兩種組織成分, 不包括碰撞癌。有學者建議以兩種腫瘤成分占比分別≥30%作為cHCC-CCA的病理學診斷標準[93] , 但是目前還沒有國際統(tǒng)一的cHCC-CCA兩種組織學成分占比的病理診斷標準, 有待于大樣本多中心研究。為此, 建議在cHCC-CCA病理診斷時對兩種腫瘤成分的比例狀況加以標注, 并注意分別對HCC及ICC成分進行組織學分級及亞型分型、 MVI分級、 淋巴管侵犯, 以供臨床評估腫瘤生物學特性和制定診療方案時參考。對于某種腫瘤成分占比極少時慎用cHCC-CCA的診斷。
2. 5. 2 肝癌病理診斷規(guī)范
肝癌病理學診斷規(guī)范由標本處理、 標本取材、 病理檢查和病理報告等部分組成[88, 93] 。
(1) 標本處理要點: ①手術醫(yī)師應在病理檢查申請單上明確標注送檢標本的部位、 種類和數(shù)量, 是否曾接受轉化/新輔助治療以及方案與周期, 對手術切緣和重要病變可以用染料或縫線加以標記; ②盡可能在離體30 min以內將腫瘤標本完整地送達病理科, 由病理醫(yī)師切開固定。組織庫留取標本時應在病理科的指導下進行, 以保證取材的準確性, 并應首先滿足病理診斷的需要; ③10%中性緩沖福爾馬林溶液固定12~24 h。
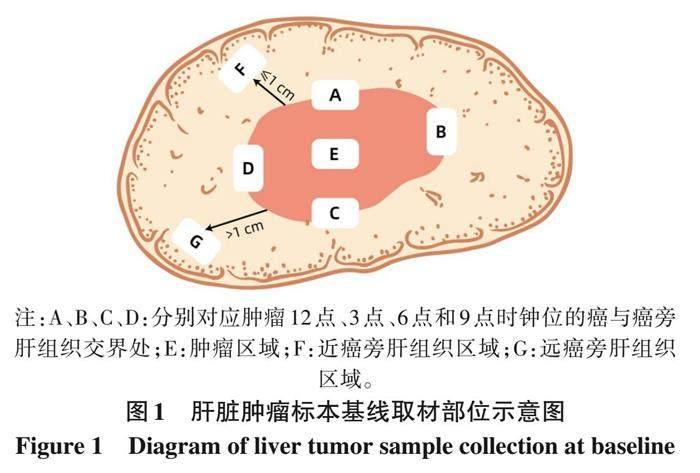
(2) 標本取材要點: 肝癌周邊區(qū)域是腫瘤生物學行為的代表性區(qū)域。為此, 要求采用 “7點” 基線取材法 (圖1), 在腫瘤的12點、 3點、 6點和9點時鐘位上于癌與癌旁肝組織交界處按1∶1取材; 在腫瘤內部至少取材1塊; 對距腫瘤邊緣≤1 cm (近癌旁) 和>1 cm (遠癌旁) 范圍內的肝組織分別取材1塊。肝臟最近切緣及單獨送檢的門靜脈栓子需分別取材。ICC標本還應對膽管切緣進行取材。對于單個腫瘤最大直徑≤3 cm的小肝癌, 應全部取材檢查。實際取材的部位和數(shù)量還須根據(jù)腫瘤的直徑和數(shù)量酌情增加取材[94-95] (證據(jù)等級3, 推薦B)。
2. 5. 3 肝癌病理檢查要點
(1) 大體標本觀察與描述[96] : 對送檢的所有手術標本全面觀察, 重點描述腫瘤的大小、 數(shù)量、 顏色、 質地、 與血管和膽管的關系、 包膜狀況、 周圍肝組織病變、 肝硬化類型、 腫瘤至切緣的距離以及切緣情況等。
(2) 顯微鏡下觀察與描述[96] : 對所有取材組織全面觀察, 肝癌的病理診斷可參照2019年 《WHO消化系統(tǒng)腫瘤分類》 [93] , 重點描述以下內容: HCC的分化程度可以采用國際上常用的Edmondson-Steiner 四級 (Ⅰ~Ⅳ) 分級法或WHO推薦的高中低分化。HCC的組織學類型:常見有細梁型、 粗梁型、 假腺管型、 團片型等; HCC的特殊組織學類型: 如纖維板層型、 硬化型、 透明細胞型、 富脂型、 嫌色型、 富中性粒細胞型、 富淋巴細胞型和未分化型等。雙表型HCC在臨床、 影像學、 血清學、 癌細胞形態(tài)和組織結構上均表現(xiàn)為典型的HCC特征, 但免疫組化標記顯示同時表達肝細胞性標志物和膽管上皮標志物, 這類HCC的侵襲性較強[97] , 對瑞戈非尼治療可能敏感[98] 。轉化/新輔助治療后手術切除標本還應觀察腫瘤壞死和間質反應的程度和范圍; 肝癌的生長方式: 包括癌周浸潤、 包膜侵犯或突破、 MVI和衛(wèi)星結節(jié)等; 慢性肝病評估:肝癌常伴隨不同程度的慢性病毒性肝炎或肝硬化, 推薦采用較為簡便的Scheuer評分系統(tǒng)和中國慢性病毒性肝炎組織學分級和分期標準[99-101] , 并注意描述肝細胞脂肪變性所占比例, 以及脂肪性肝病的診斷和鑒別診斷。
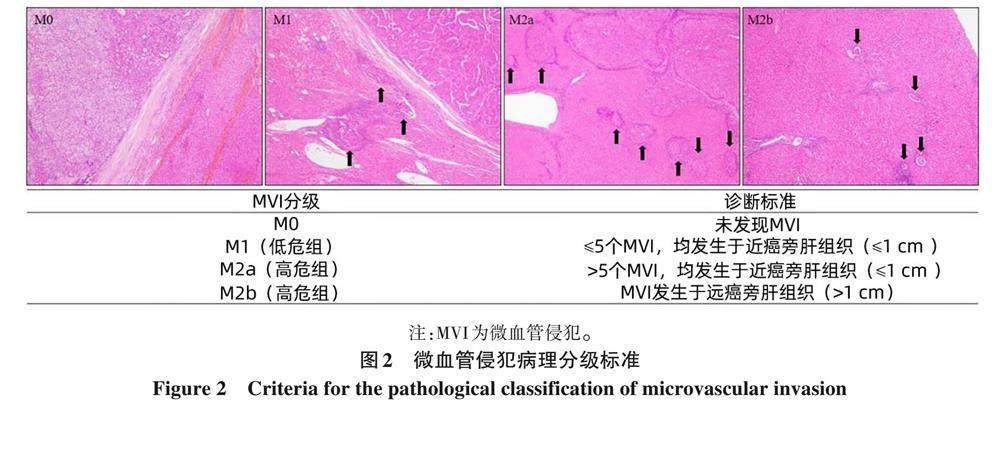
(3) MVI診斷: MVI是指在顯微鏡下于內皮細胞襯覆的脈管腔內見到癌細胞巢團[102] , 肝癌以門靜脈分支侵犯 (含包膜內血管) 最為多見, 在ICC可有淋巴管侵犯。MVI病理分級方法[103] : M0: 未發(fā)現(xiàn)MVI; M1 (低危組): ≤5個MVI, 且均發(fā)生于近癌旁肝組織 (≤1 cm); M2 (高危組): M2a定義為>5個近癌旁MVI, 且無遠癌旁MVI; M2b定義為MVI發(fā)生于遠癌旁肝組織 (>1 cm)(圖2)。MVI各組患者的術后復發(fā)轉移風險依次增加, 臨床預后依次降低[94-95, 104] 。MVI和衛(wèi)星灶可視為肝癌發(fā)生肝內轉移過程的不同演進階段, 當癌旁肝組織內的衛(wèi)星灶與MVI難以區(qū)分時, 可一并計入MVI病理分級。MVI是評估肝癌復發(fā)轉移風險和選擇治療方案的重要參考依據(jù)[88, 93, 105-106] ,應作為組織病理學常規(guī)檢查指標。MVI病理分級是建立在 “7點” 基線取材的基礎上, 當送檢標本不能滿足“7點” 基線取材時, 應在MVI分級時加以說明 (證據(jù)等級2, 推薦A)。
2. 5. 4 免疫組織化學檢查
肝癌免疫組化檢查的主要目的是: ①肝細胞良性、惡性腫瘤之間的鑒別; ②HCC與ICC以及其他特殊類型的肝臟腫瘤之間的鑒別; ③原發(fā)性肝癌與轉移性肝癌之間的鑒別。由于肝癌組織學類型的高度異質性, 現(xiàn)有的肝癌標志物在診斷特異度和靈敏度均存在某種程度的不足, 常需要合理組合、 客觀評估, 有時還需要與其他系統(tǒng)腫瘤的標志物聯(lián)合使用。
(1) HCC常用的免疫組化標志物
以下標志物對肝細胞標記陽性, 有助于提示肝細胞來源的腫瘤, 但不能作為區(qū)分肝細胞良性、 惡性腫瘤的依據(jù)。
①精氨酸酶-1: 肝細胞胞漿/胞核染色。
②肝細胞抗原: 肝細胞胞漿染色。
③肝細胞膜毛細膽管緣特異性染色抗體: 如CD10、多克隆性癌胚抗原和膽鹽輸出泵蛋白等抗體, 可以在肝細胞膜的毛細膽管面出現(xiàn)特異性染色, 有助于確認肝細胞性腫瘤。
以下標志物有助于肝細胞良性、 惡性腫瘤的鑒別。
①谷氨酰胺合成酶: HCC多呈彌漫性胞漿強陽性;部分肝細胞腺瘤, 特別是β-catenin突變激活型肝細胞腺瘤也可以表現(xiàn)為彌漫陽性; 在高級別異型增生結節(jié)為中等強度灶性染色, 陽性細胞數(shù)<50%; 在肝局灶性結節(jié)性增生呈特征性的不規(guī)則地圖樣染色; 在正常肝組織僅中央靜脈周圍的肝細胞染色, 這些特點有助于鑒別診斷。
②磷脂酰肌醇蛋白-3: HCC胞漿及胞膜染色。
③熱休克蛋白70: HCC胞漿或胞核染色。
④CD34: CD34免疫組化染色雖然并不直接標記腫瘤實質細胞, 但可以顯示不同類型肝臟腫瘤的微血管密度及其分布模式特點, 如HCC為彌漫型、 ICC為稀疏型、肝細胞腺瘤為斑片型、 肝局灶性結節(jié)性增生為條索型等, 結合腫瘤組織學形態(tài)有助于鑒別診斷。
(2) ICC常用的免疫組化標志物
①ICC通用免疫組化標志物: 細胞角蛋白7、 細胞角蛋白19、 黏蛋白1、 上皮細胞黏附分子。
②大膽管型ICC: S100鈣結合蛋白、 黏蛋白5AC等。
③小膽管型ICC: C反應蛋白、 神經(jīng)性鈣黏蛋白、 神經(jīng)細胞相關黏附分子 (CD56)。
(3) cHCC-CCA常用的免疫組化標志物
HCC和ICC兩種成分分別表達上述各自腫瘤的標志物。此外, CD56、 CD117和上皮細胞黏附分子 (epithelialcell adhesion molecule, EpCAM) 等標志物陽性表達則可能提示腫瘤伴有干細胞分化特征, 侵襲性更強。
2. 5. 5 分子病理檢測
肝癌分子病理檢測的主要目的是: 輔助診斷HCC特殊亞型; ICC常用靶向/免疫治療藥物的篩選。根據(jù)分子病理檢測在肝癌診斷中的應用, 不僅可以鑒別出HCC特殊亞型及篩選出ICC靶向/免疫治療藥物, 指導臨床預后監(jiān)測及個體化治療, 同時還可以加深HCC特殊亞型及ICC的病理認識, 臨床可以依據(jù)分子病理改變對患者進行分層管理。
(1) HCC常用的分子病理診斷標志物:
①纖維板層型 HCC: 具有 DNAJB1-PRKACA 基因融合[89] 。
②硬化型HCC: 具有結節(jié)性硬化癥1/2基因突變[89] 。
(2) ICC常用的靶向/免疫治療標志物:
①大膽管型ICC: 常見人類表皮生長因子受體2基因擴增、 BRAF V600E基因突變、 神經(jīng)營養(yǎng)因子受體絡氨酸激酶基因融合、 RET基因融合、 微衛(wèi)星高度不穩(wěn)定性、高腫瘤突變負荷等[107] 。
②小膽管型ICC: 常見成纖維生長因子受體2基因突變 (重排或融合) [108] 與異檸檬酸脫氫酶1/2基因突變[109] 。
2. 5. 6 轉化/新輔助治療后肝癌切除標本的病理學評估
(1) 標本取材: 對于臨床標注有術前行轉化/新輔助治療的肝癌切除標本, 可以按以下流程處理: 在瘤床 (腫瘤在治療前所處的原始位置) 最大直徑處切開并測量三維尺寸, 詳細描述壞死及殘存腫瘤范圍及占比。直徑≤3 cm的小肝癌應全部取材; 而直徑>3 cm的腫瘤應在最大直徑處按0. 5~1. 0 cm間隔將腫瘤切開, 選擇腫瘤殘留最具代表性的切面全部取材, 其他切面選擇性取材。注意在取材時同時留取腫瘤床及周邊肝組織以相互對照, 可以對大體標本照相用于組織學觀察的對照。
(2) 鏡下評估: 主要評估肝癌切除標本腫瘤床的3種成分比例, 包括存活腫瘤、 壞死區(qū)域、 腫瘤間質 (纖維組織及炎細胞)。腫瘤床的這3個面積之和等于100%。在病理報告中應標注取材蠟塊數(shù)量, 在評估每張切片上述3種成分百分比的基礎上, 取均值確定殘存腫瘤的總百分比, 并在病理報告中注明。
(3) 病理學評估: 病理完全緩解 (pathologic completeresponse, pCR)、 明顯病理緩解 (major pathologic response,MPR) 評估是評價術前治療療效和探討術后合理干預的重要病理指標。
①pCR: 是指在術前治療后, 完整評估腫瘤床標本的組織學后未發(fā)現(xiàn)存活腫瘤細胞。
②MPR: 是指在術前治療后, 存活腫瘤減少到可以影響臨床預后的閾值以下。在肺癌研究中常將MPR定義為腫瘤床殘留腫瘤細胞減少到≤10%[110] , 這與肝癌術前經(jīng)TACE治療后, 腫瘤壞死程度與預后的相關性研究結果也相同[111] 。但是在轉化/新輔助治療的肝癌切除樣本中, 腫瘤床殘留腫瘤細胞減少到多少有臨床意義, 目前尚無明確定論, 一般認為應至少減少50%以上。建議對初診為MPR的腫瘤標本進一步擴大取材范圍加以明確。
(4) 對于免疫檢查點抑制劑治療后肝癌標本, 注意描述淋巴細胞浸潤程度及三級淋巴結結構[112] , 同時注意觀察癌周肝組織有無免疫相關性肝損傷, 包括肝細胞損傷、 小葉內炎癥及膽管炎等。
2. 5. 7 肝癌病理診斷報告 主要由大體標本描述、 顯微鏡下描述、 免疫組化檢查、 病理診斷名稱和MVI分級等部分組成, 必要時還可以向臨床提出說明和建議 (附錄D)。此外, 還可以酌情開展多結節(jié)性/復發(fā)性肝癌克隆起源檢測、 藥物靶點檢測、 生物學行為評估以及預后判斷等相關的分子病理學檢查, 提供臨床參考。要點概述:
(1) 肝癌切除標本的規(guī)范化處理和及時送檢對保持腫瘤組織和細胞的完整及正確病理診斷十分重要。
(2) 肝癌標本取材應遵循 “7點” 基線取材的規(guī)范, 有利于獲得肝癌代表性的病理生物學特征信息。
(3) 肝癌病理診斷報告內容應規(guī)范全面, 應特別重視描述影響肝癌預后的重要因素, 如肝癌的組織學類型、 分化程度、 浸潤性生長方式、 MVI病理分級以及具有靶向治療指導意義的靶點的分子病理檢測等。
(4) 關注轉化/新輔助治療后肝癌切除標本的病理學評估。
2. 6 肝癌的臨床診斷及路線圖
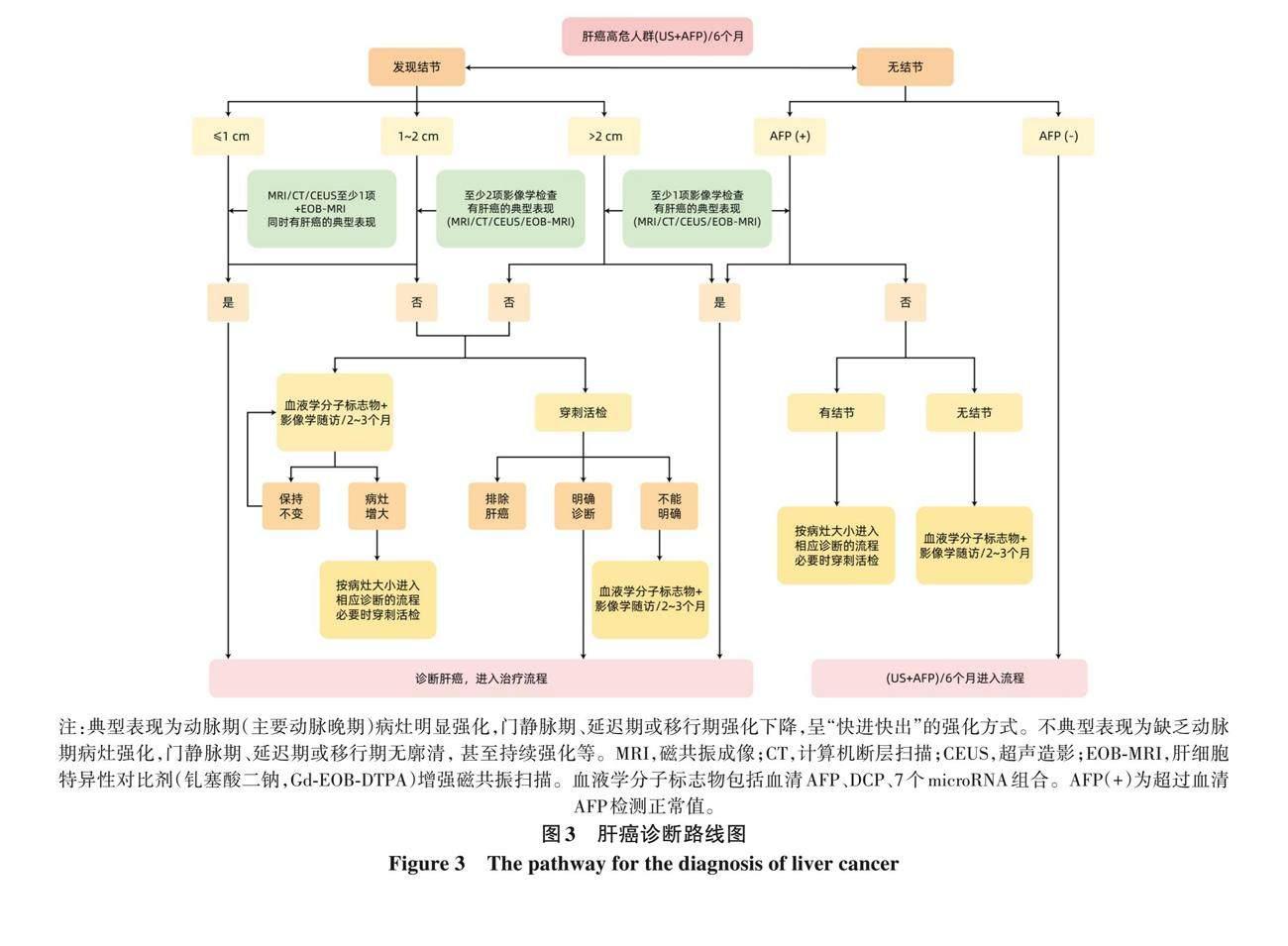
結合肝癌發(fā)生的高危因素、 影像學特征以及血液學分子標志物, 依據(jù)路線圖的步驟對肝癌進行臨床診斷 (圖3)。
(1) 肝癌高危人群, 至少每隔6個月進行1次超聲顯像及血清AFP檢測, 發(fā)現(xiàn)肝內直徑≤1 cm結節(jié), 動態(tài)增強MRI、 動態(tài)增強CT、 超聲造影3種檢查中至少1項檢查以及Gd-EOB-DTPA增強MRI檢查同時顯示 “快進快出” 的肝癌典型特征, 則可以做出肝癌的臨床診斷; 若不符合上述要求, 可以進行每2~3個月的影像學檢查隨訪并結合血清AFP、 DCP、 7個microRNA組合以明確診斷, 必要時進行肝病灶穿刺活檢。
(2) 肝癌高危人群, 隨訪發(fā)現(xiàn)肝內直徑1~2 cm結節(jié), 若動態(tài)增強MRI、 動態(tài)增強CT、 超聲造影或Gd-EOB-DTPA增強MRI的4種檢查中至少2項檢查有典型的肝癌特征, 則可以做出肝癌的臨床診斷; 若上述4種影像學檢查無或只有1項典型的肝癌特征, 可以進行每2~3個月的影像學檢查隨訪并結合血清AFP、 DCP、 7個microRNA組合以明確診斷, 必要時進行肝病灶穿刺活檢。
(3) 肝癌高危人群, 隨訪發(fā)現(xiàn)肝內直徑>2 cm結節(jié),若動態(tài)增強 MRI、 動態(tài)增強 CT、 超聲造影或 Gd-EOB-DTPA增強MRI的4項檢查中至少1項檢查有典型的肝癌特征, 則可以做出肝癌的臨床診斷; 若上述4種影像學檢查無典型的肝癌特征, 可以進行每2~3個月的影像學檢查隨訪并結合血清AFP、 DCP、 7個microRNA組合以明確診斷, 必要時進行肝病灶穿刺活檢。
(4) 肝癌高危人群, 如血清AFP升高, 特別是持續(xù)升高, 應進行影像學檢查以明確肝癌診斷; 若動態(tài)增強MRI、 動態(tài)增強CT、 超聲造影或Gd-EOB-DTPA增強MRI的4種檢查中至少1項檢查有典型的肝癌特征, 即可以臨床診斷為肝癌; 如上述4種影像學檢查未發(fā)現(xiàn)肝內結節(jié), 在排除妊娠、 慢性或活動性肝病、 生殖腺胚胎源性腫瘤以及其他消化系統(tǒng)腫瘤的前提下, 應每隔2~3個月進行1次影像學復查, 同時密切隨訪血清AFP、 DCP、 7個microRNA組合變化。
3 肝癌的分期
肝癌的分期對于治療方案的選擇、 預后評估至關重要。國外有多種分期方案, 如: 巴塞羅那肝癌臨床分期(Barcelona Clinic Liver Cancer, BCLC)、 TNM分期、 日本肝病學會 (Japanese Society of Hepatology, JSH) 分期和亞太肝病研究學會(Asian Pacific Association for the Study of the Liver, APASL) 分期等。結合中國的具體國情及實踐積累, 依據(jù)患者體能狀態(tài) (performance status, PS)、 肝腫瘤及肝功能情況, 建立中國肝癌的分期方案(China Liver Cancer Staging, CNLC), 包括: CNLC Ⅰa期、 Ⅰb期、 Ⅱa期、Ⅱb期、 Ⅲa期、 Ⅲb期、 Ⅳ期, 具體分期方案描述見圖4。
CNLC Ⅰa期: PS 0~2分, 肝功能Child-Pugh A/B級, 單個腫瘤、 直徑≤5 cm, 無影像學可見血管癌栓和肝外轉移。CNLC Ⅰb期: PS 0~2分, 肝功能Child-Pugh A/B級,單個腫瘤、 直徑>5 cm, 或2~3個腫瘤、 最大直徑≤3 cm,無影像學可見血管癌栓和肝外轉移。
CNLC Ⅱa期: PS 0~2分, 肝功能Child-Pugh A/B級,2~3個腫瘤、 最大直徑>3 cm, 無影像學可見血管癌栓和肝外轉移。
CNLC Ⅱb 期: PS 0~2 分, 肝功能 Child-Pugh A/B級, 腫瘤數(shù)目≥4個, 不論腫瘤直徑大小, 無影像學可見血管癌栓和肝外轉移。
CNLC Ⅲa期: PS 0~2分, 肝功能Child-Pugh A/B級,不論腫瘤直徑大小和數(shù)目, 有影像學可見血管癌栓而無肝外轉移。
CNLC Ⅲb 期: PS 0~2 分, 肝功能 Child-Pugh A/B級, 不論腫瘤直徑大小和數(shù)目, 不論有無影像學可見血管癌栓, 但有肝外轉移。
CNLC Ⅳ期: PS 3~4分, 或肝功能Child-Pugh C級,不論腫瘤直徑大小和數(shù)目, 不論有無影像學可見血管癌栓, 不論有無肝外轉移。
4 治療
肝癌治療的特點是多學科參與、 多種治療方法共存, 其常見治療方法包括肝切除術、 肝移植術、 消融治療、 血管內介入治療、 放射治療、 系統(tǒng)性抗腫瘤治療、 中醫(yī)藥治療等多種手段, 各種治療手段均存在其特有的優(yōu)勢和局限性, 且適應證互有重疊。規(guī)范而準確的治療決策應基于指南及高級別循證醫(yī)學證據(jù), 同時也需兼顧各領域的最新進展及研究結果, 而單一學科對其他領域治療方法的知識更新可能存在局限性和滯后性, 因此, 肝癌診療須重視多學科診療團隊 (multidisciplinary team,MDT) 的溝通與合作, 以確保為患者選擇最適合的治療決策, 并不斷推動肝癌治療的進步。目前肝癌MDT的重要性與必要性已成為業(yè)界廣泛共識, 然而受實際條件的影響, 不同地區(qū)和不同單位之間肝癌MDT的實施方式和水平仍存在較大差異。建議開展肝癌診療工作的各級醫(yī)院將MDT管理納入醫(yī)療質量管理體系, 由醫(yī)療行政主管部門和指定的MDT負責人共同管理, 以固定時間、 固定地點、 固定人員的多學科會診模式開展, 基層醫(yī)院如因條件所限難以自行組織MDT, 可通過 “醫(yī)聯(lián)體” 或者“遠程醫(yī)療” 等方式實施。隨著國家癌癥中心 《中國肝癌規(guī)范診療質量控制指標 (2022版)》 的公布和實施, 將進一步推進全國肝癌診療的規(guī)范性與同質化。
4. 1 外科治療
肝癌的外科治療是肝癌患者獲得長期生存的重要手段 (證據(jù)等級2, 推薦A), 主要包括肝切除術和肝移植。
4. 1. 1 肝切除術的基本原則
(1) 徹底性: 完整切除腫瘤, 切緣無殘留腫瘤。
(2) 安全性: 保留足夠體積且有功能的肝組織 (具有良好血供以及良好的血液和膽汁回流) 以保證術后肝功能代償, 減少手術并發(fā)癥、 降低死亡率。
4. 1. 2 患者的全身情況、 肝臟儲備功能評估及隨訪
在術前應對患者的全身情況、 肝臟儲備功能及肝臟腫瘤情況 (分期及位置) 進行全面評價, 常采用美國東部腫瘤協(xié) 作 組 提 出 的 功 能 狀 態(tài) 評 分(Eastern Cooperative Oncology Group performance status, ECOG PS)評估患者的全身情況; 采用肝功能 Child-Pugh 評分、 吲哚菁綠(indocyanine, ICG) 清除試驗、 瞬時彈性成像測定肝臟硬度或終末期肝病模型 (model for end-stage liver disease,MELD) 評分, 評價肝臟儲備功能情況[113-118] 。研究結果提示: 經(jīng)過選擇的合并門靜脈高壓癥的肝癌患者, 仍可以接受肝切除手術, 其術后長期生存優(yōu)于接受其他治療[119-120] (證據(jù)等級3, 推薦B)。因此, 更為精確地評價門靜脈高壓的程度 (如肝靜脈壓力梯度測定等) [121-122] ,有助于篩選適合手術切除的患者。如預期保留肝臟組織體積較小, 則采用CT、 MRI或肝臟三維重建測定剩余肝臟體積, 并計算剩余肝臟體積占標準化肝臟體積的百分比[114] 。通常認為, 肝功能Child-Pugh A級、 ICG 15 min滯留率 (ICG-R15) <30%是實施手術切除的必要條件; 剩余肝臟體積 (future liver remnant, FLR) 須占標準肝臟體積 (standard liver volume, SLV) 的40%以上 (伴有慢性肝病、 肝實質損傷或肝硬化者) 或30%以上 (無肝纖維化或肝硬化者), 也是實施手術切除的必要條件。有肝功能損害者, 則需保留更多的FLR。非酒精性脂肪性肝炎引起肝癌的患者手術預后優(yōu)于酒精性脂肪性肝病引起者[123] (證據(jù)等級2, 推薦B)。
肝癌術后1~2個月患者需復診1次, 之后需每隔3個月密切監(jiān)測影像學 (超聲顯像, 必要時選擇動態(tài)增強CT、動態(tài)增強MRI掃描以及Gd-EOB-DTPA增強MRI掃描)及血清AFP、 DCP和7個microRNA組合等腫瘤學標志物的改變, 2年后可適當延長至3~6個月, 持續(xù)時間建議終身隨訪 (證據(jù)等級3, 推薦B)。目前的證據(jù)不支持更頻繁的隨訪對生存的益處[124] 。
4. 1. 3 肝癌切除的適應證
(1) 肝臟儲備功能良好的CNLC Ⅰa期、 Ⅰb期和Ⅱ a期肝癌的首選治療方式是手術切除。既往研究結果顯示: 對于直徑≤3 cm肝癌, 手術切除的總體生存時間類似或稍優(yōu)于消融治療[125-127] (證據(jù)等級1, 推薦A)。同時有部分研究顯示: 手術切除后局部復發(fā)率顯著低于射頻消融后[128-132] 。對于復發(fā)性肝癌, 手術切除的預后優(yōu)于射頻消融[133] (證據(jù)等級2, 推薦B)。
(2) 對于CNLC Ⅱb期肝癌患者, 多數(shù)情況下不宜首選手術切除, 而以TACE為主的非手術治療為首選。如果腫瘤局限在同一段或同側半肝者, 或可以同時行術中消融處理切除范圍外的病灶; 即使腫瘤數(shù)目>3個, 經(jīng)過MDT討論, 手術切除有可能獲得比其他治療更好的效果[134-137] , 也可以推薦行手術切除 (證據(jù)等級2, 推薦B)。
(3) 對于CNLC Ⅲa期肝癌, 大多數(shù)情況下不宜首選手術切除, 尤其是合并門靜脈主干癌栓者, 而以TACE或TACE聯(lián)合系統(tǒng)抗腫瘤治療為主的非手術治療為首選。但有研究提示與索拉非尼相比, 肝切除術治療晚期非轉移性肝癌的總體生存率 (overall survival, OS) 和無進展生存時間 (progression free survival, PFS) 顯著更優(yōu)[138] 。手術切除治療CNLC Ⅲa期肝癌的數(shù)據(jù)大部分來源于亞洲國家[139-140] , 少部分來自于西方國家[141-142] 。如符合以下情況, 經(jīng)過MDT討論, 也可考慮行手術切除: ①合并門靜脈分支癌栓 (程氏分型Ⅰ/Ⅱ型) 者, 若腫瘤局限于半肝或肝臟同側, 可以考慮手術切除腫瘤同時切除癌栓, 術后再實施TACE治療、 門靜脈化療或其他系統(tǒng)抗腫瘤治療[143-144] (證據(jù)等級3, 推薦C); 此類患者術前接受三維適形放射治療, 亦可以改善術后生存[145] (證據(jù)等級2, 推薦B); 門靜脈主干癌栓 (程氏分型Ⅲ型) 者術后短期復發(fā)率較高, 多數(shù)患者的術后生存不理想, 因此不是手術切除的絕對適應證[146] (證據(jù)等級3, 推薦B); ②合并膽管癌栓但肝內病灶亦可以切除者; ③部分肝靜脈受侵犯但肝內病灶可以切除者。
(4) 對于伴有肝門部淋巴結轉移者 (CNLC Ⅲb期),經(jīng)過MDT討論, 可以考慮切除腫瘤的同時行肝門淋巴結清掃或術后外放射治療。周圍臟器受侵犯可以一并切除者, 也可以考慮手術切除。
此外, 對于術中探查發(fā)現(xiàn)不適宜手術切除的肝癌,可以考慮行術中肝動脈、 門靜脈插管化療或術中其他的局部治療措施 (如消融治療), 或待手術創(chuàng)傷恢復后接受后續(xù)TACE治療、 系統(tǒng)抗腫瘤治療等非手術治療。
4. 1. 4 肝癌根治性切除標準
(1) 術中判斷標準: ①肝靜脈、 門靜脈、 膽管以及下腔靜脈未見肉眼癌栓; ②無鄰近臟器侵犯, 無肝門淋巴結或遠處轉移; ③肝臟切緣距腫瘤邊界≥1 cm; 如切緣<1 cm, 則切除肝斷面組織學檢查無腫瘤細胞殘留, 即切緣陰性。
(2) 術后判斷標準: ①術后1~2個月行超聲、 CT、MRI檢查 (必須有其中兩項) 未發(fā)現(xiàn)腫瘤病灶; ②如術前血清AFP、 DCP和7個microRNA組合等腫瘤標志物升高者, 則要求術后2~3個月腫瘤標志物定量測定, 其水平降至正常范圍內。術后腫瘤標志物如AFP下降速度, 可以早期預測手術切除的徹底性[147] 。
4. 1. 5 手術切除技術 常用的肝切除技術主要是包括入肝和出肝血流控制技術、 肝臟離斷技術以及止血技術。術前三維可視化技術進行個體化肝臟體積計算和虛擬肝切除有助于在實現(xiàn)腫瘤根治性切除目標的前提下, 設計更為精準的切除范圍和路徑以保護剩余肝臟的管道、 保留足夠FLR[148-150] (證據(jù)等級2, 推薦A)。
近年來, 微創(chuàng)手術 (包括腹腔鏡肝切除術和機器人輔助肝切除術) 飛速發(fā)展。腹腔鏡肝切除術具有創(chuàng)傷小和術后恢復快等優(yōu)點[151-152] (證據(jù)等級2, 推薦B)。早期肝癌患者接受腹腔鏡肝切除術與開腹手術的5年OS相當[153] (證據(jù)等級2, 推薦B)。與開腹肝切除術相比, 腹腔鏡肝切除術治療老年肝癌患者 (≥65歲) 的手術結局更優(yōu), 腫瘤學結局相當[154] (證據(jù)等級2, 推薦B)。腹腔鏡肝切除術其適應證和禁忌證盡管原則上與開腹手術類似, 但仍然建議根據(jù)腫瘤大小、 腫瘤部位、 腫瘤數(shù)目、 合并肝臟基礎疾病以及手術團隊的技術水平等綜合評估、謹慎開展。對于巨大肝癌、 多發(fā)肝癌、 位于困難部位及中央?yún)^(qū)緊鄰重要管道肝癌和肝癌合并重度肝硬化者, 建議經(jīng)嚴格選擇后由經(jīng)驗豐富的醫(yī)師謹慎實施。對于合并門靜脈肉眼癌栓、 腫瘤破裂出血的肝癌患者, 不建議行腹腔鏡肝切除術。應用腹腔鏡超聲檢查結合ICG熒光腫瘤顯像, 可以有助于發(fā)現(xiàn)微小病灶、 標記切除范圍和獲得腫瘤陰性切緣[155] 。初步研究表明, 機器人輔助與開腹肝切除術治療肝癌的療效和安全性相當[156] (證據(jù)等級3, 推薦C)。
解剖性切除與非解剖性切除均為常用的肝切除技術, 都需要保證有足夠的切緣才能獲得良好的腫瘤學效果。解剖性切除對于伴有MVI的肝癌病例, 相對于非解剖性切除, 雖然OS沒有區(qū)別, 但局部復發(fā)率更低[157-158] (證據(jù)等級3, 推薦B)。有研究發(fā)現(xiàn), 寬切緣 (≥1 cm的切緣) 的肝切除效果優(yōu)于窄切緣的肝切除術[159-160] (證據(jù)等級2, 推薦A), 特別是對于術前可預判存在MVI的患者[161] 。腹腔鏡下解剖性肝切除術與非解剖性肝切除術相比, 解剖性肝切除術治療肝癌的5年無病生存率顯著更高[162] (證據(jù)等級2, 推薦B)。對于巨大肝癌, 可以采用最后游離肝周韌帶的前入路肝切除法[163] 。對于多發(fā)性肝癌, 可以采用手術切除結合術中消融治療[164] (證據(jù)等級3, 推薦C)。對于門靜脈癌栓者, 行門靜脈取栓術時應暫時阻斷健側門靜脈血流, 防止癌栓播散[165] 。對于肝靜脈癌栓或腔靜脈癌栓者, 可以行全肝血流阻斷, 盡可能整塊去除癌栓[166] 。對于肝癌伴膽管癌栓者, 切除肝臟腫瘤的同時聯(lián)合膽管切除, 爭取獲得根治切除的機會[167-168] (證據(jù)等級3, 推薦C)。
4. 1. 6 手術為基礎的綜合治療策略
基于既往的大宗病例數(shù)據(jù), 中晚期肝癌 (CNLC Ⅱb、Ⅲa、 Ⅲb期) 手術后總體生存雖然不令人滿意, 但當前系統(tǒng)抗腫瘤治療與綜合治療取得長足進步, 局部治療和/或系統(tǒng)抗腫瘤治療控制腫瘤的效果可以為中晚期肝癌患者提高手術切除率、 降低術后復發(fā)轉移和改善預后提供更多可能[169] (證據(jù)等級4, 推薦B), 手術適應證的適度擴大成為共識。探索中晚期肝癌以手術為基礎的綜合治療新策略已成為近期關注重點。
(1) 肝癌的轉化治療
轉化治療指不適合手術切除的肝癌患者, 經(jīng)過干預后獲得手術切除的機會, 干預手段包括有功能的FLR轉化、 腫瘤學轉化等。手術切除是轉化成功后患者獲得長期生存的重要手段, 但仍需隨機對照研究的證據(jù)支持(證據(jù)等級4, 推薦C)。
①肝癌轉化治療中有功能的FLR轉化
FLR不足是肝癌外科學無法手術切除的重要原因。對于這類患者, 轉化治療的目標就是由FLR不足轉變?yōu)橛泄δ艿腇LR足夠[170] 。
A. 門靜脈栓塞術 (portal vein embolization, PVE)
經(jīng)門靜脈栓塞腫瘤所在的半肝, 使剩余肝臟代償性增生后再切除腫瘤, 若合理選擇肝癌患者, 其轉化成功率可為60%~80%, 并發(fā)癥發(fā)生率為10%~20%。PVE術后剩余肝臟增生耗時相對較長 (通常需4~6周), 約有20%以上的患者因等待增生期間腫瘤進展或FLR增生不足而最終失去手術機會[171-172] (證據(jù)等級3, 推薦B)。對于這部分患者, 目前的治療策略有聯(lián)合TACE[173] 、 肝靜脈栓塞[174] 、 動脈結扎[175] , 以期進一步促進FLR增生并控制腫瘤進展; 或者行拯救性聯(lián)合肝臟分隔和門靜脈結扎的二步肝切除術(associating liver partition and portal vein ligation for staged hepatectomy, ALPPS) 切除腫瘤[176] 。PVE的禁忌證包括門靜脈主干或一級分支癌栓, 腫瘤廣泛轉移, 合并嚴重的門靜脈高壓癥和凝血功能障礙。對于預期有功能的FLR增生時間較長 (例如較嚴重肝硬化、 年齡較大的患者), 腫瘤進展可能較快的患者需要謹慎使用。
B. ALPPS
作為近期肝臟外科的主要創(chuàng)新技術, ALPPS通常可在1~2周誘導產生高達47%~192%的剩余肝臟增生率, 遠遠高于PVE。因兩期手術間隔時間短, 故能最大程度減少腫瘤進展風險, 腫瘤切除率達95%~100%[177-178] 。隨著手術技術的進步和經(jīng)驗的積累, 與ALPPS相關的手術并發(fā)癥及死亡率已較ALPPS開展初期大大減少。近年來已出現(xiàn)多種ALPPS改進術式, 主要集中于一期手術肝斷面分隔操作 (部分分隔和使用射頻消融、 微波、 止血帶等方式分隔) 以及采用腹腔鏡微創(chuàng)入路行ALPPS, 進一步提高了ALPPS手術的安全性。若ALPPS一期術后2周,有功能的FLR仍不足以達到手術切除要求, 則可以行動脈栓塞 (transarterial embolization, TAE), 此術式被稱為TAE挽救性ALPPS (TAE-salvaged ALPPS), 1周后幾乎達到100%的二期手術切除率[179] 。有隨機對照研究已經(jīng)證實, ALPPS較PVE在快速誘導FLR增生的能力方面具有顯著優(yōu)勢[180] (證據(jù)等級2, 推薦A)。ALPPS一般應限定于以下患者: 年齡<65歲、 肝功能正常 (Child?Pugh A級,ICG-R15<20%)、 FLR不足 (正常肝臟者, FLR/SLV<30%;伴有慢性肝病和肝損傷者, FLR/SLV<40%)、 一般狀態(tài)良好、 手術耐受力良好、 無嚴重肝硬化、 無嚴重脂肪肝、 無嚴重門靜脈高壓癥者。
②肝癌轉化治療中的腫瘤學轉化
A. 局部治療在腫瘤學轉化中的應用
TACE[181] 、 肝動脈灌注化療 (hepatic arterial infusion chemotherapy, HAIC) [182]、 放療等局部治療手段為初始不可切除肝癌患者創(chuàng)造手術切除機會, 并且能夠轉化為生存獲益 (證據(jù)等級3, 推薦B)。TACE或HAIC與系統(tǒng)抗腫瘤治療的聯(lián)合可進一步提高轉化率[183-184] 。對于腫瘤負荷較大或合并門靜脈癌栓 (尤其是主干癌栓), 暫時不能接受外科手術治療的肝癌患者, 多項臨床研究顯示HAIC治療具有較高的客觀緩解率 (objective response rate,ORR), 部分患者經(jīng)HAIC治療后腫瘤體積縮小或門靜脈癌栓退縮, 提高了轉化治療的成功率 (證據(jù)等級3, 推薦C)。HAIC聯(lián)合TACE[185] 、 放療[186] 、 靶向藥物和/或免疫治療可能進一步提高轉化的成功率。
B. 系統(tǒng)抗腫瘤治療在腫瘤學轉化中的應用
抗血管生成藥物聯(lián)合免疫治療、 靶向藥物和/或聯(lián)合免疫治療已成為不可切除或中晚期肝癌的重要治療方式, 也是肝癌轉化治療的重要手段 (證據(jù)等級4, 推薦B)。單從系統(tǒng)抗腫瘤治療方案選擇的角度, 需要鑒別無法行根治切除的原因、 重視病因學的處理、 在MDT框架下嚴格隨訪腫瘤緩解的持續(xù)時間和緩解深度, 嚴密監(jiān)測系統(tǒng)抗腫瘤治療的毒性及對轉化治療手段的可能影響, 積極探索轉化治療前后腫瘤免疫微環(huán)境的變化, 積極開展高級別循證醫(yī)學證據(jù)的大型臨床研究, 力爭使患者最大程度獲益。
(2) 肝癌的新輔助治療
新輔助治療是指對于適合手術切除但具有術后高危復發(fā)轉移風險的肝癌患者 (CNLC Ⅰb~Ⅱa期和部分CNLC Ⅱb、 Ⅲa期), 在術前先進行局部治療或系統(tǒng)抗腫瘤治療, 以期消滅微小病灶、 降低術后復發(fā)轉移率、 延長生存期 (證據(jù)等級4, 推薦C)。術前評估的高危復發(fā)轉移因素包括: 血管侵犯、 單發(fā)腫瘤直徑>5 cm、 多發(fā)腫瘤、鄰近臟器受累、 術前AFP水平較高、 術前血清HBV DNA高載量等。新輔助治療也存在風險, 應嚴格選擇適宜人群, 同時根據(jù)新輔助治療的目標選擇適宜的治療方案。治療方案選擇上, 在考慮ORR同時應該考慮選擇更高疾病控制率的方案, 以免因疾病進展而失去手術機會。同時也應選擇相對安全、 不良反應小的治療手段, 避免增加并發(fā)癥的發(fā)生。
(3) 肝癌術后輔助治療
肝癌切除術后 5 年腫瘤復發(fā)轉移率高達 50%~70%[187-188] 。術后輔助治療是降低腫瘤復發(fā)轉移風險,改善患者生存的重要手段 (證據(jù)等級2, 推薦B)。相比于新輔助治療, 術后輔助治療可以根據(jù)術后病理及分子分型更進一步精準選擇治療人群及個體化治療方案, 且不會因此而延期手術。術后輔助治療的人群主要是適合手術切除且具有高危復發(fā)轉移風險的肝癌患者。雖然不同研究定義的高危復發(fā)轉移因素不同, 但術后評估的高危復發(fā)轉移因素一般包括: 腫瘤破裂、 腫瘤直徑>5 cm、 多發(fā)腫瘤、 微血管侵犯、 大血管侵犯、 淋巴結轉移、 切緣陽性或窄切緣、 組織分化Edmondson Ⅲ~Ⅳ級等[189-191] 。
對于具有術后高危復發(fā)轉移風險的患者, 目前尚無國際標準的輔助治療方案。兩項隨機對照研究證實術后TACE治療可以有效減少復發(fā)轉移, 延長生存[192-193](證據(jù)等級1, 推薦A)。采用氟尿嘧啶/奧沙利鉑/亞葉酸鈣 (mFOLFOX) 方案的HAIC可以降低合并微血管侵犯的肝癌患者復發(fā)轉移, 改善生存[194] (證據(jù)等級1, 推薦B)。對于手術切除、 射頻消融或無水乙醇注射的肝癌患者,活化的細胞因子誘導的殺傷細胞治療亦可顯著延長中位無復發(fā)生存時間[195] (證據(jù)等級2, 推薦B); 免疫調節(jié)劑 (如胸腺法新[196] ) 也具有類似作用。另一項前瞻性多中心隨機對照Ⅲ期臨床研究證明, 中藥槐耳顆粒可以減少術后復發(fā)轉移, 延長總生存期[197] (證據(jù)等級1, 推薦A)。另外, 對于HBV感染的肝癌患者, 核苷類似物抗病毒治療有助于降低術后復發(fā)轉移, 應長期服用[198] (證據(jù)等級1, 推薦A)。對于病毒性肝炎相關肝癌患者, 術后輔助使用聚乙二醇化干擾素, 可以提高OS及無復發(fā)生存率, 并且不會帶來嚴重的不良反應[199] (證據(jù)等級1, 推薦B)。對于HCV感染的肝癌患者, 直接抗病毒藥物以獲得持續(xù)的病毒學應答, 目前沒有確鑿的數(shù)據(jù)表明直接抗病毒藥物治療與肝癌術后腫瘤復發(fā)轉移風險增加或降低、 復發(fā)時間或術后生存時間的差異相關[200-201] (證據(jù)等級3, 推薦C)。此外, 對于伴有門靜脈癌栓患者術后經(jīng)門靜脈置管化療聯(lián)合TACE, 也可以延長患者生存期[144](證據(jù)等級3, 推薦B)。近年來, 系統(tǒng)抗腫瘤治療在肝癌輔助治療中的研究也在不斷深入, 多項在晚期肝癌中有效的治療方案正在積極探索在輔助治療中的價值。其中IMbrave050研究結果顯示, 阿替利珠單克隆抗體聯(lián)合貝伐珠單克隆抗體可以減少28%的術后復發(fā)轉移風險[202] (證據(jù)等級1, 推薦A)。
要點論述:
(1)肝切除術是肝癌患者獲得長期生存的重要手段。
(2) 完善的術前肝臟儲備功能評估與腫瘤學評估非常重要。一般認為肝功能Child-Pugh A級、 ICG-R15<30%是實施手術切除的必要條件; FLR須占SLV的40%以上(伴有慢性肝病、 肝實質損傷或肝硬化者) 或30%以上(無肝纖維化或肝硬化者), 也是實施手術切除的必要條件。有肝功能損害者, 則需保留更多FLR。術前評估,還包括肝臟硬度、 門靜脈高壓程度的測定等。
(3) 肝臟儲備功能良好的CNLC Ⅰa、 Ⅰb和Ⅱa期肝癌的首選治療是手術切除。在CNLC Ⅱb期和Ⅲa期肝癌患者中, 經(jīng)MDT評估, 部分患者仍有機會從手術切除中獲益。
(4) 肝切除時經(jīng)常采用入肝 (肝動脈和門靜脈) 和出肝 (肝靜脈) 血流控制技術; 術前三維可視化技術有助于提高肝切除的準確性; 腹腔鏡技術具有創(chuàng)傷小和術后恢復快等優(yōu)點, 但對于巨大肝癌、 多發(fā)肝癌、 位于困難部位及中央?yún)^(qū)緊鄰重要管道肝癌和肝癌合并重度肝硬化者,建議經(jīng)嚴格選擇后由經(jīng)驗豐富的醫(yī)師實施。
(5) 肝癌術后患者需每隔3個月密切監(jiān)測影像學 (超聲顯像, 必要時選擇動態(tài)增強CT、 動態(tài)增強MRI掃描以及Gd-EOB-DTPA增強MRI掃描) 及AFP、 DCP和7個microRNA組合等腫瘤學標志物的改變, 2年之后可適當延長至3~6個月, 建議終身隨訪。
(6) 轉化治療指不適合手術切除的肝癌患者, 經(jīng)過干預后獲得手術切除的機會, 干預手段包括有功能的FLR轉化、 腫瘤學轉化等。對于FLR不足的肝癌患者, 在合適人群中采用ALPPS或PVE以短期內增加有功能的FLR;ALPPS較PVE具有更高的轉化效率。系統(tǒng)抗腫瘤治療和/或聯(lián)合局部治療已成為不可切除或中晚期肝癌的重要治療方式, 也是肝癌轉化治療的重要手段。
(7) 新輔助治療是指對于適合手術切除但具有術后高危復發(fā)轉移風險的肝癌患者, 在術前先進行局部治療或系統(tǒng)抗腫瘤治療, 以期消滅微小病灶, 降低術后復發(fā)率、 延長生存期; 但新輔助治療也存在風險, 應嚴格選擇適宜人群, 同時根據(jù)新輔助治療的目標選擇適宜的治療方案。
(8) 對于適合手術切除同時具有術后高危復發(fā)轉移風險的肝癌患者, 術后可采取抗病毒、 TACE、 HAIC、 放射治療、 系統(tǒng)抗腫瘤治療等輔助治療以降低術后復發(fā)轉移率, 延長生存時間。
4. 1. 7 肝移植術
(1) 肝癌肝移植適應證
肝移植是肝癌根治性治療手段之一, 尤其適用于肝功能失代償、 不適合手術切除及消融治療的小肝癌患者(證據(jù)等級2, 推薦A)。合適的肝癌肝移植適應證是提高肝癌肝移植療效、 保證寶貴的供肝資源得到公平合理應用、 平衡有或無腫瘤患者預后差異的關鍵[203] (證據(jù)等級3, 推薦B)。
關于肝癌肝移植適應證, 國際上主要采用米蘭(Milan)標準、 美國加州大學舊金山分校(University of California at San Francisco, UCSF) 標準、 美國器官共享聯(lián)合網(wǎng)絡 (United Network for Organ Sharing, UNOS) 標準等。國內尚無統(tǒng)一標準, 已有多家單位和學者陸續(xù)提出了不同的標準, 包括上海復旦標準[204] 、 杭州標準[205] 、 華西標準[206] 和三亞共識[207] 等, 這些標準對于無大血管侵犯、淋巴結轉移及肝外轉移的要求都是一致的, 但是對于腫瘤大小和數(shù)目的要求不盡相同。上述國內標準在未明顯降低術后OS的前提下, 均不同程度地擴大了肝癌肝移植的適用范圍, 使更多的肝癌患者因肝移植手術受益, 但是需要多中心協(xié)作研究以支持和證明, 從而獲得高級別的循證醫(yī)學證據(jù)。經(jīng)專家組充分討論, 現(xiàn)階段本指南推薦采用UCSF標準, 即: 單個腫瘤直徑≤6. 5 cm; 腫瘤數(shù)目≤3個, 其中最大腫瘤直徑≤4. 5 cm, 且腫瘤直徑總和≤8. 0 cm; 無大血管侵犯。中國人體器官分配與共享基本原則和核心政策對肝癌肝移植有特別說明, 規(guī)定肝癌受體可以申請早期肝特例評分, 申請成功可以獲得MELD評分22分 (≥12歲肝臟移植等待者), 每3個月進行特例評分續(xù)期。
符合肝癌肝移植適應證的肝癌患者在等待供肝期間可以接受橋接治療控制腫瘤進展, 以防止患者失去肝移植機會, 是否降低肝移植術后復發(fā)轉移概率目前證據(jù)有限[208-209] (證據(jù)等級2, 推薦B)。橋接治療的方式目前主要推薦局部治療, 包括TACE、 釔-90放射栓塞、 消融治療、體部立體定向放射治療 (stereotactic body radiation therapy,SBRT) 等。移植術前使用免疫檢查點抑制是否會增加術后排斥和移植物損失的風險, 有待進一步觀察[210] 。
部分腫瘤負荷超出肝移植適應證標準的肝癌患者可以通過降期治療將腫瘤負荷縮小而符合適應證范圍。降期治療成功后的肝癌患者, 肝移植術后療效預后優(yōu)于非肝移植患者[211-212] (證據(jù)等級2, 推薦B)。最近的多中心前瞻性研究進一步證實肝癌肝移植術前腫瘤降期的可行性以及降期后對生存的益處[213] 。降期治療這個過程也可以作為一種選擇工具來識別具有有利的腫瘤生物學特性的肝移植受者。降期治療引起肝功能失代償?shù)娘L險必須重視。
外科技術的發(fā)展擴大了可用供肝的范圍。活體肝移植治療肝癌的適應證可以嘗試進一步擴大[214-215] (證據(jù)等級4, 推薦C)。活體肝移植預后仍與受體的選擇密切相關[216-218] 。
(2) 肝癌肝移植術后復發(fā)轉移的預防和治療
腫瘤復發(fā)轉移是肝癌肝移植術后面臨的主要問題[219] 。其危險因素包括腫瘤分期、 腫瘤血管侵犯、 術前血清AFP水平以及免疫抑制劑用藥方案等。術后早期撤除或無激素方案[220] 、 減少肝移植后早期鈣調磷酸酶抑制劑的用量可以降低腫瘤復發(fā)轉移率[221] (證據(jù)等級3, 推薦B)。肝癌肝移植術后采用以哺乳動物雷帕霉素靶蛋白抑制劑 (如雷帕霉素、 依維莫司) 為主的免疫抑制方案可以減少腫瘤復發(fā)轉移[222-226] (證據(jù)等級2, 推薦B)。
肝癌肝移植術后一旦腫瘤復發(fā)轉移 (75%的病例發(fā)生在肝移植術后2年內), 病情進展迅速, 復發(fā)轉移后患者的中位生存時間大約為1年[227-228] 。在多學科診療的基礎上, 采取包括變更免疫抑制方案、 再次手術切除、TACE、 消融治療、 放射治療、 系統(tǒng)抗腫瘤治療等綜合治療手段, 可能延長患者生存時間[229-230] (證據(jù)等級3, 推薦B)。免疫檢查點抑制劑用于肝癌肝移植術后的治療仍需慎重[231] (證據(jù)等級4, 推薦C)。與標準他克莫司相比, 依維莫司聯(lián)合減量他克莫司方案治療活體肝移植受者的肝癌復發(fā)轉移率相似, 但腎小球濾過率更高[232]。肝癌肝移植術后最常見的復發(fā)轉移部位是肺 (約40%)及肝臟 (33%)。移植術后的密切監(jiān)測與接受潛在的根治性治療和改善復發(fā)轉移后生存有關[233] 。
要點論述:
(1) 肝移植是肝癌根治性治療手段之一, 尤其適用于肝功能失代償、 不適合手術切除及消融治療的小肝癌患者。
(2)推薦 UCSF標準作為中國肝癌肝移植適應證標準。
(3) 肝癌肝移植術后早期撤除/無激素方案、 減少肝移植后早期鈣調磷酸酶抑制劑的用量、 采用以哺乳動物雷帕霉素靶蛋白抑制劑 (如雷帕霉素、 依維莫司) 為主的免疫抑制方案等有助于減少腫瘤復發(fā)轉移。
(4) 局部治療在肝癌肝移植的降期治療或橋接治療中具有重要作用。
(5) 肝癌肝移植術后一旦腫瘤復發(fā)轉移, 病情進展迅速, 在多學科診療基礎上的綜合治療, 可以延長患者生存時間。
4. 2 消融治療 目前消融治療已經(jīng)被認為是手術切除之外治療小肝癌的根治性治療方式, 消融治療具有對肝功能影響少、 創(chuàng)傷小、 療效確切的特點, 在一些早期肝癌患者中可以獲得與手術切除相類似的療效。
肝癌消融治療是借助醫(yī)學影像技術的引導, 對腫瘤病灶靶向定位, 局部采用物理或化學的方法直接殺滅腫瘤組織的一類治療手段。主要包括射頻消融 (radiofrequency ablation, RFA)、 微波消融 (microwave ablation, MWA)、 無水乙醇注射治療 (percutaneous ethanol injection, PEI)、 冷凍消融 (cryoablation, CRA)、 高強度超聲聚焦消融 (high intensity focused ultrasound ablation, HIFU)、 激光消融 (laser ablation, LA)、 不可逆電穿孔 (irreversible electroporation,IRE)等。消融治療常用的引導方式包括超聲、 CT和MRI, 其中最常用的是超聲引導, 具有方便、 實時、 高效的特點。CT、 MRI可以用于觀察和引導常規(guī)超聲無法探及的病灶。CT及MRI引導技術還可以應用于肺、 腎上腺、骨等肝癌轉移灶的消融治療。
消融的路徑有經(jīng)皮、 腹腔鏡、 開腹或經(jīng)內鏡4種方式。大多數(shù)的小肝癌可以經(jīng)皮穿刺消融, 具有經(jīng)濟、 方便、 微創(chuàng)等優(yōu)點。位于肝包膜下的肝癌 (特別是突出肝包膜外的肝癌經(jīng)皮穿刺消融風險較大), 影像學引導困難的肝癌或經(jīng)皮消融高危部位的肝癌 (如貼近心臟、 膈肌、 胃腸道、 膽囊等), 可以考慮采用經(jīng)腹腔鏡消融、 開腹消融或水隔離技術的方法。
消融治療主要適用于CNLC Ⅰa期及部分Ⅰb期肝癌 (即單個腫瘤、 直徑≤5 cm; 或2~3個腫瘤、 最大直徑≤3 cm); 無血管、 膽管和鄰近器官侵犯以及遠處轉移, 肝功能 Child-Pugh A/B級者, 可以獲得根治性的治療效果[131, 234-238] (證據(jù)等級1, 推薦A)。對于不適合單純手術切除的直徑3~7 cm的單發(fā)腫瘤或多發(fā)腫瘤, 可以采用消融聯(lián)合手術切除或TACE治療, 其效果優(yōu)于單純的消融治療[239-243] (證據(jù)等級2, 推薦B)。
4. 2. 1 目前常用消融治療手段
(1) RFA: RFA是肝癌微創(chuàng)治療常用消融方式, 其優(yōu)點是操作方便、 住院時間短、 療效確切、 消融范圍可控性好, 特別適用于高齡、 合并其他疾病、 嚴重肝硬化、 腫瘤位于肝臟深部或中央型肝癌的患者。對于能夠手術的早期肝癌患者, RFA的總體生存時間類似或略低于手術切除,但并發(fā)癥發(fā)生率低、 住院時間較短[126, 131, 234, 236-238, 244] (證據(jù)等級1, 推薦A)。對于單個直徑≤2 cm肝癌, 有證據(jù)顯示RFA的療效與手術切除類似, 特別是位于中央型的肝癌[245-246] (證據(jù)等級2, 推薦A)。RFA治療的技術要求是腫瘤整體滅活和具有足夠的消融安全邊界, 并盡量減少正常肝組織損傷, 其前提是對腫瘤浸潤范圍的準確評估和衛(wèi)星灶的識別。因此, 強調精確治療前多模態(tài)影像學檢查和治療前后影像學評估。超聲造影技術有助于確認腫瘤的實際大小和形態(tài)、 界定腫瘤浸潤范圍、 檢出微小肝癌和衛(wèi)星灶, 尤其在超聲引導消融過程中為制定消融方案、 完全滅活腫瘤提供可靠的參考依據(jù)。
(2)MWA: 近年來MWA應用比較廣泛, 在局部療效、 并發(fā)癥發(fā)生率以及遠期生存方面與RFA相比都無顯著差異[247-251] (證據(jù)等級1, 推薦A)。其特點是消融效率高、 所需消融時間短、 能降低RFA所存在的 “熱沉效應”,尤其對于鄰近血管的腫瘤、 富血供腫瘤和較大腫瘤具有更徹底的消融毀損效果。利用溫度監(jiān)控系統(tǒng)有助于調控功率、 時間等參數(shù), 確定有效熱場范圍, 保護熱場周邊組織避免熱損傷, 提高MWA消融安全性。至于MWA和RFA這兩種消融方式的選擇, 可以根據(jù)腫瘤的大小、 位置, 選擇更適宜的消融方式。
(3) PEI: PEI對直徑≤2 cm的肝癌消融效果確切, 遠期療效與RFA類似, 但>2 cm腫瘤局部復發(fā)率高于RFA[252](證據(jù)等級2, 推薦B)。PEI的優(yōu)點是安全, 特別適用于病灶貼近肝門、 膽囊及胃腸道組織等高危部位, 但需要多次、 多點穿刺以實現(xiàn)藥物在瘤內彌散作用, 因而目前多用于熱消融技術的輔助治療。
(4) CRA: CRA治療途徑與RFA和MWA相同, 可經(jīng)皮、 經(jīng)腹腔鏡或開腹直視下完成。CRA治療≤2 cm肝癌效果與MWA、 RFA治療手段相似[253] (證據(jù)等級2, 推薦B)。
4. 2. 2 基本技術要求
(1) 操作醫(yī)師必須經(jīng)過嚴格培訓和積累足夠的實踐經(jīng)驗, 掌握各種消融技術手段的優(yōu)缺點與治療選擇適應證。治療前應該全面充分地評估患者的全身狀況、 肝功能狀態(tài)、 凝血功能及腫瘤的大小、 位置、 數(shù)目以及與鄰近器官的關系, 制定合理的穿刺路徑、 消融計劃及術后照護, 在保證安全的前提下, 達到有效的消融安全范圍。
(2) 根據(jù)腫瘤的大小、 位置, 強調選擇適合的影像引導設備 (超聲或CT等) 和消融方法 (RFA、 MWA、 CRA或PEI等), 有條件的可采用多模態(tài)融合影像引導。
(3) 鄰近肝門部或靠近一、 二級膽管的肝癌需要謹慎應用消融治療, 避免發(fā)生損傷膽管等并發(fā)癥。采用PEI的方法較為安全, 或消融聯(lián)合PEI。如果采用熱消融方法, 腫瘤與一、 二級肝管之間要有足夠的安全距離 (至少>5 mm), 并采用安全的消融參數(shù) (低功率、 短時間、 間斷輻射)。對于有條件的消融設備推薦使用溫度監(jiān)測方法。
(4) 消融范圍應力求覆蓋包括至少5 mm的癌旁組織, 以獲得 “安全邊緣”, 徹底殺滅腫瘤。對于邊界不清晰、 形狀不規(guī)則的病灶, 在鄰近肝組織及結構條件許可的情況下, 建議適當擴大消融范圍。
4. 2. 3 對于直徑3~5 cm的肝癌治療選擇 數(shù)項前瞻性隨機對照臨床試驗和系統(tǒng)回顧性分析顯示, 對于直徑3~5 cm的肝癌宜首選手術切除[132, 237, 254] (證據(jù)等級1,推薦A)。在臨床實踐中, 應該根據(jù)患者的一般狀況和肝功能, 腫瘤的大小、 數(shù)目、 位置決定, 并結合從事消融治療醫(yī)師的技術和經(jīng)驗, 全面考慮后選擇合適的初始治療手段。通常認為, 如果患者能夠耐受肝切除術, 尤其是肝癌位置表淺、 位于肝臟邊緣或不適合消融的高危部位肝癌, 均應首選手術切除。對于直徑3~5 cm的單發(fā)肝癌, 我國最新多中心回顧性研究數(shù)據(jù)顯示, MWA可取得和腹腔鏡肝切除術相近的 OS, 而無病生存稍遜于切除[235] 。對于2~3個病灶位于不同區(qū)域、 或者位居肝臟深部或中央型的肝癌, 可以選擇消融治療或者手術切除聯(lián)合消融治療。
4. 2. 4 肝癌消融治療后的評估和隨訪 局部療效評估的推薦方案是在消融后1個月左右, 復查動態(tài)增強CT、動態(tài)增強MRI掃描或超聲造影, 以評價消融效果。另外, 還要檢測血清學腫瘤標志物動態(tài)變化。影像學評判消融效果可以分為[255] : ①完全消融: 經(jīng)動態(tài)增強CT、 動態(tài)增強MRI掃描或超聲造影隨訪, 腫瘤消融病灶動脈期未見強化, 提示腫瘤完全壞死; ②不完全消融: 經(jīng)動態(tài)增強CT、 動態(tài)增強MRI掃描或超聲造影隨訪, 腫瘤消融病灶內動脈期局部有強化, 提示有腫瘤殘留。
對治療后有腫瘤殘留者, 可以進行再次消融治療; 若2次消融后仍有腫瘤殘留, 應放棄消融療法, 改用其他療法。完全消融后應定期隨訪復查, 通常情況下每隔2~3個月復查血清學腫瘤標志物、 超聲顯像、 增強CT或動態(tài)增強MRI掃描, 以便及時發(fā)現(xiàn)可能的局部復發(fā)病灶和肝內新發(fā)病灶, 利用消融治療微創(chuàng)安全和簡便易于反復施行的優(yōu)點, 有效地控制腫瘤進展。
4. 2. 5 肝癌消融術后預防復發(fā)轉移的輔助治療 近期IMbrave050研究[202] 結果顯示, 在以治愈為目的的手術切除或消融后具有術后高危復發(fā)轉移風險的肝癌患者中,阿替利珠單克隆抗體聯(lián)合貝伐珠單克隆抗體與主動監(jiān)測相比, 提高了無復發(fā)生存率。此項研究中, 消融后高危復發(fā)轉移風險的標準定義為: 單個腫瘤且最大腫瘤直徑>2 cm且≤5 cm或多發(fā)腫瘤≤4個且最大腫瘤直徑≤5 cm。
有研究顯示, 消融治療可提高腫瘤相關抗原和新抗原釋放, 增強肝癌相關抗原特異性T淋巴細胞應答, 激活或者增強機體抗腫瘤的免疫應答反應[256-258] ; 消融治療聯(lián)合免疫治療可以產生協(xié)同抗腫瘤作用[256, 259-260]。目前多項相關臨床研究正在開展之中。
要點概述:
(1) 消融治療適用于CNLC Ⅰa期及部分Ⅰb期肝癌 (即單個腫瘤、 直徑≤5 cm; 或2~3個腫瘤、 最大直徑≤3 cm), 可以獲得根治性的治療效果。對于不能單純手術切除的直徑3~7 cm的單發(fā)腫瘤或多發(fā)腫瘤, 可以消融治療聯(lián)合TACE或手術切除。
(2) 對于直徑≤3 cm的肝癌患者, 消融治療的總體生存時間類似或稍低于手術切除, 但并發(fā)癥發(fā)生率、 住院時間低于手術切除。對于單個直徑≤2 cm肝癌, 消融治療的療效類似于手術切除, 特別是中央型肝癌。
(3) RFA與MWA在局部療效、 并發(fā)癥發(fā)生率以及遠期生存方面, 兩者無顯著差異, 可以根據(jù)腫瘤的大小、 位置來選擇。
(4) PEI對直徑≤2 cm的肝癌遠期療效與RFA類似。PEI的優(yōu)點是安全, 特別適用于病灶貼近肝門、 膽囊及胃腸道組織等高危部位, 但需要多次、 多點穿刺以實現(xiàn)藥物在瘤內彌散作用。
(5) CRA治療可借助B超、 CT等引導, 在腹腔鏡或直視下進行, 對于≤2 cm肝癌消融效果與微波、 射頻相似。
(6)消融治療后定期復查動態(tài)增強CT、 動態(tài)增強MRI掃描、 超聲造影和血清學腫瘤標志物, 以評價消融效果。
4. 3 經(jīng)動脈介入治療 (研究進展見附錄E)
根據(jù)動脈插管化療、 栓塞操作的不同, 經(jīng)動脈介入治療通常分為: ①動脈灌注化療: 是指經(jīng)腫瘤供血動脈灌注化療藥物, 包括HAIC, 常用化療藥物有蒽環(huán)類、 鉑類和氟尿嘧啶類等, 需根據(jù)患者的腫瘤負荷、 體表面積、肝腎功能狀態(tài)、 血細胞水平、 體能狀態(tài)、 既往用藥及合并疾病等情況選擇配伍與用量, 同時根據(jù)化療藥物的藥代動力學特點設計灌注藥物的濃度和時間[261] ; ②TACE:是指將帶有化療藥物的碘化油乳劑或載藥微球、 輔以顆粒型栓塞劑 (如明膠海綿顆粒、 空白微球、 聚乙烯醇顆粒) 等經(jīng)腫瘤供血動脈支的栓塞治療; ③TAE: 單純用顆粒型栓塞劑栓塞腫瘤的供血動脈分支; ④經(jīng)動脈放射性栓塞 (transarterial radioembolization, TARE), 指經(jīng)腫瘤供血動脈注射帶有放射性核素的物質 (其具體應用見附錄F)。其中TACE是肝癌最常用的經(jīng)動脈介入治療方法[262-267] 。
4. 3. 1 TACE的基本原則 ①要求在DSA機下進行; ②必須嚴格掌握適應證和禁忌證; ③必須強調超選擇插管至腫瘤的供血動脈分支再進行治療; ④必須強調保護患者的肝功能; ⑤必須強調治療的規(guī)范化和個體化; ⑥經(jīng)過3~4次TACE治療后, 治療的靶病灶仍處于疾病進展, 應考慮更換TACE方案或聯(lián)合其他治療方法, 如消融治療、 系統(tǒng)抗腫瘤治療、 放射治療以及外科手術等。
4. 3. 2 TACE適應證 ①CNLC Ⅱb、 Ⅲa期肝癌患者,為首選治療推薦; ②有手術切除或消融治療適應證, 但由于高齡、 肝功能儲備不足、 腫瘤高危部位等非手術原因, 不能或不愿接受上述治療方法的CNLC Ⅰa、 Ⅰb和Ⅱa期肝癌患者; ③預計通過TACE治療能控制肝內腫瘤生長而獲益的CNLC Ⅲb期肝癌患者; ④門靜脈主干未完全阻塞, 或雖完全阻塞但門靜脈代償性側支血管豐富或通過門靜脈支架植入可以恢復門靜脈血流的肝癌患者; ⑤肝動脈-門靜脈分流造成門靜脈高壓出血的肝癌患者; ⑥具有高危復發(fā)因素 (包括腫瘤較大或多發(fā)、 合并肉眼或鏡下癌栓、 姑息性手術、 術后AFP等腫瘤標志物未降至正常范圍等) 肝癌患者手術切除后的輔助性TACE治療; ⑦初始不可切除, 但可接受術前轉化治療后為手術切除、 肝臟移植、 消融創(chuàng)造機會的肝癌患者; ⑧肝癌肝移植患者等待期的橋接治療及降期治療; ⑨肝癌自發(fā)破裂患者。
4. 3. 3 TACE禁忌證 ①肝功能嚴重障礙 (Child-Pugh C級), 包括嚴重黃疸、 肝性腦病、 難治性腹水或肝腎綜合征等; ②無法糾正的凝血功能障礙; ③門靜脈主干完全被癌栓/血栓栓塞, 門靜脈側支代償不足且不能通過門靜脈成形術有效復通門靜脈向肝血流者; ④嚴重感染或合并活動性肝炎且不能有效控制者; ⑤腫瘤彌漫或遠處廣泛轉移, 估計生存期<3個月; ⑥ECOG PS評分>2分、 惡液質或多器官功能衰竭者; ⑦腫瘤占全肝體積的比例≥70% (非絕對禁忌, 如肝功能基本正常, 可考慮采用分次栓塞); ⑧外周血白細胞和血小板顯著減少, 白細胞<3. 0×109/L, 血小板<50×109/L (非絕對禁忌, 如脾功能亢進者, 排除化療性骨髓抑制); ⑨腎功能障礙: 血肌酐>176. 8 ?mol/L或者血肌酐清除率<30 ml/min; ⑩嚴重碘對比劑過敏者。
4. 3. 4 TACE操作程序要點和分類[268-269]
(1) 動脈造影: 全面、 規(guī)范的動脈造影是TACE成功的基礎。通常采用Seldinger方法, 經(jīng)皮穿刺股動脈 (或橈動脈) 途徑插管, 將導管置于腹腔動脈或肝總動脈行DSA造影。造影圖像采集應包括動脈期、 實質期及靜脈期, 以明確腫瘤部位、 大小、 數(shù)目及供血動脈情況。結合術前影像學檢查仔細分析造影表現(xiàn), 若發(fā)現(xiàn)肝臟區(qū)域血管稀少/缺乏或腫瘤染色不完全, 應做腸系膜上動脈、 胃左動脈、 膈下動脈、 腎動脈、 胸廓內動脈、 肋間動脈、 腰動脈等動脈造影, 以發(fā)現(xiàn)異位起源的肝動脈及肝外動脈側支供養(yǎng)血管[61] 。推薦使用DSA聯(lián)合CBCT以提高腫瘤病灶顯示率和供血動脈分支判斷的準確性[62] (證據(jù)等級2, 推薦強度A)。對于嚴重肝硬化、 門靜脈主干及一級分支癌栓者, 推薦經(jīng)腸系膜上動脈或脾動脈行間接門靜脈造影, 了解門靜脈血流情況。
(2)根據(jù)栓塞劑的不同, TACE 分為常規(guī) TACE(conventional-TACE, cTACE)和藥物洗脫微球 TACE(drug-eluting beads-TACE, DEB-TACE)。cTACE是指采用以碘化油化療藥物乳劑為主, 輔以明膠海綿顆粒、 空白微球或聚乙烯醇顆粒的栓塞治療。通常先灌注一部分化療藥物, 一般灌注時間不應<20 min, 然后將另一部分化療藥物與碘化油混合成乳劑進行栓塞。碘化油與化療藥物需充分混合成乳劑, 單次用量一般為5~20 mL,最多不超過30 mL。在透視監(jiān)視下依據(jù)腫瘤區(qū)碘化油沉積是否濃密, 腫瘤周圍是否出現(xiàn)門靜脈小分支顯影為碘化油乳劑栓塞的終點。在碘化油乳劑栓塞后加用顆粒性栓塞劑, 盡量避免栓塞劑反流栓塞正常肝組織或進入非靶器官。DEB-TACE是指采用加載化療藥物的藥物洗脫微球為主的栓塞治療, 又稱載藥微球TACE。載藥微球通常加載蒽環(huán)類化療藥物, 在栓塞肝癌供血動脈使腫瘤缺血壞死的同時作為化療藥物的載體, 使化療藥物持續(xù)穩(wěn)定釋放, 達到腫瘤局部較高血藥濃度。根據(jù)腫瘤大小、 血供豐富情況和治療目的選擇不同粒徑的微球, 常用為100~300 ?m、 300~500 ?m。載藥微球推注速度推薦1 mL/min, 需注意微球栓塞后再分布, 盡可能充分栓塞遠端腫瘤滋養(yǎng)動脈, 同時注意保留腫瘤近端供血分支, 減少微球反流對正常肝組織損害[270-271] 。cTACE與DEB-TACE治療的總體療效無顯著差異, 但腫瘤的客觀有效率方面DEB-TACE具有一定的優(yōu)勢[272] (證據(jù)等級1, 推薦B)。
(3) 精細TACE治療: 為減少腫瘤的異質性導致TACE療效的差異, 提倡精細TACE治療。精細TACE包括: ①規(guī)范的動脈造影; ②微導管超選擇插管至腫瘤的供血動脈分支進行栓塞[273] ; ③術中采用CBCT技術為輔助的靶血管精確插管及監(jiān)測栓塞后療效[274] ; ④栓塞材料的合理聯(lián)合應用, 包括碘化油、 明膠海綿顆粒、 空白微球、 藥物洗脫微球等[275] ; ⑤根據(jù)患者腫瘤狀況、 體能狀態(tài)、 肝功能狀態(tài)和治療目的采用不同的栓塞終點。治療前確定個體化的TACE治療目標至關重要。對于局限于肝段或直徑<5 cm的肝癌, 應使腫瘤完全去血管化和/或周邊門靜脈小分支顯影, 達到肝動脈和門靜脈雙重栓塞效果[276-277] ; 對于巨塊型肝癌需結合患者的肝功能、 體能狀態(tài)、 門靜脈通暢等情況, 盡量使腫瘤去血管化; 對于腫瘤累及全肝且腫瘤負荷較高的患者, 可采用分次TACE治療, 先處理負荷較高肝葉的腫瘤, 待2~4周患者肝功能恢復后再處理剩余腫瘤, 以減少患者肝功能損傷, 提高TACE治療的安全性。
4. 3. 5 TACE術后常見不良反應和并發(fā)癥 TACE治療的最常見不良反應是栓塞后綜合征, 主要表現(xiàn)為發(fā)熱、疼痛、 惡心和嘔吐等。發(fā)熱、 疼痛的發(fā)生原因是肝動脈被栓塞后引起局部組織缺血、 壞死, 而惡心、 嘔吐主要與化療藥物有關。此外, 還有一過性肝功能異常、 腎功能損害以及骨髓抑制等其他不良反應。TACE治療后的不良反應可持續(xù)5~7天, 經(jīng)對癥治療后大多數(shù)患者能完全恢復。
TACE治療的并發(fā)癥: 急性肝腎功能損害; 消化道出血; 膽囊炎和膽囊穿孔; 肝膿腫和膽汁瘤形成; 栓塞劑異位栓塞 (包括肺和腦栓塞、 消化道穿孔、 脊髓損傷、 膈肌損傷等)。
4. 3. 6 TACE的療效評價 最常采用mRECIST和/或歐洲肝病學會 (EASL) 標準評價TACE療效[87, 278] 。分短期療效評價和長期療效評價。短期療效評價指標有ORR、PFS等, 長期療效評價指標為OS。基于mRECIST標準評估的ORR與OS有一定相關性, 早期獲得腫瘤客觀緩解,特別是完全緩解者, 預后較好[279-281] (證據(jù)等級2, 推薦強度B)。
4. 3. 7 影響TACE療效的主要因素 ①腫瘤分期; ②腫瘤負荷; ③腫瘤包膜完整性; ④腫瘤血供情況; ⑤腫瘤的病理分型; ⑥血清AFP水平; ⑦肝硬化程度; ⑧肝功能狀態(tài); ⑨伴慢性HBV感染者的血清乙型肝炎e抗原 (hepatitis B e antigen, HbeAg) 狀態(tài)、 HBV DNA水平; ⑩ECOG PS評分; ?是否聯(lián)合消融、 分子靶向治療、 免疫治療、 放射治療以及外科手術等綜合治療。
4. 3. 8 隨訪及TACE間隔期間治療 一般建議第1次TACE治療后4~6周時復查動態(tài)增強CT和/或動態(tài)增強MRI掃描、 腫瘤相關標志物、 肝腎功能和血常規(guī)檢查等; 再次TACE治療應遵循按需原則 [282-283] , 若影像學隨訪顯示肝臟腫瘤灶內碘油沉積濃密、 腫瘤組織壞死無強化且無新病灶, 暫時可以不做TACE治療。后續(xù)是否需要TACE治療及頻次應依隨訪結果而定, 主要包括患者對上一次治療的反應、 肝功能和體能狀況的變化。隨訪間隔1~3個月或更長時間, 依據(jù)動態(tài)增強CT和/或動態(tài)增強MRI動態(tài)增強掃描評價肝臟腫瘤的存活情況, 以決定是否需要再次TACE治療。對于大肝癌/巨塊型肝癌常要3~4次或以上的TACE治療, 目前主張TACE聯(lián)合其他治療方法, 目的是控制腫瘤、 提高患者生活質量和延長生存。
4. 3. 9 以TACE為基礎的綜合治療
需重視TACE聯(lián)合其他局部治療和/或系統(tǒng)抗腫瘤治療, 以進一步提高TACE療效[262] 。
(1) 在TACE基礎上采用門靜脈內支架置入術聯(lián)合碘-125粒子條或碘-125粒子門靜脈支架置入術, 有助于恢復門靜脈向肝血流、 緩解門靜脈高壓、 有效處理門靜脈主干癌栓[284-286] (證據(jù)等級2, 推薦B)。采用碘-125粒子條或直接穿刺植入碘-125粒子治療門靜脈一級分支癌栓[287-289] (證據(jù)等級2, 推薦B)。
(2) TACE聯(lián)合消融治療: 為了提高TACE療效, 主張在TACE治療基礎上酌情聯(lián)合消融治療, 包括RFA、 MWA以及CRA等治療[290-291] 。對不能手術切除的CNLC Ⅰb、Ⅱa期直徑3~7 cm的單發(fā)或多發(fā)腫瘤, 效果優(yōu)于單純消融治療[240-241, 292] (證據(jù)等級2, 推薦B)。目前臨床有兩種TACE聯(lián)合熱消融治療方式: ①序貫消融: 先行TACE治療, 術后1~4周內加用消融治療; ②同步消融: 在TACE治療的同時給予消融治療, 可以明顯提高臨床療效, 并減輕肝功能損傷[290, 293] 。
(3) TACE聯(lián)合外放射治療: TACE聯(lián)合外放射治療可提高腫瘤局部緩解率。聯(lián)合治療常用于局限性大肝癌介入治療后、 伴有門靜脈或下腔靜脈癌栓及肝外轉移的CNLC Ⅲ期肝癌[294-295] (證據(jù)等級2, 推薦B)。
(4) TACE聯(lián)合外科治療:
①外科治療前橋接、 降期或轉化治療: TACE可有效降低腫瘤負荷, 將部分超越肝移植標準的患者轉化至符合肝移植標準, 提高肝移植率, 降低移植術后復發(fā)轉移率, 轉化后的肝移植患者OS與標準內患者類似[211, 296-298](證據(jù)等級2, 推薦B)。TACE還可為初始不可切除肝癌患者創(chuàng)造潛在手術切除機會, 并轉化為長期生存獲益[181] 。TACE聯(lián)合HAIC、 放療等局部治療以及靶向/免疫治療可以提高轉化成功率[299-300] (證據(jù)等級2, 推薦B)。
②外科術后高危復發(fā)轉移患者輔助性TACE治療:輔助性TACE可及時發(fā)現(xiàn)外科術后殘留或復發(fā)的肝癌病灶, 并進行有效治療。對存在術后復發(fā)高危因素者, 如術前腫瘤破裂、 直徑>5 cm、 多病灶腫瘤、 微血管侵犯/脈管瘤栓、 切緣陽性、 組織分化差、 術后腫瘤標志物水平未降至正常水平, 推薦術后輔助性TACE治療[192-193, 301-303](證據(jù)等級1, 推薦A)。
(5) TACE聯(lián)合HAIC治療: 對于肝癌伴門靜脈癌栓(尤其是主干癌栓)、 明顯或廣泛動-靜脈瘺TACE不能良好栓塞、 巨大腫瘤以及多次TACE治療產生抵抗的肝癌患者, 采用TACE聯(lián)合mFOLFOX-HAIC治療能進一步提高TACE療效[304-305] (證據(jù)等級3, 推薦B)。
(6) TACE聯(lián)合系統(tǒng)抗腫瘤治療: 對于中或高腫瘤負荷、 TACE治療抵抗或失敗的患者, 應盡早聯(lián)合分子靶向藥物治療[306-307] (證據(jù)等級2, 推薦B)。目前, TACE聯(lián)合分子靶向藥物療效優(yōu)于單一分子靶向藥物[184, 308] (證據(jù)等級2, 推薦B)。采用TACE聯(lián)合靶向和免疫治療能延長中晚期肝癌患者生存期, 療效優(yōu)于單一TACE治療[309-311](證據(jù)等級2, 推薦A)。
(7) TACE聯(lián)合抗病毒治療: 對有HBV、 HCV背景肝癌患者TACE治療同時應積極抗病毒治療[312-313] (證據(jù)等級1, 推薦A)。
4. 3. 10 HAIC HAIC作為一種經(jīng)動脈介入治療方式, 目前尚未形成統(tǒng)一治療技術標準。近年來, 我國學者采用mFOLFOX為基礎的灌注方案使晚期肝癌患者HAIC療效得以提高[314] 。研究表明, mFOLFOX-HAIC治療對于多次TACE治療產生抵抗、 肝癌伴門靜脈癌栓、 肝外寡轉移的肝癌患者, 療效優(yōu)于索拉非尼治療[182-183, 315] (證據(jù)等級1,推薦A); 另外對肝癌伴門靜脈癌栓患者 (CNLC Ⅲa期) 采用HAIC聯(lián)合索拉非尼治療療效優(yōu)于單用索拉非尼治療[183] (證據(jù)等級1, 推薦A)。
要點論述:
(1) TACE是肝癌最常用的經(jīng)血管內介入治療方法,主要適用于CNLC Ⅱb、 Ⅲa和部分Ⅲb期肝癌患者。
(2) TACE必須遵循規(guī)范化和個體化的方案, 提倡精細TACE治療, 以減少腫瘤異質性導致TACE療效的差異。
(3) 對肝癌伴門靜脈主干或一級分支癌栓可以在TACE基礎上聯(lián)合使用門靜脈內支架聯(lián)合碘-125粒子條或碘-125粒子門靜脈支架治療或直接穿刺植入碘-125粒子治療。
(4) 提倡TACE聯(lián)合消融治療、 放射治療、 外科手術、HAIC、 分子靶向藥物、 免疫治療和抗病毒治療等綜合治療, 以進一步提高TACE療效。
(5) mFOLFOX-HAIC治療對于多次TACE治療產生抵抗、 肝癌伴門靜脈癌栓、 肝外寡轉移的肝癌患者, 療效優(yōu)于索拉非尼治療。
4. 4 放射治療
放射治療分為外放射治療和內放射治療。外放射治療是利用放療設備產生的射線 (光子或粒子) 從體外進入體內對腫瘤照射。內放射治療是利用放射性核素,經(jīng)機體管道或通過針道植入腫瘤內。肝癌對放射敏感,中等劑量的放療, 就可以獲得較好的腫瘤緩解率。
4. 4. 1 外放射治療
(1) 外放射治療適應證
①CNLC Ⅰa、 部分Ⅰb期肝癌患者, 如無手術切除或消融治療適應證或不愿接受有創(chuàng)治療, 可以考慮采用SBRT作為有效治療手段[316-323] (證據(jù)等級2, 推薦B);
②CNLC Ⅱa、 Ⅱb期肝癌患者, TACE聯(lián)合外放射治療,可以改善局部控制率、 延長生存時間, 較單用TACE、 索拉非尼或TACE聯(lián)合索拉非尼治療的療效好, 可以適當采用[294, 318, 324-330] (證據(jù)等級2, 推薦B); ③CNLC Ⅲa期肝癌患者, 可以切除的伴門靜脈癌栓的肝癌行術前新輔助放射治療[331] 或術后輔助放射治療, 延長生存[145, 332](證據(jù)等級2, 推薦B); 對于不能手術切除的, 可行姑息性放射治療, 或放射治療與 TACE 等聯(lián)合治療, 尤其TACE前放療, 可顯著延長患者生存時間[294, 329-330, 333-334](證據(jù)等級2, 推薦B); ④CNLC Ⅲb期肝癌患者, 部分寡轉移灶者, 可以行SBRT, 延長生存時間; 淋巴結、 肺、 骨、腦或腎上腺等轉移灶, 外放射治療可以減輕轉移灶相關疼痛、 梗阻或出血等癥狀, 延長生存時間[295, 335-337] (證據(jù)等級3, 推薦B); ⑤放療可與手術聯(lián)合, 能改善部分肝癌患者生存。外放射治療可用于等待肝癌肝移植術前的橋接治療[338-339] (證據(jù)等級2, 推薦B); 與可切除門靜脈癌栓的肝癌類似, 部分中央型肝癌 (指緊鄰肝門, 距離主要的血管結構<1 cm的肝癌, 其通常位于Couinaud Ⅰ、Ⅳ、 Ⅴ、 Ⅷ段, 或者位于中央段的交界處) 可行術前新輔助放療, 其療效較好且患者耐受性佳[340] ; 放射治療可聯(lián)合介入或免疫檢查點抑制劑治療[300] , 使部分無法手術切除的肝癌患者, 在腫瘤縮小或降期后轉化為手術切除[295, 320] (證據(jù)等級3, 推薦B); 肝癌術后病理提示有MVI者、 肝癌手術切緣距腫瘤≤1 cm的窄切緣者, 術后輔助放射治療可以減少病灶局部復發(fā)或遠處轉移延長患者無瘤生存期[341-344] (證據(jù)等級2, 推薦B); ⑥放療可與分子靶向類、 免疫檢查點抑制劑聯(lián)合: 部分CNLC Ⅲ期或伴MVI等不良預后因素的患者, 放射治療前、 后使用索拉非尼[345]等分子靶向藥可能延長生存時間[346-348], 但同步使用這類藥物須謹慎[349-350] ; 免疫檢查點抑制劑聯(lián)合SBRT治療肝癌, 有研究結果提示可能起到相互協(xié)同增效的作用[351-355] (證據(jù)等級3, 推薦C)。
(2) 外放射治療禁忌證
肝癌患者如肝內病灶彌散分布, 或CNLC Ⅳ期者,不建議行外放射治療。
(3) 外放射治療實施原則與要點
肝癌外放射治療實施原則為綜合考慮腫瘤照射劑量, 周圍正常組織耐受劑量, 以及所采用的放射治療技術。肝癌外放射治療實施要點為: ①放射治療計劃制定時, 肝內病灶在增強CT中定義, 必要時參考MRI影像等多種影像資料, 可以利用正常肝組織的增生能力, 放射治療時保留部分正常肝不受照射, 以期部分正常肝組織獲得增生。②肝癌照射劑量, 與患者生存時間及局部控制率密切相關, 基本取決于周邊正常組織的耐受劑量[186, 356] 。肝癌照射劑量: SBRT一般推薦≥45~60 Gy/3~10分次 (fraction, Fx) [357] 、 放射治療生物等效劑量 (biological effective dose, BED) ≥80 Gy (α/β比值取10 Gy), 病灶可獲得較好的放療效果[317] ; 常規(guī)分割放射治療為50~75 Gy; 新輔助放射治療門靜脈癌栓的劑量可以為3 Gy × 6 Fx[145] 。
具有圖像引導放射治療 (image guided radiation therapy,IGRT) 技術條件者, 部分肝內病灶、 癌栓或肝外淋巴結、肺、 骨等轉移灶可行低分割放射治療者盡量采用低分割放療, 以提高單次劑量、 縮短放射治療時間、 療效不受影響甚至可以提高[358-360] ; 非SBRT的低分割外放射治療,可以利用模型計算BED, 有HBV感染者的肝細胞α/β比值取8 Gy, 腫瘤細胞α/β比值取10~15 Gy, 作為劑量換算參考[186, 295, 361] 。③正常組織耐受劑量需考慮: 放射治療分割方式、 肝功能Child-Pugh分級、 正常肝 (肝臟-腫瘤) 體積[362] 、 胃腸道淤血和凝血功能狀況等 (附錄G);④肝癌放射治療技術: 建議采用三維適形或調強放射治療、 IGRT或SBRT等技術。IGRT優(yōu)于非IGRT技術[356] ,螺旋斷層放射治療適合多發(fā)病灶的肝癌患者。呼吸運動是導致肝臟腫瘤在放射治療過程中運動和形變的主要原因, 目前可以采取多種技術以減少呼吸運動帶來的影響, 如門控技術、 實時追蹤技術、 呼吸控制技術以及腹部加壓結合4D-CT確定內靶區(qū)技術等[363] 。⑤目前尚缺乏較高級別的臨床證據(jù)以支持肝癌患者質子放射治療的生存率優(yōu)于光子放射治療[318] 。
(4) 放療療效評估
肝癌放療的療效可以參考EASL或mRECIST標準進行評價[318] 。增強CT和/或動態(tài)增強MRI掃描常用來評價肝癌放療后療效。放療后早期 (3周~3個月) 腫瘤多為凝固壞死, 縮小緩慢, 療效評價多為穩(wěn)定[364] ; 放療后期 (3~6個月后), 腫瘤壞死被逐漸吸收表現(xiàn)為腫瘤明顯縮小, 可平均縮小36%以上, 腫瘤動脈期強化顯著降低或不強化[365] 。
(5) 外放射治療主要并發(fā)癥: 放射性肝病 (radiation-induced liver disease, RILD) 是肝臟外放射治療的劑量限制性并發(fā)癥, 分典型性和非典型性兩種: ①典型RILD: 堿性磷酸酶升高>2倍正常值上限、 無黃疸性腹腔積液、 肝腫大; ②非典型RILD: 堿性磷酸酶>2倍正常值上限、 谷丙轉氨酶>正常值上限或治療前水平5倍、 肝功能Child-Pugh評分下降≥2分, 但是無肝大和腹腔積液。診斷RILD必須排除肝腫瘤進展、 病毒性或藥物性所致臨床癥狀和肝功能損害[295, 362] 。
臨床影像學所見局灶放射性肝損傷是對應于肝臟受到較高劑量照射的區(qū)域, 如在此基礎上出現(xiàn)RILD相關臨床癥狀體征、 實驗室指標異常, 并需臨床干預治療, 才可診斷放射性肝病。早期, 局灶放射性肝損傷CT表現(xiàn)多為邊界清楚肝內低密度區(qū), MRI表現(xiàn)為T1加權成像低信號/T2加權成像高信號, T1加權成像增強動脈期強化下降[364] 。晚期, 增強CT或MRI均表現(xiàn)為病變區(qū)局部萎縮、動脈及延遲期呈不均質強化, 該強化退出緩慢[366-368] , 隨訪時需與局部復發(fā)或進展相鑒別[295, 369] 。
4. 4. 2 質子束放射療法與內放射治療 質子束放射療法對于術后復發(fā)或殘留肝癌病灶(大小<3 cm, 數(shù)目≤2個) 的療效與RFA相似[370] (證據(jù)等級2, 推薦B)。
內放射治療是肝癌局部治療的一種方法, 包括釔- 90微球療法、 碘-131單克隆抗體、 放射性碘化油、 碘-131粒子植入等[336-337]。RFA治療肝癌后序貫使用碘-131-美妥昔單克隆抗體治療, 可以降低RFA治療后局部復發(fā)率, 改善患者生存[371] (證據(jù)等級2, 推薦B)。粒子植入技術包括組織間植入、 門靜脈植入、 下腔靜脈植入和膽道內植入, 分別治療肝內病灶、 門靜脈癌栓、 下腔靜脈癌栓和膽管內癌或癌栓。氯化鍶 (89Sr) 發(fā)射出β射線, 可以用于靶向治療肝癌骨轉移病灶[372] (證據(jù)等級3, 推薦C)。
要點論述:
(1) CNLC Ⅲa期肝癌患者, 合并可切除門靜脈癌栓的肝癌患者可以行術前新輔助放射治療或術后輔助放射治療, 延長生存; 對于不能手術切除者, 可以行姑息性放射治療, 或放射治療與TACE等聯(lián)合治療, 延長患者生存。
(2) CNLC Ⅲb期肝癌患者, 淋巴結、 肺、 骨、 腦或腎上腺轉移可采用外放射治療減輕疼痛、 梗阻或出血等癥狀。
(3) 肝腫瘤照射劑量: SBRT一般推薦≥45~60 Gy/3~10 Fx, 常規(guī)分割放射治療一般為50~75 Gy, 照射劑量與患者生存密切相關。部分肝內病灶或肝外轉移灶可以行低分割放射治療, 以提高單次劑量、 縮短放射治療時間。
(4) 正常組織的耐受劑量必須考慮: 放射治療分割方式、 肝功能Child-Pugh分級、 正常肝 (肝臟-腫瘤) 體積、胃腸道淤血和凝血功能狀況等。
(5) IGRT優(yōu)于三維適形放射治療或調強放射治療,SBRT必須在IGRT下進行。
(6) 內放射治療是肝癌局部治療的一種方法。
4. 5 系統(tǒng)治療
系統(tǒng)治療或稱之為全身性治療, 主要指抗腫瘤治療,包括分子靶向藥物治療、 免疫檢查點抑制劑治療、 化學治療和中醫(yī)中藥治療等; 另外還包括了針對肝癌基礎疾病的治療, 如抗病毒治療、 保肝利膽和支持對癥治療等。由于肝癌起病隱匿, 首次診斷時只有不到30%的肝癌患者適合接受根治性治療, 系統(tǒng)抗腫瘤治療在中晚期肝癌的治療過程中發(fā)揮重要的作用。系統(tǒng)抗腫瘤治療可以控制疾病的進展, 延長患者的生存時間, 部分患者可獲得腫瘤部分或完全緩解。系統(tǒng)抗腫瘤治療在不可手術切除的中晚期肝癌中的適應證主要為: ①CNLC Ⅲa、 Ⅲb期肝癌患者; ②不適合手術切除或TACE治療的CNLC Ⅱb期肝癌患者; ③TACE治療抵抗或TACE治療失敗的肝癌患者。
4. 5. 1 一線系統(tǒng)抗腫瘤治療
(1) 阿替利珠單克隆抗體聯(lián)合貝伐珠單克隆抗體:阿替利珠單克隆抗體聯(lián)合貝伐珠單克隆抗體被批準用于既往未接受過全身系統(tǒng)性治療的不可切除肝癌患者(證據(jù)等級1, 推薦A)。IMbrave150全球多中心Ⅲ期研究[373-374] 結果顯示, 阿替利珠單克隆抗體聯(lián)合貝伐珠單克隆抗體組的中位生存時間和PFS較索拉非尼組均有明顯延長, 死亡風險降低34%, 疾病進展風險降低35%。對于中國亞群人群, 聯(lián)合治療組患者也有明顯的臨床獲益, 與索拉非尼相比死亡風險降低47%, 疾病進展風險降低40%。并且聯(lián)合治療延遲了患者報告的中位生命質量惡化時間。常見的不良反應有高血壓、 蛋白尿、 肝功能異常、 腹瀉以及食欲下降等。
(2) 信迪利單克隆抗體聯(lián)合貝伐珠單克隆抗體類似物: 信迪利單克隆抗體聯(lián)合貝伐珠單克隆抗體類似物已在我國被批準用于既往未接受過系統(tǒng)抗腫瘤治療的不可切除或轉移性肝癌的一線治療 (證據(jù)等級1, 推薦A)。ORIENT-32全國多中心Ⅲ期研究[375] 結果顯示, 信迪利單克隆抗體聯(lián)合貝伐珠單克隆抗體類似物療效顯著優(yōu)于索拉非尼組, 與索拉非尼組相比, 聯(lián)合治療組死亡風險下降43%, 疾病進展風險下降44%。聯(lián)合方案安全性較好, 聯(lián)合治療組最常見的不良反應為蛋白尿, 血小板減少、 谷草轉氨酶升高、 高血壓和甲狀腺功能減退等。
(3) 甲磺酸阿帕替尼聯(lián)合卡瑞利珠單克隆抗體: 甲磺酸阿帕替尼聯(lián)合卡瑞利珠單克隆抗體在我國被批準用于不可切除或轉移性肝癌患者的一線治療 (證據(jù)等級1, 推薦A)。CARES-310國際多中心Ⅲ期研究[376]結果顯示, 甲磺酸阿帕替尼聯(lián)合卡瑞利珠單克隆抗體組與索拉非尼單藥組相比, 聯(lián)合治療組死亡風險降低38%, 疾病進展風險下降48%。聯(lián)合治療組≥3級不良事件主要是高血壓、 手足綜合征和氨基轉移酶升高。
(4) 多納非尼: 多納非尼在我國已被批準用于既往未接受過全身系統(tǒng)性抗腫瘤治療的不可切除肝癌患者 (證據(jù)等級1, 推薦A)。與索拉非尼相比, 多納非尼能夠明顯延長晚期肝癌的中位生存時間, 死亡風險下降17%; 多納非尼和索拉非尼兩組的中位PFS相似, 但多納非尼組具有良好的安全性和耐受性[377] 。最常發(fā)生的不良反應為手足皮膚反應、 谷草轉氨酶升高、 總膽紅素升高、 血小板降低和腹瀉等。
(5) 侖伐替尼: 侖伐替尼適用于不可切除的肝功能Child-Pugh A級的晚期肝癌患者 (證據(jù)等級1, 推薦A)。臨床Ⅲ期對照研究[378] 顯示, 其總體生存期非劣于索拉非尼, 研究達到非劣效終點 (風險比為0. 92, 95%置信區(qū)間為0. 79~1. 06)。侖伐替尼組中位PFS顯著優(yōu)于索拉非尼組, 疾病進展風險下降34%, ORR也高于索拉非尼。常見不良反應為高血壓、 蛋白尿、 腹瀉、 食欲下降、 疲勞、手足綜合征以及甲狀腺功能減退等。
(6) 替雷利珠單克隆抗體: 替雷利珠單克隆抗體在我國被批準一線治療不可切除或轉移性肝癌患者 (證據(jù)等級1, 推薦A)。RATIONALE-301全球多中心Ⅲ期研究[379] 結果顯示, 與索拉非尼相比, 達到了預設的主要研究終點, OS為非劣效性 (風險比為0. 85, 95%置信區(qū)間為0. 71~1. 02), 死亡風險降低了15%。常見不良反應為谷草轉氨酶升高、 谷丙轉氨酶升高和總膽紅素升高。
(7) 索拉非尼: 索拉非尼是第一個被批準用于肝癌系統(tǒng)抗腫瘤治療的分子靶向藥物。多項臨床研究[380-381]表明, 索拉非尼對于不同國家地區(qū)、 不同肝病背景的晚期肝癌患者都具有一定的生存獲益 (證據(jù)等級1, 推薦A)。索拉非尼可以用于肝功能Child-Pugh A/B級的患者, 但是相對于肝功能Child-Pugh B級, Child-Pugh A級的患者生存獲益比較明顯[382] 。治療過程中應定期評估療效和監(jiān)測毒性。常見的不良反應為腹瀉、 手足綜合征、 皮疹、 高血壓、 納差以及乏力等, 一般發(fā)生在治療開始后的2~6周內。治療過程中需要密切監(jiān)測血壓, 定期檢查肝腎功能、 HBV DNA、 血常規(guī)、 凝血功能以及尿蛋白等。在治療過程中, 還需要注意心肌缺血風險, 特別高齡患者應給予必要的監(jiān)測和相關檢查。
(8) 系統(tǒng)化療: FOLFOX4方案在我國被批準用于一線治療不適合手術切除或局部治療的局部晚期和轉移性肝癌[383-384] (證據(jù)等級1, 推薦A)。另外, 三氧化二砷對中晚期肝癌具有一定的姑息治療作用[385] (證據(jù)等級3, 推薦C), 在臨床應用時應注意監(jiān)測和防止肝腎毒性。
(9) 其他一線系統(tǒng)抗腫瘤治療進展: 雙免疫聯(lián)合治療在不可手術切除的中晚期肝癌一線治療領域也取得了成功。全球Ⅲ期臨床試驗HIMALAYA研究[386] 結果顯示,與索拉非尼對比, 程序性死亡受體配體1抑制劑度伐利尤單克隆抗體聯(lián)合細胞毒性T淋巴細胞相關抗原4抑制劑替西木單克隆抗體 (STRIDE方案: 單次給藥300 mg替西木單克隆抗體+度伐利尤單克隆抗體1 500 mg, 每4周1次常規(guī)間隔給藥) 具有較好的臨床療效和可控的安全性, 降低死亡風險22%。STRIDE方案使得亞洲 (除日本以外) 患者死亡風險降低了29%, HBV陽性患者的死亡風險降低了34%。STRIDE方案被美國FDA、 歐盟和日本批準用于治療不可切除的肝癌患者。但該方案用于不能切除肝癌的一線治療在我國尚未得到批準。
此外, 免疫檢查點抑制劑單藥在肝癌一線治療中也獲得了一定的進展。如HIMALAYA研究[386] 中, 度伐利尤單克隆抗體與索拉非尼對比用于晚期肝癌一線治療,度伐利尤單克隆抗體達到了預設的非劣效終點, 死亡風險降低了14%。目前, 多項免疫檢查點抑制劑/雙免疫聯(lián)合抗血管生成藥物[387] 、 免疫檢查點抑制劑聯(lián)合化療、 多免疫檢查點抑制劑聯(lián)合等一線治療不可切除肝癌的臨床研究正在進行中, 結果值得期待。
4. 5. 2 二線系統(tǒng)抗腫瘤治療
(1) 瑞戈非尼: 瑞戈非尼被批準用于既往接受過索拉非尼治療的肝癌患者 (證據(jù)等級1, 推薦A)。國際多中心Ⅲ期RESORCE研究[388] 評估了瑞戈非尼用于索拉非尼治療后出現(xiàn)進展的肝癌患者的療效和安全性。其結果顯示, 與安慰劑相比, 瑞戈非尼組患者死亡風險顯著降低37%, 疾病進展風險下降54%。常見不良反應為高血壓、 手足皮膚反應、 乏力及腹瀉等。其不良反應與索拉非尼類似, 因此, 不適合用于那些對索拉非尼不能耐受的患者。
(2) 阿帕替尼: 甲磺酸阿帕替尼是我國自主研發(fā)的小分子靶向新藥, 已被批準單藥用于既往接受過至少一線系統(tǒng)性抗腫瘤治療后失敗或不可耐受的晚期肝癌患者 (證據(jù)等級1, 推薦A)。阿帕替尼二線治療中國晚期肝癌的Ⅲ期臨床研究[389] 結果表明, 與安慰劑相比, 阿帕替尼顯著延長二線或以上晚期肝癌患者的中位生存時間, 死亡風險降低21. 5%, 疾病進展風險下降52. 9%。常見不良反應是高血壓、 蛋白尿、 白細胞減少癥以及血小板減少癥等。在使用過程中, 應密切隨訪患者的不良反應, 需要根據(jù)患者的耐受性給予必要的劑量調整。
(3) 雷莫西尤單克隆抗體: 雷莫西尤單克隆抗體被批準用于既往接受過索拉非尼治療且AFP≥400 ng/mL的肝癌患者的治療 (證據(jù)等級1, 推薦A)。REACH-2研究[390]結果顯示, 在既往索拉非尼治療失敗, AFP≥400 ng/mL的晚期肝癌患者中, 與安慰劑相比, 雷莫西尤單克隆抗體顯著改善患者的OS和PFS, 死亡風險降低29. 0%, 疾病進展風險下降54. 8%。REACH-2 China Ⅲ期擴展研究[391]結果提示, 與安慰劑相比, 雷莫西尤單克隆抗體在既往接受過索拉非尼治療且AFP≥400 ng/mL的中國肝癌患者中, 死亡風險降低14. 6%, 疾病進展風險降低51. 2%。常見不良反應為疲勞、 外周水腫、 高血壓和食欲下降。
(4) 帕博利珠單克隆抗體: 帕博利珠單克隆抗體在我國批準單藥用于治療既往接受過索拉非尼或含奧沙利鉑化療的肝癌患者 (證據(jù)等級1, 推薦A)。KEYNOTE-394研究[392] 評估帕博利珠單克隆抗體或者安慰劑聯(lián)合最佳支持治療對此前接受索拉非尼或奧沙利鉑化療的亞洲晚期肝癌患者的療效, 其中80%的患者來自中國。結果顯示, 帕博利珠單克隆抗體組與安慰劑組相比, 死亡風險降低21%, 疾病進展風險降低26%。常見的不良反應為谷草轉氨酶/谷丙轉氨酶升高、 皮疹、 瘙癢和血膽紅素增高。
(5) 卡瑞利珠單克隆抗體: 卡瑞利珠單克隆抗體已被批準用于既往接受過索拉非尼治療和/或含奧沙利鉑系統(tǒng)化療的晚期肝癌患者的治療 (證據(jù)等級3, 推薦B)。卡瑞利珠單克隆抗體在既往系統(tǒng)抗腫瘤治療過的中國肝癌的Ⅱ期臨床研究[393] 結果顯示, ORR為14. 7%, 6個月生存率為74. 4%, 12個月生存率為55. 9%。常見的不良反應是反應性毛細血管增生癥、 谷草轉氨酶升高、 谷丙轉氨酶升高、 甲狀腺功能減退和乏力等。多項臨床研究[394-395] 表明, 卡瑞利珠單克隆抗體和阿帕替尼聯(lián)合應用后, 反應性毛細血管增生癥的發(fā)生率明顯下降。
(6) 替雷利珠單克隆抗體: 替雷利珠單克隆抗體被批準用于既往接受過索拉非尼或侖伐替尼或含奧沙利鉑全身化療的晚期肝癌患者的治療 (證據(jù)等級3, 推薦B)。一項全球、 多中心旨在評估替雷利珠單克隆抗體用于治療既往接受過至少一種全身治療的不可切除的肝癌的療效和安全性的Ⅱ期研究 (RATIONALE-208) [396] 結果顯示, 中位PFS 2. 7個月, 中位生存時間13. 2個月。總人群的ORR為13%。安全性良好, 主要不良反應為谷草轉氨酶升高、 谷丙轉氨酶升高、 無力、 瘙癢和甲狀腺功能減退等。
(7) 其他二線系統(tǒng)抗腫瘤治療方案: 美國FDA批準納武利尤單克隆抗體聯(lián)合伊匹木單克隆抗體用于既往索拉非尼治療后進展或無法耐受索拉非尼的肝癌患者[397] , 卡博替尼用于一線系統(tǒng)抗腫瘤治療后進展的肝癌患者[398] 。免疫檢查點抑制劑治療與靶向藥物、 化療藥物、 局部治療等的聯(lián)合方案, 以及雙靶點免疫檢查點抑制劑 (程序性死亡受體1/細胞毒性T淋巴細胞相關抗原4雙抗、 程序性死亡受體1/血管內皮生長因子雙抗) 用于肝癌的二線治療的研究也在不斷地探索之中。
4. 5. 3 系統(tǒng)抗腫瘤治療的選擇 鑒于IMbrave150、 ORIENT-32和CARES-310研究結果顯示, 肝癌一線治療中阿替利珠單克隆抗體聯(lián)合貝伐珠單克隆抗體、 信迪利單克隆抗體聯(lián)合貝伐珠單克隆抗體類似物和甲磺酸阿帕替尼聯(lián)合卡瑞利珠單克隆抗體近期及遠期療效均優(yōu)于索拉非尼單藥治療, 可作為一線治療的優(yōu)先選擇。2023年更新的AASLD/NCCN/JSH等肝癌指南和共識[399-401] 對系統(tǒng)抗腫瘤治療一線方案均優(yōu)先推薦阿替利珠單克隆抗體聯(lián)合貝伐珠單克隆抗體或度伐利尤單克隆抗體聯(lián)合替西木單克隆抗體組合 (STRIDE方案)。STRIDE方案在歐盟、 美國及日本批準用于肝癌的一線治療, 其優(yōu)勢是不增加門靜脈高壓導致的出血風險。但該方案用于不能切除肝癌的一線治療在我國尚未獲得批準。
由于貝伐珠單克隆抗體有導致出血的風險, 建議使用阿替利珠單克隆抗體聯(lián)合貝伐珠單克隆抗體或信迪利單克隆抗體聯(lián)合貝伐珠單克隆抗體類似物治療前接受胃鏡檢查, 評估高危靜脈曲張或其他胃腸道出血風險, 并依據(jù)相關指南進行治療。對于最近6個月內發(fā)生胃腸道出血和內鏡檢查顯示高危出血的患者, 貝伐珠單克隆抗體治療前充分治療食管胃底靜脈曲張, 或選用其他治療方案。系統(tǒng)抗腫瘤治療對于中重度肝功能不全患者 (Child-Pugh評分7以上) 的研究數(shù)據(jù)有限, 此類患者需在醫(yī)師指導下謹慎使用, 并嚴密監(jiān)測肝功能。
目前二線治療藥物的適應證獲批是基于針對一線索拉非尼或系統(tǒng)化療失敗后與安慰劑對照的Ⅲ期臨床研究。對于一線接受免疫聯(lián)合方案、 免疫單藥或酪氨酸激酶抑制劑單藥治療的患者, 二線治療方案國內外目前尚未提供高級別循證醫(yī)學證據(jù)。可根據(jù)疾病進展情況及一線治療的具體方案, 選擇批準的二線治療藥物, 也可選擇未曾使用過的一線治療藥物。
4. 5. 4 系統(tǒng)抗腫瘤治療的療效評價 對于采用系統(tǒng)抗腫瘤治療的患者, 目前大多采用RECIST 1. 1標準進行療效評價。對于接受抗血管分子靶向治療的患者, 可以聯(lián)合應用mRECIST標準。對于接受免疫檢查點抑制劑治療的患者, 也可以應用iRECIST標準[402] 。
4. 5. 5 中醫(yī)傳統(tǒng)方藥治療
在病證辨治中西醫(yī)結合臨床醫(yī)學體系[403] 指導下,針對肝癌早期、 中晚期、 終末期等不同階段, 采取病證結合臨床診療模式[404] , 以肝癌的核心病機 “癌毒盛衰” 為著眼點, 綜合運用中國醫(yī)藥學方藥、 現(xiàn)代中藥制劑以及中醫(yī)藥特色診療技術, 與現(xiàn)代醫(yī)學技術互補協(xié)作, 形成系統(tǒng)規(guī)范方案, 以期達到協(xié)同抗癌、 提高治療耐受性、 減少術后并發(fā)癥、 預防復發(fā)轉移、 減輕不良反應及延長生存期的作用。
(1) 中國醫(yī)藥學方藥分階段治療
①早期肝癌 (CNLC Ⅰa~Ⅱa期)
治療原則: 應著眼于正氣受損、 癌毒未凈, 重點在于預防治療術后復發(fā)轉移, 包括維護肝功能儲備、 增強機體免疫力、 提高手術成功率、 減少術后并發(fā)癥。此階段中醫(yī)辨證常見以下兩種證型:
A. 肝氣郁結證
辨識要點: 脅肋脹痛, 痛無定處, 脘腹脹滿, 胸悶、 善太息, 急躁易怒, 舌質淡紅, 苔薄白, 脈弦。
治療理法: 舒肝解郁, 理氣和胃。
治療推薦:《景岳全書》 柴胡舒肝散加減: 柴胡、 陳皮、 白芍、 枳殼、 香附、 川芎、 郁金、 八月札、 石見穿、 土茯苓、 雞內金、 甘草等, 常規(guī)劑量, 每日2次水煎送服治法。
B. 氣滯血瘀證
辨識要點: 癥見上腹腫塊, 質硬, 有結節(jié)感, 疼痛固定拒按, 或胸脅掣痛, 入夜尤甚, 或見肝掌、 蜘蛛痣和腹壁青筋暴露, 甚則肌膚甲錯, 舌邊瘀暗或暗紅, 舌苔薄白或薄黃, 脈弦細或細澀無力。兼有郁熱者多伴煩熱口苦, 大便干結, 小便黃或短赤。
治療理法: 活血化瘀, 軟堅散結。
推薦治療:《醫(yī)林改錯》 膈下逐瘀湯加減: 生地、 當歸、 赤芍、 川芎、 桃仁、 紅花、 五靈脂, 枳殼、 桔梗、 甘草、 柴胡、 玄參等, 常規(guī)劑量, 每日2次水煎送服。
②中晚期肝癌 (CNLC Ⅱb~Ⅲb期)
治療原則: 應著眼于癌毒內壅、 正氣未衰, 綜合運用中藥方劑, 有利于減少或緩解并發(fā)癥、 提高療效及生活質量。此階段中醫(yī)辨證常見以下兩種證型:
A. 肝郁牌虛證
辨識要點: 胸腹脹滿, 食后尤甚, 腫塊觸痛, 倦怠消瘦, 短氣乏力, 納少失眠, 口干不欲飲, 大便溏數(shù), 甚則腹水黃疸, 下肢浮腫, 舌質胖大, 苔白, 脈濡。
治療理法: 疏肝健脾, 理氣消癥。
推薦治療:《太平惠民合劑局方》 逍遙散加減。柴胡、 當歸、 白芍、 黨參、 白術、 茯苓、 薏苡仁、 半枝蓮、 七葉一枝花、 干蟾皮、 蜈蚣、 厚樸、 甘草等。
B. 濕熱毒蘊證
辨識要點: 右脅脹滿, 疼痛拒按, 發(fā)熱, 口苦或口臭,身黃目黃, 小便黃, 黃如橘色或煙灰, 腹水或胸腔積液, 惡心咽吐, 大便秘結或黏膩不爽, 舌質紅, 苔黃膩, 脈滑數(shù)。治療理法: 清熱利濕, 解毒消癥。
推薦治療:《傷寒論》 茵陳蒿湯合五苓散加減。茵陳蒿、 大黃、 梔子、 豬苓、 茯苓、 白術、 澤瀉、 虎杖、 白花蛇舌草、 八月札、 半枝蓮、 赤芍、 人工牛黃、 貓人參、 石見穿、 山慈菇、 雞內金等。
③終末期肝癌 (CNLC Ⅳ期)
治療原則: 應著眼于癌毒熾盛、 正氣虧虛, 治療以扶正為主, 治療目標在于發(fā)揮整體調節(jié)優(yōu)勢、 減輕癥狀、 提高生活質量、 適當延長生存期。終末期肝癌常見肝腎不足、 氣陰兩虧等證候表現(xiàn)。
辨識要點: 疲乏無力、 納呆厭食, 常伴腹脹肢腫, 腹大, 青筋暴露, 四肢消瘦, 短氣喘促, 顴紅口干, 潮熱或手足心熱, 煩躁不眠, 便秘, 甚則神昏譫語, 齒衄鼻衄, 或二便下血, 舌紅少苔, 脈細數(shù)無力。
治療理法: 益氣養(yǎng)陰、 扶正消癥。
治療推薦:《柳州醫(yī)話》 一貫煎加減; 生地黃、 麥冬、沙參、 枸杞子、 五味子、 黃芪、 當歸、 黨參、 白術、 茯苓、 山茱萸、 西洋參、 八月札、 龜板、 鱉甲、 貓人參、 石見穿、 山慈菇、 雞內金等, 常規(guī)劑量, 每日2次水煎送服。
(2) 現(xiàn)代中藥制劑治療
阿可拉定 (淫羊藿素) 軟膠囊是一種從天然藥用植物暨傳統(tǒng)草本中藥淫羊藿中提取、 分離和純化獲得的單分子創(chuàng)新藥物, 具有抑制腫瘤生長、 調節(jié)免疫等多重作用[405] 。在我國已經(jīng)附條件批準用于不適合標準治療的晚期肝癌患者的治療, 具體的適應證: 不適合或拒絕接受標準治療, 且既往未接受過全身系統(tǒng)性治療的、 不可切除的肝癌患者, 同時患者外周血復合標志物滿足以下檢測指標的至少2項: AFP≥400 ng/mL; TNF-α<2. 5 pg/mL;IFN-γ≥7. 0 pg/mL。
除阿可拉定軟膠囊外, 我國國家藥品監(jiān)督管理局已經(jīng)批準了若干種現(xiàn)代中藥制劑用于治療晚期肝癌, 如槐耳顆粒、 欖香烯注射液、 華蟾素、 康萊特注射液、 康艾注射液、 艾迪注射液、 肝復樂膠囊、 金龍膠囊、 鴉膽子油軟膠囊、 復方斑蝥膠囊和慈丹膠囊[406-413] 等。另外, 槐耳顆粒[197] 、 華蟾素注射液聯(lián)合解毒顆粒[414] 、 慈丹膠囊聯(lián)合TACE[413] 可以用于肝癌手術切除后的輔助治療。
(3) 中醫(yī)藥現(xiàn)代特色診療技術
①針灸治療
根據(jù)病情及臨床實際可以選擇應用體針、 頭針、 電針、 耳針、 腕踝針、 眼針、 灸法、 穴位埋線、 穴位敷貼、 耳穴壓豆和拔罐等方法。
針灸治療的取穴以肝俞、 足三里為主穴, 配以陽陵泉、 期門、 章門、 三陰交等; 穴位敷貼以章門、 期門、 肝俞、內關、 公孫主穴, 疼痛者配外關、 足三里、 陽陵泉; 腹水配氣海、 三陰交、 陰陵泉等。
②其他治療
根據(jù)病情酌情使用活血化瘀、 清熱解毒等中藥、 中成藥, 進行外敷治療、 中藥泡洗、 中藥熏洗等。
4. 5. 6 抗病毒治療及其他保肝治療 對于所有確診肝癌患者, 應常規(guī)篩查乙型肝炎表面抗原 (hepatitis B surface antigen, HBsAg)、 乙型肝炎表面抗體(hepatitis B surface antibody, HBsAb)和乙型肝炎核心抗體(hepatitis B core antibody, HBcAb)。對于HBsAg陽性或HBcAb陽性患者,應進一步行血清HBV DNA定量檢測。HBV相關肝癌患者只要HBsAg陽性, 無論 HBV DNA是否可檢測出, 均建議給予一線抗病毒治療[415] 。對既往HBV感染, 即HBcAb陽性、 HBsAg陰性的肝癌患者, 應密切監(jiān)測HBsAg、 HBV DNA、 谷丙轉氨酶指標變化[416] 。HBV相關肝癌患者推薦使用一線抗病毒藥物恩替卡韋、 替諾福韋酯、 丙酚替諾福韋或艾米替諾福韋 (證據(jù)等級1, 推薦A) [415-416] 。合并HBV感染的肝癌患者, 口服核苷 (酸) 類似物抗病毒治療應始終貫穿治療的全過程。接受核苷 (酸) 類似物抗病毒治療的患者, 每3~6個月檢測病毒學、 血生化等指標; 未接受抗病毒治療的患者, 每3~6個月檢測HBV DNA、 HBsAg及谷丙轉氨酶等指標。推薦使用高靈敏血清HBV DNA檢測, 及時發(fā)現(xiàn)低病毒血癥患者, 調整抗病毒治療藥物, 最大限度抑制病毒復制。對于HCV相關肝癌, HCV RNA陽性均建議采用直接抗病毒藥物行抗病毒治療 (證據(jù)等級1, 推薦A) [416-417] 。抗病毒治療終點為治療結束后12周, 采用敏感檢測方法檢測不到血清或血漿中HCV RNA。
肝癌患者在自然病程中或治療過程中可能會伴隨肝功能異常, 應及時適當?shù)厥褂镁哂锌寡住?利膽、 抗氧化、 解毒和肝細胞膜修復保護作用的藥物, 如異甘草酸鎂注射液、 甘草酸二銨、 復方甘草酸苷、 腺苷蛋氨酸、 熊去氧膽酸、 雙環(huán)醇、 水飛薊素、 還原型谷胱甘肽、 多烯磷脂酰膽堿和烏司他丁[418] 等。
4. 5. 7 對癥支持治療 肝癌患者往往合并有肝硬化、脾臟腫大, 并因抗腫瘤治療等導致一系或多系血細胞減少, 可考慮給予藥物治療或血制品輸注。中性粒細胞減少患者可酌情給予粒細胞集落刺激因子(granulocyte colony stimulating factor, G-CSF, 包括PEG-rhG-CSF和rhG-CSF) [419] 。血紅蛋白<80 g/L的患者, 可根據(jù)貧血的病因給予鐵劑、 葉酸、 維生素B12和促紅細胞生成素等治療。慢性肝病引起血小板減少的患者根據(jù)病情需要可以使用重組人血小板生成素或血小板生成素受體激動劑 (如阿伐曲泊帕、 蘆曲泊帕) 等提升血小板計數(shù)[420] 。
對于終末期肝癌患者, 應給予最佳支持治療, 包括積極鎮(zhèn)痛、 糾正低白蛋白血癥、 加強營養(yǎng)支持, 控制合并糖尿病患者的血糖水平, 處理腹水、 黃疸、 肝性腦病、 消化道出血及肝腎綜合征等并發(fā)癥。針對有癥狀的骨轉移患者, 可以使用雙膦酸鹽類藥物或地舒單抗。另外,適度的康復運動可以增強患者的免疫功能。同時, 要重視患者的心理干預, 增強患者戰(zhàn)勝疾病的信心, 把消極心理轉化為積極心理, 通過舒緩療護讓其享有安全感、舒適感, 而減少抑郁與焦慮。
要點論述:
(1) 系統(tǒng)抗腫瘤治療在不可手術切除的中晚期肝癌中的適應證主要為: CNLC Ⅲa、 Ⅲb期肝癌患者, 不適合手術切除或TACE治療的CNLC Ⅱb期肝癌患者, TACE治療抵抗或TACE治療失敗的肝癌患者。
(2) 一線系統(tǒng)抗腫瘤治療方案可以優(yōu)先選擇阿替利珠單克隆抗體聯(lián)合貝伐珠單克隆抗體、 信迪利單克隆抗體聯(lián)合貝伐珠單克隆抗體類似物或甲磺酸阿帕替尼聯(lián)合卡瑞利珠單克隆抗體。多納非尼、 侖伐替尼、 替雷利珠單克隆抗體、 索拉非尼或者FOLFOX4方案的系統(tǒng)化療仍然用于肝癌的一線治療。
(3) 二線系統(tǒng)抗腫瘤治療方案, 在我國可以選擇瑞戈非尼、 阿帕替尼、 帕博利珠單克隆抗體、 雷莫西尤單克隆抗體 (血清AFP水平≥400 ?g/L)、 卡瑞利珠單克隆抗體和替雷利珠單克隆抗體。對于一線接受免疫聯(lián)合方案、免疫單藥或酪氨酸激酶抑制劑單藥治療的患者, 二線治療方案選擇可根據(jù)疾病進展方式和具體一線方案不同,選擇批準的二線治療藥物, 也可選擇未曾使用過的一線治療的藥物。
(4) 可根據(jù)病情選擇中醫(yī)傳統(tǒng)方藥治療。除阿可拉定軟膠囊外, 我國已經(jīng)批準了若干種現(xiàn)代中藥制劑用于治療晚期肝癌。另外, 槐耳顆粒可以用于肝癌手術切除后的輔助治療。
(5) 在抗腫瘤治療的同時, 抗病毒治療應始終貫穿治療全過程。
4. 6 肝癌自發(fā)破裂的治療 肝癌自發(fā)破裂是肝癌潛在的致死性并發(fā)癥, 單純保守治療在院病死率極高, 但并非影響患者長期生存的決定因素, 獲得手術切除可以使部分患者具有明顯的生存獲益[421] 。因此, 在最初搶救成功后, 應充分評估患者血流動力學、 肝功能、 全身情況以及腫瘤是否可切除, 制訂后續(xù)個體化的治療方案[422-426] 。
(1) 對于肝腫瘤可切除、 肝臟儲備功能良好、 血流動力學穩(wěn)定的患者, 首選手術切除[427-428] (證據(jù)等級3, 推薦B)。
(2) 對于肝臟儲備功能差, 血流動力學不穩(wěn)定、 無手術條件的患者, 可以選擇TAE[429] (證據(jù)等級4, 推薦B)。
(3) 受急診條件限制, 肝功能及肝腫瘤情況無法充分評估, 可以先行TAE, 結合后續(xù)評估再選擇相應治療方案, 若能行二期手術切除可以獲得顯著的生存獲益[427] (證據(jù)等級3, 推薦B)。
(4) 肝癌自發(fā)破裂是手術后的高危復發(fā)因素, 術中應充分的沖洗腹腔; 術后輔助治療有助于延長生存[421, 430] ; 術后應加強監(jiān)測, 術后單純腹膜轉移的患者可以考慮行積極根治性切除[431] (證據(jù)等級3, 推薦C)。
要點論述:肝癌自發(fā)破裂是肝癌潛在的致死性并發(fā)癥, 應充分評估患者血流動力學、 肝功能、 全身情況以及腫瘤是否可切除, 制訂個體化的治療方案。
5 聲明
本指南的編撰工作獨立于任何贊助單位, 并且所有編寫人員都承諾編撰內容與是否受到資助無關。
《原發(fā)性肝癌診療指南 (2024年版)》 編寫專家委員會
名譽主任委員: 湯釗猷 ?劉允怡 ?鄭樹森 ?王學浩
陳孝平 ?董家鴻 ?竇科峰 ?滕皋軍
主任委員: 樊 ?嘉
執(zhí)行主任委員: 周 ?儉
副主任委員: ?秦叔逵 ?蔡秀軍 ?沈 ?鋒 ?蔡建強
李 ?強 ?王偉林 ?陳敏山 ?孫惠川 ?陸驪工 ?吳 ?泓
介入及局部治療學組組長: 滕皋軍
副組長: 韓國宏 ?顏志平 ?王茂強 ?劉瑞寶 ?郭金和
曾昭沖 ?梁 ?萍 ?邵國良
內科及系統(tǒng)治療組組長: 秦叔逵
副組長: 任正剛 ?侯金林 ?張艷橋 ?劉秀峰 ?潘宏銘
畢 ?鋒
外科學組組長: 周儉
副組長: 周偉平 ?劉連新 ?文天夫 ?匡 ?銘 ?張必翔
陶開山
影像學組組長: 曾蒙蘇
副組長: 梁長虹 ?陳 ?敏 ?嚴福華 ?徐輝雄 ?謝曉燕
居勝紅
病理學組組長: 叢文銘
副組長: 紀 ?元 ?云徑平 ?李增山
委員 (按姓氏拼音排序):
白雪莉 ?蔡定芳 ?陳衛(wèi)霞 ?陳亞進 ?陳擁軍 ?成文武
程樹群 ?代 ?智 ?戴朝六 ?高 ?強 ?郭榮平 ?郭文治
郭亞兵 ?花寶金 ?黃曉武 ?蔣涵羽 ?莢衛(wèi)東 ?李 ?秋
李 ?濤 ?李相成 ?李 ?汛 ?李亞明 ?李曄雄 ?梁 ?軍
梁 ?霄 ?凌昌全 ?劉 ?輝 ?劉 ?嶸 ?劉天舒 ?盧實春
呂國悅 ?毛一雷 ?孟志強 ?彭 ?濤 ?任偉新 ?施國明
石洪成 ?石 ?明 ?史穎弘 ?宋天強 ?譚 ?廣 ?王建華
王 ?葵 ?王 ?魯 ?王文濤 ?王曉穎 ?王 ?征 ?王志明
向邦德 ?夏 ?君 ?肖永勝 ?邢寶才 ?徐建明 ?徐 ?鈞
楊建勇 ?楊欣榮 ?楊業(yè)發(fā) ?楊云柯 ?姚小紅 ?尹震宇
袁振剛 ?曾永毅 ?曾 ?勇 ?張博恒 ?張雷達 ?張水軍
張 ?倜 ?張志偉 ?趙 ?明 ?趙永福 ?鄭紅剛 ?周樂杜
朱繼業(yè) ?朱康順
秘書長: 孫惠川
副秘書長: 王 ?征 ?史穎弘 ?劉 ?嶸 ?張 ?嵐
秘書組: 肖永勝 ?楊 ?春 ?吳志峰 ?丁振斌 ?朱小東
唐 ?政 ?黃曉勇 ?韓 ?紅

