槲皮素抑制自噬恢復LTA誘導的奶牛乳腺上皮細胞緊密連接功能


摘 要: 旨在探究槲皮素(quercetin)修復脂磷壁酸(lipoteichoic acid, LTA)誘導的奶牛乳腺上皮細胞(mammary alveolar cells-large T antigen, MAC-T)緊密連接損傷的作用機制。本試驗以MAC-T為研究對象,設置不同濃度的LTA組(0、0.1、1、10 μg·mL-1)、不同濃度的槲皮素組(0、5、10、20 μmol·L-1)、空白組,檢測不同濃度LTA和槲皮素對MAC-T細胞活力的影響。設置對照組(不做任何處理)、低、中、高濃度LTA組(0.1、1、10 μg·mL-1),篩選LTA最佳作用濃度;設置對照組(不做任何處理)、高濃度LTA+低濃度槲皮素(5 μmol·L-1)、高濃度LTA+中濃度槲皮素組(10 μmol·L-1)、高濃度LTA+高濃度槲皮素組(20 μmol·L-1),篩選槲皮素最佳作用濃度。在自噬與緊密連接關系的研究中,將細胞分為對照組(不做任何處理)、高濃度LTA組、高濃度LTA+中濃度槲皮素組、高濃度LTA+自噬抑制劑氯喹(chloroquine,CQ)組(50 μmol·L-1)。每組均進行3次重復,槲皮素與氯喹均在LTA作用前加入,即使用槲皮素和氯喹分別孵育細胞3 h后,再加入10 μg·mL-1 LTA繼續培養12 h,通過CCK-8法檢測不同濃度LTA和槲皮素對MAC-T活力的影響,利用Western blot和免疫熒光檢測細胞緊密連接蛋白(Occludin、ZO-1、Claudin-1)和自噬相關蛋白(Beclin-1、LC3、P62)的表達水平。結果顯示,中、高濃度LTA對MAC-T活力有顯著影響,但細胞活性維持在90%以上,不同濃度槲皮素對MAC-T活力均無顯著影響。此外,LTA誘導后的MAC-T中緊密連接蛋白表達降低,自噬水平升高;槲皮素作用MAC-T后,細胞緊密連接蛋白表達升高,自噬水平降低;自噬抑制劑CQ作用后,自噬水平被抑制,緊密連接蛋白表達升高。LTA可導致MAC-T自噬過度激活,破壞緊密連接功能,而槲皮素可通過抑制自噬恢復緊密連接功能。該研究結果為奶牛乳腺炎的治療提供了新的研究思路和理論依據。
關鍵詞: 槲皮素;奶牛乳腺上皮細胞;脂磷壁酸;自噬;緊密連接
中圖分類號: S823.91
文獻標志碼: A 文章編號: 0366-6964(2024)09-3887-10
Quercetin Inhibits Autophagy to Restore LTA-induced Tight Junction Function in Mammary
Alveolar Cells-large T Antigen
LI" Xiangchen, WANG" Linnan, YU" Zhengqing, ZHANG" Li, YANG" Chenchen, SONG" Liangli*
(College of Animal Science and Technology, Ningxia University, Yinchuan 750021," China)
Abstract:" The aim of this study was to investigate the mechanism of action of quercetin in repairing lipoteichoic acid (LTA)-induced tight junction damage in mammary alveolar cells-large T antigen (MAC-T) of dairy cows. MAC-T was used as the research object, and different concentrations of LTA group (0, 0.1, 1, 10 μg·mL-1), different concentrations of quercetin group (0, 5, 10, 20 μmol·L-1), and blank wells were set up to detect the effects of different concentrations of LTA and quercetin on the viability of MAC-T cells; A control group (without any treatment), low, medium and high LTA concentration groups (0.1, 1 and 10 μg·mL-1) were set up to screen for the optimal concentration of LTA action; A control group (without any treatment), a high concentration of LTA+low concentration of quercetin (5 μmol·L-1), a high concentration of LTA+medium concentration of quercetin group (10 μmol·L-1), and a high concentration of LTA+high concentration of quercetin group (20 μmol·L-1) were set up to screen for the optimal action concentration of quercetin. In the study of the relationship between autophagy and tight junctions, the cells were divided into a control group (without any treatment), a high-concentration LTA group, a high-concentration LTA+medium-concentration quercetin group, and a high-concentration LTA+autophagy inhibitor chloroquine (CQ) group (50 μmol·L-1). Each group was subjected to 3 replications, and both quercetin and chloroquine were added before the action of LTA, the cells were incubated with quercetin and chloroquine for 3 h respectively, and then 10 μg·mL-1 LTA was added to continue the incubation for 12 h. The effects of different concentrations of LTA and quercetin on the viability of MAC-T were detected by CCK-8 assay; the expression levels of cellular tight junction proteins (Occludin, ZO-1, Claudin-1) and autophagy-associated proteins (Beclin-1, LC3, P62) were detected by Western blot and immunofluorescence. The results showed that the MAC-T cell activity was maintained at 90% with the increase of LTA concentration, and 5-20 μmol·L-1 quercetin had no significant effect on MAC-T viability (Pgt;0.05), and the optimal action concentration was further screened by a follow-up experiment on the basis of CCK-8 results. The expression of tight junction proteins of MAC-T was reduced and the level of autophagy was elevated after LTA induction; the expression of tight junction proteins of the cells was elevated and the level of autophagy was reduced after the action of quercetin on MAC-T, the expression of tight junction proteins was elevated and the autophagy level was reduced after CQ treatment. LTA can lead to over-activation of MAC-T autophagy and disruption of tight junction function, whereas quercetin can restore tight junction function by inhibiting autophagy. The results of this study provide new research ideas and theoretical basis for the treatment of mastitis in dairy cows.
Key words: quercetin; mammary alveolar cells-large T antigen; lipoteichoic acid; autophagy; tight junction
*Corresponding author:SONG Liangli, E-mail: sll2019@nxu.edu.cn
奶牛乳腺炎是奶牛最常見的疾病之一,是由物理、化學或微生物等因素刺激奶牛乳腺所引發的一種炎癥反應[1],會造成奶牛泌乳機能受損,影響產奶量和乳制品質量,給奶產業造成巨大的經濟損失[2-3]。研究顯示,金黃色葡萄球菌是造成奶牛乳腺炎最廣泛的致病菌之一[4-6],其細胞壁毒力因子脂磷壁酸(lipoteichoic acid, LTA)是金黃色葡萄球菌最主要的致病成分,可引起乳腺上皮細胞損傷,嚴重破壞乳房的免疫活性屏障和血乳屏障[7-9]。乳腺上皮細胞間的緊密連接(tight junction, TJ)作為血乳屏障的結構基礎,其需要多種蛋白質的參與,其中ZO-1、Occludin和Claudin-1已被證實是維護上皮細胞完整性的重要物質[10-12]。大量研究表明,炎癥會引起皮膚、乳腺、腸道等多種器官TJ蛋白表達降低[13-16]。De Benedetto等[14]在對皮膚炎癥的研究中發現,炎癥會導致特異性皮炎患者皮膚中緊密連接Claudin-1蛋白的表達顯著下降;在LPS誘導的小鼠乳腺炎中,小鼠乳腺上皮細胞的TJ蛋白完整性降低[17];在腸道中的研究顯示,增強腸道上皮細胞緊密連接屏障,可以緩解腸道炎癥和腸上皮細胞的凋亡[18-19]。此外,更進一步研究發現,自噬激活可增強腸上皮細胞緊密連接屏障功能,減輕腸道炎癥[10-11,20-21]。然而,Deng等[22]對血腦屏障進行研究發現,過度自噬會破壞細胞緊密連接功能,導致腦水腫疾病的惡化。因此,為探明LTA對奶牛乳腺上皮細胞(mammary alveolar cells-large T antigen, MAC-T)緊密連接及自噬功能的作用,使用LTA對MAC-T進行誘導建立緊密連接功能損傷模型,建立該模型對研究奶牛乳腺炎的發病機制極其重要。
槲皮素(quercetin;3, 3′, 4′, 5, 7-五羥基黃酮)是一種黃酮類化合物,廣泛存在于各種水果、蔬菜、花卉及草藥中,具有多種生物學特性,如抗氧化、抗炎、抗纖維化、抗腫瘤、抗病毒等,因此具有很高的藥用價值[23-27]。據報道,槲皮素不僅能夠恢復腸炎癥性腸上皮細胞緊密連接蛋白的表達,而且能夠調控腸黏膜屏障的緊密連接蛋白和自噬,改善LPS誘導的十二指腸炎癥[28]。然而槲皮素是否能夠調控LTA誘導的MAC-T中緊密連接蛋白和自噬相關蛋白的表達,目前尚不可知。
因此,本試驗以LTA誘導的MAC-T緊密連接功能損傷模型為研究對象,探明槲皮素能否通過調控自噬恢復LTA誘導的MAC-T緊密連接功能。該研究結果將為奶牛乳腺炎的治療提供新的研究思路和理論依據。
1 材料與方法
1.1 主要試劑
MAC-T由實驗室凍存;LTA(默克化工技術有限公司,貨號:L3140);胎牛血清(Gibico,貨號:16000-044);胰酶、雙抗、DMEM/F-12培養液、β-actin、FITC標記的山羊抗兔IgG(武漢賽維爾生物科技有限公司,貨號:G4010-100ML、G4003-100ML、G4612-500ML、GB15003-100、GB22303);RIPA裂解液(白鯊生物,貨號:BL504A);槲皮素(上海麥克林生化科技股份有限公司,貨號:Q817162-10g);Occludin抗體、ZO-1抗體、Claudin-1抗體、Beclin-1抗體、LC3抗體、P62抗體(Proteintech,貨號:27260-1-AP、21773-1-AP、28674-1-AP、111306-1-AP、14600-1-AP、18420-1-AP);Rabbit Anti-Goat IgG Hamp;L/HRP antibody(北京博奧森生物技術有限公司,bs-0294R-HRP)。
1.2 細胞培養
培養瓶中提前加入含10 mL·L-1胎牛血清、1 mL·L-1青霉素-鏈霉素雙抗的DMEM培養液,將液氮凍存的MAC-T細胞解凍后轉移至培養瓶中,將培養瓶中的細胞混合均勻后置于50 mL·L-1 CO2、37℃、飽和濕度的細胞培養箱中進行培養。
1.3 CCK-8法檢測細胞活力
待細胞生長貼壁至80%時,使用胰酶消化收集細胞,取部分細胞懸液稀釋至1×105·mL-1,傳至96孔板中,置于50 mL·L-1 CO2、37℃、飽和濕度的細胞培養箱中培養12 h后,使用不同濃度的LTA(0、0.1、1、10 μg·mL-1)、不同濃度的槲皮素(0、5、10、20 μmol·L-1)處理,均處理12 h后進行檢測。每組重復3孔,并設置空白孔。在測量前更換培養液,去除藥物對OD值的影響,每孔加入10 μL CCK-8溶液孵育2 h后使用酶標儀檢測450 nm波長處各孔吸光度,計算細胞活力。
1.4 細胞處理
胰酶消化收集細胞,以1×106·mL-1密度接種于6孔板中培養,待孔內細胞生長密度達到80%時,更換新鮮培養液。LTA 濃度篩選時,將細胞分為4組,對照組(不對細胞做任何處理)、低濃度LTA組(0.1 μg·mL-1)、中濃度LTA組(1 μg·mL-1)、高濃度LTA組(10 μg·mL-1);槲皮素濃度篩選時,將細胞分為4組,對照組(不對細胞做任何處理)、高濃度LTA+低濃度槲皮素組(10 μg·mL-1 LTA+5 μmol·L-1槲皮素)、高濃度LTA+中濃度槲皮素組(10 μg·mL-1 LTA+10 μmol·L-1槲皮素)、高濃度LTA+高濃度槲皮素組(10 μg·mL-1 LTA+20 μmol·L-1槲皮素);在自噬抑制研究中,將細胞分為4組,對照組(不對細胞做任何處理)、高濃度LTA組、高濃度LTA+中濃度槲皮素組、高濃度LTA+自噬抑制劑氯喹(chloroquine,CQ)組(10 μg·mL-1 LTA+50 μmol·L-1 CQ)。槲皮素組與氯喹均在LTA對細胞作用前加入,即使用槲皮素和氯喹分別孵育細胞3 h后,再加入10 μg·mL-1 LTA繼續培養12 h。
1.5 Western blot檢測自噬以及緊密連接相關蛋白的表達
6孔板每孔加入200 μL RIPA,冰上裂解30 min,使用BCA試劑盒調整蛋白濃度一致,加入5× Loading Buffer,95℃變性20 min,結束后放入-20℃保存。使用SDS-PAGE凝膠電泳(13.5%)分離蛋白,濕轉至PVDF膜,5%脫脂牛奶封閉90 min后使用Occludin(1∶2 000稀釋)、ZO-1(1∶2 000稀釋)、Claudin-1(1∶1 000稀釋)、Beclin-1(1∶2 000稀釋)、LC3(1∶1 000稀釋)、P62(1∶2 000稀釋)、β-actin(1∶2 000稀釋)兔多克隆抗體4℃孵育過夜,TBST清洗3次,每次5 min,加入HRP標記羊抗兔IgG二抗(1∶12 000稀釋)孵育1.5 h,TBST清洗3次,每次5 min,清洗結束使用化學發光儀曝光并采集圖像保存顯色結果,使用Image J軟件對結果進行灰度分析,使用β-actin作為參照,計算Occludin、ZO-1、Claudin-1、Beclin-1、LC3、P62蛋白的相對表達量。
1.6 免疫熒光檢測自噬及緊密連接相關蛋白的表達
藥物孵育完成后吸去培養液,PBS清洗3次,每次5 min。用提前預冷的4 mL·L-1多聚甲醛在4℃冰箱固定20 min,室溫復溫5 min后,棄掉廢液,PBS清洗。使用0.5 mL·L-1 Triton-100室溫孵育20~25 min,PBS清洗。5 mL·L-1山羊血清常溫封閉1~1.5 h后,PBS清洗。滴加Occludin(1∶500稀釋)、ZO-1(1∶2 000稀釋)、Claudin-1(1∶400稀釋)、LC3(1∶500稀釋)一抗工作液,4℃孵育過夜。次日將樣品室溫復溫30 min后,回收一抗,PBS清洗。在暗室中加入FITC標記熒光二抗(1∶200稀釋),置于不透光的濕盒中37℃孵育1 h后,在暗室中用PBS清洗。暗室中滴加DAPI孵育10 min后,PBS清洗,滴加甘油后封片,于暗室中觀察染色結果并拍照。
1.7 數據處理
使用GraphPad Prism 9.5.0軟件進行作圖和數據分析。每個試驗重復3次,結果以“平均值±標準差”表示。多組比較采用單因素方差(One-way ANOVA)分析,組間比較采用最小顯著差異(least significant difference,LSD)t檢驗分析。Plt;0.05表示差異顯著,Plt;0.01表示差異極顯著。
2 結 果
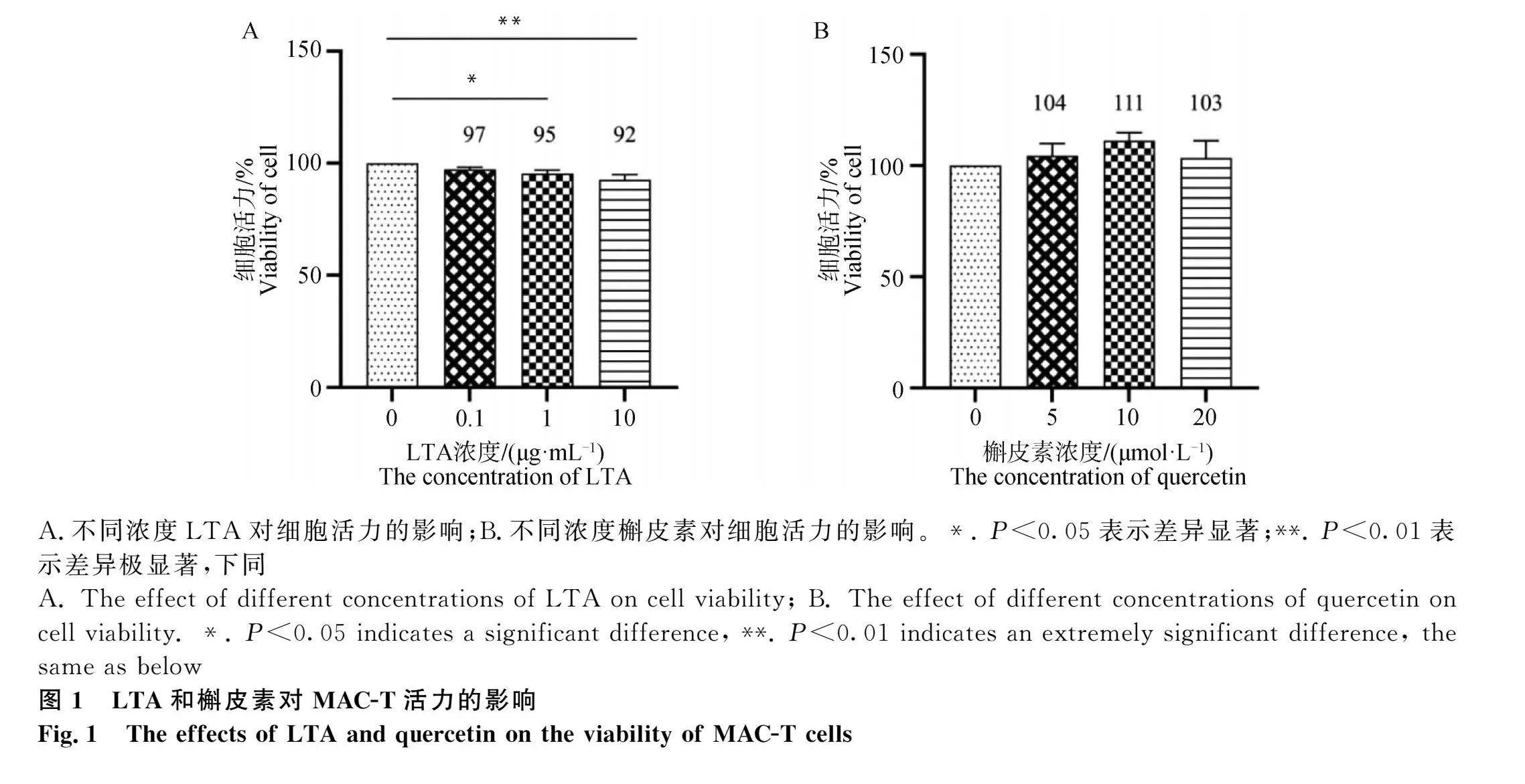
2.1 LTA和槲皮素對MAC-T活力的影響
利用CCK-8法檢測LTA和槲皮素處理后的MAC-T細胞活力,如圖1所示:LTA與槲皮素處理12 h后,與對照組相比,LTA對細胞活力的影響具有劑量依賴性,隨著LTA濃度的增加,MAC-T細胞活性降低,當LTA濃度達到10 μg·L-1時,細胞活力維持在90%以上,對細胞有一定的抑制作用而不會使細胞完全失活;5~20 μmol·L-1槲皮素對MAC-T細胞活力均無顯著影響(Pgt;0.05),證實槲皮素藥物劑量范圍對細胞無毒性作用(圖1A、圖1B)。
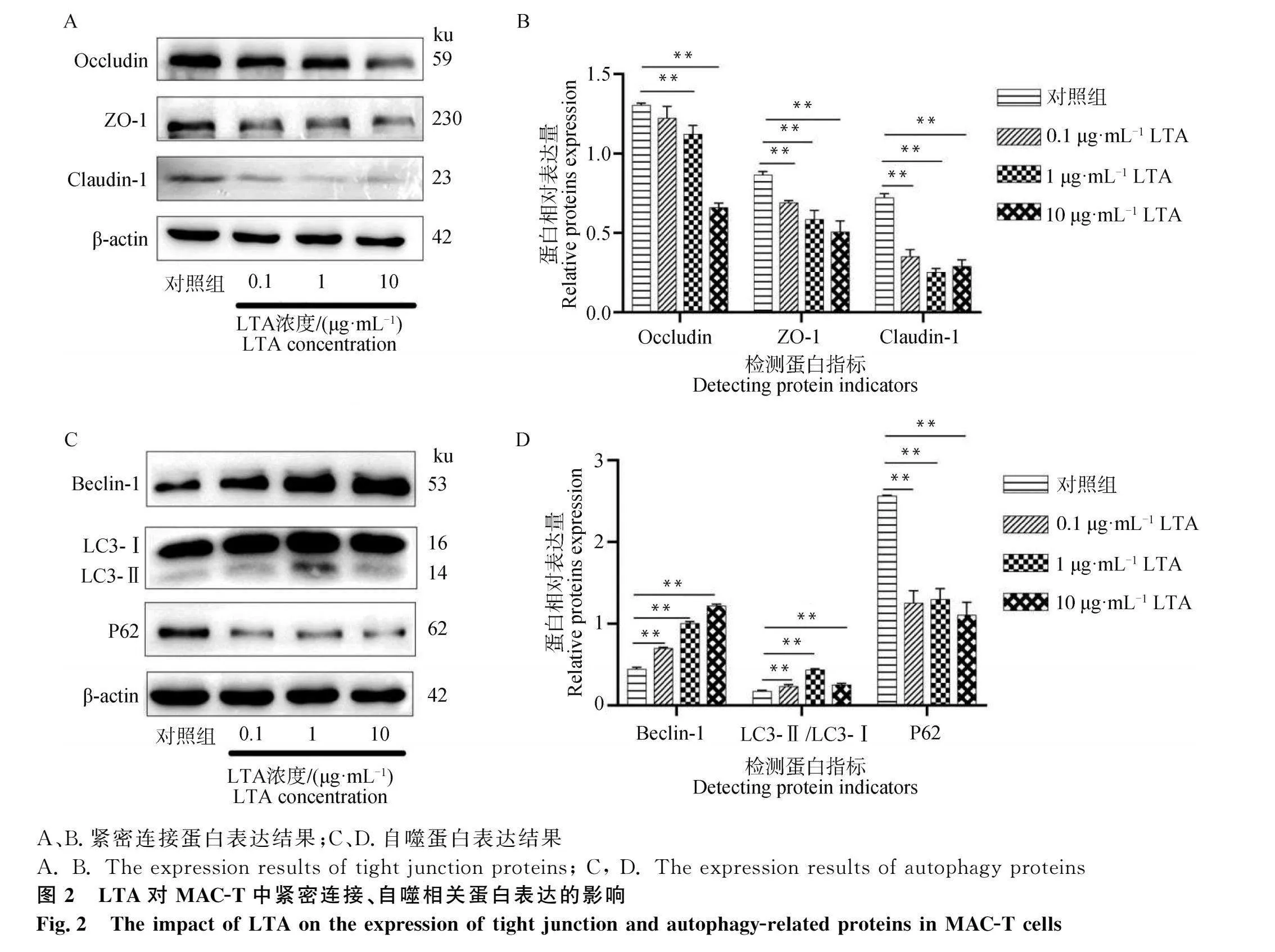
2.2 不同濃度LTA對緊密連接、自噬相關蛋白表達的影響
LTA對緊密連接蛋白表達的影響如圖2A-B所示,Occludin的表達隨LTA濃度升高逐漸降低,且當LTA濃度為1 μg·mL-1、10 μg·mL-1時,Occludin的表達顯著低于對照組(Plt;0.01);不同濃度LTA組中ZO-1的表達均顯著低于對照組,且隨LTA濃度提高,ZO-1的表達逐漸降低(Plt;0.01);相比于對照組,Claudin-1的表達量在不同LTA處理組中的表達均顯著降低(Plt;0.01)。
LTA對自噬蛋白表達的影響如圖2C-D所示,Beclin-1的表達隨著LTA濃度升高逐漸升高且均顯著高于對照組(Plt;0.01);不同濃度LTA組中LC3的表達均顯著高于對照組(Plt;0.01);不同濃度LTA組中P62的表達均顯著低于對照組(Plt;0.01)。
故選取10 μg·mL-1 LTA作為后續試驗條件。
2.3 槲皮素對MAC-T炎癥模型中緊密連接和自噬相關蛋白表達的影響
槲皮素對MAC-T炎癥模型中緊密連接蛋白表達的影響如圖3A-B所示,相比于對照組,LTA組中Occludin、ZO-1、Claudin-1的表達均顯著降低(Plt;0.01);不同濃度槲皮素作用后,10 μmol·L-1槲皮素處理組中緊密連接蛋白Occludin、ZO-1、Claudin-1的表達均顯著高于LTA組(Plt;0.01)。圖3E-G為緊密連接蛋白Occludin、ZO-1、Claudin-1細胞免疫熒光結果,結果顯示LTA處理組中緊密連接蛋白Occludin、ZO-1、Claudin-1熒光強度減弱,而槲皮素作用后,緊密連接蛋白Occludin、ZO-1、Claudin-1熒光強度增強。
槲皮素對MAC-T炎癥模型中自噬相關蛋白表達的影響如圖3C-D所示,相比于對照組,LTA組中P62的表達低于對照組(Plt;0.05),Beclin-1、LC3的表達均顯著升高(Plt;0.01);不同濃度槲皮素作用后,P62的表達均顯著高于對照組,Beclin-1的表達顯著降低(Plt;0.01)。經過5 μmol·L-1、10 μmol·L-1槲皮素處理,LC3的表達量均顯著低于LTA組,20 μmol·L-1無顯著差異。圖3H所示為自噬蛋白LC3細胞免疫熒光結果,結果顯示LTA處理組中自噬蛋白LC3熒光強度增強,而槲皮素作用后,自噬蛋白LC3熒光強度減弱。
故選擇10 μmol·L-1槲皮素作為后續試驗條件。
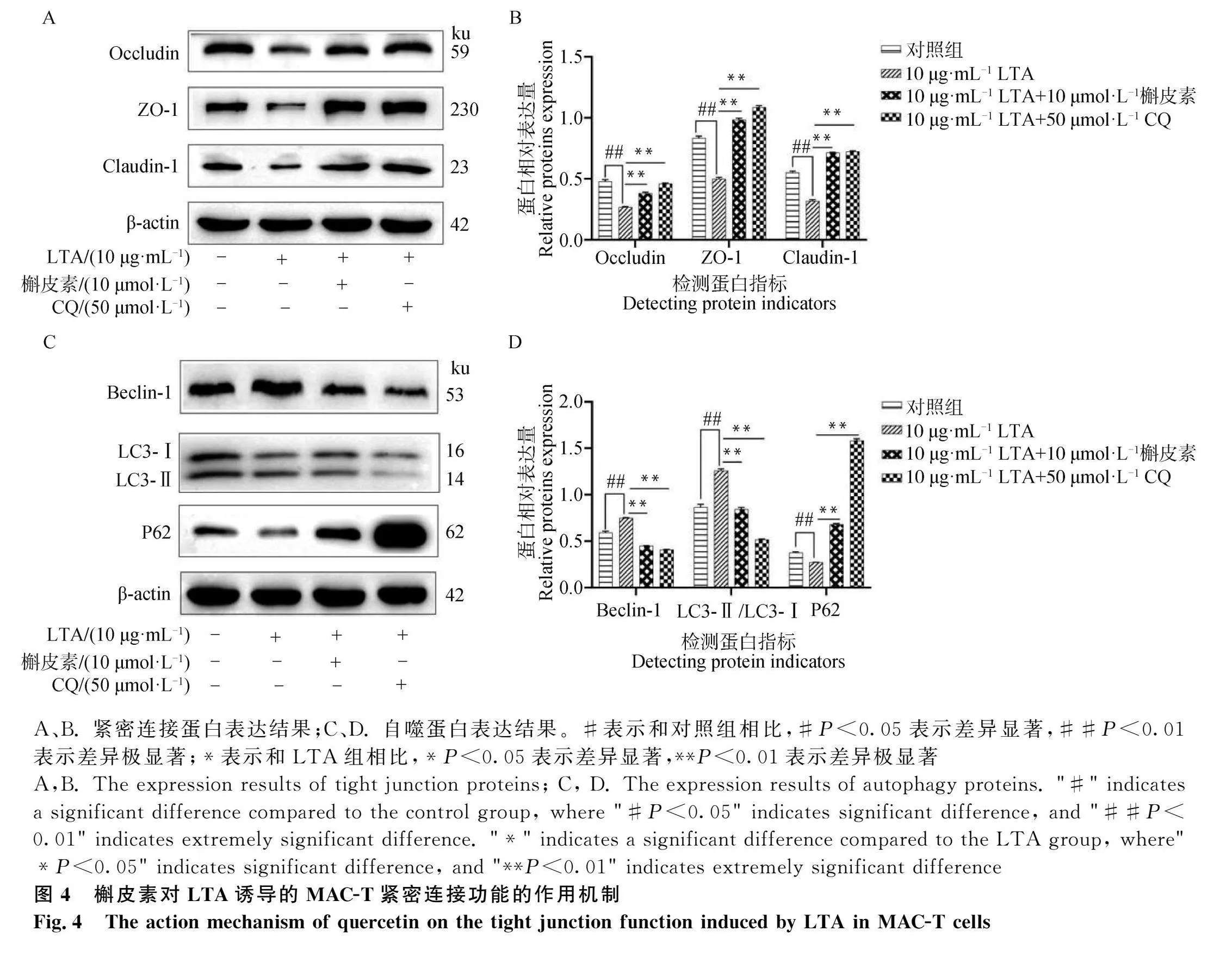
2.4 槲皮素對LTA誘導的MAC-T緊密連接功能的作用機制
如圖4A-B所示,相比于對照組,LTA組緊密連接蛋白Occludin、ZO-1、Claudin-1表達量均顯著降低(Plt;0.01)。使用槲皮素作用后,相比于LTA組,緊密連接蛋白Occludin、ZO-1、Claudin-1表達量均顯著升高(Plt;0.01)。使用50 μmol·L-1 CQ作用后,相比于LTA組,緊密連接蛋白Occludin、ZO-1、Claudin-1表達量均顯著升高(Plt;0.01)。
如圖4C-D所示,相比于對照組,LTA組自噬蛋白LC3、Beclin-1表達量顯著上升(Plt;0.01),P62表達量顯著下降(Plt;0.01)。使用10 μmol·L-1槲皮素作用后,相比于LTA組,自噬蛋白Beclin-1、LC3表達量均顯著下降(Plt;0.01),P62表達量顯著上升(Plt;0.01)。使用50 μmol·L-1 CQ作用后,相比于LTA組,自噬蛋白Beclin-1、LC3表達量均顯著下降(Plt;0.01),P62表達量顯著上升(Plt;0.01)。
3 討 論
緊密連接蛋白通過形成細胞間的密封屏障,阻止物質在細胞間隙中自由擴散[29-30]。這種屏障功能使得細胞能夠對外界環境進行選擇性的物質通透性調節,保持細胞內環境的相對穩定;在組織中起到連接細胞的作用,使得細胞能夠緊密地排列在一起形成組織。這種組織屏障的形成,有助于維持組織的結構完整性和功能[31]。緊密連接對于維持組織和器官功能和結構的完整性非常重要,在上皮組織中尤其常見[32-33]。
乳腺上皮細胞是乳房重要的免疫活性屏障和物理屏障[4]。在奶牛乳房炎中,病原菌感染會直接侵害乳腺上皮細胞,改變緊密連接的表達,從而破壞血乳屏障,影響乳腺的結構和功能[17]。研究顯示,金黃色葡萄球菌是造成奶牛乳腺炎最廣泛的致病菌之一[4],其細胞壁毒力因子脂磷壁酸是金黃色葡萄球菌最主要的致病成分。
正常乳腺上皮細胞中的緊密連接結構可以防止泌乳期乳汁成分的泄漏,維持MAC-T的正常生理功能[34-35],當金黃色葡萄球菌入侵乳腺時,破壞了乳房組織的緊密連接結構,引發乳腺炎[36]。本試驗中,使用不同濃度LTA處理MAC-T后,MAC-T緊密連接相關蛋白Occludin、ZO-1和Claudin-1的表達顯著低于對照組,這與宋潔[37]在MAC-T細胞中的研究結果一致,證明了炎癥會導致緊密連接功能受損。在腸上皮屏障功能障礙的治療中,Cui等[38]研究發現LPS引發的過度自噬引起小鼠腸道TJ蛋白表達降低,破壞了腸上皮屏障;在血腦屏障功能障礙的治療中,Deng等[22]研究發現過度自噬可導致小鼠腦內皮細胞死亡、TJ蛋白降低,導致了疾病的惡化;在小鼠炎癥性腸病的治療中,Li等[39]研究發現過度自噬會損害上皮細胞的緊密連接,當抑制自噬后可以恢復TJ蛋白的表達。本試驗結果顯示,LTA處理后,MAC-T細胞自噬水平顯著高于對照組,表明LTA對MAC-T緊密連接功能的影響可能是自噬過度激活引起的。
槲皮素作為抗炎物質,不僅能夠恢復腸炎癥性腸上皮細胞緊密連接蛋白的表達,而且能夠調控腸黏膜屏障的緊密連接蛋白和自噬改善LPS誘導的十二指腸炎癥[28]。有研究已證實,槲皮素對LTA誘導的小鼠乳腺上皮細胞炎癥的保護作用[40]。本試驗結果顯示,相比于LTA組,槲皮素處理可顯著增加緊密連接蛋白Occludin、ZO-1、Claudin-1的表達,說明槲皮素能夠恢復LTA誘導的緊密連接損傷。此外,Zheng等[41]研究發現,槲皮素可通過調控自噬,改善小鼠腸道組織緊密連接功能。本試驗中,相比于LTA組,槲皮素處理組中P62蛋白表達水平顯著升高,Beclin-1和LC3的表達量顯著降低,這和Geng等[42]、黃超等[43]的研究結果一致,說明LTA能夠過度激活自噬,而槲皮素能夠抑制自噬。當使用雷帕霉素(CQ)抑制自噬水平時,發現槲皮素對緊密連接蛋白表達的影響和CQ是一致的,表明槲皮素是通過抑制自噬來恢復緊密連接功能。
4 結 論
LTA可使得MAC-T自噬過度激活,從而破壞緊密連接功能,而槲皮素可通過抑制自噬增加緊密連接蛋白的表達,從而恢復緊密連接功能。該研究結果為奶牛乳腺炎的治療提供了新的研究思路和理論依據。
參考文獻(References):
[1] ZIGO F,VASIL’ M,ONDRAOVI ACˇG OV "S,et al.Maintaining optimal mammary gland health and prevention of mastitis[J].Front Vet Sci,2021,8:607311.
[2] 孫雅君.奶牛乳腺炎源金黃色葡萄球菌耐藥性相關基因的檢測與耐藥菌株表型異質性分析[D].楊凌:西北農林科技大學,2021.
SUN Y J.Resistance-related genes in Staphylococcus aureus from bovine mastitis and phenotypic heterogeneity in the resistant isolate[D].Yangling:Northwest Aamp;F University,2021.(in Chinese)
[3] 郭上朝.34味中藥對牛源金黃色葡萄球菌耐藥性和生物被膜的影響[D].秦皇島:河北科技師范學院,2023.
GUO S C.Effects of 34 traditional Chinese medicines on drug resistance and biofilm of Staphylococcus aureus of bovine origin[D].Qinhuangdao:Hebei Normal University of Science amp; Technology,2023.(in Chinese)
[4] KLEIN R C,FABRES-KLEIN M H,BRITO M A V P,et al.Staphylococcus aureus of bovine origin:genetic diversity,prevalence and the expression of adhesin-encoding genes[J].Vet Microbiol,2012,160(1-2):183-188.
[5] RANA E A,FAZAL M A,ALIM M A.Frequently used therapeutic antimicrobials and their resistance patterns on Staphylococcus aureus and Escherichia coli in mastitis affected lactating cows[J].Int J Vet Sci Med,2022,10(1):1-10.
[6] ZHU L L,LAI Y X,LI X W,et al.Molecular and epidemiological characterization of Staphylococcus aureus causing bovine mastitis in China[J].Microb Pathog,2024,191:106640.
[7] BURTCHETT T A,SHOOK J C,HESSE L E,et al.Crucial role for lipoteichoic acid assembly in the metabolic versatility and antibiotic resistance of Staphylococcus aureus[J].Infect Immun,2023,91(7):e0055022.
[8] RAINARD P,GILBERT F B,GERMON P.Immune defenses of the mammary gland epithelium of dairy ruminants[J].Front Immunol,2022,13:1031785.
[9] LIU M J,SONG S X,LI H R,et al.The protective effect of caffeic acid against inflammation injury of primary bovine mammary epithelial cells induced by lipopolysaccharide[J].J Dairy Sci,2014,97(5):2856-2865.
[10] TSUGAMI Y,SUZUKI N,KAWAHARA M,et al.Establishment of an in vitro culture model to study milk production and the blood-milk barrier with bovine mammary epithelial cells[J].Anim Sci J,2020,91(1):e13355.
[11] VISSER J,ROZING J,SAPONE A,et al.Tight junctions,intestinal permeability,and autoimmunity:celiac disease and type 1 diabetes paradigms[J].Ann N Y Acad Sci,2009,1165(1):195-205.
[12] WANG Y,LI X R,HAN Z Q,et al.iE-DAP induced inflammatory response and tight junction disruption in bovine mammary epithelial cells via NOD1-dependent NF-κB and MLCK signaling pathway[J].Int J Mol Sci,2023,24(7):6263.
[13] B SLER K,BRANDNER J M.Tight junctions in skin inflammation[J].Pflugers Arch,2017,469(1):3-14.
[14] DE BENEDETTO A,RAFAELS N M,MCGIRT L Y,et al.Tight junction defects in patients with atopic dermatitis[J].J Allergy Clin Immunol,2011,127(3):773-786.e7.
[15] STELWAGEN K.Effect of milking frequency on mammary functioning and shape of the lactation curve[J].J Dairy Sci,2001,84 Suppl:E204-E211.
[16] VAZIRI N D,YUAN J,RAHIMI A,et al.Disintegration of colonic epithelial tight junction in uremia:a likely cause of CKD-associated inflammation[J].Nephrol Dial Transplant,2012,27(7):2686-2693.
[17] KOBAYASHI K,OYAMA S,NUMATA A,et al.Lipopolysaccharide disrupts the milk-blood barrier by modulating claudins in mammary alveolar tight junctions[J].PLoS One,2013,8(4):e62187.
[18] AL-SADI R,DHARMAPRAKASH V,NIGHOT P,et al.Bifidobacterium bifidum enhances the intestinal epithelial tight junction barrier and protects against intestinal inflammation by targeting the toll-like receptor-2 pathway in an NF-κB-independent manner[J].Int J Mol Sci,2021,22(15):8070.
[19] 秦士貞,楊敏敏,任志雄,等.枯草芽孢桿菌對脂多糖應激肉仔雞腸道免疫、腸道組織形態以及腸道屏障的影響[J].畜牧獸醫學報,2023,54(11):4676-4690.
QIN S Z,YANG M M,REN Z X,et al.Effects of Bacillus subtilis on intestinal immunity,intestinal tissue morphology and intestinal barrier of broilers challenged with lipopolysaccharide[J].Acta Veterinaria et Zootechnica Sinica,2023,54(11): 4676-4690.(in Chinese)
[20] LI Y J,ZHANG P,ZHANG J,et al.Role of autophagy inducers and inhibitors in intestinal barrier injury induced by intestinal ischemia-reperfusion (I/R)[J].J Immunol Res,2022,2022:9822157.
[21] ZHANG C,DENG Y A,ZHANG Y S,et al.CXCR3 Inhibition blocks the NF-κB signaling pathway by elevating autophagy to ameliorate lipopolysaccharide-induced intestinal dysfunction in mice[J].Cells,2023,12(1):182.
[22] DENG S W,HU Q,CHEN X Q,et al.GM130 protects against blood-brain barrier disruption and brain injury after intracerebral hemorrhage by regulating autophagy formation[J].Exp Gerontol,2022,163:111772.
[23] BATIHA G E S,BESHBISHY A M,IKRAM M,et al.The pharmacological activity,biochemical properties,and pharmacokinetics of the major natural polyphenolic flavonoid:quercetin[J].Foods,2020,9(3):374.
[24] XU D,HU M J,WANG Y Q,et al.Antioxidant activities of quercetin and its complexes for medicinal application[J]. Molecules, 2019,24(6):1123.
[25] SUN W L,SHAHRAJABIAN M H.Therapeutic potential of phenolic compounds in medicinal plants-natural health products for human health[J].Molecules,2023,28(4):1845.
[26] KERANMU A,PAN L B,YU H,et al.The potential biological effects of quercetin based on pharmacokinetics and multi-targeted mechanism in vivo[J].J Asian Nat Prod Res,2022,24(5):403-431.
[27] WICIN'SKI M,ERDMANN J,NOWACKA A,et al.Natural phytochemicals as SIRT activators-focus on potential biochemical mechanisms[J].Nutrients,2023,15(16):3578.
[28] SULTANA R,MCBAIN A J,O’NEILL C A.Strain-dependent augmentation of tight-junction barrier function in human primary epidermal keratinocytes by Lactobacillus and Bifidobacterium lysates[J].Appl Environ Microbiol,2013,79(16):4887-4894.
[29] BAZZONI G,DEJANA E.Endothelial cell-to-cell junctions:molecular organization and role in vascular homeostasis[J].Physiol Rev,2004,84(3):869-901.
[30] SCHWAYER C,SHAMIPOUR S,PRANJIC-FERSCHA K,et al.Mechanosensation of tight junctions depends on ZO-1 phase separation and flow[J].Cell,2019,179(4):937-952.e18.
[31] IONESCU POPESCU C,LILIAC L,CEAU U R A,et al.CLDN3 expression and significance- breast carcinoma versus ovarian carcinoma[J].Rom J Morphol Embryol,2013,54(1):99-106.
[32] 高志光,秦環龍.腸上皮細胞緊密連接的生物學功能及在腸屏障中的作用[J].腸外與腸內營養,2005,12(5):299-302.
GAO Z G,QIN H L.The biological functions of intestinal epithelial tight junctions and its role in intestinal barrier[J].Parenteral amp; Enteral Nutrition,2005,12(5):299-302.(in Chinese)
[33] 楊 斐,楊艷紅,張馨月,等.細胞連接分子對上皮組織物質轉運的調控機制[J].生物技術,2019,29(2):199-204.
YANG F,YANG Y H,ZHANG X Y,et al.Regulatory mechanism of cell-linked molecules on epithelial material transport[J].Biotechnology,2019,29(2):199-204.(in Chinese)
[34] ITOH M,BISSELL M J.The organization of tight junctions in epithelia:implications for mammary gland biology and breast tumorigenesis[J].J Mammary Gland Biol Neoplasia,2003,8(4):449-462.
[35] NGUYEN D A D,NEVILLE M C.Tight junction regulation in the mammary gland[J].J Mammary Gland Biol Neoplasia,1998, 3(3):233-246.
[36] 沈義媛,童津津,熊本海,等.多組學技術在奶牛瘤胃微生物與宿主互作機制中的研究進展[J].中國乳業,2021(8):68-75.
SHEN Y Y,TONG J J,XIONG B H,et al.Progress of Multi-omics in interaction mechanism between rumen microorganism and host in dairy cows[J].China Dairy,2021(8):68-75.(in Chinese)
[37] 宋 潔.黃花蒿醇提物緩解LPS誘導奶牛乳腺上皮細胞炎癥損傷的作用機制研究[D].呼和浩特:內蒙古農業大學,2023.
SONG J.Mechanism of Artemisia annua ethanol extract alleviating LPS-induced inflammatory injury in bovine mammary epithelial cells[D].Hohhot:Inner Mongolia Agricultural University,2023.(in Chinese)
[38] CUI Y J,LIU L,DOU X X,et al.Lactobacillus reuteri ZJ617 maintains intestinal integrity via regulating tight junction,autophagy and apoptosis in mice challenged with lipopolysaccharide[J].Oncotarget,2017,8(44):77489-77499.
[39] LI M X,LUO T,HUANG Y,et al.Polysaccharide from Pycnoporus sanguineus ameliorates dextran sulfate sodium-induced colitis via helper T cells repertoire modulation and autophagy suppression[J].Phytother Res,2020,34(10):2649-2664.
[40] 曹 璐,王 桃,陳 艷,等.槲皮素對LPS誘導小鼠乳腺上皮細胞炎癥的保護機制[J].農業生物技術學報,2023, 31(6): 1218-1228.
CAO L,WANG T,CHEN Y,et al.Protective mechanism of quercetin against LPS-induced inflammation in mouse (Mus musculus) mammary epithelial cells[J].Journal of Agricultural Biotechnology,2023,31(6):1218-1228.(in Chinese)
[41] ZHENG J Y,XU H,HUANG C L,et al.Quercetin protects against intestinal barrier disruption and inflammation in acute necrotizing pancreatitis through TLR4/MyD88/p38?MAPK and ERS inhibition[J].Pancreatology,2018,18(7):742-752.
[42] GENG N,LIU K P,LU J W,et al.Autophagy of bovine mammary epithelial cell induced by intracellular Staphylococcus aureus[J].J Microbiol,2020,58(4):320-329.
[43] 黃 超,黃慶華,尤 荻,等.槲皮素在創傷性腦損傷治療中潛在分子機制和臨床應用的可行性[J].中國組織工程研究,2019,23(23):3760-3766.
HUANG C,HUANG Q H,YOU D,et al.Molecular mechanism of quercetin in the treatment of traumatic brain injury:its feasibility of clinical application[J].Chinese Journal of Tissue Engineering Research,2019,23(23):3760-3766.(in Chinese)
(編輯 郭云雁)

