五指山豬MYH基因家族結構變異對背最長肌肌纖維性狀的影響

摘 要: 旨在通過探究五指山豬背最長肌MYH基因家族結構變異(SVs)對背最長肌肌纖維性狀的影響,為深入理解肌纖維生長規(guī)律和分子機制提供基礎。研究對象為五指山豬,采用大白豬作為對照組。屠宰前一周將3頭五指山豬(4月齡母豬,平均體重14.2 kg)和3頭大白豬(4月齡母豬,平均體重58.0 kg)飼養(yǎng)在相同的環(huán)境中,飼喂充足的食物和水,所有豬饑餓處理24 h之后屠宰。采集6頭豬背最長肌組織,提取完整DNA,PacBio平臺建庫測序,每個樣本測序大約40 Gb,測序數(shù)據(jù)與參考基因組(Sscrofa 11.1)比對,使用Sniffles和PBSV軟件的默認參數(shù)檢測SVs,過濾條件:50 bp≤SVs≤10 kb;提取每頭豬背最長肌總RNA,轉(zhuǎn)錄組測序,計算基因表達量;統(tǒng)計五指山豬和大白豬SVs在染色體上分布位置和數(shù)目,比較五指山豬相對于大白豬SVs差異,篩選五指山豬特異性SVs,構建五指山豬MYH基因家族系統(tǒng)發(fā)育樹,預測結構域,分析MYH基因表達量與肌纖維指標相關性。結果表明:1)五指山豬共有7個特異性MYH基因,主要分布在第3、5、6、12、13號染色體,第12號染色體包含3個MYH基因;2)系統(tǒng)進化樹顯示,五指山豬7個MYH基因分化為2個分支,分別編碼非肌肉肌球蛋白和肌肉肌球蛋白,MYH9與MYH11基因、MYH1與MYH4基因同源性最高;7個MYH基因都包含結構域Motor domain,5個MYH基因包含結構域Myosin-N,MYH基因頭部結構域(Myosin-N和Motor domain)相對保守,中間和尾部結構域差異較大;其中五指山豬MYH1、MYH4和MYH9基因包含SVs而大白豬沒有SVs,皮爾森系數(shù)統(tǒng)計表明,MYH基因是否包含SVs可能與基因表達量相關;綜合轉(zhuǎn)錄組測序和Q-PCR試驗,檢測這3個MYH基因的表達量與肌纖維指標相關性,MYH1基因表達量與肌纖維密度和數(shù)量正相關,MYH4基因表達量與肌纖維密度和數(shù)量負相關,MYH9基因表達量與肌纖維密度負相關,與直徑正相關。綜上所述,五指山豬第12號染色體上特異性MYH基因最多;MYH基因家族主要分化為非肌肉肌球蛋白和肌肉肌球蛋白2個分支;MYH蛋白頭部結構域相對保守,中間和尾部結構域差異可能是造成MYH基因家族分化的主要原因;MYH1、MYH4和MYH9基因表達量均與肌纖維密度相關,可能通過調(diào)控背最長肌肌纖維密度影響肌肉生長發(fā)育。本研究不僅擴展了肌纖維生長發(fā)育的分子機制相關內(nèi)容,也為優(yōu)化結構變異有關的遺傳育種模式提供借鑒。
關鍵詞: 五指山豬;肌纖維;結構變異;蛋白結構域;相關性
中圖分類號:S828.2
文獻標志碼:A
文章編號:0366-6964(2024)11-4912-13
收稿日期:2024-04-02
基金項目:國家重點研發(fā)計劃青年科學家項目(2022YFF1001300);海南省農(nóng)業(yè)科學院院本級科研項目(HAAS2023RCQD04);海南省自然科學基金青年基金項目(324QN351)
作者簡介:任鈺為(1986-),女,湖北宜昌人,副研究員,博士,主要從事畜禽基因組和遺傳育種研究,E-mail: renyuwei@hnaas.org.cn
*通信作者:晁 哲,主要從事畜禽基因組和遺傳育種研究,E-mail:chaozhe@hnaas.org.cn
Effect of Structural Variation of MYH Gene Family on Longissimus Dorsi Muscle Fiber of Wuzhishan Pigs
REN" Yuwei, WANG" Feng, SUN" Ruiping, ZHANG" Yan, LIU" Hailong, LIN" Yanning, HONG" Lingling,
HUANG" Xiaoxian, CHAO" Zhe*
(Key Laboratory of Tropical Animal Breeding and Disease Research, Institute of
Animal Science and Veterinary Medicine, Hainan Academy of Agricultural Sciences, Haikou 571100," China)
Abstract:" The study aimed to explore the effect of structural variation (SVs) in MYH gene family on muscle growth for longissimus dorsi muscle (LDM) of Wuzhishan pigs, and to provide a theoretical basis for further understanding of the rule and molecular mechanism of muscle growth. The study subjects were Wuzhishan pigs, and Large White pigs were used as control group. Three Wuzhishan pigs (4-month-old sows, average weight was 14.2 kg) and three Large White pigs (4-month-old sows, average weight was 58.0 kg) were raised in the same environment for one week before slaughter, fed sufficient food and water, and all pigs were starved for 24 hours before slaughter. LDM of 6 pigs were collected and sent to Beijing Novogene Technology Company on dry ice, complete DNA was extracted, library was built and sequenced by PacBio platform, the sequencing data of each sample was about 40 Gb.
The sequencing data was aligned to reference genome.
Filter condition: 50 bp≤SVs≤10 kb; Total RNA was extracted from longissimus dorsi muscle of each pig, transcriptome sequencing was performed, and gene expression was calculated. The distribution position and number of SVs on chromosomes of Wuzhishan pig and Large White pigs were counted, the specific SVs of Wuzhishan pigs were screened, and the phylogenetic tree of MYH gene family was constructed, the structure domains were predicted, and the correlation between MYH gene expression and muscle fiber indicators was analyzed. The results showed as follows: 1) There were 7 specific MYH genes in Wuzhishan pigs, which were mainly distributed in chromosomes 3, 5, 6, 12 and 13, and chromosome 12 contained 3 MYH genes; 2) Phylogenetic tree showed that 7 MYH genes of Wuzhishan pigs differentiated into 2 branches, encoding non-muscle myosin and muscle myosin respectively, MYH9 and MYH11 genes, MYH1 and MYH4 genes had the highest homology; All 7 MYH genes contained the Motor domain, and 5 MYH genes contain the Myosin-N domain. The head domain of MYH gene (Myosin-N and Motor domain) was relatively conservative, and the middle and tail domain of MYH gene were different. The MYH1, MYH4 and MYH9 genes of Wuzhishan pigs contained SVs,
while those of Large White pigs did not. Pearson coefficient statistics showed that the existence of SVs in MYH genes might be related to gene expression. The correlation between the expression levels of these three MYH genes and muscle fiber indexes was detected by both RNA-seq and Q-PCR. MYH1 gene expression was positively correlated with muscle fiber density and number, MYH4 gene expression was negatively correlated with muscle fiber density and number, MYH9 gene expression was negatively correlated with muscle fiber density and positively correlated with diameter. In summary,
the largest number of MYH genes distributed on chromosome 12,
the MYH gene family is mainly divided into two branches: non-muscle myosin and muscle myosin. The head domain is relatively conservative, and the difference between the middle and tail domain may be the main reason for the differentiation of MYH gene family. The expression levels of MYH1, MYH4 and MYH9 genes were significantly correlated with muscle fiber density, indicating that these genes might affect LDM growth through regulating the muscle fiber density. This study not only expands the content of molecular mechanism of muscle growth and development, but also provides reference for optimizing genetic breeding model related to structural variation.
Key words: Wuzhishan pigs; muscle fiber; structural variations; protein domains; correlations
*Corresponding author:" CHAO Zhe, E-mail: chaozhe@hnaas.org.cn
五指山豬是海南省特有的一種小型豬,具有耐粗飼、瘦肉率高、抗逆行強、遺傳性能穩(wěn)定等特點。雖然五指山豬肉質(zhì)優(yōu)良,但是生長緩慢,相比于其它商品豬,例如大白豬、長白豬、杜洛克等豬品種,五指山豬缺乏市場優(yōu)勢[1]。大部分養(yǎng)殖場利用傳統(tǒng)雜交選育方法提高五指山豬子代個體的生長速度[2],然而,雜種優(yōu)勢個體差異較大,而且不能穩(wěn)定遺傳;少數(shù)養(yǎng)殖場引入全基因組選擇技術,研發(fā)芯片進行定向選育,但是該方法技術成本高、實施難度大[3]。因此,亟需探究有效穩(wěn)定的遺傳育種模式來提高五指山豬的生長性能。
肌球蛋白分為非肌肉肌球蛋白(non-muscle myosin)和肌肉肌球蛋白,前者屬于平滑肌組成成分,參與細胞遷移、黏附和形成細胞骨架等多種功能[4],后者構成骨骼肌重要成分。骨骼肌主要由不同含量肌球蛋白重鏈(myosin heavy chains,MYH)亞型的不同收縮性和代謝特性的肌纖維組成[5];同時,肌纖維周圍也包含大量的血管和免疫細胞。肌球蛋白重鏈(MYH)是肌球蛋白的重要組成部分,由多基因家族編碼,在不同種類肌細胞生長發(fā)育過程中均能檢測到MYH基因[6]。骨骼肌衛(wèi)星細胞分化后的成熟肌管中肌球蛋白重鏈MYHC基因和蛋白水平顯著高于分化前的細胞[7]。通過對豬混合群體進行全基因組關聯(lián)分析,發(fā)現(xiàn)差異最顯著的數(shù)量性狀區(qū)域位于MYH基因家族,與骨骼肌肌纖維總數(shù)目性狀相關[8]。馬身豬和大白豬MYH3和MYH6基因能夠影響肌纖維組成[9]。牦牛骨骼肌快肌纖維MYH1和 MYH4基因表達量隨海拔增高而顯著增加,能夠在缺氧環(huán)境下迅速提供短期能量[10]。MYH1、MYH4、MYH6、MYH7、MYH9 和MYH13與烏蘇里白鮭肌肉生長相關[11]。這些研究結果說明,MYH基因家族編碼的非肌肉肌球蛋白和肌肉肌球蛋白都參與調(diào)控肌肉生長發(fā)育過程。
基因組結構變異(structural variation,SVs)主要指基因序列發(fā)生大片段變異,包括插入、缺失、易位、倒位和重復[12]。基因組結構變異對豬的遺傳多樣性和適應性具有重要作用。野豬和家豬的拷貝數(shù)變異用來研究肉質(zhì)性狀、肌肉生長和免疫反應[13]。在亞洲家豬品種中,亞洲家豬X染色體普遍存在一段30 Mb序列長度SV,但在亞洲野豬中未檢測到此片段,表明亞洲家豬與野豬已經(jīng)發(fā)生了明顯分化[14]。藏豬缺氧反應、骨骼發(fā)育、心臟收縮調(diào)節(jié)和神經(jīng)元細胞發(fā)育的基因發(fā)生轉(zhuǎn)錄因子結構變異,可能有助于增強藏豬的本地適應[15]。不同養(yǎng)殖系統(tǒng)、生態(tài)環(huán)境和地理環(huán)境可能誘導碳水化合物代謝相關的SVs,影響豬群生長狀態(tài)[16]。此外,基因SVs通過影響調(diào)控元件來改變基因的轉(zhuǎn)錄水平,增強子區(qū)域SVs影響豬肉質(zhì)基因的表達[17]。秦川牛、云嶺牛、夏南牛動力蛋白基因拷貝數(shù)變異影響肌肉細胞增殖和分化,減緩生長速度[18]。此外,北京黑豬背最長肌(longissimus dorsi muscle,LDM)MYH3基因編碼區(qū)檢測到1個SNP(single nucleotide polymorphism),與肌內(nèi)脂肪和基因表達顯著相關;MYH13基因的SNPs與滴水損失和肉質(zhì)顯著相關[19]。晉汾白豬與長白豬、大白豬、馬身豬和太湖豬(二花臉)相比較,MYH基因家族的SNPs具有較大差異[20]。
基因結構變異可能影響豬的體型,調(diào)控豬的新陳代謝、細胞增殖分化和免疫反應[21]。例如,香豬以小型豬為主,也有少數(shù)體型較大的個體,體型差異主要與14個SVs相關,主要參與調(diào)控細胞周期、營養(yǎng)物質(zhì)儲存等功能[22]。梅山豬與杜洛克豬相比,共檢測到49 103個SVs,其中4.02%是亞洲豬特異性SVs[14]。藏豬IGF2R轉(zhuǎn)錄調(diào)控區(qū)存在1個SV(274 bp缺失),抑制藏豬生長發(fā)育[14]。五指山豬與大白豬相比,生長因子IGF1基因UTR3區(qū)域檢測到一段缺失序列,可能影響該基因的調(diào)控功能[23]。
推測五指山豬MYH基因家族可能具有生長發(fā)育相關的特異性SVs。本研究將從基因組結構變異的角度分析背最長肌MYH基因家族結構和功能特征,探究MYH基因家族調(diào)控生長規(guī)律的分子機制,為優(yōu)化五指山豬結構變異相關選育指標提供參考。
1 材料與方法
1.1 樣本采集和測序
樣本和測序方法參考本項目前期測序數(shù)據(jù)(PRJNA1030798)[23]。具體步驟是,將3頭五指山豬(4月齡母豬,平均體重14.2 kg)和3頭大白豬(4月齡母豬,平均體重58.0 kg)飼養(yǎng)在相似的環(huán)境中,屠宰前一周飼喂充足的食物和水,過渡期結束后,所有豬饑餓處理24 h,電擊昏迷并放血。采集6頭豬背最長肌組織,干冰寄送至北京諾禾致源科技股份有限公司,提取完整DNA,PacBio平臺建庫測序,每個樣本測序大約40 Gb。
1.2 結構變異分析
原始三代測序數(shù)據(jù)與參考基因組(Sscrofa 11.1)比對,使用Sniffles和PBSV軟件的默認參數(shù)檢測SV,包括缺失(deletions,DELs)、插入(insertions,INSs)、重復(duplication, DUP) 、倒位(inversions, INVs)和易位(translocations,TRAs)。過濾條件:50 bp≤SVs≤10 kb。將兩個品種的3個重復樣本的SVs分別組合,然后比較兩個品種不同的SVs(將SVs共分為四類:一是兩個品種位置相同、變異類型相同且變異序列相同的SVs;二是兩個品種位置相同、變異類型相同但是序列具有差異的SVs;三是兩個品種序列位置不同的SVs;四是兩個品種結構變異種類不同的SVs),篩選兩個品種特異性SVs,即第二、三、四類SVs。從差異SVs中提取MYH基因家族SVs,統(tǒng)計不同MYH基因SVs種類和數(shù)目,開展MYH基因家族同源性分析和結構域功能分析。
1.3 進化樹和蛋白結構分析
首先,根據(jù)步驟“1.2”篩選的MYH基因,從NCBI數(shù)據(jù)庫下載蛋白序列(MYH1: NP_001098421.1; MYH4: NP_001116613.1; MYH9: JAA53670.1; MYH10: XP_020923522.1; MYH11: XP_020941824.1; MYH14: XP_020950448.1; MYH15:XP_020925485.1),利用MEGA11軟件最大似然法構建7個MYH蛋白序列的進化樹,結合分支長度和距離分析親緣關系。然后,查詢Uniprot數(shù)據(jù)庫結構域(https://www.uniprot.org/),比較MYH蛋白結構域種類、長度和數(shù)量,分析不同結構域?qū)Φ鞍坠δ艿挠绊憽?/p>
1.4 基因表達量和相關性分析
五指山豬和大白豬轉(zhuǎn)錄組測序樣本與步驟“1.1”采集的組織樣本相同,測序數(shù)據(jù)是[PRJNA1030798]。使用Trimmomatic(版本0.36.6)過濾原始數(shù)據(jù)的低質(zhì)量數(shù)據(jù),用HISAT2軟件(Version 2.2.1)[24]默認的參數(shù)將過濾后的數(shù)據(jù)映射到參考基因組(Sscrofa11.1),利用HTSeq v. 0.9.1[25]計算基因表達量計數(shù)。采用DEseq2[26]鑒定差異表達基因(differentially expressed genes, DEGs)。
比較五指山豬和大白豬MYH基因的SVs,將具有SVs的MYH基因標記為1,沒有SVs的MYH基因標記為0,采用皮爾森統(tǒng)計法(Pearson)分別計算每個基因是否存在SVs與表達量之間的皮爾森相關系數(shù)(R)和顯著性,篩選與存在SVs具有一定關聯(lián)的MYH基因繼續(xù)分析基因表達量與肌纖維指標之間的相關性。
提取轉(zhuǎn)錄組數(shù)據(jù)中MYH基因家族成員的基因表達量,采用皮爾森統(tǒng)計法(Pearson)分別計算SVs關聯(lián)MYH與步驟“2.4”測量的肌纖維指標之間的皮爾森相關系數(shù)(R)和顯著性,閾值設定為:R≥0.9,P≤0.05。篩選相關性程度強且差異顯著的MYH基因與肌纖維指標,并用R軟件繪制相關性圖。同時,提取組織總RNA,采用定量PCR試驗檢測SVs關聯(lián)MYH基因表達量,計算2-ΔΔCT值,T-TEST統(tǒng)計顯著性,分析表達顯著差異的MYH基因與肌纖維指標相關性,判斷轉(zhuǎn)錄組數(shù)據(jù)和定量PCR數(shù)據(jù)一致性。
1.5 切片染色分析
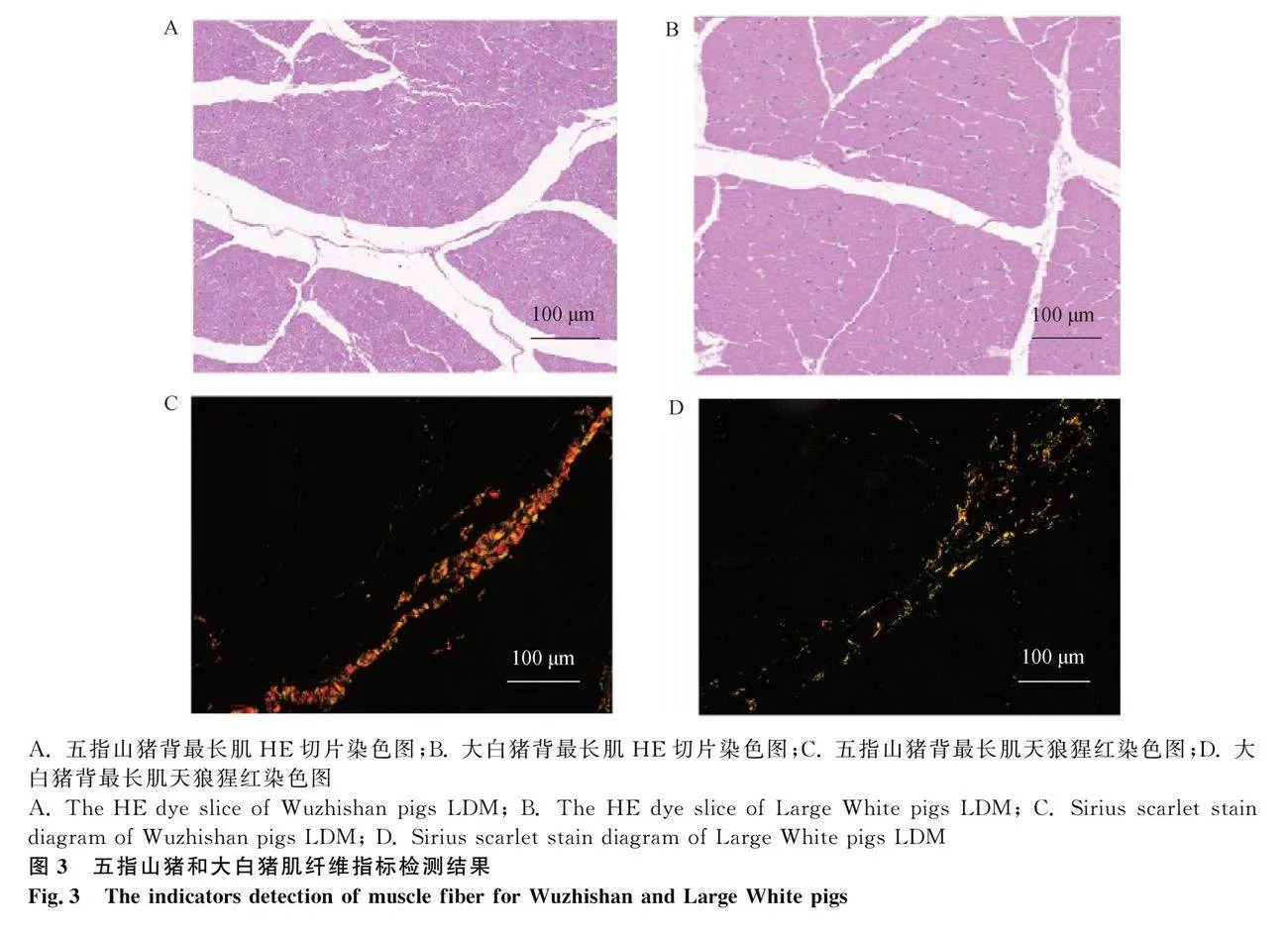
分別對步驟“1.1”采集的五指山豬和大白豬背最長肌組織使用4%多聚甲醛處理,進行修剪、包埋、切片、染色(HE染色和天狼猩紅染色)、封片和檢測,選取合格切片成像。HE染色采用蘇木精-伊紅染色法(hematoxylin-eosin staining,簡稱HE染色)制作石蠟切片,蘇木精為堿性,使細胞核內(nèi)的染色質(zhì)與細胞質(zhì)內(nèi)的核糖體著紫藍色,伊紅為酸性,使細胞質(zhì)和細胞外基質(zhì)著紅色。天狼猩紅是強酸性染料,易與膠原基團中的堿性分子結合,采用偏振光鏡檢測,天狼猩紅增強膠原纖維的雙折射,從而區(qū)分I型/III型膠原纖維。利用PANNORAMIC全景切片掃描儀將組織切片掃描移動成像,成像文件繼續(xù)用CaseViewer2.2軟件以1~400倍像素觀測;調(diào)整Eclipse Ci-L偏振光強度,捕獲并拍照顯微鏡下的目標區(qū)域,調(diào)整為200倍像素圖片,利用Image-Pro Plus 6.0分析軟件檢測I型膠原纖維(橙色)和III型膠原纖維(綠色)含量;使用Image-Pro Plus 6.0分析軟件統(tǒng)一以1mm作為計數(shù)單位,統(tǒng)計肌纖維總數(shù)、密度、面積、直徑和I型/III型膠原纖維比率。
每張切片統(tǒng)計400倍視野內(nèi)肌纖維數(shù)量并測量視野內(nèi)肌纖維總面積,重復3次,計算平均值。每個肌纖維面積(mm2)=肌纖維總面積(mm2)/肌纖維數(shù)量(n);肌纖維密度(n·mm-2)=肌纖維數(shù)量(n)/肌纖維總面積(mm2);肌纖維直徑(mm)=(每個肌纖維面積(mm2)/2π)1/2×2。
2 結 果
2.1 MYH基因家族SVs數(shù)量及分布
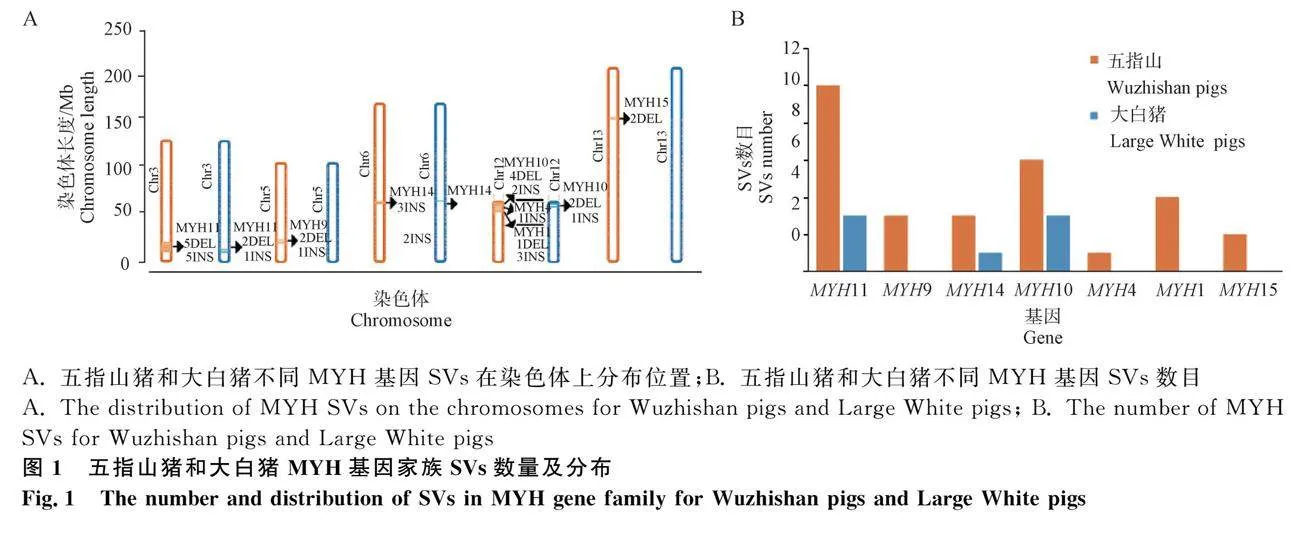
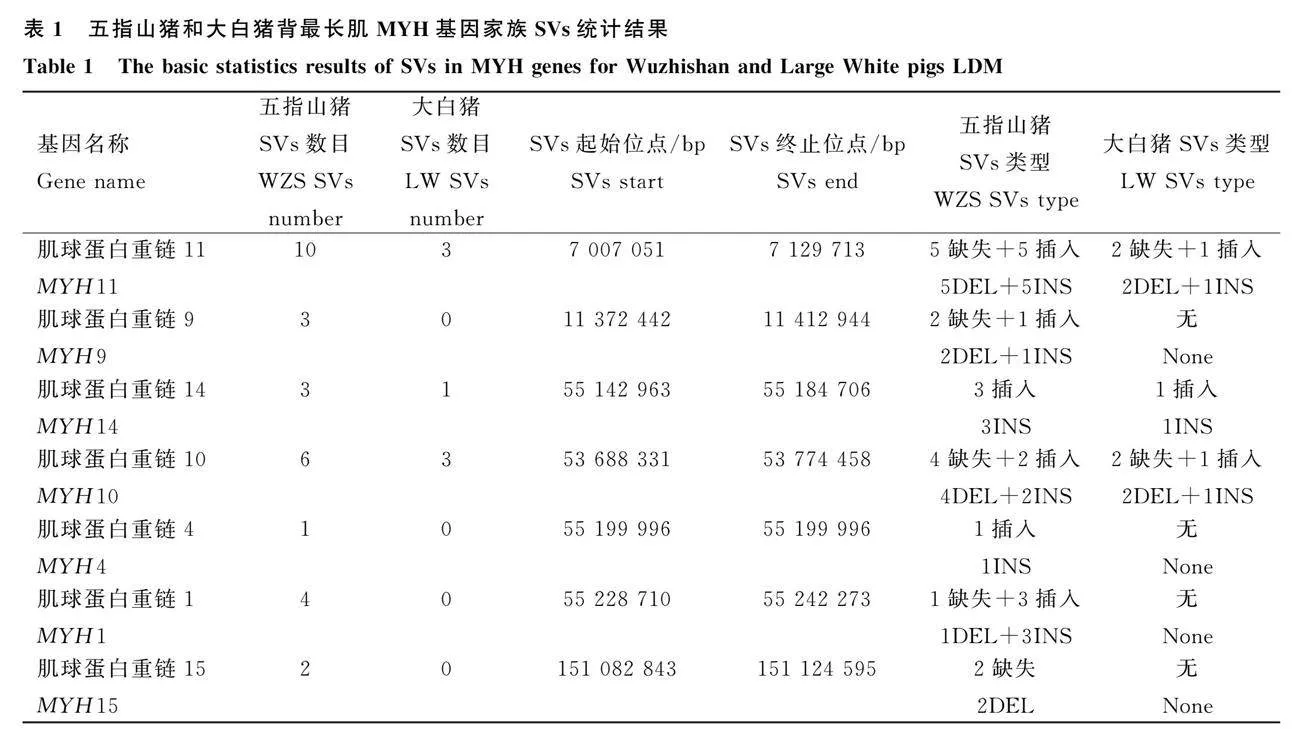
通過比較五指山豬和大白豬MYH基因家族SVs,篩選兩個品種特異性SVs。五指山豬和大白豬MYH基因家族的基因分別檢測到29個SVs和7個SVs。五指山豬共檢測到7個MYH基因具有SVs,分別分布在5條染色體上,其中第12號染色體包含3個MYH基因(MYH10、MYH4和MYH1),其它4條染色體上分別有1個(圖1A);大白豬共有3個具有SVs的MYH基因,分別分布在3條染色體上(圖1A)。五指山豬3號染色體MYH11基因的SVs最多,共有10個SVs(5DEL+5INS),其次是12號染色體MYH10基因(4DEL+2INS)(圖1B);大白豬也是MYH11和MYH10基因的SVs最多,分別有3個(2DEL+1INS)(圖1B,表1)。五指山豬MYH1基因檢測到2個INS位于外顯子區(qū)域,長度分別為64 bp和74 bp,其它SVs都位于內(nèi)含子區(qū)域;大白豬所有SVs都位于內(nèi)含子區(qū)域。這些統(tǒng)計結果說明大多數(shù)SVs都位于調(diào)控區(qū)域,僅少數(shù)SVs位于編碼區(qū);五指山豬MYH基因發(fā)生結構變異的染色體和基因數(shù)目均多于大白豬,而且兩個豬品種的變異結構類型主要是缺失和插入。
2.2 MYH基因家族同源性分析
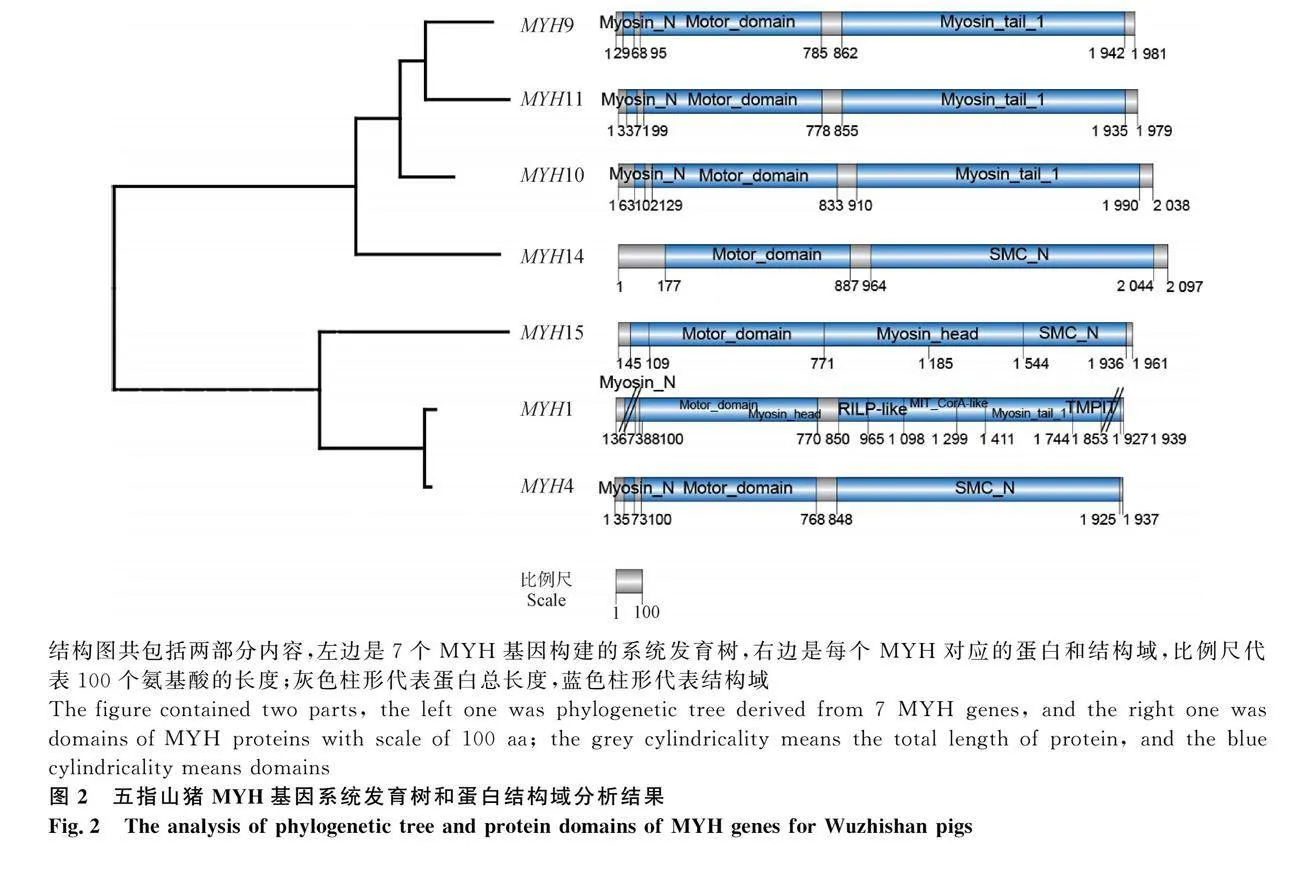
利用7個MYH蛋白序列構建系統(tǒng)發(fā)育樹,結果表明,系統(tǒng)發(fā)育樹主要分成2個分支。一個分支是非肌肉肌球蛋白,包含4個MYH蛋白,序列長度范圍較長(1 979~2 038 aa);另一個分支是肌肉肌球蛋白,包含3個MYH蛋白,序列長度范圍較短(1 937~1 961 aa)。MYH頭部結構域較保守,中間和尾部結構域差異較大。MYH蛋白都具有結構域Motor domain,但是兩個分支的長度范圍不同,分別是679~710 aa和662~670 aa;5個MYH蛋白預測到Myosin-N結構域,該結構域序列長度波動范圍較小(37~39 aa),而且氨基酸序列相似度較高,說明Myosin-N結構域保守性較強。在這7個MYH蛋白中,蛋白MYH9、MYH10和MYH11同源性較高,其中 MYH9和MYH11蛋白序列長度和3個結構域位置相似,同源性最高;MYH1和MYH4蛋白的系統(tǒng)進化樹分支距離較近,兩者都具有結構域Myosin-N和Motor domain。MYH1蛋白結構域最多,包含7個結構域,其中2個外顯子區(qū)域的SVs可能位于頭部的Myosin-N和右邊的Myosin-tail編碼區(qū)(圖2)。
2.3 肌纖維指標測定
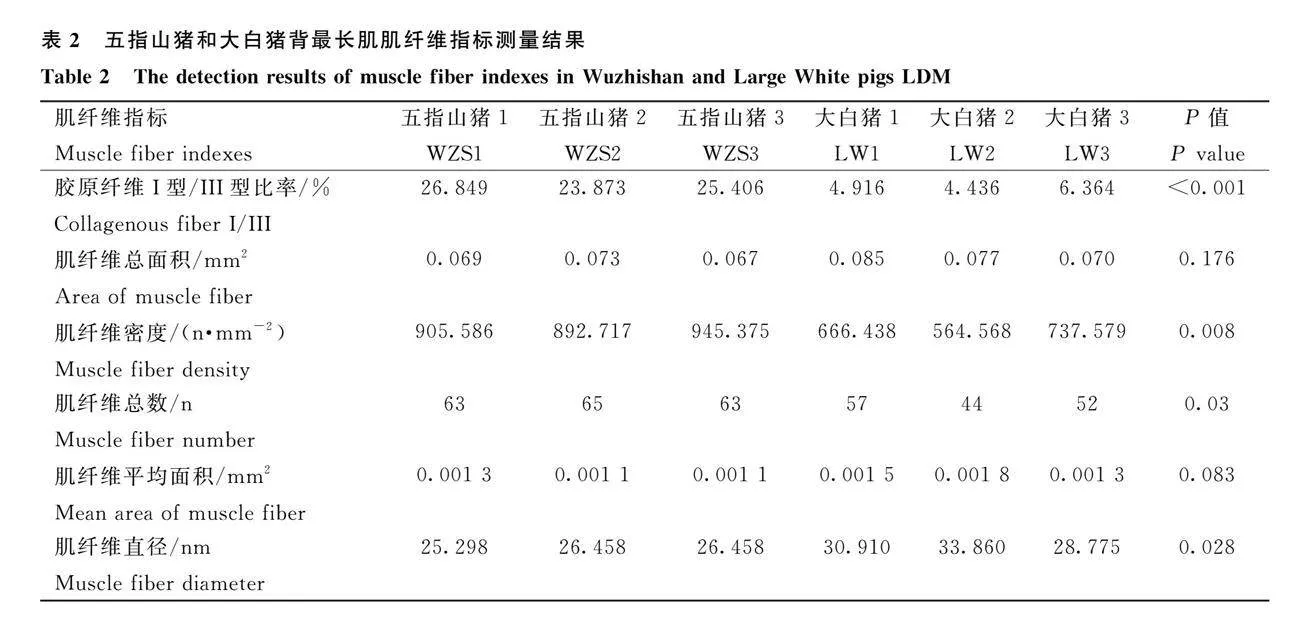
肌纖維呈較粗不規(guī)則性狀,膠原纖維呈均勻細長的絲狀。通過HE切片染色初步比較五指山豬與大白豬肌纖維密度(圖3A和3B),利用天狼猩紅染色比較兩個品種I型和III型膠原纖維含量(圖3C和3D,表2)。HE染色圖片顯示,以100 μm為比例尺的視野中,五指山豬肌纖維排列比大白豬相對緊密;天狼猩紅染色圖片顯示,五指山豬肌纖維的橙色(I型膠原纖維)含量比大白豬多。肌纖維指標測量值的結果表明,五指山豬與大白豬相比,肌纖維密度顯著增高、肌纖維直徑顯著減小,膠原纖維I型/III型比例有增大趨勢。成熟骨骼肌細胞外基質(zhì)層分子組成主要由Ⅰ型和Ⅲ型膠原參與控制,這些纖維分子協(xié)助肌肉內(nèi)部承受巨大的壓力,使骨骼肌細胞外基質(zhì)能夠向肌腱傳遞能量。檢測結果表明,五指山豬和大白豬膠原纖維I型/III型比例無顯著差異,說明兩個豬品種膠原纖維I型或III型可能不是影響肌肉生長發(fā)育的主要因素。
2.4 MYH基因表達量與肌纖維指標相關性分析
轉(zhuǎn)錄組檢測MYH基因表達量結果表明,共
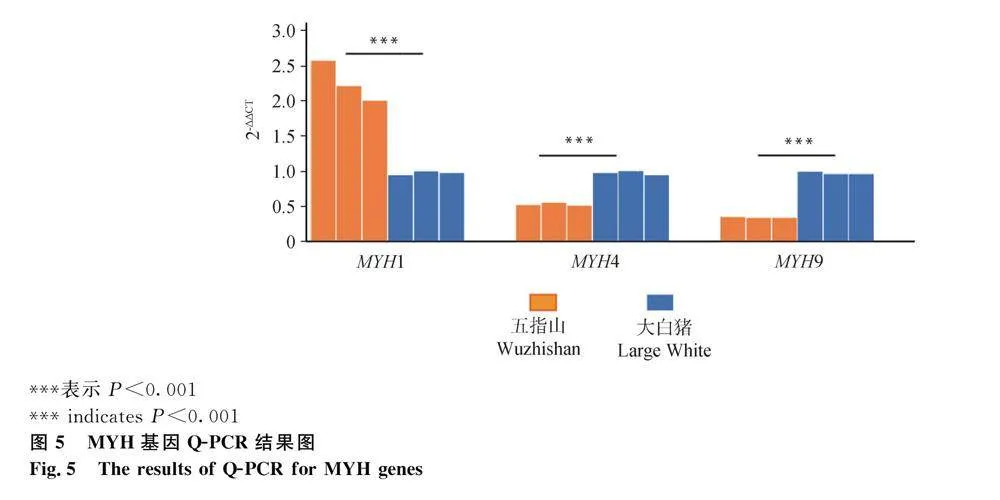
6個基因在背最長肌組織中表達(表3)。五指山豬和大白豬5個MYH基因表達差異顯著,其中五指山豬4個基因(MYH4、MYH9、MYH10、MYH14)表達量顯著低于大白豬,MYH1基因表達量顯著高于大白豬(表3)。兩個豬品種的MYH1基因表達量與其它4個表達差異顯著的基因呈現(xiàn)相反的趨勢。
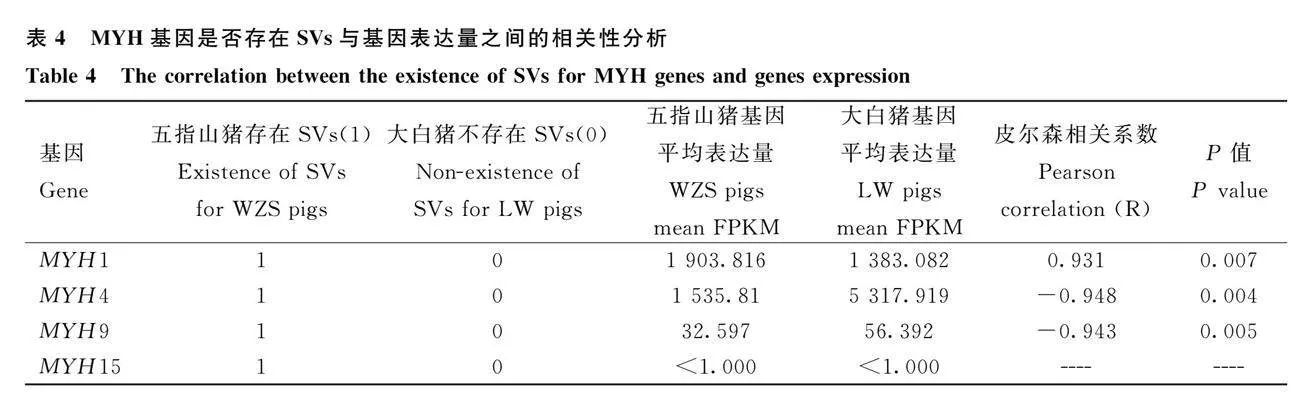
皮爾森相關系數(shù)及顯著性分析結果表明, MYH基因是否存在SVs與基因表達量之間可能具有相關性(表4)。五指山豬的4個MYH基因(MYH1、MYH4、MYH9和MYH15)具有SVs,而大白豬的4個MYH基因沒有SVs(表1)。差異表達基因MYH1、MYH4和MYH9表達量分別與這3個基因是否存在SVs顯著相關,由于五指山豬和大白豬MYH15基因表達量都很低(FPKMlt;1),無法計算皮爾森相關系數(shù)。
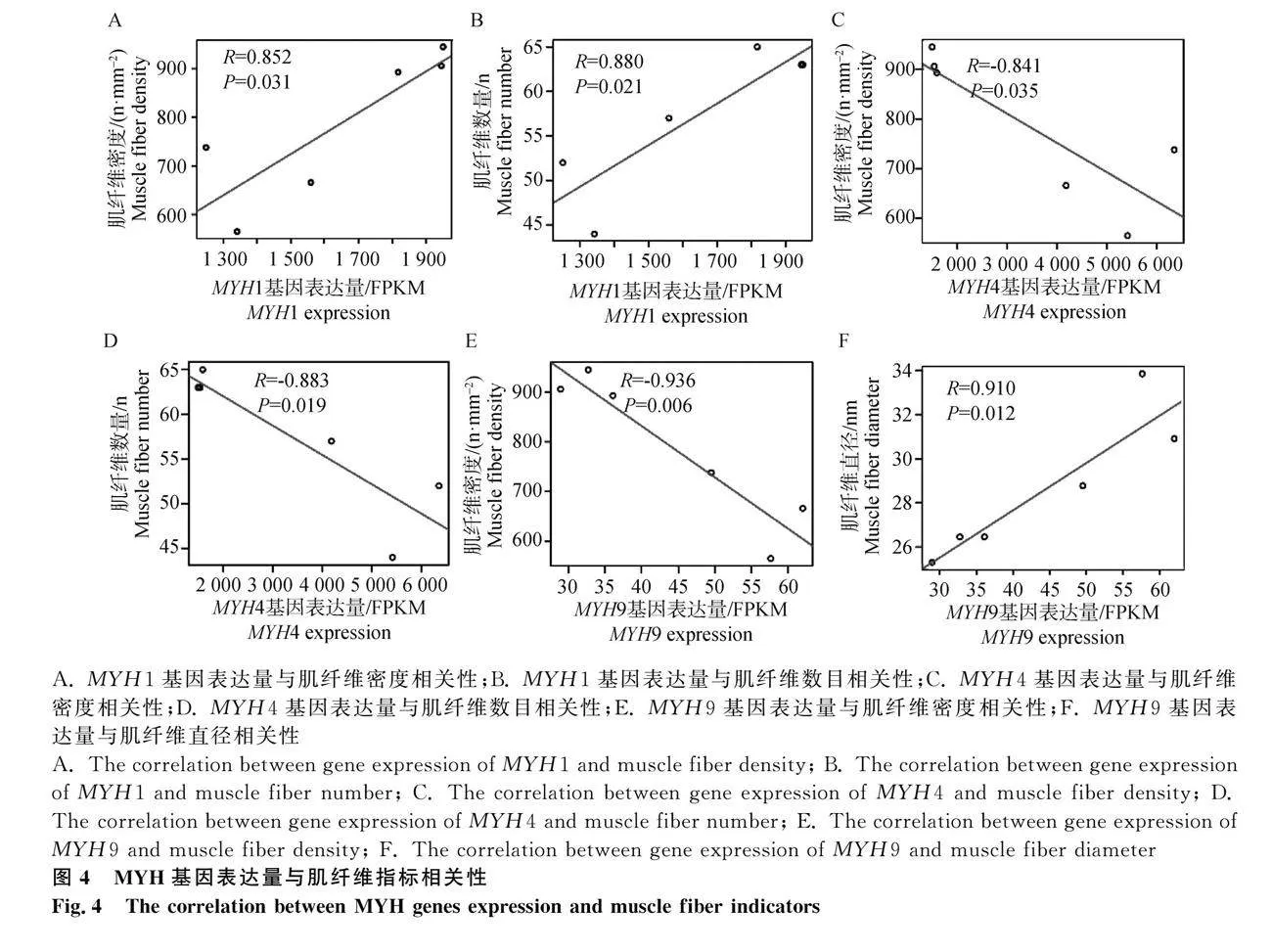
進一步采用皮爾森相關系數(shù)分析差異表達基因MYH1、MYH4和MYH9表達量與肌纖維指標的相關性,發(fā)現(xiàn)這3個MYH基因與肌纖維密度顯著相關。其中MYH1基因表達量與肌纖維密度、肌纖維數(shù)目正相關(圖4A和4B),MYH4基因與肌纖維密度、肌纖維數(shù)目負相關(圖4C和4D),MYH9與肌纖維密度負相關,與肌纖維直徑正相關(圖4E和4F)。
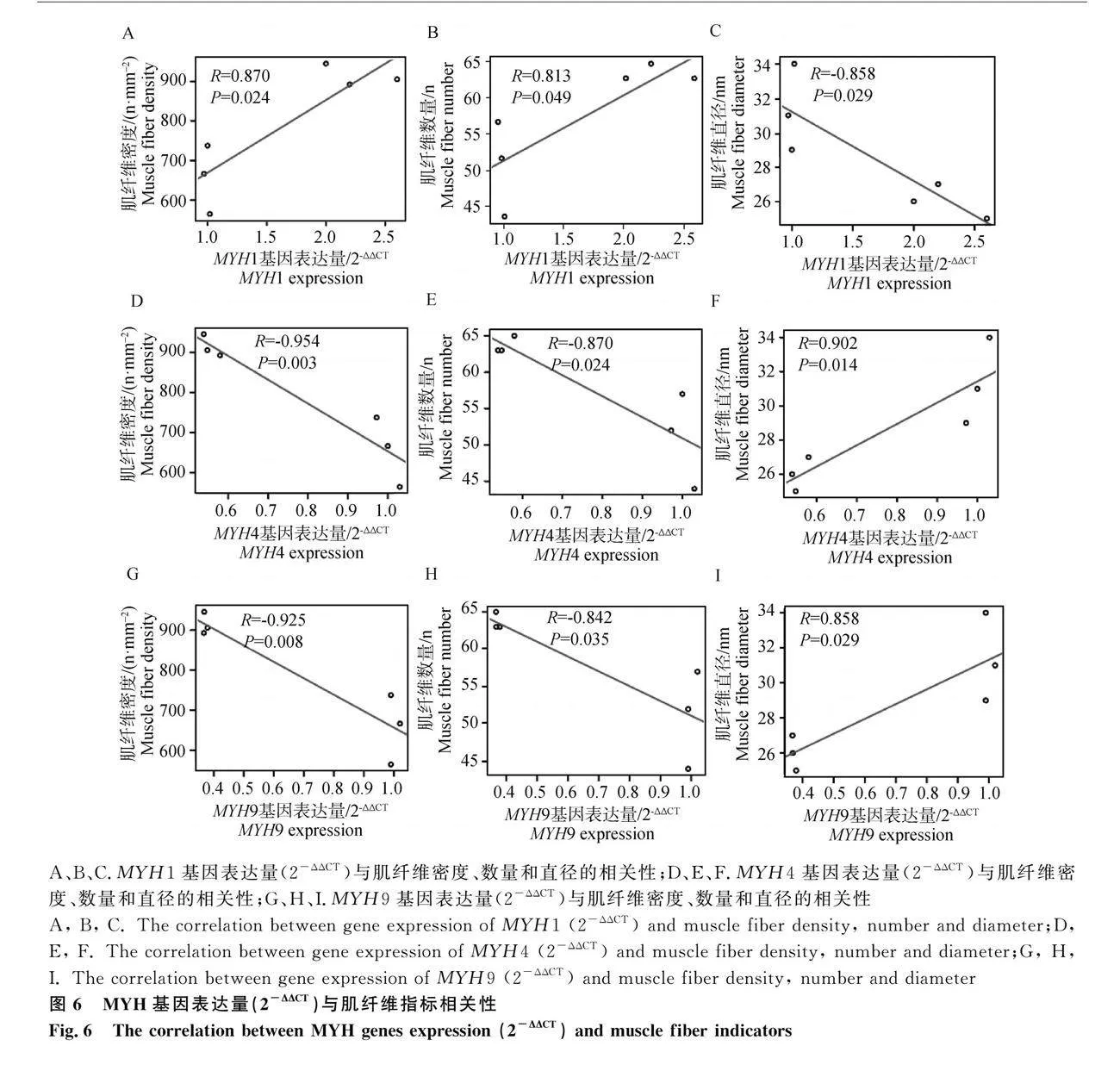
進一步采用Q-PCR方法驗證MYH1、MYH4和MYH9基因表達量,并分析這3個基因表達量與肌纖維指標的相關性。Q-PCR試驗結果表明,五指山豬MYH1基因表達量顯著高于大白豬,MYH4和MYH9基因表達量顯著低于大白豬(圖5),該結果與轉(zhuǎn)錄組檢測結果一致。而且這3個基因表達量(2-ΔΔCT)均與3個肌纖維指標(肌纖維密度、數(shù)目、直徑)顯著相關。MYH1基因表達量與肌纖維密度和肌纖維數(shù)量正相關,與肌纖維直徑負相關(圖6A、6B和6C);MYH4和MYH9基因表達量與肌纖維密度和肌纖維數(shù)量負相關,與肌纖維直徑正相關(圖6D、6E、6F、6G、6H和6I)。
3 討 論
本項目研究發(fā)現(xiàn),五指山豬共有7個MYH基因檢測到特異性SVs,主要分布在第3、5、6、12、13號染色體。系統(tǒng)發(fā)育樹顯示MYH基因在進化演變過程中主要分化出兩個分支,分別包含非肌肉肌球蛋白和肌肉肌球蛋白。MYH基因結構域Myosin-N和Motor domain相對保守,造成基因分化的可能是中間和尾部的結構域。物種進化過程中,除了在生存環(huán)境突發(fā)劇烈變化的特殊時期(例如地殼遷移、海嘯等海陸演變的歷史階段),群體中少數(shù)發(fā)生基因組結構變異的個體具有特異性表型性狀,能夠適應新環(huán)境并繁衍后代,渡過群體瓶頸期,擴大群體規(guī)模;大多數(shù)情況下,基因組大片段結構變異對生物群體生長發(fā)育和繁衍弊大于利。自然選擇能夠有效規(guī)避基因序列中罕見SVs對生物個體造成的危害,淘汰有害變異,保留有利于物種適應環(huán)境性狀的SVs[27]。五指山豬是一種小型豬,具有反應靈敏、善于奔跑、遺傳穩(wěn)定、代謝率低、適應性強等優(yōu)良特性,這些特性都與肌肉生長發(fā)育和能量代謝有關,而且相比于其它豬品種(杜洛克豬、大白豬、梅山豬和湘西黑豬),五指山豬的馴化時間較短[23],說明五指山豬肌肉生長特征可能是生存環(huán)境塑造的適應性表型。
系統(tǒng)發(fā)育樹7個MYH基因具有不同特征。MYH蛋白都具有結構域Motor domain,檢測到5個MYH含有保守結構域Myosin-N。在其中一個分支中,MYH9、MYH10和MYH11蛋白都具有相同結構域,都屬于非肌肉肌球蛋白;MYH9和MYH11結構域的序列長度和位置都非常相似,親緣關系最近。在另一個分支中,MYH1和MYH4親緣關系較近,都屬于肌肉肌球蛋白。MYH9、MYH10、MYH11、MYH1和MYH4蛋白都具有結構域Myosin-N和Motor domain,但是屬于2個分支,說明MYH蛋白頭部(Myosin-N和Motor domain)結構域相對保守,中間和尾部結構域差異較大,可能是產(chǎn)生MYH基因分化的主要原因。
MYH基因家族共6個MYH基因在五指山豬和大白豬背最長肌表達,其中5個MYH基因在兩個豬品種表達量差異顯著,共4個MYH基因(MYH14、MYH4、MYH9和MYH10)在五指山的表達量顯著低于大白豬,MYH1基因的表達量顯著高于大白豬。五指山豬MYH1、MYH4、MYH9基因具有SVs,而大白豬沒有SVs,皮爾森相關系數(shù)表明,這3個MYH基因是否存在SVs與基因表達量相關。進一步分析MYH1、MYH4、MYH9基因表達量與肌纖維指標的相關性,轉(zhuǎn)錄組測序數(shù)據(jù)表明,MYH1基因表達量與肌纖維密度和數(shù)目正相關,MYH4基因表達量與肌纖維密度和數(shù)目負相關,MYH9基因表達量與肌纖維密度負相關,與肌纖維直徑正相關;Q-PCR試驗驗證了上述結果。全基因組關聯(lián)分析表明,豬12號染色體MYH基因家族與肌纖維數(shù)目顯著關聯(lián)[8],馬身豬(小型豬)背最長肌肌纖維直徑顯著小于大白豬,而肌纖維密度顯著高于大白豬[9],該結果與本研究中五指山豬和大白豬肌纖維指標結果類似,說明肌纖維數(shù)目可能與豬體型有關。牛MYH1基因啟動子活性在成肌細胞C2C12中高于脂肪細胞模型3T3-L1[28]。綿羊胎兒成肌細胞分化過程中,MYF6、MYH1、 MYH2、MYH4和MYH7基因表達量增加,促進肌肉生長[29],其中MYH1和MYH4基因表達量水平一致,本研究中,MYH1、MYH4和MYH9基因都與肌纖維數(shù)目相關,但是MYH1和MYH4基因表達量趨勢相反,可能與不同物種、不同生長發(fā)育時期或不同組織有關。MYH9基因通常被認為編碼非肌肉肌球蛋白,然而研究結果表明MYH9基因調(diào)控雞的骨骼肌纖維生長速度[30],也與西伯利亞鱘肌纖維直徑長度相關[31]。本研究中,MYH9基因表達量和肌纖維密度和直徑顯著相關,說明骨骼肌生長不僅依賴肌肉肌球蛋白,也需要非肌肉肌球蛋白。
MYH1外顯子區(qū)域2個SVs可能影響基因功能。MYH1和MYH9蛋白共有的結構域Moter domain可能與肌肉病變有關[32]。馬MYH1蛋白E321G氨基酸發(fā)生替換之后,改變Myosin head結構域功能,導致肌纖維收縮異常[33]。全外顯子測序結果表明,編碼人類肌纖維蛋白的MYH1基因錯義突變可能導致人類橫紋肌溶解和肌肉損傷,而且該突變位點的致病效應與馬E321G氨基酸替換導致肌肉病變的癥狀類似[34]。對小鼠MYH1基因引入無義移碼突變,編碼蛋白序列紊亂,導致出生2周后的小鼠開始出現(xiàn)骨骼肌發(fā)育不良[35]。本研究中,五指山豬背最長肌MYH1基因表達量與肌纖維密度成正比,與肌纖維直徑成反比,而且外顯子區(qū)域包含2個SVs,表明五指山豬可能通過SVs調(diào)控MYH1基因表達量,從而影響背最長肌肌纖維密度。本研究采用轉(zhuǎn)錄組測序、Q-PCR試驗驗證和相關性分析等多種方法探討MYH基因?qū)±w維的影響,不足之處是肌纖維指標檢測樣本量較少,相關結論還需進一步擴大樣本量深入研究。
4 結 論
五指山豬特異性MYH基因主要分布在第3、5、6、12、13號染色體,其中第12號染色體包含基因數(shù)目最多,分別是MYH1、MYH4和MYH10。五指山豬MYH蛋白頭部結構域Myosin-N和Motor domain相對保守,造成基因分化的可能是中間尾部結構域。皮爾森相關系數(shù)分析表明,MYH1、MYH4和MYH9基因是否存在SVs與基因表達量相關。五指山豬MYH1基因表達量高于大白豬;兩個豬品種MYH1基因表達量趨勢與MYH4和MYH9基因相反;綜合轉(zhuǎn)錄組測序和Q-PCR檢測的基因表達量與肌纖維指標相關性結果,取兩者交集,MYH1基因表達量與肌纖維密度和數(shù)量正相關,MYH4基因表達量與肌纖維密度和數(shù)量負相關,MYH9基因表達量與肌纖維密度負相關,與直徑呈正相關;說明五指山豬背最長肌生長不僅依賴肌肉肌球蛋白,也需要非肌肉肌球蛋白。MYH1、MYH4和MYH9基因均與肌纖維密度相關,可能通過調(diào)控背最長肌肌纖維密度影響肌肉生長發(fā)育。本研究結果不僅擴展了五指山豬背最長肌肌纖維分子機制的相關內(nèi)容,也為優(yōu)化結構變異有關的遺傳育種模式提供借鑒。
參考文獻(References):
[1] 曹 婷,周漢林,于 萍,等.五指山豬資源現(xiàn)狀、保護及開發(fā)利用[J].家畜生態(tài)學報,2017,38(7):79-83.
CAO T,ZHOU H L,YU P,et al.The status Quo,protection,development and utilization of Wuzhishan pig resources[J]. Acta Ecologae Animalis Domastici,2017,38(7):79-83.(in Chinese)
[2] 王 峰,孫瑞萍,晁 哲,等.五指山豬與臨高豬雜交利用效果研究[J].豬業(yè)科學,2023,40(6):120-122.
WANG F,SUN R P,CHAO Z,et al.Study on cross utilization effect of Wuzhishan pig and Lingao pig[J].Swine Industry Science,2023,40(6):120-122.(in Chinese)
[3] PECCI A,MA X F,SAVOIA A, et al.MYH9:structure,functions and role of non-muscle myosin IIA in human disease[J].Gene,2018,664:152-167.
[4] 吳 駿,蔡曉鈿,林 清,等.大白豬眼肌面積、估計瘦肉率和背膘厚的加權一步法全基因組關聯(lián)分析[J].畜牧獸醫(yī)學報,2023,54(4):1403-1414.
WU J,CAI X D,LIN Q,et al.Weighted single-step GWAS of eye muscle area,predicted lean meat percentage and average backfat thickness in a Yorkshire pig population[J].Acta Veterinaria et Zootechnica Sinica,2023,54(4):1403-1414.(in Chinese)
[5] LONG K R,SU D,LI X K,et al.Identification of enhancers responsible for the coordinated expression of myosin heavy chain isoforms in skeletal muscle[J].BMC Genomics,2022,23(1):519.
[6] HETTIGE P,TAHIR U,NISHIKAWA K C,et al.Transcriptomic profiles of muscular dystrophy with myositis (mdm) in extensor digitorum longus,psoas,and soleus muscles from mice[J].BMC Genomics,2022,23(1):657.
[7] 張 力,許加龍,黃錦鈺,等.鵝骨骼肌衛(wèi)星細胞的分離培養(yǎng)與鑒定[J].畜牧獸醫(yī)學報,2023,54(10):4186-4195.
ZHANG L,XU J L,HUANG J Y,et al.Isolation,culture,and identification of skeletal muscle satellite cells in goose[J].Acta Veterinaria et Zootechnica Sinica,2023,54(10):4186-4195.(in Chinese)
[8] HUANG Y Z,CAI L P,DUAN Y Y,et al.Whole-genome sequence-based association analyses on an eight-breed crossed heterogeneous stock of pigs reveal the genetic basis of skeletal muscle fiber characteristics[J].Meat Sci,2022,194:108974.
[9] 成志敏,張寧芳,王媛媛,等.基于RNA-Seq技術篩選影響豬肌纖維性狀的候選基因[J].畜牧獸醫(yī)學報,2019,50(5):918-929.
CHENG Z M,ZHANG N F,WANG Y Y,et al.Screening of candidate genes for muscle fiber characteristics in pig using RNA-Seq[J].Acta Veterinaria et Zootechnica Sinica,2019,50(5):918-929.(in Chinese)
[10] 周 娟,孟祥瓊,秦鴻楠,等.不同海拔牦牛骨骼肌肌纖維類型和MYHC基因表達的比較[J].中國獸醫(yī)學報,2022, 42(6):1263-1269.
ZHOU J,MENG X Q,QIN H N,et al.Comparative on skeletal muscle fiber types and MYHC gene expression in yaks at different altitudes[J].Chinese Journal of Veterinary Science,2022,42(6):1263-1269.(in Chinese)
[11] 李文文,徐革鋒,黃天晴,等.基于轉(zhuǎn)錄組測序篩選烏蘇里白鮭肌肉生長關鍵候選基因研究[J].漁業(yè)科學進展,2024, 45(3):87-100.
LI W W,XU G F,HUANG T Q,et al.Screening muscle growth-related genes of Coregonus ussurinsis berg based on transcriptome sequencing[J].Progress in Fishery Sciences,2024,45(3):87-100.(in Chinese)
[12] HOLLOX E J,ZUCCHERATO L W,TUCCI S.Genome structural variation in human evolution[J].Trends Genet,2022,38(1): 45-58.
[13] FAN S H,KONG C C,CHEN Y G,et al.Copy number variation analysis revealed the evolutionary difference between Chinese indigenous pigs and Asian wild boars[J].Genes (Basel),2023,14(2):472.
[14] ZHOU R,LI S T,YAO W Y,et al.The Meishan pig genome reveals structural variation-mediated gene expression and phenotypic divergence underlying Asian pig domestication[J].Mol Ecol Resour,2021,21(6):2077-2092.
[15] LI Z C,LIU X H,WANG C,et al.The pig pangenome provides insights into the roles of coding structural variations in genetic diversity and adaptation[J].Genome Res,2023,33(10):1833-1847.
[16] HE W T,JI X,HE W,et al.Genomic epidemiology,evolution,and transmission dynamics of porcine deltacoronavirus[J].Mol Biol Evol,2020,37(9):2641-2654.
[17] LI X,LIU Q,F(xiàn)U C,et al.Characterizing structural variants based on graph-genotyping provides insights into pig domestication and local adaption[J].J Genet Genomics,2024,51(4):394-406.
[18] HU L Y,YU J J,HUANG R,et al.Copy number variation of the CCDC39 gene is associated with growth traits in Chinese cattle[J].Vet Med Sci,2022,8(2):917-924.
[19] 楊 曼,劉 海,張 潤,等.北京黑豬MYH3和MYH13基因多態(tài)性與肉質(zhì)性狀的關聯(lián)分析[J].中國畜牧獸醫(yī),2022,49(9):3428-3437.
YANG M,LIU H,ZHANG R,et al.Association analysis of polymorphism of MYH3 and MYH13 genes with meat quality traits in Beijing black pigs[J].China Animal Husbandry amp; Veterinary Medicine,2022,49(9):3428-3437.(in Chinese)
[20] 路 暢,董 磊,張萬鋒,等.基于全基因組重測序?qū)x汾白豬單核苷酸多態(tài)性位點鑒定和篩選[J].畜牧獸醫(yī)學報,2023, 54(7):2761-2771.
LU C,DONG L,ZHANG W F,et al.Identification and screening of single nucleotide polymorphism loci in Jinfen white pigs based on whole genome resequencing[J].Acta Veterinaria et Zootechnica Sinica,2023,54(7):2761-2771.(in Chinese)
[21] ESTEVE-CODINA A,KOFLER R,PALMIERI N,et al.Exploring the gonad transcriptome of two extreme male pigs with RNA-seq[J].BMC Genomics,2011,12:552.
[22] LIU C,RAN X Q,YU C Y,et al.Whole-genome analysis of structural variations between Xiang pigs with larger litter sizes and those with smaller litter sizes[J].Genomics,2019,111(3):310-319.
[23] REN Y W,WANG F,SUN R P,et al.The genetic selection of HSPD1 and HSPE1 reduce inflammation of liver and spleen while restraining the growth and development of skeletal muscle in Wuzhishan pigs[J].Animals (Basel),2024,14(1):174.
[24] KIM D,LANGMEAD B,SALZBERG S L.HISAT:a fast spliced aligner with low memory requirements[J].Nat Methods,2015, 12(4):357-360.
[25] ANDERS S,PYL P T,HUBER W.HTSeq—a python framework to work with high-throughput sequencing data[J]. Bioinformatics,2015,31(2):166-169.
[26] LOVE M I,HUBER W,ANDERS S.Moderated estimation of fold change and dispersion for RNA-seq data with DESeq2[J]. Genome Biol,2014,15(12):550.
[27] COLLINS R L,BRAND H,KARCZEWSKI K J,et al.A structural variation reference for medical and population genetics[J]. Nature,2020,581(7809):444-451.
[28] 陳 偉,許厚強,陳 祥,等.牛UCP3和MYH1基因啟動子在C2C12和3T3-L1細胞中的啟動活性分析[J].中國畜牧獸醫(yī),2020,47(12):3825-3832.
CHEN W,XU H Q,CHEN X,et al.Promoters activity analysis of UCP3 and MYH1 genes of cattle in C2C12 and 3T3-L1 cells[J].China Animal Husbandry amp; Veterinary Medicine,2020,47(12):3825-3832.(in Chinese)
[29] WANG H J,DOU M M,LI J,et al.Expression patterns and correlation analyses of muscle-specific genes in the process of sheep myoblast differentiation[J].In Vitro Cell Dev Biol Anim,2022,58(9):798-809.
[30] WU P F,ZHOU K Z,ZHANG J,et al.Identification of crucial circRNAs in skeletal muscle during chicken embryonic development[J].BMC Genomics,2022,23(1):330.
[31] YANG S Y,ZHANG J J,XU Z H,et al.Dietary resveratrol improves the flesh quality of Siberian sturgeon (Acipenser baerii) by enhancing myofiber growth,nutrient accumulation and antioxidant capacity[J].BMC Genomics,2024,25(1):514.
[32] POPPELAARS F,ESKANDARI S K,DAMMAN J,et al.A non-muscle myosin heavy chain 9 genetic variant is associated with graft failure following kidney transplantation[J].Kidney Res Clin Pract,2023,42(3):389-402.
[33] OCHALA J,F(xiàn)INNO C J,VALBERG S J.Myofibre hyper-contractility in horses expressing the myosin heavy chain myopathy mutation,MYH1E321G[J].Cells,2021,10(12):3428.
[34] ALSAIF H S,ALSHEHRI A,SULAIMAN R A,et al.MYH1 is a candidate gene for recurrent rhabdomyolysis in humans[J].Am J Med Genet A,2021,185(7):2131-2135.
[35] HITACHI K,KIYOFUJI Y,YAMAGUCHI H,et al.Simultaneous loss of skeletal muscle myosin heavy chain IIx and IIb causes severe skeletal muscle hypoplasia in postnatal mice[J].FASEB J,2023,37(1):e22692.
(編輯 郭云雁)

