正交法優選炒菟絲子的最佳炮制工藝
徐 鑫, 張學蘭, 唐 超
(山東中醫藥大學,山東濟南 250355)
菟絲子為旋花科植物菟絲子南方菟絲子Cuscuta australisR.Br.或菟絲子Cuscuta chinensisLam.的干燥成熟種子,具有滋補肝腎,固精縮尿,安胎,明目,止瀉等作用,臨床上常用于肝腎不足,腰膝酸軟,陽痿遺精,遺尿尿頻,腎虛胎漏等的治療[1]。現代文獻研究表明,菟絲子的化學成分主要含有黃酮類、甾類化合物、多糖、微量元素及氨基酸等[2-4]。藥理實驗研究表明,菟絲子中黃酮類特征成分金絲桃苷是菟絲子的主要活性成分,具有保護肝組織和增強免疫等作用[5]。目前中國藥典收載的菟絲子規格為菟絲子和鹽菟絲子,炒菟絲子作為傳統的炮制規格,目前還缺乏深入而系統的研究,本實驗研究了清炒菟絲子的客觀工藝技術參數,為炒菟絲子飲片的質量標準和炮制機理研究提供實驗依據。
1 儀器與試藥
菟絲子藥材,產地山東,購自亳州成源中藥飲片有限公司(批號:20090501),經周鳳琴教授鑒定為旋花科植物菟絲子Cuscuta chinensisLam.的干燥成熟種子。
多星電炒鍋(淄博多星電器集團有限責任公司);PM PLUS型紅外測溫儀(美國Raytek公司);KQ-250E型醫用超聲波清洗器(江蘇昆山市超聲儀器有限公司);LDZ4-0.8型離心機(北京醫用離心機廠);1100型高效液相色譜儀、工作站及紫外檢測器(美國Agilent公司)。
金絲桃苷對照品(批號:111521-200303)購自中國藥品生物制品檢定所;高效液相用乙腈為色譜純;濰坊娃哈哈飲料有限公司純凈水,其余試劑均為分析純。
2 方法與結果
2.1 清炒工藝的設計 炒制溫度和炒制時間對藥材質量影響較大,采用正交實驗設計法,因素與水平見表1,正交試驗安排見表2,進行工藝優選。

表1 因素與水平
2.2 樣品的制備 藥材的投藥量為50 g,取9份,按正交設計表的組合,用紅外測溫儀測定鍋底溫度,進行炒制,各樣品性狀及成品得率見表3。
2.3 含水量的測定 取2.2項下的各樣品(過2號篩)約2.5g,精密稱定,按《中國藥典》2010版一部附錄項下的烘干法測定,9份樣品的含水量為1.42% ~4.76%,樣品中各指標成分的含量以干燥品計算。
2.4 HPLC法測定金絲桃苷含量[1]
2.4.1 色譜條件 KromasiL C18色譜柱;以乙腈-0.1%磷酸水(17∶83)為流動相,流速為1.0 mL/min;柱溫為30℃;檢測波長為360 nm;參比波長為400 nm;進樣量為20 μL。
2.4.2 對照液的制備 取金絲桃苷對照品20.24 mg,精密稱定,加甲醇溶解并稀釋至25 mL量瓶中,得到對照液貯備液,備用,并依次精密吸取金絲桃苷對照液貯備液0.2、0.4、0.6、0.8、1.0、1.2 mL 置10 mL 量瓶中,加甲醇稀釋至刻度,搖勻,即得對照液。
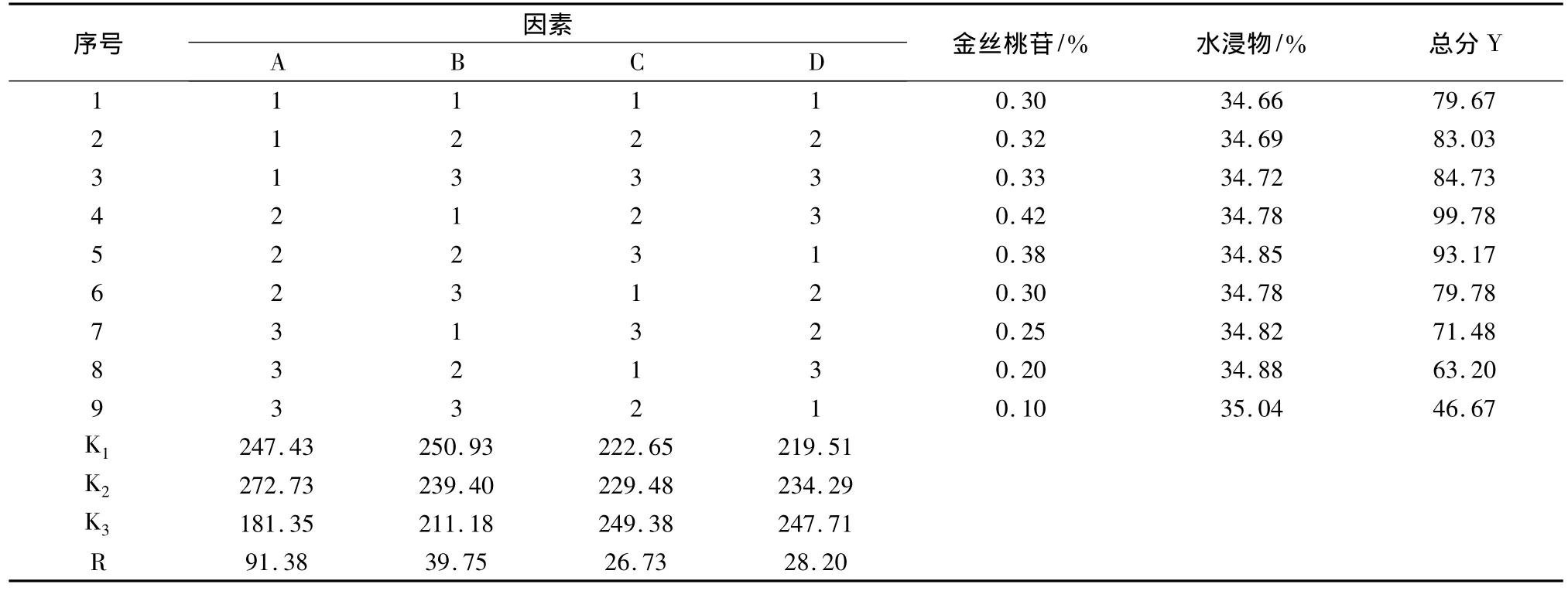
表2正交試驗結果

表3 菟絲子樣品性狀及成品得率
2.4.3 供試液的制備 取菟絲子各炒品過4號篩粉末約1 g,精密稱定,置50 mL量瓶中,加80%甲醇40 mL超聲處理(功率250 W,頻率40 kHz)60 min,放冷,加80%甲醇稀釋至刻度,搖勻,濾過,取續濾液,微孔濾膜濾過,作為供試液。
2.4.4 標準曲線的繪制 用2.4.2項中的對照品溶液,按2.4.1項下色譜條件進行測定以峰面積Y對金絲桃苷濃度X進行線性回歸,得回歸方程為Y=23.652X-4.794 6(R=0.999 6)。實驗表明,金絲桃苷濃度在0.016 2~0.097 2 mg/mL范圍內,峰面積與濃度呈良好的線性關系。
2.4.5 精密度試驗 取4號供試品溶液,按2.4.1項下色譜條件連續進樣6次,金絲桃苷峰面積的RSD為0.49%。
2.4.6 穩定性試驗 取4號供試液,按2.4.1項下色譜條件分別于 0、2、4、6、8、12 h 時進樣,金絲桃苷峰面積的 RSD為0.99%,可見在12 h內供試液穩定。
2.4.7 重復性試驗 取4號樣品,平行制備6份供試液,按2.4.1項下色譜條件進樣,RSD為1.43%,可見方法重現性良好。
2.4.8 加樣回收率試驗 取已知金絲桃苷含量的4號樣品約1 g,精密稱定,共稱取6份,分別置50 mL量瓶中,各加入金絲桃苷對照品溶液(0.809 6 mg/mL)6 mL,再按2.4.3項方法制備,按2.4.1項下色譜條件進樣,依法測定,結果其平均回收率為96.38%,RSD為1.46%,見表4。
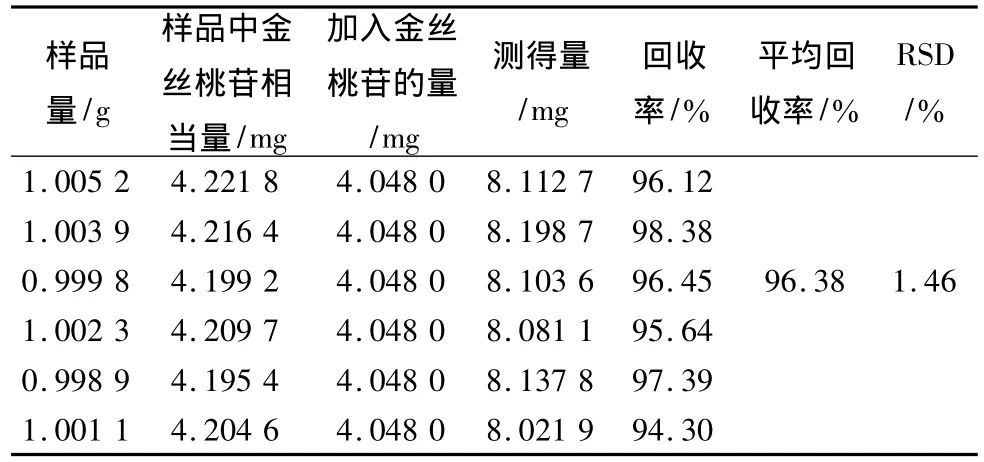
表4 回收率測定結果
2.4.9 供試品含量測定 取金絲桃苷對照液與供試液按2.4.1項下色譜條件進樣,依法測定,色譜圖見圖1,含量測定結果見表2。
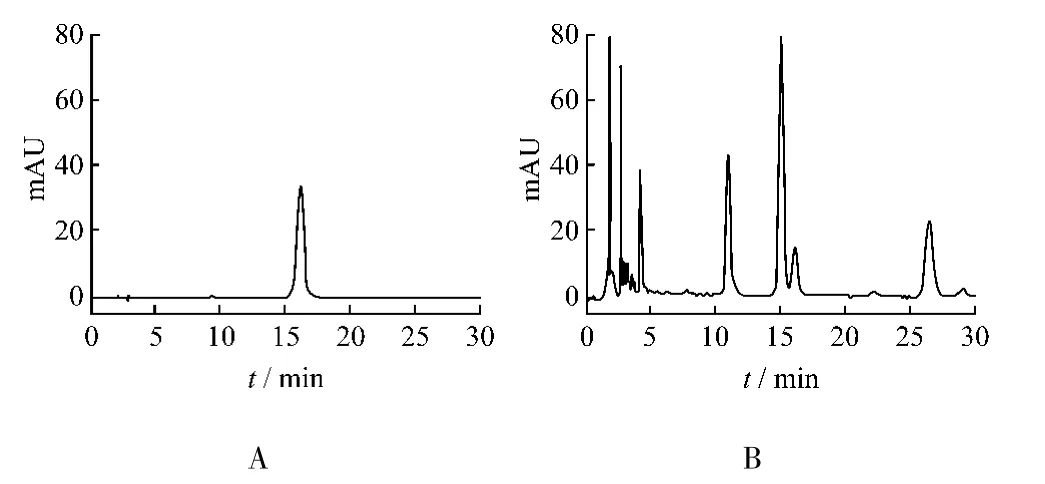
圖1金絲桃苷對照品(A)、2號樣品(B)HPLC圖
2.5 水溶性浸出物含量測定 取過2號篩的各樣品粉末約2 g,精密稱定,置250 mL錐形瓶中,分別精密加水100 mL,密塞,稱定重量,靜置1 h,連接回流冷凝管,加熱至沸騰,保持微沸回流1 h,放冷后,取下錐形瓶,密塞,稱定重量,補足失重,搖勻,離心(3 000 r/min,20 min),精密量取續濾液25 mL至已干燥至恒重的蒸發皿中,水浴蒸干后,于105℃干燥3 h,置干燥器中冷卻30 min,迅速精密稱定重量,結果見表2。
2.6 最佳炮制工藝條件的優選 以炮制品中金絲桃苷(測定方法見2.4.9項,n=3)、水溶性浸出物含量(測定方法見2.5項,n=3)為指標,利用綜合加權評分法確定最佳的炮制方法。具體權重為:金絲桃苷的含量占70%,水溶性浸出物含量占30%。各項試驗指標得分相加求出綜合評價值,以綜合評價值對實驗結果進行直觀分析和方差分析。評分標準見表5,結果見表2。由表2結果可以看出,170℃炒制5 min為菟絲子清炒的最佳工藝。因素C,D為空白項,所以,選擇C,D列合并為誤差列。由表6方差分析結果可以看出,炒制溫度是影響菟絲子飲片質量的主要因素,炒制時間沒有顯著性。

表5 各指標成分含量的評分標準
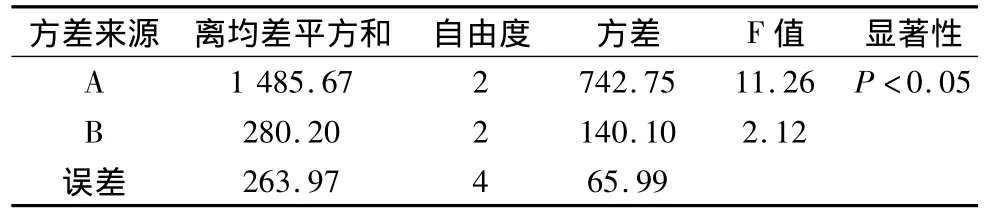
表6 方差分析
3 小結與討論
3.1 本實驗在對菟絲子炮制歷史沿革和現代文獻分析的基礎上,采用正交試驗設計法,選取金絲桃苷和水溶性浸物含量作指標,以炒制溫度和炒制時間作考察因素,優選出了炒菟絲子的炮制工藝,結果其最佳工藝為170℃炒制5 min。最佳工藝所炮制出的樣品,表面棕黃色,微有裂口,略有香氣。炒制溫度是影響菟絲子質量的主要因素。
3.2 菟絲子為臨床常用的補腎類中藥,其質地堅硬,傳統認為,菟絲子炒后可提高煎出效果,便于粉碎,利于制劑[6]。按本實驗相關方法測定菟絲子生品和最佳工藝炒制品中水溶性浸出物和金絲桃苷含量,結果表明水溶性浸出物和金絲桃苷含量均有增加,說明菟絲子炒制后確實利于其藥效成分的溶出。但炒制溫度過高或時間過長,金絲桃苷含量明顯降低,提示炒制溫度要適中。
3.3 菟絲子含黏液質較多,在按藥典附錄法測定樣品中水溶性浸出物含量時樣品難于過濾,所以本實驗采用離心法去除雜質。
[1]中國藥典[S]. 一部.2010:290-291.
[2]郭 澄,王雅君,張劍萍,等.菟絲子的化學成分和藥理活性研究[J].時珍國醫國藥,2005,16(10):1035-1036.
[3]葉 敏,閻玉凝,喬 梁,等.中藥菟絲子化學成分研究[J].中國中藥雜志,2002,27(2):115-117.
[4]林慧彬,林建強,林建群,等.山東4種菟絲子微量元素的比較研究[J].山東中醫雜志,2002,21(2):105-106.
[5]李敏芳,李 慧,王學美.金絲桃苷藥理作用研究進展[J].中國中醫藥信息雜志,2008,15(4):102-104.
[6]龔千鋒.中藥炮制學[M].北京:中國中醫藥出版社,2003:226.

