實驗性腦出血后大鼠行為學和血腫周圍組織病理學的研究
陳 娟 胡曉晴 劉永明 曾文高 倪厚杰 唐洲平
腦出血(intracerebral hem orrhage,ICH)發(fā)病率高,占急性腦血管病的20%~30%,急性期病死率可達30%~40%,是急性腦血管病中最高的[1]。本實驗采用VII型膠原酶法制備大鼠腦出血模型,觀察模型大鼠神經行為學和腦組織病理學的改變,進一步了解此模型特點為腦出血的研究提供依據。
1 材料與方法
1.1 材料和設備
實驗動物:健康SD大鼠40只,體重220~280 g,由華中科技大學同濟醫(yī)學院實驗動物中心提供[許可證號:SYXK(鄂)2004-2007]。主要設備:大鼠腦立體定位儀(淮北正華生物儀器設備有限公司),微量進樣器(上海佳安分析儀器廠),牙科鉆(鄭州市一美牙科工業(yè)有限公司),恒溫冰凍切片機(沈陽市龍首電子儀器有限公司),顯微鏡(日本OLYPUS公司)。
1.2 方法
1.2.1 根據Rosenberg等[2]報道的膠原酶誘導ICH模型法建立大鼠尾狀核ICH模型。實驗過程中對大鼠處置符合動物倫理學標準;6%水合氯醛腹腔麻醉大鼠(1m l/200 g),俯臥位將大鼠固定在江灣大鼠腦立體定位儀上,先將門齒掛在門齒鉤上,固定雙耳間線,再將門齒固定在門齒鉤上,使門齒鉤平面較耳間線平面低2.4 mm,使前囟和后囟位于同一平面上;頭顱頂部常規(guī)消毒后在雙耳間線與雙眼間線之間取正中矢狀切口1.5 cm,切開至皮下;3%雙氧水腐蝕顱骨外膜,暴露前囟及冠狀縫;根據包新民圖譜[6]定位右側尾狀核(前囟右旁開3.2 mm,硬腦膜下5.6mm,向后1.4mm),在此處用牙科鉆鉆一直徑約1.0mm的圓孔,深達硬腦膜表面;用微量注射器抽取Ⅶ型膠原酶液1.5μl(內含0.5 UⅦ型膠原酶),將微量注射器固定于定位儀上,沿鉆孔垂直進針至硬腦膜下5.6mm處,將Ⅶ型膠原酶液緩慢推注入腦內,約5min,停針2 min,緩慢退出顱外;用骨蠟封閉顱骨鉆孔,防液體沿針道外溢,最后縫合皮下組織及皮膚。假手術組除不注射VII型膠原酶外,其余條件完全一致。假手術組和腦出血組大鼠清醒后按照Zea Longa(0~4分)法對大鼠神經功能進行評分[3],即0分:無神經系統(tǒng)損傷癥狀,活動正常;1分:提尾時不能完全伸展對側前肢;2分:行走時身體向手術對側轉圈;3分:向手術對側傾倒;4分:不能自發(fā)行走,意識喪失。1~3分視為模型制作成功。各組大鼠在1、3、7、14、28 d五個時間點進行1次行為學評分。
1.2.2 組織形態(tài)學觀察 各組大鼠經水合氯醛麻醉后 ,ICH 后 1、3、7、14、28 d各時間點將大鼠斷頭取腦,oct膠包裹,于-80℃的異戊烷中速凍3~5 min,取出于-80℃冰箱保存?zhèn)溆?連續(xù)冰凍腦組織切片(10 um),以針孔為中心行冠狀位切片;切片行常規(guī)HE染色,冰凍切片用多聚甲醛固定10~30 s,流水洗1~2 s,蘇木精液染色30~60 s,流水洗去蘇木精液 5~10 s,1%鹽酸乙醇 1~3 s,流水洗1~2 s,促藍液返藍 5~10 s,流水沖洗 15~30 s,0.5%伊紅染色 30~60 s,蒸餾水稍洗 1~2 s,80%乙醇1~2 s,95%乙醇 1~2 s,無水乙醇 1~2 s,石炭酸二甲苯 2~3 s,二甲苯(Ⅰ)2~3 s,二甲苯(Ⅱ)2~3 s,中性樹膠封固;在光鏡下觀察血腫及周圍組織學變化。
1.2.3 統(tǒng)計學處理 采用SPSS11.0軟件包,組間采用t檢驗,P<0.05為有顯著差異。
2 結 果
2.1 實驗動物數量 本實驗腦出血組共有6只大鼠被淘汰(其中4只于出血后48h死亡,考慮與嚴重腦水腫有關;2只無神經功能缺損癥狀,證實為血腫破入腦室而致),剔除上述情況后隨機補充,最終分析仍為40只大鼠。
2.2 神經行為學改變
假手術組的所有大鼠麻醉清醒后均無明顯神經功能缺損癥狀,神經行為學評分為0分,無明顯差異。腦出血組大鼠3d時神經功能缺損癥狀最重,神經行為學評分最高;1 d時神經行為學評分即非常明顯,隨著時間延長,7 d時評分開始降低,14 d時神經功能缺損已不明顯。腦出血組的神經行為學評分顯示3 d與1 d和7 d無明顯差異(P>0.05),而3 d與14、28 d差異顯著(P<0.05),且7 d與14、28 d時間點無顯著差異(P>0.05)(圖1)。
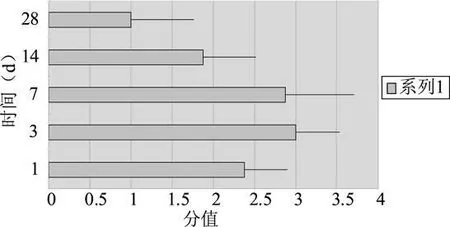
圖1 腦出血組的神經行為學評分顯示3 d時神經功能缺損癥狀最重,3 d與1和7 d無明顯差異(P>0.05),而3 d與14、28 d差異顯著(P<0.05),7 d與14、28 d時間點無顯著差異(P>0.05)
2.3 腦組織顯微結構觀察
假手術組:僅在針道周圍見少量散在的血細胞,以后可見少量增生的膠質細胞,其余部位無明顯病理改變,見圖2。腦出血組:腦出血1d時尾狀核即形成明顯的類圓形或不規(guī)則形血腫,血腫中心區(qū)有散在的神經細胞,周邊區(qū)有水腫,可見中性粒細胞浸潤;3 d時病灶區(qū)血腫仍明顯存在,腦組織明顯水腫,可見細胞間隙增寬,神經元腫脹、胞核溶解甚至消失,見圖3;7 d時血腫血細胞溶解增多,水腫減輕,細胞排列不整齊,核形態(tài)不規(guī)則,部分核皺縮,血腫及周圍神經元減少,膠質細胞增生,毛細血管增多,腦組織液化壞死,正常腦組織逐漸消失,見圖4;14 d時類圓形或不規(guī)則的血腫形成了囊腔,見圖5;28 d時囊腔仍在,周邊區(qū)見膠質細胞進一步增生,見圖6。

圖2 假手術組幾乎正常(HE染色×400倍)
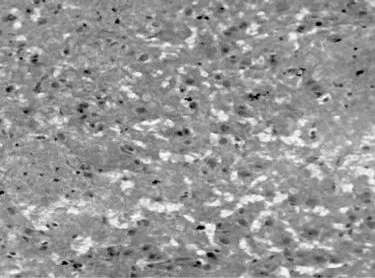
圖3 腦出血模型3 d血腫周圍腦組織細胞損害明顯,細胞腫脹,腦組織松散,顯微鏡下囊腔增多(HE染色,×400倍)
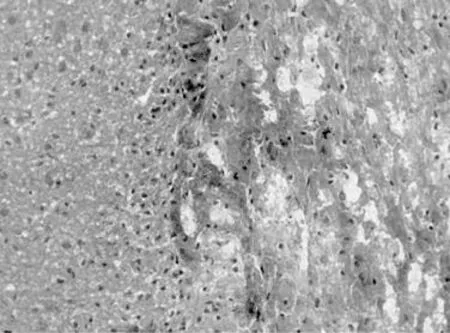
圖4 腦出血模型7 d星型膠質細胞增多,腦組織液化(HE染色×400倍)
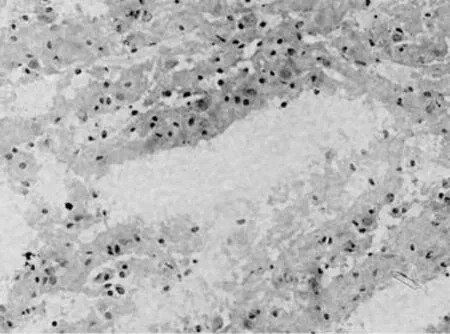
圖5 腦出血模型14 d,血腫不規(guī)則囊腔形成(HE染色×400倍)

圖6 腦出血模型28 d血腫囊腔仍然存在,周圍膠質細胞增多(HE染色×400倍)
3 討 論
動物模型的成功選擇是實驗的關鍵,目前國內外比較常用腦出血模型制作方法主要有四種[4]:自體血注入法、膠原酶誘導法、微氣囊充脹法、自發(fā)性腦出血模型。自體血注入法用于大鼠時的重復性差,尤其是注血量、血腫大小與部位難以掌握,所致血腫形態(tài)不一,常伴有血液外滲到胼胝體白質及腦室內。微氣囊充脹法未涉及到出血和腦實質之間的重要關系,且無血管活性因子的作用,故其與臨床脫節(jié)太多,現已較少應用。自發(fā)性腦出血模型亦因出血的發(fā)生、出血量及部位的不可靠而使其應用受到限制。膠原酶誘導法制作方法簡單,快捷且重復性好,與人類腦出血病理、生化和病理生理學有許多相似性[5],且這種模型可產生長期運動缺陷,為研究腦出血后神經功能的恢復和評價藥物療效提供了一個有用的模型[6]。故本實驗采取了此種模型。
本實驗結果表明,腦出血后1 d時即出現神經功能缺損癥狀,3 d時神經功能缺損癥狀最明顯,可能與腦出血后腦水腫有關,這與以往的研究結果一致。7 d時行為學評分下降,腦出血后14 d時大鼠神經功能缺損癥狀逐漸恢復。組間比較,腦出血7 d以后已無顯著差異。分析原因可能有大鼠神經功能恢復能力強,而腦出血后神經行為學有自然恢復的過程[7];另外Longa評分法較粗糙,不能精確顯示各組評分,且分值差距較小。腦出血的病理生理改變除血腫本身的占位性損害外,尚有周圍腦組織血液循環(huán)障礙、代謝紊亂如酸中毒、血管運動麻痹、血腦屏障受損及血液分解產物釋放多種生物活性物質對腦組織的損害。本實驗觀察到隨血細胞的滲出,腦水腫加劇,血腫部位出現明顯的小裂隙,隨著時間延長,血細胞吸收,這些裂隙擴大并匯合成囊腔,囊腔周圍有膠質細胞增生,隨后囊腔一直存在。
本實驗重現了腦出血后血腫的形成、血細胞的吸收、膠質細胞增生、囊腔形成等動態(tài)演變過程,這些變化過程結合大鼠腦出血模型為腦出血基礎研究及藥物干預治療時間窗提供了依據。
1 吳 江.神經病學.北京:人民衛(wèi)生出版社,2005.170.
2 Rosenberg GA,Mun-Bryce S,W esley M.et al.Collagenase--induced intracerebral hem orrhage in rats.Stroke,l990,2l(5):80l-807.
3 Zea Longa E1,Weinstein PR,Carlson S,et a1.Reversiblem iddle cereb ral artery occ lusion w ithou t cranectomy in rat.Stroke,1989,20(10):84-91.
4 張化彪,張?zhí)K明.腦出血模型.國外醫(yī)學腦血管疾病分冊,2002,11(10):469-471.
5 許 東,文玉軍,張蓮香,等.膠原酶注入小鼠尾狀核建立腦出血模型.中國實驗動物學報,2006,14(1):36-39.
6 李紅玲,李玉敏,楊 靜.自體血注入法和膠原酶注入法誘導腦出血動物模型的比較.中國臨床康復,2006,10(8):148-150.
7 Ji XH,Li nJ,Wang J.Efect of early rehabilitation intervention on nerve fun ctionrehabilitation of cereb ral hemor rhage patients in recovery stage.Zhong Guo Lin Chuang Kang Fu(Chin JC lin Rehabil),2002,6(11):1701.

