兩種PARP-1抑制劑對羥基喜樹堿誘導ECA-109細胞增殖及凋亡的影響
鄭永仁 何曉山 王 礡 楊曉密
云南中醫學院實驗中心,云南昆明 650500
喜樹堿(camptothecin,CPT)羥基喜樹堿(hydroxy camptothecin,HCPT)是一種植物抗癌藥物,在臨床上已廣泛用于食管癌、胃癌、腸癌、肝癌、肺癌等多種惡性腫瘤的治療[1-5]。盡管HCPT對于多數腫瘤細胞均有殺傷作用,但其不良反應較多且嚴重,限制了它的臨床應用。因此,探索其影響腫瘤作用的各種相關因素具有十分重要的意義。聚腺苷二磷酸核糖聚合酶[Poly(ADP-ribose)polymerase,PARP]是一種多功能核蛋白,廣泛參與DNA損傷的識別和信號轉導過程,尤其在DNA的堿基切除修復過程中發揮著無法替代的作用,是當今腫瘤基因治療的一個新靶點[6]。抑制PARP活性能降低腫瘤細胞的DNA修復功能,從而提高腫瘤放療和化療療效。研究表明,無論對于單一用藥或聯合化療藥物,PARP抑制劑都顯示了在抗腫瘤治療領域的潛力[7-8]。
NU1025和AG14361分別是第2代和第3代PARP抑制劑的代表,二者均能顯著提高化療藥物的細胞毒性作用,即對腫瘤細胞產生很強的化學致敏效果[9-10]。本研究探討了NU1025和AG14361與食管癌常用化療藥HCPT聯用對食管癌細胞ECA-109的增殖與凋亡的影響,并通過彗星實驗觀察細胞DNA損傷水平的變化,以初步探討二者與HCPT聯用的可能機制,為食管癌的臨床治療提供基礎理論依據。
1 材料與方法
1.1 細胞株和試劑
人食管癌細胞株ECA-109購買于中國科學院上海生命科學研究院細胞資源中心。胎牛血清、DMEM培養基為美國Gibco公司生產。HCPT購自深圳萬樂藥業有限公司(批號:0708G1,2mg/瓶)。NU1025(編 號:493800)和 AG14361(編號:S2178)分別為德國Merck公司和美國Selleck公司產品。Annexin V-FITC/PI細胞凋亡檢測試劑盒由南京凱基生物科技發展有限公司提供。四甲基偶氮唑藍(four methyl thiazolyl tetrazolium,MTT)產自美國Sigma-Aldrich公司。其他化學試劑均為國產分析純。
1.2 方法
1.2.1 細胞培養 ECA-109細胞用DMEM培養液培養(含10%胎牛血清、鏈霉素和青霉素各100 U/mL)于37℃、5%CO2飽和濕度的培養箱中培養。每2天傳代1次。
1.2.2 MTT試驗 取對數生長期的ECA-109細胞,接種到96孔板(100 μL/孔,約3.0×103/孔),待細胞貼壁后進行實驗處理。HCPT濃度參照本課題組預實驗結果及國內其他文獻報道,選用10 μmol/L。細胞隨機分成兩組,其中第1組采用以下方式處理:(1)對照組(不加任何處理);(2)1.0 μmol/L NU1025(或 AG14361)處理組;(3)5.0 μmol/L NU1025(或 AG14361)處理組;(4)5.0 μmol/L NU1025(或 AG14361)處理組。第 2 組采用以下方式處理:(1)對照組(不加任何處理);(2)10 μmol/L HCPT 處 理 組;(3)HCPT+1.0 μmol/L NU1025(或 AG14361)處理組;(4)HCPT+5.0 μmol/L NU1025或 AG14361處理組;(5)HCPT+5.0 μmol/L NU1025(或AG14361)處理組。每組設6個平行孔,24 h后,每孔加入6 mg/mL的MTT 20 μL,37℃繼續孵育4 h,棄上清,加入150 μL二甲基亞砜溶解甲瓚結晶,后于酶標儀上測定570 nm處的吸光度OD值,計算細胞增值率。計算公式為:細胞增殖率=處理組OD值/對照組OD值×l00%。
1.2.3 流式細胞術檢測細胞凋亡 取對數生長期的ECA-109細胞,以6×104個細胞接種于6孔培養板,待細胞貼壁后進行處理。細胞分組按1.2.2第2組,按相應方法處理ECA-109細胞24 h后收集細胞,制備成濃度為3.0×106/mL單細胞懸液,取80 μL細胞懸液,加入320 μL 1×Binding Buffer重懸細胞,分別加入5 μL Annexin V-FITC和10 μL PI混勻,室溫避光孵育20 min后,由專業技術人員檢測。
1.2.4 彗星實驗檢測細胞DNA損傷 選取對數生長期的ECA-109細胞,以3×104個細胞接種于6孔培養板,待細胞貼壁后進行實驗處理。細胞分組按1.2.2第2組,按相應方法處理ECA-109細胞24 h后收集細胞,制備單細胞懸液,參照文獻方法[11],經消化、解旋、電泳后,Gel-red核酸染料染色,熒光顯微鏡下觀察細胞彗星形態,每個濃度制備3張片子,每張片子統計100個彗星樣細胞,通過CASP彗星圖像分析軟件分別計算彗星圖像的頭部DNA百分率、尾部DNA百分率、尾矩和Olive尾矩,本研究以Olive尾矩作為本實驗體系中評價細胞DNA損傷程度的指標。
1.3 統計學處理
應用SPSS13.0版軟件包處理數據,計量資料用()的形式表示,行t檢驗,采用單因素方差分析比較各組間差異的顯著性,P<0.05為差異有統計學意義。
2 結果
2.1 MTT實驗結果
采用MTT法比較兩種PARP抑制劑單獨或聯合HCPT對ECA-109細胞增值率的影響,見圖1。ECA-109細胞被處理24 h后,除1.0 μmol/L NU1025處理組(P>0.05)外的所有NU1025和AG14361處理組細胞增殖率均顯著低于對照組,差異有統計學意義(P<0.05);且5.0 μmol/L和10.0 μmol/L的NU1025對細胞增殖的抑制作用分別為5%和9%,明顯小于5.0 μmol/L(10%)和10.0 μmol/L(17%)的AG14361對細胞增殖的抑制作用(P<0.05)。MTT法比較兩種PARP抑制劑聯合HCPT對細胞增值率的影響,見圖2。
所有處理組(HCPT單獨處理組、HCPT+NU1025處理組和HCPT+AG14361處理組)細胞增殖率均顯著低于對照組,差異有統計學意義(P<0.05);且5.0 μmol/L和10.0 μmol/L PARP抑制劑聯合HCPT處理組細胞增殖率明顯低于HCPT單獨處理組,差異有統計學意義(P<0.05);其中5.0 μmol/L和10.0 μmol/L NU1025聯合HCPT處理對ECA-109細胞增殖的抑制作用分別為29%和45%,明顯高于5.0 μmol/L(18%)和10.0 μmol/L(29%)的AG14361聯合HCPT處理,差異有統計學意義(P<0.05)。
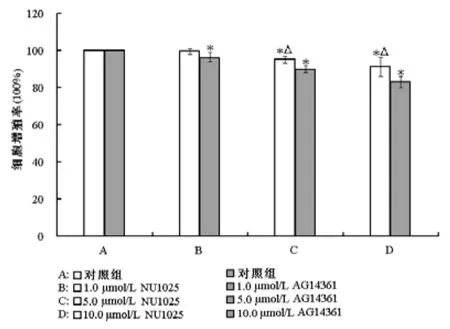
圖1 MTT試驗分析NU1025和AG14361處理24 h后ECA-109細胞增值率的變化。與對照組比較,*P<0.05;相同濃度下NU1025組與AG14361組比較,△P<0.05
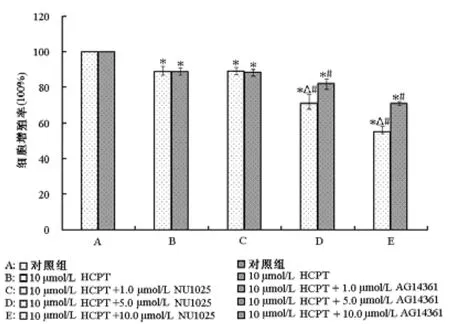
圖2 MTT試驗分析HCPT聯合NU1025或AG14361處理24 h后ECA-109細胞凋亡率的變化。與對照組比較,*P<0.05;與對HCPT處理組比較,#P<0.05;相同濃度下NU1025組與AG14361組比較,△P<0.05
2.2 流式細胞術檢測結果
通過流式細胞術Annexin V-FITC/PI雙標法進一步分析了HCPT聯合NU1025或AG14361對ECA-109細胞凋亡的影響,見圖3。ECA-109細胞被處理24 h后,所有處理組(HCPT單獨處理組、HCPT+NU1025處理組和HCPT+AG14361處理組)細胞凋亡率均顯著高于對照組,差異有統計學意義(P<0.05);且5.0 μmol/L和10.0 μmol/L PARP抑制劑聯合HCPT處理組細胞增殖率明顯低于HCPT單獨處理組,差異有統計學意義(P< 0.05);其中 5.0 μmol/L和 10.0 μmol/L NU1025聯合HCPT分別誘導了32%和44%的ECA-109細胞凋亡,明顯強于5.0 μmol/L(18%)和10.0 μmol/L(30%)的AG14361聯合HCPT處理,差異有統計學意義(P<0.05)。
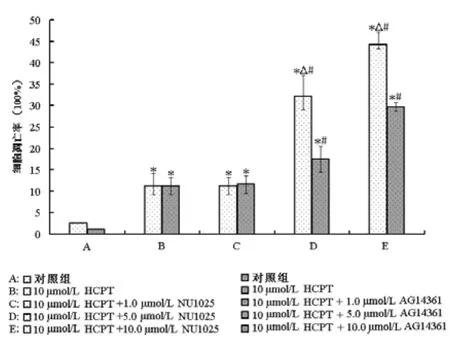
圖3 流式細胞術分析HCPT聯合NU1025或AG14361處理24 h后ECA-109細胞凋亡率的變化。與對照組比較,*P<0.05;與HCPT處理組比較,#P<0.05;相同濃度下NU1025組與AG14361組比較,△P<0.05
2.3 彗星實驗檢測結果
為明確NU1025和AG14361是通過何種方式起到增敏作用,通過彗星實驗評價了HCPT聯合NU1025或AG14361處理后ECA-109細胞DNA損傷程度的影響,見圖4。ECA-109細胞被處理24 h后,所有處理組(HCPT單獨處理組、HCPT+NU1025處理組和HCPT+AG14361處理組)細胞DNA損傷水平均顯著高于對照組,差異有統計學意義(P<0.05);且5.0 μmol/L和10.0 μmol/L PARP抑制劑聯合HCPT處理組細胞DNA損傷程度明顯高于HCPT單獨處理組,差異有統計學意義(P<0.05);其中5.0 μmol/L和10.0 μmol/L NU1025聯合HCPT對細胞DNA損傷的誘導作用明顯強于5.0 μmol/L和10.0 μmol/L的AG14361聯合HCPT處理,前者分別為6.72和9.31,后者分別為5.34和6.91,前者相比與后者,差異有統計學意義(P<0.05)。
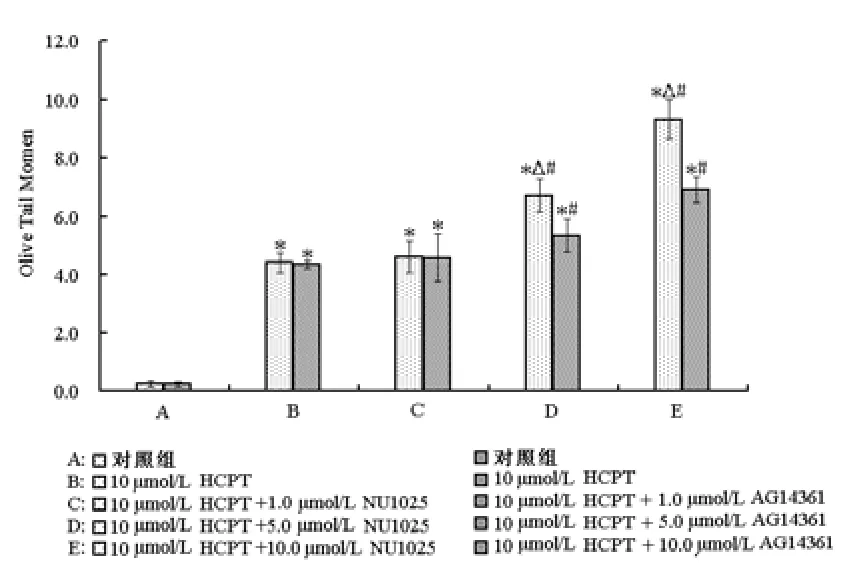
圖4 彗星實驗分析HCPT聯合NU1025或AG14361處理24 h后的ECA-109細胞DNA損傷程度變化。與對照組比較,*P<0.05;與HCPT處理組比較,#P<0.05;相同濃度下NU1025組與AG14361組比較,△P<0.05
3 討論
NU1025和AG14361均為新型PARP抑制劑,前者在低毒劑量時可使3-甲基吲哚誘導人支氣管上皮細胞(NHBE)DNA損傷水平增加1倍,后者在低毒劑量時則可使拓撲替康誘導的人白血病細胞(K562) 凋亡水平上升3倍以上[11-12]。盡管如此,由于不同PARP抑制劑的選擇性不同,在不同細胞株或與不同化療藥物(或放療)聯用時表現出的增敏效果也有所不同,因此,在不同實驗體系中的具體應用仍需深入研究。
本研究以人食管癌細胞株ECA-109作為研究對象,探討NU1025和AG14361對HCPT誘導的細胞增殖和凋亡的影響。研究結果表明,NU1025和AG14361在單獨使用時,對ECA-109細胞增殖均起到了一定的抑制作用,且前者表現出較低的細胞毒性;但當NU1025和AG14361分別與HCPT聯用時,和AG14361相比,NU1025表現出了更強的增敏作用[13]。通過流式細胞術凋亡分析實驗證實NU1025和AG14361分別與HCPT聯用時,NU1025表現出了更強的增敏作用。研究結果表明,NU1025和AG14361分別與HCPT聯用時,在5.0~10.0 μmol/L時,二者均明顯加重了HCPT誘導的ECA-109細胞DNA損傷效應,相比于AG14361,NU1025對HCPT誘導的ECA-109細胞DNA損傷效應表現出了更強的促進作用。因此,結合MTT和細胞凋亡研究結果,說明在本研究體系中,NU1025和AG14361通過抑制PARP-1的活性,阻礙了PARP-1對HCPT誘導的DNA損傷的修復作用,進而促進了細胞凋亡,降低了細胞增值率,且NU1025表現出了更強的作用,相關分子機制有待進一步研究。
綜上所述,本研究結果表明,在5.0~10.0 μmol/L時濃度范圍內的NU1025和AG14361均可顯著增強人食管癌細胞株ECA-109對HCPT的藥敏作用,且NU1025較AG14361具有更低的細胞毒性和更高的增敏作用的優勢,為今后食管癌的藥物治療研究提供了一個可能的治療靶點[14-15]。
[1] 金學平,金學蘭.天然抗腫瘤藥物羥基喜樹堿的制備方法研究概況[J].中國藥業,2006,15(19):63-64.
[2] S.P.Tu,J.Zhong,J.H.Tan,et al.Induction of apoptosis by arsenic trioxide and hydroxy camptothecin in gastriccancer cells in vitro[J].World J Gastroenterol,2000,6(4):532-539.
[3] Y.R.Fu,Z.J.Yi,Y.R.Yan,et al.Hydroxycamptothecin-induced apoptosis in hepatoma SMMC-7721 cells and the role of mitochondrial pathway[J].Mitochondrion,2006,6(4):211-217.
[4] 朱霞,李紅,楊峰.羥基喜樹堿治療晚期乳腺癌療效觀察[J].中國腫瘤,2004,13(1):57-59.
[5] 荊孝東,趙積曄,李猛.羥基喜樹堿膀胱灌注預防膀胱癌術后復發的療效分析 [J].臨床外科雜志,2010,18(2):131-132.
[6] 韓煒,鐘俊,王永峰,等.PARP抑制劑用于腫瘤治療的研究進展[J].中國新藥雜志,2011,20(12):1086-1092.
[7] A.Peralta-Leal,J.M.Rodriguez-Vargas,R.Aguilar-Quesada,et al.PARP inhibitors:new partners in the therapy of cancer and inflammatory diseases[J].Free Radic Biol Med,2009,47(1):13-26.
[8] A.J.Chalmers.The potential role and application of PARP inhibitors in cancer treatment[J].Br Med Bull,2009(89):23-40.
[9] S.Boulton,L.C.Pemberton,J.K.Porteous,et al.Potentiation of temozolomideinduced cytotoxicity:a comparative study of the biological effects of poly(ADP-ribose) polymerase inhibitors[J].Br J Cancer,1995,72(4):849-856.
[10] C.R.Calabrese,R.Almassy,S.Barton,et al.Anticancer chemosensitization and radiosensitization by the novel poly(ADP-ribose)polymerase-1 inhibitor AG14361 [J].J Natl Cancer Inst,2004,96(1):56-67.
[11] L.A.Corcuera,L.Arbillaga,A.Vettorazzi,et al.Ochratoxin a reduces aflatoxin B1 induced DNA damage detected by the comet assay in Hep G2 cells[J].Food Chem Toxicol,2011,49(11):2883-2889.
[12] 趙凌舟,張華北.抗腫瘤藥物PARP-1抑制劑及其放射性核素標記的研究進展 [J].同位素,2011,24(S1):45-58.
[13] 李思遠.吡柔比星與羥基喜樹堿治療淺表性膀胱癌術后的短期療效對比[J].中外醫學研究,2011,9(15):20-21.
[14] 聶先鋒.羥基喜樹堿治療難治復發性陣發性睡眠性血紅蛋白尿癥的臨床分析 [J].中國醫學創新,2011,8(7):32-33.
[15] 張徐龍,李海燕.羥基喜樹堿膀胱灌注防治膀胱癌術后復發的療效分析[J].中外醫學研究,2010,8(18):373-374.

