神經肽Y和5-羥色胺在腹瀉型腸易激綜合征模型大鼠中表達的研究
唐洪梅,房財富,廖小紅,李得堂,姚 楠,何嘉侖
(1.廣州中醫藥大學第一附屬醫院藥學部,2.廣州中醫藥大學,廣東 廣州510405;3.廣東省中醫研究所 廣東廣州 510095)
腸易激綜合征(irritable bowel syndrome,IBS)是一種以腹痛或腹部不適伴排便習慣改變為特征的功能性腸病,腹瀉型腸易激綜合征(D-IBS)患者以腹痛腹瀉為主,同時多伴有頭昏、心煩、失眠、焦慮、抑郁等植物神經功能失調的癥狀,發病易受精神等因素影響,關于D-IBS的病因和發病機制目前尚不明確。近年來隨著神經胃腸病學和分子生物學研究的發展,人們認為D-IBS的發病與慢性心理應激引起的腦腸軸功能紊亂密切相關,D-IBS患者易出現腦腸互動失調或環節障礙[1]。腦腸軸異常可能是導致D-IBS患者對各種應激的運動反應增強和內臟敏感性增加的主要因素,是D-IBS病理生理機制的共同通路。腦腸軸的變化和影響在D-IBS的發病中起重要作用,而腦腸肽作為一類具有神經遞質和激素雙重功能的小分子多肽,在調節內臟感覺、分泌和運動中起重要作用。這些神經遞質主要有五羥色胺(5-hydroxy tryptamine,5-HT)、P物質、降鈣素基因相關肽、神經肽Y(neuropeptide Y,NPY)等。這些神經遞質和D-IBS有著密切的聯系。本課題組前期的實驗已經對P物質和降鈣素基因相關肽開展研究,研究結果表明模型組結腸黏膜降鈣素基因相關肽和P物質的表達分別較正常組及給藥組高[2]。NPY廣泛分布于哺乳動物的中樞神經系統、周圍神經系統以及許多器官中,而且含量豐富。NPY在情感及應激行為發生的機制中均發揮重要功能。作為一種重要的神經遞質,NPY在D-IBS的病理機制中如何發揮傳遞作用尚未見報道。本文通過免疫組化法檢測D-IBS模型大鼠結腸組織5-HT的表達,采用熒光定量RT-PCR技術檢測模型大鼠下丘腦和結腸組織NPY mRNA的表達,同時旨在通過腦腸肽和神經遞質的研究為D-IBS的腦腸軸異常調控機制提供一定的依據。
1 材料與方法
1.1實驗動物SPF級SD大鼠乳鼠2窩,出生2 d。購自廣東省醫學實驗中心,實驗動物中心動物合格證號:0088139。
1.2實驗試劑和儀器TRIzol Reagent(美國 Invitrogen公司),Bio-Rad iQTM5 Multicolor Real-time PCR(美國 Bio-Rad公司),Bio-Rad SmartSpecTMPlus Spectrophotometer(美國 Bio-Rad公司),AlphaImager HP凝膠成像系統(美國ProteinSimple公司),DNase I(美國Fermentas公司),RevertAidTMFirst Strand cDNA Synthesis Kit(美國 Fermentas公司),MaximaTMSYBR Green/Fluorescein qPCR Master Mix(美國 Fermentas公司)。
1.3模型的制備將新生大鼠分為正常組和模型組。出生2 d后的大鼠乳鼠,模型組從乳鼠出生后2~14 d每天與母鼠分隔開180 min,在d 15~27的兩周內,模型組將石蠟油潤滑后的輸液導管經肛門插入 2 cm,注入 0.087 mol·L-1的醋酸 0.5 ml[3],每天給予直腸內醋酸刺激1次,在醋酸刺激之后,立即用紙袋束縛大鼠的前后肢。限制前上肢搔抓頭面部,但不限制其活動,束縛時間1 h。正常組給予直腸注入0.5 ml生理鹽水。d 29在冰塊上迅速取下大鼠的下丘腦和結腸組織,用液氮冷凍后置于-80℃冰箱保存。
1.4免疫組化法檢測大鼠下丘腦和結腸組織5-HT石蠟切片常規脫蠟至水,3%H2O2室溫20 min以滅活內源性過氧化物酶。蒸餾水洗滌3次。0.01mol·L-1枸櫞酸鹽緩沖溶液抗原熱修復。PBS洗滌2次。滴加5%BSA封閉液,室溫20 min。甩去多余液體,滴加1∶100稀釋的一抗(羊抗多克隆抗體,大鼠),4℃過夜。PBS洗2 min×3次。滴加生物素化山羊抗大鼠IgG,37℃ 20 min。PBS洗2 min×3次。滴加試劑SABC,37℃ 30 min。PBS洗5 min×4次。DAB顯色劑室溫顯色,鏡下控制反應時間,蘇木精輕度復染,脫水,透明,封片,400倍顯微鏡觀察。
1.5實時熒光定量RT-PCR檢測NPY mRNA表達
1.5.1總RNA提取和cDNA合成取凍存組織,經過液氮研磨后按每100 mg加入1 ml TRIzol試劑,總RNA的提取按TRIzol試劑說明書進行。提取的總RNA用DNaseⅠ處理,以去除DNA污染。用1%的瓊脂糖凝膠電泳檢測總RNA的完整性。用紫外分光光度計檢測總RNA的純度和含量。按照反轉錄試劑盒要求,用Oligo(dT)18合成cDNA,在-20℃ 保存備用。
1.5.2引物設計與合成查 NCBI GenBank里的基因序列,用Primer premier 5.0軟件進行引物設計,設計的引物由上海英濰捷基貿易有限公司合成。
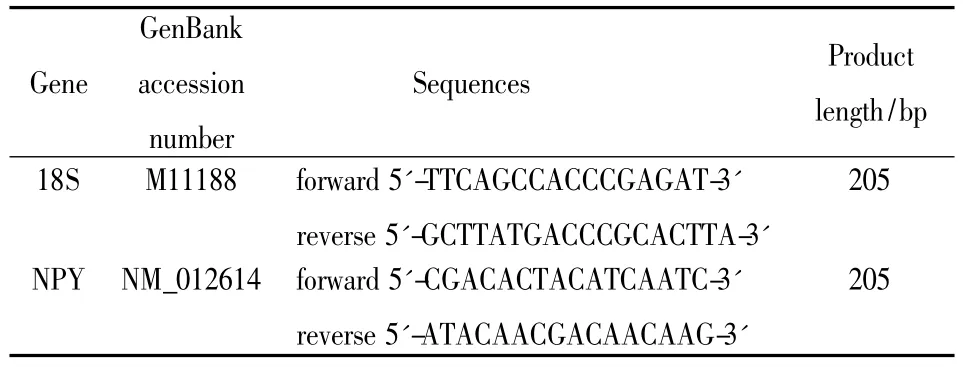
Tab 1 Primer sequences used for NPY mRNA detection with real time RT-PCR
1.6熒光定量PCR擴增效率檢測進行相對基因表達分析普遍采用 Livak(2-△△Ct)法,條件是目標基因和參照基因擴增效率都接近100% ,且相互間效率偏差在5%以內。使用Livak法之前,必須驗證目標基因和參照基因的擴增效率,制備熒光定量PCR標準曲線。稀釋樣品cDNA成5個梯度(105、104、103、102、10),分別進行靶基因 NPY 及內參基因18S的PCR反應,制備兩基因的標準曲線并檢測擴增效率。
1.7實時熒光定量PCR每個樣品均進行 NPY基因和內參18S基因的熒光定量 PCR,每個樣品均設兩個平行管。總反應體積 25 μl,反應體系為:12.5 μl SYBR Green/Fluorescein qPCR Master Mix,上下游引物各 1 μl,1 μl cDNA,9.5 μl ddH2O。反應條件:94℃ 5 min;94℃ 30 s,55℃ 40 s,72℃ 50 s,共40個循環;最后 72℃ 7 min結束反應。PCR擴增結束后,從55℃至94℃ 每隔10 s上升0.5℃,并收集一次熒光信號獲得熔解曲線,以確定擴增產物的特異性。最終結果根據樣品 Ct值,按照 Livak(2-△△Ct)方法計算。
1.8統計學分析結果用±s表示,用SPSS 15.0統計學軟件對所得數據進行t檢驗。
2 結果
2.1HE染色和免疫組化法在大鼠的下丘腦組織HE染色中,模型組無病理改變(Fig 1)。在大鼠的結腸組織中,在400倍光鏡下連續觀察腸腺腔200個細胞,均可見5-HT免疫染色陽性細胞,此類細胞多分布在腸腺腔基底部,以腸腺隱窩部位較多。模型組免疫組化染色陽性細胞體積較大,大多為錐形或圓形,染色強度較強;正常組免疫組化染色陽性細胞體積較小,多為圓形,染色強度較弱(Fig 2)。與正常組比較,模型組5-HT陽性細胞數增多,免疫組化染色強度增強(均P<0.01)。
Fig 1 Hypothalamus tissue of model group(A)and control group(B)(HE×200)
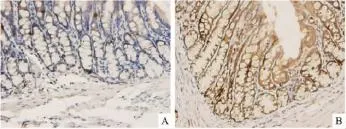
Fig 2 Protein distribution of 5-HT in IBS-D rats colon tissue by immunohistochemistry(×400)
2.2實時熒光定量PCR擴增曲線及基因擴增效率從Fig 3中可以計算得出NPY和18S的擴增效率分別為98%和95%。

Fig 3 Quantitative real-time PCR standard curve of NPY(A)and 18S(B)standard templates
2.3PCR產物分析NPY和18S基因PCR產物經瓊脂糖凝膠電泳證實PCR產物為單一目的條帶。擴增產物大小分別為280 bp及205 bp(Fig 4)。
熔解曲線分析顯示NPY和18S的基因PCR產物的熔解曲線峰值分別為81.5℃及86℃,熔解溫度均一,為單一銳利主峰,說明無引物二聚體及非特異性擴增(Fig 5)。
2.4NPY mRNA在下丘腦和結腸組織中的相對表達量分析為了校正標本之間RNA的質量和反轉錄效率的差異,將每一標本檢測所得NPY基因的拷貝數均和相對應的18S基因的拷貝數相比來進行標準化。結果表明,在下丘腦組織中,與正常組相比,模型組NPY基因表達明顯下降,差異具有統計學意義(P<0.05),模型組可將NPY mRNA表達下調約1.66倍(Fig 6);在結腸組織中,與正常組相比,模型組NPY基因表達明顯下降,差異具有統計學意義(P<0.05),模型組可將NPY mRNA表達下調約1.20倍(Fig 7)。
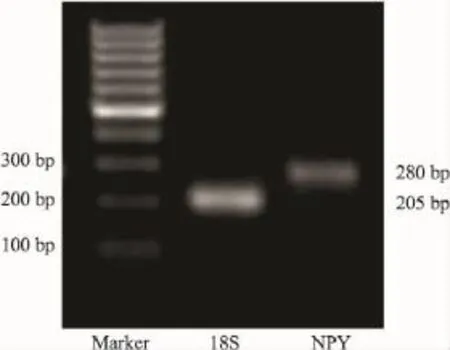
Fig 4 Agarose gel electrophoresis results
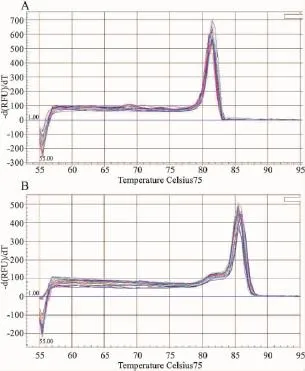
Fig 5 Dissociation curve of NPY and 18S
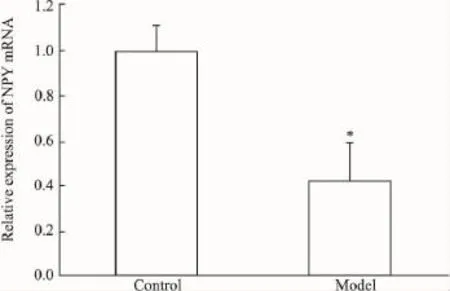
Fig 6 Relative expression of NPY mRNA in hypothalamus tissues
3 討論
現代醫學研究認為,IBS的發病與慢性心理應激引起的腦腸軸功能紊亂密切相關。腦腸軸是將認知和情感中樞與神經內分泌、腸神經系統、免疫系統相聯系的雙向交通通路,在人的腸肌間神經叢內存在著神經系統,它分泌的神經遞質同時存在于大腦皮層-神經系統內。這些神經遞質不但存在于ENS,也存在于CNS,在調節內臟感覺、分泌和運動中起重要作用。國外研究學者研究表明,腦內許多區域和核團均參與了胃腸道運動的調節,但主要集中在邊緣系統。包括圍繞中腦室周圍的結構——下丘腦、穹窿、杏仁及扣帶回[4]。IBS患者與健康人群的性格存在較大差異,患者焦慮、抑郁、神經質和負性生活事件評分明顯高于健康人群。美國一項大規模社區人群調查表明[5],抑郁狀態等心理因素易導致IBS患者產生腹痛感覺,并且抑郁的程度與直腸痛覺閾值呈反比關系。
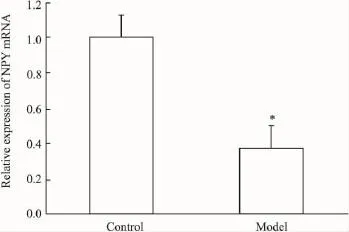
Fig 7 Relative expression of NPY mRNA in colon tissues
NPY廣泛分布于中樞神經系統和腸道交感神經叢中。研究認為[6],NPY通過G蛋白結合受體(NPY-Rs)與配體結合而發揮其作用。腸神經叢中的NPY可與腸黏膜下神經節中周圍性膽堿乙酰轉移酶(pChAT)相結合而發揮其效能,或在中樞通過作用于海馬和下丘腦而發揮其拮抗應激、穩定情緒的作用。
本研究表明,與對照組相比,模型組大鼠下丘腦和結腸組織 NPY mRNA的表達明顯下調,表明DIBS的腹痛和焦慮情緒與NPY表達下調有一定的關聯性。關于腹痛的調節機制,NPY及其受體在中樞神經系統的痛覺調制中起重要作用,其作用機制或直接通過Y1受體,或間接通過阿片受體。抑制性神經遞質NPY主要通過Y1受體抑制脊髓背角SP、CGRP和其它致痛性神經遞質的釋放起鎮痛作用。關于焦慮情緒的調節機制,NPY是人類及哺乳動物體內分布最為廣泛及含量最為豐富的肽類物質。主要分布于與情感調節有關的腦區(如下丘腦、杏仁核、海馬、藍斑、伏核等)及交感神經末梢,參與情感行為的調節及應激反應[7]。研究證實這些效應主要是通過 NPY-Y1受體介導的[8]。
5-HT是一種廣泛存在于神經系統和胃腸道的神經遞質,參與了心理和神經功能的調節。5-HT的生理作用包括激活腸道分泌功能、對傳入神經元的激活及直接對平滑肌的作用,從而參與了胃腸運動、感覺、分泌等過程。研究證實5-HT與D-IBS的病有一定的關系,在D-IBS患者中,患者血漿及結腸黏膜中的5-HT均明顯升高。Drossman[9]認為 D-IBS患者腸道EC細胞分泌的5-HT通過腦腸軸,參與胃腸道動力和內臟感覺的調控。整個調節過程復雜,可能在腦腸軸的不同傳導水平有異常。當外周組織損傷或炎癥時,損傷或者炎癥部位的血小板和肥大細胞都可以釋放5-HT,活化初級傳入感應器,并提高傷害性感應器的敏感性,從而引起傷害性反應和痛覺過敏[10]。生理性刺激(進餐、擴張)及病理性刺激(缺血、應激)促使5-HT釋放,導致內臟傳入神經及腸神經系統高敏感而激活多種神經活性物質,使參與腦-腸調節的化學信號異常。本實驗表明,模型組5-HT明顯升高,5-HT的異常升高會導致腸道動力異常和內臟感覺過敏,也是引起腹瀉的重要物質,提示5-HT和D-IBS患病關系密切。
由于D-IBS的病理機制還尚且不明確,基于以上實驗結果,腦腸軸異常機制在D-IBS的發病機制中起著重要的作用,D-IBS與NPY的表達下調和5-HT的升高有密切的關系,腦腸軸異常機制的研究為明確D-IBS的機制提供了重要的參考依據,但DIBS具體調節機制還有待進一步研究。
[1]Mathew P,Bhatia S J.Pathogenesis and management of irritable bowel syndrome[J].Trop Gastroenterol,2009,30(1):19.
[2]唐洪梅,丘振文,李得堂,等.腸激安方干預腹瀉型IBS模型大鼠 SP、CGRP 的機制研究[J].今日藥學,2008,18(5):1-4.
[2]Tang H M,Qiu Z W,Li D T,et al.Mechanism research of chang jian fang intervention on SP and CGRP in model rats of diarrhea-irritable bowel syndrome[J].Pharm Today,2008,18(5):1 -4.
[3]唐洪梅.李得堂.黃櫻華,等.腹瀉型腸易激綜合征大鼠模型的建立及敏感性評估的實驗研究[J].中國藥理學通報,2009,25(5):693-4.
[3]Tang H M,Li D T,Huang Y H,et al.Establishment of the diarrhepredominant IBS SD rat model and appraisal of its sensitivity[J].Chin Pharmacol Bull,2009,25(5):693 -4.
[4]Yuan Y Z,Tao R J,Xu B,et al.Functional brain imaging in irritable bowel syndrome with rectal balloon-distention by using fMRI[J].World J Gastronterol,2003,9:1356.
[5]Choung R S,Locke G R,Zinsmeister A R,et al.Psychosocial distress and somatic symptoms in community subjects with irritable bowel syndrome:a psychological component is the rule[J].Am J Gastroenterol,2009,104:1772 -9.
[6]MA G P.Hormonal control of the neuropeptide Y system[J].Curr Protein Pept Sci,2003,4:45 -57.
[7]Morales-Medina J C,Dumont Y,Quirion R.A possible role of neuropeptide Y in depression and stress[J].Brain Res,2010,13(14):194-205.
[8]Luo D D,An S C,Zhang X.Involvement of hippocampal serotonin and neuropeptide Y in depression induced by chronic unpredicted mild stress[J].Brain Res Bull,2008,77(1):8 - 12.
[9]Drossman D A.The function gastrointestinal disorders and the RomeⅡ Proeess[J].Gut,1999,45(suppl 2):111 -5.
[10]吳饒平,熊 偉,高 云.三叉神經痛的分子發病機制的研究進展[J].中國藥理學通報,2011,27(11):1487 -8.
[10]Wu R P,Xiong W,Gao Y.Progress on molecular pathogenesis of trigeminal neuralgia[J].Chin Pharmacol Bull,2011,27(11):1487-8.

