H1N1豬流感病毒HA基因在畢赤酵母中的表達(dá)
袁芳艷 劉澤文 周丹娜等
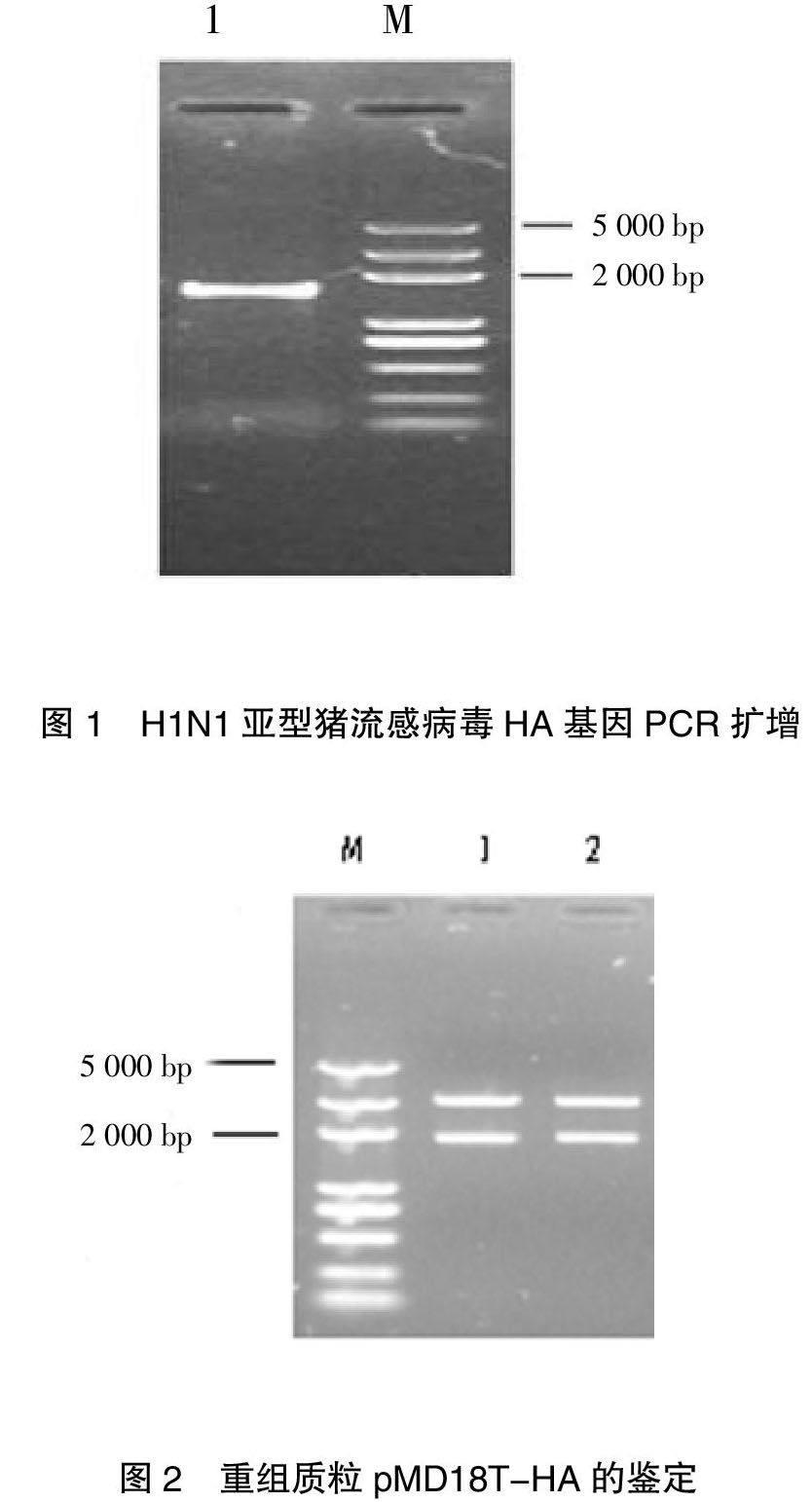
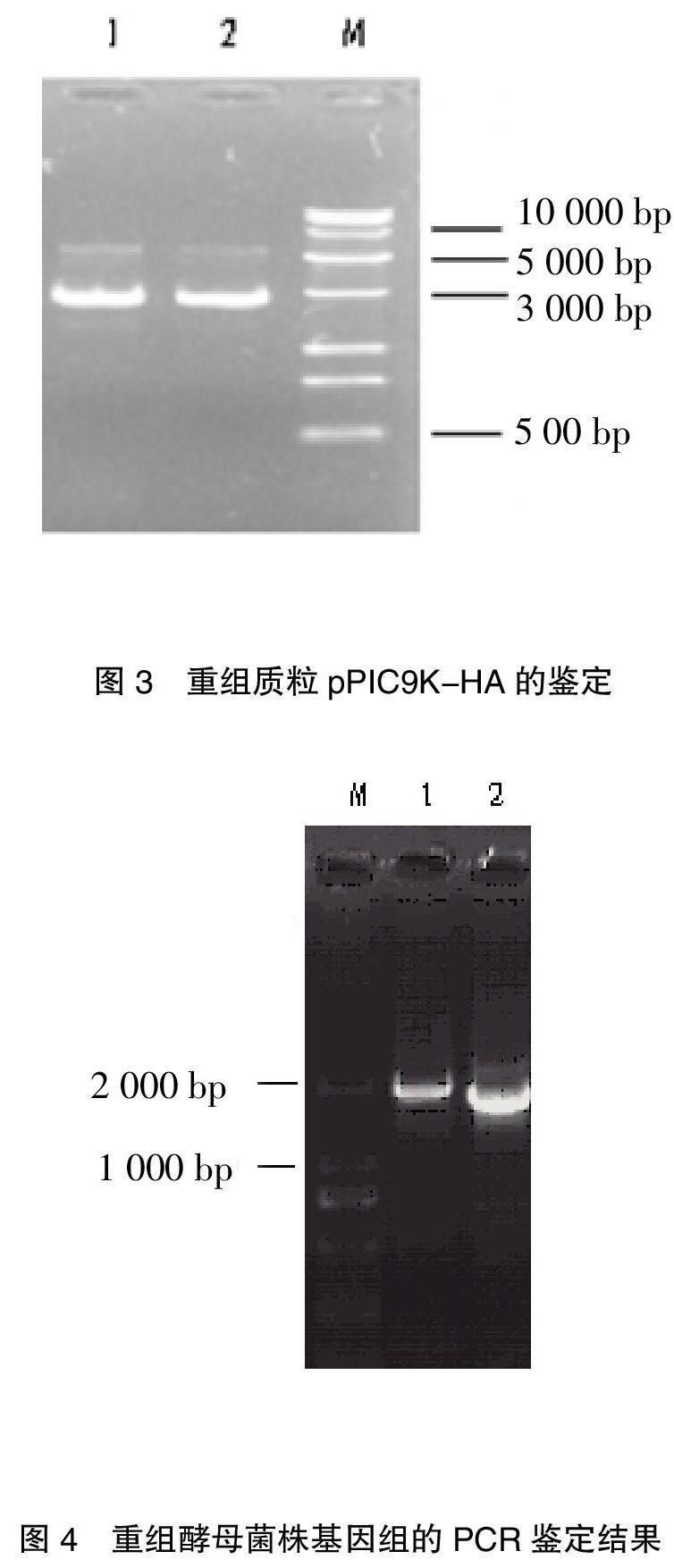
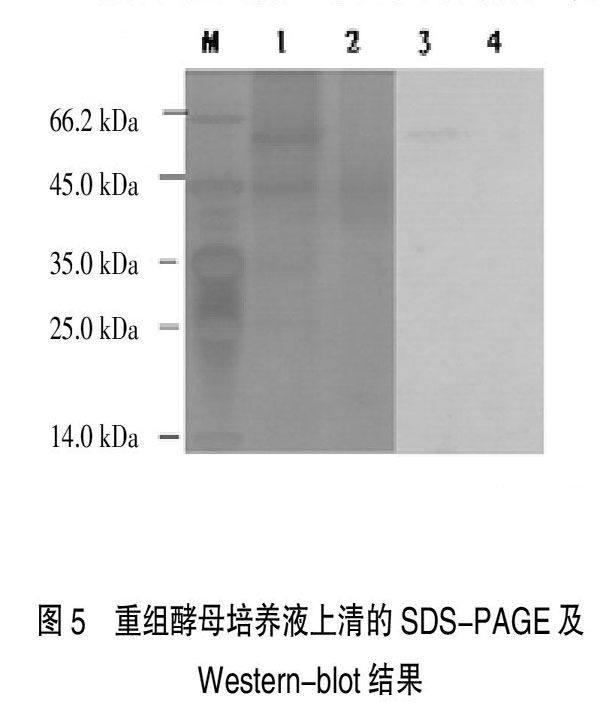
摘要:利用 RT-PCR擴(kuò)增H1N1亞型豬流感病毒HA基因,亞克隆到畢赤酵母表達(dá)載體pPIC9K中,構(gòu)建分泌型重組表達(dá)載體pPIC9K-HA。將線性化的pPIC9K-HA電轉(zhuǎn)化畢赤酵母菌GS115。將經(jīng)MD平板篩選和PCR鑒定的陽性菌株用G418篩選多拷貝重組子。最后用1%甲醇誘導(dǎo)表達(dá)重組子,經(jīng)SDS-PAGE和Western-blot檢測, H1N1亞型豬流感病毒HA基因在畢赤酵母中成功得到了表達(dá),產(chǎn)物約60.4KD,并具有免疫活性。本研究為進(jìn)一步研究豬H1N1亞型豬流感病毒HA基因的功能及檢測方法奠定了基礎(chǔ)。
關(guān)鍵詞:高職;養(yǎng)禽與禽病防治;實踐教學(xué)
中圖分類號:S858.4+3 文獻(xiàn)標(biāo)識碼:A 文章編號:1007-273X(2013)09-0005-03
豬流感(Swine influenza,SI)是由A型流感病毒所引起的豬的一種急性、高度傳染性呼吸道疾病。臨床特點為急性發(fā)熱,傳播迅速,發(fā)病率高,死亡率低,易引起繼發(fā)感染,是危害養(yǎng)豬業(yè)的重要疾病之一。 隨著集約化養(yǎng)豬規(guī)模的不斷擴(kuò)大,SI對養(yǎng)豬業(yè)構(gòu)成了較大的威脅。自從1918年美國首次報道SI的暴發(fā),1930年Shope從豬體中分離到HINl亞型SIV,迄今為止,SI已遍布亞、美、歐等地[1]。豬作為流感病毒的"混合器",在流感病毒跨種屬障礙而感染新宿主的過程中起著重要作用。2009年全球許多國家暴發(fā)了H1N1亞型流感,導(dǎo)致萬余人死亡。SI嚴(yán)重威脅著人類健康,并直接關(guān)系到公共衛(wèi)生及人類的生命安全。
血凝素(HA)的裂解活性為病毒具有感染性和病毒在宿主體內(nèi)的傳播所必需。HA基因在流感病毒識別靶細(xì)胞表面受體及穿膜過程中起重要作用,刺激機體產(chǎn)生的中和抗體可以抵抗病毒感染,還可以刺激機體產(chǎn)生細(xì)胞毒性淋巴細(xì)胞(CTL)反應(yīng)[2]。……

