肝動脈化療栓塞治療原發性肝癌合并糖尿病的預后因素分析
常中飛 段峰 孫紅梅 王茂強
·腫瘤介入·
肝動脈化療栓塞治療原發性肝癌合并糖尿病的預后因素分析
常中飛 段峰 孫紅梅 王茂強
目的 分析145例肝癌合并2型糖尿病患者的臨床資料,探討肝動脈灌注化療栓塞(TACE)的療效及相關預后因素。方法 回顧性分析145例肝癌合并2型糖尿病患者經TACE治療的療效及預后因素分析。生存率用Kaplan-Meier法計算,單因素分析采用Log-Rank方法,多因素分析采用Cox回歸模型。結果 DM組與非DM組患者的總生存時間無統計學差異(P>0.05)。DM組患者較非DM組患者發生肝外轉移率高,兩組比較具有統計學意義(P<0.005)。分層分析顯示:DM組中,空腹血糖≥8 mmol/L與空腹血糖<8 mmol/L相比,中位生存時間分別為15個月和30個月,具有統計學意義(P<0.001)。Cox多元回歸分析顯示:空腹血糖水平、腫瘤大小、ECOG評分、BCLC分期及門脈癌栓是影響HCC合并糖尿病患者預后的獨立危險因素。結論 空腹血糖水平可以作為影響HCC合并糖尿病患者療效的獨立預后因素。
癌,肝細胞; 肝動脈化療栓塞術; 糖尿病; 預后
肝癌是最常見的惡性腫瘤之一,其中80%為原發性肝癌(hepatocellular carcinoma,HCC)是全球第5大常見的惡性腫瘤,占腫瘤致死原因的第3位[1]。我國糖尿病的發病率逐年升高,糖尿病患者人數位居世界第二。近年來,越來越多的證據顯示糖尿病與HCC存在著密切關系,已成為HCC的獨立危險因素,有研究顯示HCC合并2型糖尿病的預后與根治術治療和射頻消融治療的復發率、死亡率及肝外轉移率與糖尿病密切相關[3-6]。但是,經肝動脈栓塞化療栓塞術(transarterial chemoembolization, TACE)治療HCC合并2型糖尿病患者的預后的臨床研究較為少見。鑒于此,本文對TACE治療HCC合并2型糖尿病患者對其生存時間、預后因素等進行了研究,為HCC合并2型糖尿病患者延長生命、提高生活質量,制定合適國人的治療方案提供依據。
對象與方法
1.病例及資料:所有患者均符合我國肝癌協作會議擬定的原發性肝癌診斷標準[7]。糖尿病診斷標準:符合美國糖尿病協會(ADA)的糖尿病診斷標準:空腹血糖水平為≥7.0 mmol/L,餐后2 h血糖≥11.1 mmol/L。排除標準包括:糖尿病病程少于1年之前確診的肝癌,有遠處轉移者,肝臟原發病灶切除治療及HCV病毒感染相關性肝癌患者。本組共收集解放軍總醫院介入放射科 2008年12月—2011年12月間符合上述標準的HCC合并2型糖尿病患者145例,其中臨床診斷123例,病理診斷者22例。我們隨機從原發性肝癌患者數據庫中抽取168例HCC進行對比研究,分析及整理其臨床及病例資料,兩組基本臨床資料比較顯示:年齡、性別、腫瘤大小、肝硬化、ECOG評分、腫瘤數目、Child分級、門脈癌栓及血清AFP水平均無統計學差異(P>0.05,表1)。
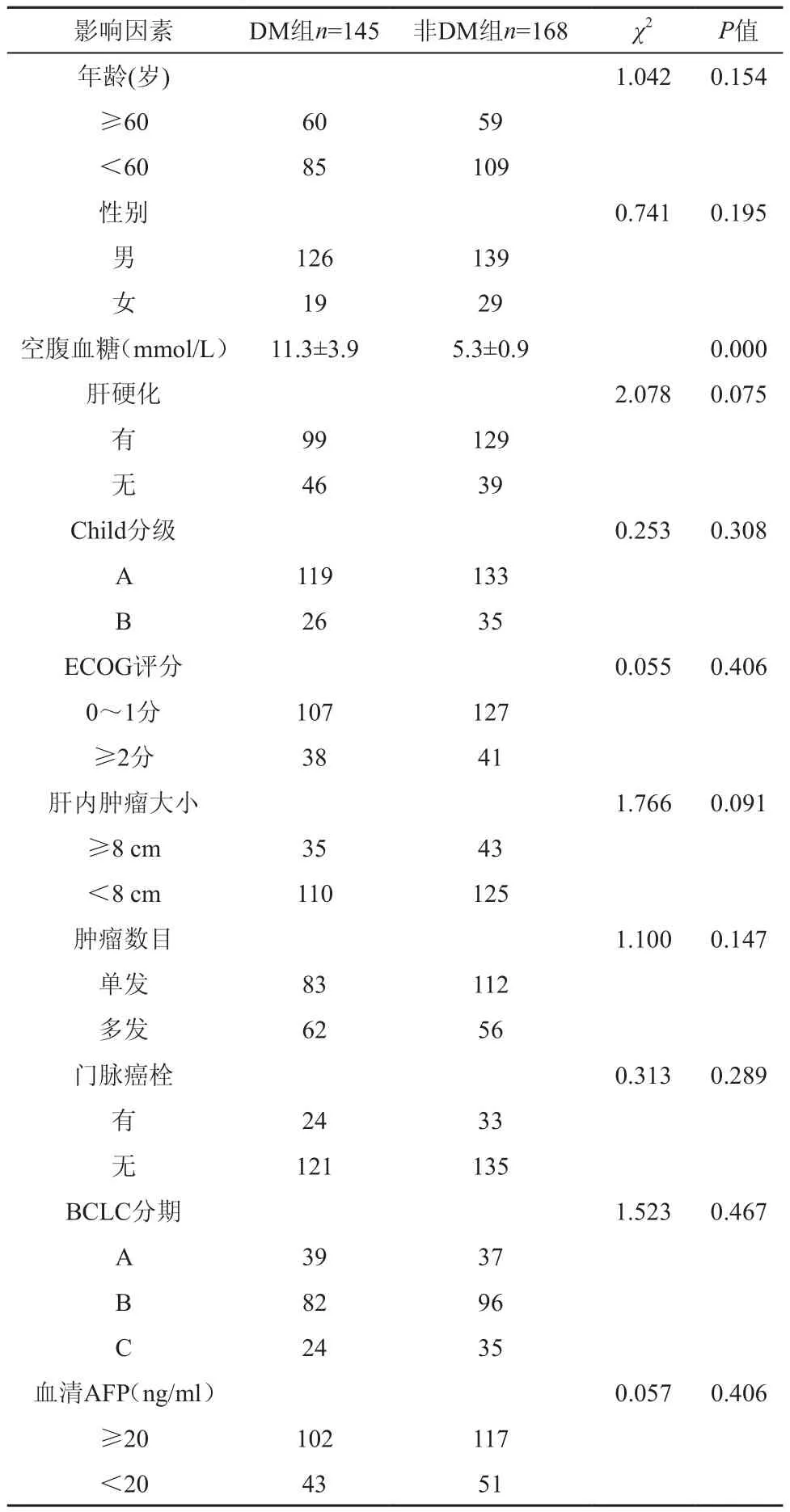
表1 兩組原發性肝癌患者的臨床基線特征比較
2.TACE 治療方案:兩組患者TACE治療術中用藥均為以下藥物:超液化碘油6~20 ml;注射用奧沙利鉑(50~150 mg/m2);注射用鹽酸表柔比星(40~50 mg/m2);注射用羥喜樹堿(10~14 mg/次);5-氟尿嘧啶注射液(500~600 mg/m2);亞葉酸鈣注射液(200~300 mg/m2)。所有病例均酌情予以1~2 mm 的明膠海綿加強栓塞供血動脈。根據肝臟腫瘤的治療反應和患者的肝功能情況決定下一次TACE治療,間隔時間為4~8周不等。TACE治療后視患者情況給予止痛、止吐、預防感染和保護肝腎功能等支持治療。
3.糖尿病治療方法:胰島素治療95例,二甲雙胍治療33例,運動及飲食控制 7 例,拜糖平 3 例、格列美脲 4 例、羅格列酮 3 例。
4.隨訪:對所有患者每2~3個月門診隨訪,檢測血常規、肝腎功能、血清AFP,酌情選擇超聲、CT、MR和或PET-CT檢查等。對不能如期進行上述方式隨訪者,則采用電話方式進行隨訪,本組患者中位隨訪時間16個月(1~36個月)。本組患者隨訪率為100%,生存期自確診HCC日期開始計算,至死亡日期或最后隨訪日期為止。生存時間以月表示,313例患者隨訪資料完整。
5.統計學分析:統計學處理采用乘積極限法Kaplan-Meier法進行生存分析,并行Log-Rank法檢驗進行單因素間相關性分析和多因素用Cox風險回歸模型進行分析。組間差異統計采用t檢驗,比例之間的差別采用χ2檢驗。P<0.05為差異有統計學意義。
結 果
1.兩組患者介入次數及不良反應的比較:DM組145例患者行TACE治療次數為2~8次,(3.35±1.47),非DM組168例患者行TACE治療次數為1~8次(3.29±1.16),無統計學意義(P=0.750)。TACE治療后的副作用及并發癥:兩組患者均未發生感染、消化道出血、肝功能衰竭及與介入治療相關的意外死亡。兩組患者其他并發癥的比較,如發熱、上腹部疼痛、腹脹、便秘、惡心、嘔吐和一過性肝功能障礙等栓塞后綜合征,無統計學意義(P>0.05)。所有患者均給予對癥處理后好轉。
2.HCC合并糖尿病患者的診斷時間及對生存期的影響:DM組患者在確診HCC前患糖尿病的時間為 1.2~30.0年,平均為6.74±5.21年。DM組患者的總生存時間較非DM組患者無明顯縮短,兩組中位生存時間分別為27.0個月和31.0個月(P>0.05),見圖1。DM組的1、2、3年生存率分別為84.5%、47.5%、39.5%;非DM組的1、2、3年生存率分別為87.5%、57.5%、42.5%。
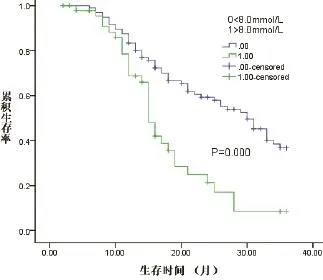
圖1 不同血糖水平對HCC合并糖尿病患者生存率的影響
分層分析結果顯示:在DM組中,空腹血糖≥8 mmol/L與空腹血糖<8 mmol/L相比,中位生存時間分別為15個月和30個月,具有統計學意義(P<0.001)。而DM組中血糖控制良好的患者,既空腹血糖<8 mmol/L的患者與非DM組相比,中位生存時間分別為28個月和31個月,無統計學差異,P>0.05。
3.兩組患者肝外轉移率的比較:至隨訪截止日期,DM組145例患者中,發生肝外轉移者51例(35.2%,51/145),其中肺轉移32例(62.7%,32/51),骨轉移11例(21.6%,11/51),肝門及腹腔淋巴結轉移7例(13.7%,7/51),右腎上腺轉移1例(2.0%,1/51)。在發生肝外轉移的患者中,有74.5%的患者血糖控制欠佳,即空腹血糖水平≥8 mmol/L。非DM組168例患者中發生肝外轉移者31例(18.5%,31/168),發生肺轉移者19例(61.3%,19/31),骨轉移6例(19.4%,6/31),肝門及腹腔淋巴結轉移5例(16.1%,5/31),腦轉移1例(3.2%,1/31)。兩組患者發生遠處轉移者比較具有統計學意義(P=0.001)。
4.生存因素分析:①單因素分析顯示性別、年齡、患糖尿病時間、糖尿病治療方式、肝硬化、腫瘤數目及肝外轉移情況均存無顯著相關;而空腹血糖水平、肝硬化、Child分級、ECOG評分、肝內原發腫瘤>8.0 cm、門脈癌栓、BCLC分期、血清白蛋白水平及AFP水平是影響糖尿病合并 HCC患者預后的獨立危險因素。②Cox多元回歸分析顯示:空腹血糖水平、腫瘤大小、ECOG評分、BCLC分期及門脈癌栓是影響HCC合并糖尿病患者預后的獨立危險因素(表3)。
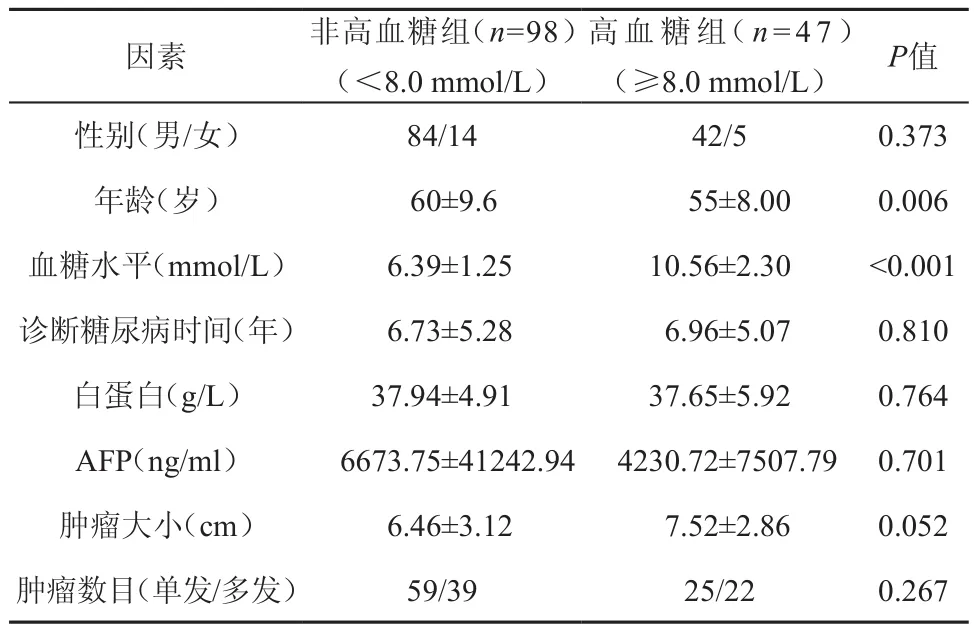
表2 HCC合并糖尿病患者的組間臨床基線特征
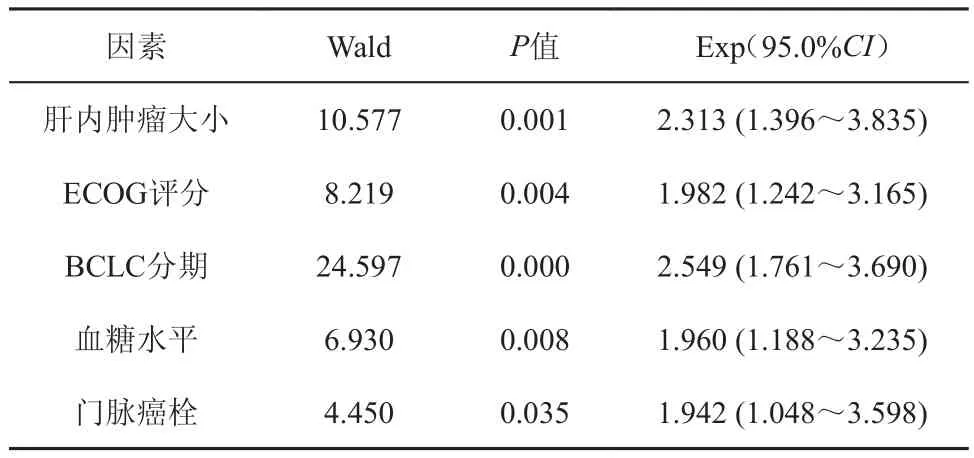
表3 HCC合并糖尿病患者預后因素Cox模型多因素分析
討 論
肝細胞癌(HCC)的發病率和死亡率顯著增加。在我國各種惡性腫瘤的死亡順位中,肝癌僅次于肺癌居第二位。經過30余年的努力,我國肝癌的治療取得了長足進步,但總體而言,預后仍很差。在我國肝癌的主要危險因素是B、C型肝炎病毒(HBV、HCV)感染及黃曲霉毒素的攝入及長年飲用不潔水等等,但是,我們臨床上發現仍有少部分肝癌患者無任何公認的致病因素。多項國內外研究表明2型糖尿病是肝癌的一個危險因素,增加肝癌發生的風險[2-5,8-9]。前瞻性研究的Meta分析結果表明糖尿病者患肝癌的相對危險度為2.01[10]。有研究證實,在糖尿病患者中,如果長期血糖控制不佳,糖化血紅蛋白水平每增加1%,則增加肝癌的風險為26%-50%[11]。
肝癌合并糖尿病其肝硬化發生率高,嚴重肝硬化患者,其肝臟的糖原合成及儲備功能下降,糖尿病對其他重要臟器如肺、心、腎所致的隱匿性病變,使得肝癌合并糖尿病在行肝切除術時風險性更大,并且影響預后。有研究顯示:對孤立性大肝癌患者行手術治療后,合并DM病人的生存時間較無DM病人的生存時間有顯著的縮短(P=0.037);合并DM組患者術后并發癥發生率明顯高于無DM組(P=0.001),其并發癥主要是腹腔及切口感染、肺部感染等[12]。本研究顯示:全組患者介入術后均未發生感染并發癥發生,我們認為可能與患者術后積極給予抗炎,預防感染等治療有關。
Takanori等[13]回顧性研究了射頻消融治療344例HCC患者,1 年、2年和3年的復發率分別為29.3%,57.5%和75.2%,單因素分析顯示:患者血糖水平,血清AFP水平及腫瘤數目與肝癌復發顯著相關。多因素分析結果顯示:血糖控制欠佳(P=0.0046)是影響預后的獨立危險因素。分層分析結果顯示:糖尿病患者中,血糖控制欠佳者與血糖控制良好的HCC患者相比,生存率明顯縮短(P=0.0003)。結果表明,糖尿病本身不是影響HCC生存的重要危險因素,但血糖水平控制欠佳,高血糖是影響HCC生存的一個重要的危險信號。高血糖影響生存及導致腫瘤復發的原因可能促進腫瘤細胞的增殖,通過加速細胞周期進程,或通過活性氧的生產,從而激活蛋白激酶C和癌細胞的DNA合成增加[14-15]。
我們的研究結果顯示:DM組患者的總生存期較非DM組患者無明顯縮短,兩組中位生存時間分別為27.0個月和31.0個月(P>0.05)。分層分析結果顯示:在DM組中,空腹血糖≥8 mmol/L與空腹血糖<8 mmol/L相比,中位生存時間分別為15個月和30個月,具有統計學差異,(P<0.001)。而DM組中血糖控制良好的患者與非DM組相比,中位生存時間分別為28個月和31個月,無統計學差異(P>0.05)。
Gregory等[6]研究顯示HCC合并糖尿病的患者更容易出現遠處轉移的發生,其共觀察了256例HCC患者,在DM組中發生肝外轉移者為30.9%,而非DM組發生肝外轉移者為9.3%,具有統計學意義(P<0.0001)。我們的研究中DM組145例患者發生肝外轉移者51例(其中74.5%的患者空腹血糖水平≥8 mmol/L),其中肺轉移32例(62.7%),骨轉移11例(21.6%);而非DM組168例患者中發生肝外轉移者31例,發生肺轉移者19例(61.3%),骨轉移6例(19.4%)。兩組患者發生遠處轉移者比較具有統計學意義(P=0.001)。
我們的研究結果還表明,有效的控制高血糖(<8 mmol/L)則可減少肝癌遠處轉移的風險和改善整體存活率。對于糖尿病的治療,改善胰島素抵抗無疑是最重要的因素。最近的研究報告指出[16-17],外源性胰島素可能增加患癌癥的風險,其機制可能與應用胰島素治療糖尿病,增加血液循環中胰島素水平,胰島素通過直接和/或間接地刺激胰島素樣生長因子-1(insulin-like growth factor 1,IGF-1),促有絲分裂和抗凋亡效應的發生有關。另有研究顯示:二甲雙胍聯合胰島素控制血糖則可以抵消致癌的風險,其機制可能與二甲雙胍減少某些脂肪生成酶的表達,抑制脂質合成,對脂質合成增加的HCC患者具有一定的治療作用[18]。
總之,我們的研究結果表明,HCC合并糖尿病患者的血糖水平控制欠佳是一個顯著的獨立危險因素,高血糖可增加肝癌患者發生遠處轉移的風險和整體存率的減少。糖尿病患者血糖的控制在HCC的總體生存起到了重要作用。高血糖導致生存時間縮短的相關機制尚不清楚,可能與肝癌高血糖患者多次介入治療、肝功能多次受到打擊帶來的損害,導致病情惡化有關。
1 El-Serag HB. Hepatocellular carcinoma[J]. N Engl J Med, 2011,365(12):1118-1127.
2 王軼,于成功.糖尿病與原發性肝癌[J].中華糖尿病雜志, 2009,1(4):304-306.
3 Lai SW, Chen PC, Liao KF, et al. Risk of hepatocellular carcinoma in diabetic patients and risk reduction associated with anti-diabetic therapy: a population-based cohort study[J]. Am J Gastroenter ol,2012,107(1):46-52.
4 Kawamura Y, Ikeda K, Arase Y, et a1.Diabetes mellitus worsens the recurrence rate after potentially curative therapy in patients with hepatocellular carcinoma associated with nonviral hepatitis[J].J Gastroenterol Hepatol,2008,23:1739-1746.
5 Amarapurkar DN, Patel ND, Kamani PM.Impact of diabetes mellitus on outcome of HCC[J].Ann Hepatol, 2008,7:148-151.
6 Connolly GC, Safadjou S, Chen R, et al. Diabetes mellitus is associated with the presence of metastatic spread at disease presentation in hepatocellular carcinoma[J]. Cancer Invest, 2012,30(10):698-702.
7 夏景林.原發性肝癌的規范化診療[J].中國臨床醫生,2012,40(1):26-30.
8 Serag H, Tran T, Everhart JE. Diabetes increases the risk of chronic liver disease and hepatocellular carcinoma[J]. Gastroenterology, 2004,126(2):460-468.
9 Pavila JA, Morgan R0, Shaib Y, et a1. Diabetes increases the risk of hepatocellular carcinoma in the United states: a population based case control study[J].Gut, 2005,54:533-539.
10 Wang C, Wang X, Gong G, et al. Increased risk of hepatocellular carcinoma in patients with diabetes mellitus:A systematic review and meta-analysis of cohort studies[J].Int J Cancer,2012,130(7):1639-1648.
11 Valter D, Massimiliano B, Francesca V, et al. Glycated hemoglobin and antidiabetic strategies as risk factors for hepatocellular carcinoma[J]. World J Gastroenterol, 2010,16(24):3025-3032.
12 歐迪鵬,楊連粵,曾志軍,等.糖尿病對肝癌肝切除術預后的影響[J].中華肝膽外科雜志,2007,13(5):317-319.
13 Takanori H, Masayuki K, Kaoru T, et al. Hyperglycemia is a signifcant prognostic factor of hepatocellular carcinoma after curative therapy[J]. World J Gastroenterol, 2013,19(2):249-257.
14 Liu H, Ma Q, Li J. High glucose promotes cell proliferation and enhances GDNF and RET expression in pancreatic cancer cells[J]. Mol Cell Biochem, 2011,347:95-101.
15 Nishikawa T, Edelstein D, Du XL, et al. Normalizing mitochondrial superoxide production blocks three pathways of hyperglycaemic damage[J]. Nature, 2000,404:787-790.
16 Kawaguchi T, Taniguchi E, Morita Y, et al. Association of exogenous insulin or sulphonylurea treatment with an increased incidence of hepatoma in patients with hepatitis C virus infection[J]. Liver Int, 2010,30:479-486.
17 Giovannucci E, Michaud D. The role of obesity and related metabolic disturbances in cancers of the colon, prostate, and pancreas[J]. Gastroenterology, 2007,132: 2208-2225.
18 Currie CJ, Poole CD, Gale EA. The influence of glucoselowering therapies on cancer risk in type 2 diabetes[J]. Diabetologia, 2009,52:1766-1777.
Prognostic factors of hepatocellular carcinoma with diabetes mellitus treated with transarterialchemoembolization
Chang Zhongfei, Duan Feng, Sun Hongmei, Wang Maoqiang *Department of Interventional Radiology, PLA General Hospital, Beijing,100853, China Corresponding author: Wang Maoqiang, Email: wangmq@vip.sina.com
Objective To evaluate the effect and prognostic factors of 145 cases of HCC patients with diabetes mellitus (DM) treated with TACE. Methods A retrospective analysis about the effect and prognostic factors of TACE was conducted on 145 cases of HCC patients with DM. The survival rates were calculated using the Kaplan-Meier method. The log-rank method was used for univariate analysis, and the Cox regression model was used for multivariate analysis. Results There was no marked difference the 2 groups patients in postoperative overall survival (P>0.05). There was significant difference between the patients HCC with DM and those without DM in distant metastasis (P<0.05). The hierarchical analysis results show: DM group comparison between groups, Compared with fasting plasma glucose≥8 mmol/L HCC patients, patients with fasting plasma glucose < 8 mmol/L status, Statistically significant(P<0.001), The median survival time 15.0(95% CI 13.648-16.352)and 30.0(95% CI 24.979-35.021), respectively. Multivariate analysis indicated fasting blood glucose level, tumor size > 8 cm, ECOG score, BCLC grade and PVTT were independent prognostic factors. Conclusions Inadequate maintenance of blood glucose in diabetic patients is a signifcant risk factor for metastasis of HCC and for poor survival after curative TACE therapy.
Carcinoma, hepatocellular; Transarterial chemoembolization; Diabetes mellitus;Prognosis
2014-7-12)
(本文編輯:黃強)
10.3877/cma.j.issn.2095-5782.2015.01.004
100853 北京,解放軍總醫院介入放射科(常中飛、段峰、王茂強);100043 北京,首都醫科大學石景山教學醫院北京市石景山醫院腫瘤科(常中飛、孫紅梅)
王茂強,Email:wangmq@vip.sina.com

