化學平衡理論的應用
沈鎮和
化學平衡理論是高中化學課程的重要內容,其理論在以后的學習中不斷地應用。弱電解質的電離平衡(包括水的電離平衡)、鹽類對水解平衡以及難溶物的溶解平衡都可以看成是化學平衡的延伸和應用。理解這些平衡的思維方式與化學平衡非常相似,有很強的可比性。以上內容在高中化學的學習中有非常重要的地位,也是高考常考的知識點。以下就化學平衡理論在上述內容中的應用加以歸納,試理出該理論在應用過程中的異同點。
一、化學平衡的判斷
在一定條件下,當一個可逆反應的正反應速率等于逆反應速率,反應體系中各物質的濃度保持不變,該可逆反應就達到平衡狀態。
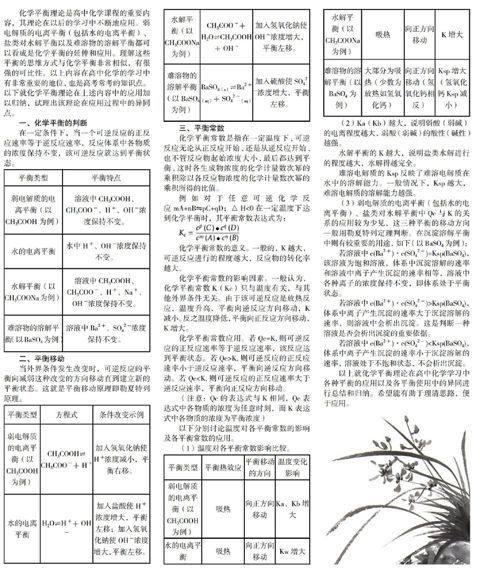
平衡類型 平衡特點
弱電解質的電離平衡(以CH3COOH為例) 溶液中CH3COOH、CH3COO-、H+、OH-濃度保持不變。
水的電離平衡 水中H+、OH-濃度保持不變。
水解平衡(以CH3COONa為例) 溶液中CH3COOH、CH3COO-、H+、Na+、OH-濃度保持不變。
難溶物的溶解平衡(以BaSO4為例) 溶液中Ba2+、SO42-濃度保持不變。
二、平衡移動
當外界條件發生改變時,可逆反應的平衡向減弱這種改變的方向移動直到建立新的平衡狀態。這就是平衡移動原理即勒夏特列原理。
平衡類型 方程式 條件改變示例
弱電解質的電離平衡(以CH3COOH為例) CH3COOH? CH3COO-+H+ 加入氫氧化鈉使H+濃度減小,平衡右移。
水的電離平衡 H2O?H++OH- 加入鹽酸使H+濃度增大,平衡左移;加入氫氧化鈉使OH-濃度增大,平衡左移。
水解平衡(以CH3COONa為例) CH3COO-+H2O?CH3COOH+OH- 加入氫氧化鈉使OH-濃度增大,平衡左移。
難溶物的溶解平衡(以BaSO4為例) BaSO4(s)?Ba2+(aq)+SO42-(aq) 加入硫酸使SO42-濃度增大,平衡左移。
三、平衡常數
化學平衡常數是指在一定溫度下,可逆反應無論從正反應開始,還是從逆反應開始,也不管反應物起始濃度大小,最后都達到平衡,這時各生成物濃度的化學計量數次冪的乘積除以各反應物濃度的化學計量數次冪的乘積所得的比值。
例如對于任意可逆化學反應 mA+nB?pC+qD;△H<0在一定溫度下達到化學平衡時,其平衡常數表達式為:
化學平衡常數的意義。一般的,K越大,可逆反應進行的程度越大,反應物的轉化率越大。
化學平衡常數的影響因素。一般認為,化學平衡常數K(Kc)只與溫度有關,與其他外界條件無關。由于該可逆反應是放熱反應,溫度升高,平衡向逆反應方向移動,K減小。反之溫度降低,平衡向正反應方向移動,K增大。
化學平衡常數應用。若Qc=K,則可逆反應的正反應速率等于逆反應速率,該反應達到平衡狀態。若Qc>K,則可逆反應的正反應速率小于逆反應速率,平衡向逆反應方向移動。若Qc (注意:Qc的表達式與K相同,Qc表達式中各物質的濃度為任意時刻,而K表達式中各物質的濃度為平衡濃度) 以下分別討論溫度對各平衡常數的影響及各平衡常數的應用。 (1)溫度對各平衡常數影響比較。 平衡類型 平衡熱效應 平衡移動的方向 溫度變化影響 弱電解質的電離平衡(以CH3COOH為例) 吸熱 向正方向移動 Ka、Kb增大 水的電離平衡 吸熱 向正方向移動 Kw增大 水解平衡(以CH3COONa為例) 吸熱 向正方向移動 K增大 難溶物的溶解平衡(以BaSO4為例) 大部分為吸熱(少數為放熱如氫氧化鈣) 向正方向移動(氫氧化鈣相反) Ksp增大(氫氧化鈣Ksp減小) (2)Ka(Kb)越大,說明弱酸(弱堿)的電離程度越大,弱酸(弱堿)的酸性(堿性)越強。 水解平衡的K越大,說明鹽類水解進行的程度越大,水解得越完全。 難溶電解質的Ksp反映了難溶電解質在水中的溶解能力。一般情況下,Ksp越大,難溶電解質的溶解能力越強。 (3)弱電解質的電離平衡(包括水的電離平衡)、鹽類對水解平衡中Qc與K的關系的應用較為少見,這三種平衡的移動方向一般用勒夏特列定理判斷。在沉淀溶解平衡中則有較重要的用途,如下(以BaSO4為例): 若溶液中c(Ba2+)·c(SO42-)=Ksp(BaSO4),該溶液為飽和溶液,體系中沉淀溶解的速率和溶液中離子產生沉淀的速率相等,溶液中各種離子的濃度保持不變,即體系處于平衡狀態。 若溶液中c(Ba2+)·c(SO42-)>Ksp(BaSO4),體系中離子產生沉淀的速率大于沉淀溶解的速率,則溶液中會析出沉淀。這是判斷一種溶液是否會析出沉淀的重要依據。 若溶液中c(Ba2+)·c(SO42-) 以上就化學平衡理論在高中化學學習中各種平衡的應用以及各平衡使用中的異同進行總結和歸納。希望能有助于理清思路,便于應用。

