雙指示劑法測定混合堿樣的含量
2015-09-10 07:22:44喻長軍
考試周刊
2015年3期
喻長軍
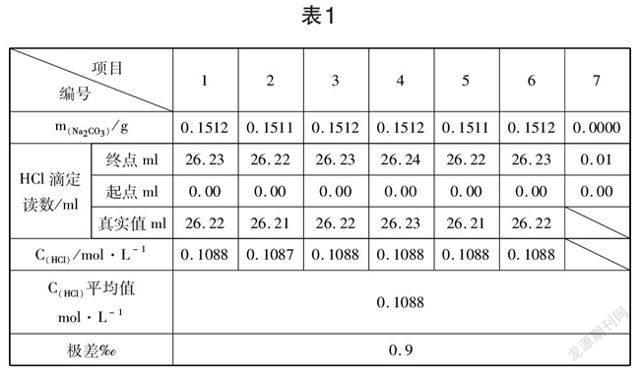

摘??? 要: 使用雙指示劑測定混合堿含量,是根據兩個終點消耗的鹽酸的體積計算混合堿中的組分與含量,利用溶液化學計量點時顏色的明顯變化,判斷其滴定終點,整個操作經濟實用,步驟簡單快捷,測定結果較準確,使用較廣泛。
關鍵詞: 雙指示劑??? 混合堿??? 含量測定
1.引言
本文是測定混合堿的含量,而目前測定混合堿的方法有很多種,如Bacl■法、混合指示劑法、自動電位滴定等,本實驗采用的是雙指示劑測定混合堿的含量。用雙指示劑測定堿含量操作簡單,使用儀器在實驗室中常見,整個實驗不需要過多開銷就能得到需要的準確數據。所謂雙指示劑是分別以酚酞和甲基橙為指示劑,在同一溶液中用鹽酸標準溶液作滴定劑進行連續滴定。根據兩個終點消耗的鹽酸標準溶液滴定的體積,計算混合堿中各組分的含量,下面是對測定混合堿的具體分析與討論。
2.實驗部分
2.1實驗原理
混合堿是Na■CO■與NaOH或Na■CO■與NaHCO■的混合物,可采用雙指示劑法進行分析,測定各組分的含量。
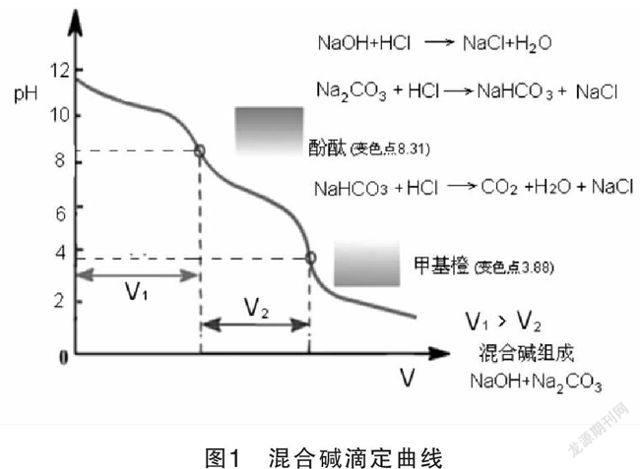
在混合堿的試液中加入酚酞指示劑用HCL標準溶液滴定至溶液呈微紅色,此時試液中所含NaOH完全被中和。Na■CO■也被滴定成NaHCO■,此時是第一個化學計量點,pH=8.31反應方程式如下:
NaOH+HCl=NaCl+H■O
Na■CO■+HCl=NaHCO■+NaCl
設滴定體積V■ml,再加入甲基橙指示劑,繼續用HCL標準溶液滴定至溶液由黃色變為橙色即為終點,此時NaHCO■被中和成H■CO■,此時是第二個化學計量點,pH=3.88反應方程式如下:
NaHCO■+HCl=NaCl+H■O+CO■
設此時消耗HCl標準溶液的體積為V■ml,根據V■和V■可以判斷出混合堿的組成。……
登錄APP查看全文

