延遲退休年齡政策的社會認同與影響因素
于鐵山


摘要:基于2014年中國勞動力調查數據(CLDS),考察我國勞動力對于延遲退休年齡政策的認同情況及其影響因素。研究表明,不贊同延遲退休年齡政策的人數是支持延遲退休年齡人數的兩倍多;60后、70后與80后對于延遲退休政策社會認同較低;在勞動力就業能力方面,教育變量與職業類型對于延遲退休年齡政策具有顯著影響,收入的影響不顯著;在社會認知層面,勞動力的生活幸福感與主觀地位對于延遲退休年齡政策具有顯著影響。因此,建議根據不同年齡采取差異化和更具彈性的延遲退休年齡政策。
關鍵詞:延遲退休;CLDS;認同;影響因素
一、研究背景與問題提出
根據《2015年國民經濟和社會發展統計公報》可知,目前我國60周歲及以上人口達到22200萬,占比為16.1%,其中65周歲及以上14386萬人,占比為10.5%。由此可知,我國已經步入老齡化社會,在這種背景下,延遲退休年齡也成為社會關注的焦點。
在世界范圍內,包括美國與德國在內的部分國家都在延長退休年齡。在我國,隨著人均預期壽命與人們受教育年限的持續延長,勞動力的供求關系也在發生變化;特別是我國的退休年齡標準已經執行數十年,從未調整。在這種背景下,逐步延遲法定退休年齡是我國適應社會發展的必然選擇。由于延遲退休年齡涉及廣大職工的切身利益,事關就業與社會穩定,特別是各類群體差異比較大,所以政策遲遲未能出臺,因此,研究勞動力對于該項政策的評價與認識,有助于推動該項政策的制定與實施。在此基礎上,本研究主要探討勞動力對于延遲退休年齡政策的社會認同與影響因素,具體包括當前我國勞動力對于延遲退休年齡政策認同情況、延遲退休年齡政策認同的相關影響因素以及延遲退休年齡政策的相關結論與建議。
二、研究回顧與研究假設
長期以來,學界關于延遲退休政策的制定就存在爭議,在工業發達的國家,在一定時期內勞動力提前退休的現象較為普遍,綜合來看,以往關于延遲退休的相關研究可以概括為三類。
第一類是探討為什么要出臺延遲退休年齡政策,并重點研究影響延遲退休年齡政策的相關因素。國外調查數據顯示,退休政策、經濟因素與個人背景等變量會影響到個人的退休計劃。英國的調查研究顯示,退休年齡的分層特征明顯,較高地位者的退休年齡受職業年金、個人儲蓄和商業養老的影響,較低地位者退休后往往繼續從事兼職。同時,國外相關研究發現不同職業對于退休年齡有一定影響。國內的相關實證研究發現受教育程度越高的人越不愿意延遲退休;在性別方面,女性比男性具有更強的延遲退休意愿;在技術職稱方面,具有高級技術職稱的人更傾向于延遲退休。生命周期理論則認為,工作年限減少、工作生命周期比下降和退休生命周期比上升帶來個人自我養老壓力加大、負擔加重,導致延遲退休不可避免。上述國內外研究發現影響延遲退休政策的變量存在一定共性,這些研究對于探討我國的延遲退休年齡政策具有一定的借鑒意義。
在此基礎上,第二類研究集中關注延遲退休年齡政策的相關效應,既有經濟效應也有社會效應。有研究根據option value模型發現延遲退休對我國男性勞動者和低收入勞動者造成明顯的經濟損失。有研究從社會政策視角出發認為研究延遲退休年齡政策要特別注重評估政策的科學性與效果。劉萬基于對城鎮職工不同退休年齡養老金財富的考察,認為調整退休年齡主要是調整各類養老金最低領取年齡。延遲退休對于青年群體就業影響如何?實證研究發現延遲退休確實會對青年人就業產生一定的負作用,但是這種影響不應該被夸大,且存在行業差異。這部分研究多關注于特定群體對于延遲退休的影響,忽略了數量龐大的勞動力對于延遲退休的社會認同,特別是缺乏大規模調查數據研究,不利于相關政策的制定與實施。
不同于前面兩種研究,第三類研究主要針對延遲退休相關研究的系統文獻梳理與介紹國外關于延遲退休政策的經驗。目前我國正在醞釀出臺延遲退休年齡政策,借鑒其他國家在延遲退休年齡政策方面的經驗,有助于制定具有中國特色的延遲退休年齡政策。
總體來看,以往的研究多關注于延遲退休年齡政策實施的成因與效應,從邏輯上屬于社會政策實施過程的評估。而本研究是在我國尚未出臺實施延遲退休年齡政策的背景下,考察我國勞動力對于延遲退休年齡政策的社會認同,重點調查勞動力對于該政策的社會認同現狀,即勞動力是否贊成出臺該政策,以及不同勞動力對于延遲退休年齡政策的社會認同差異,即分別有哪些勞動力贊成與反對該項政策;通過大規模調查數據研究,為制定與實施延遲退休年齡政策提供相關參考。
從社會政策分析的角度來看,沒有哪項具體的公共政策能夠使所有人同等受益,在社會政策體系中,受益的不均等性也較為突出,任何社會政策都會產生受益方與受損方,兩者對于社會政策具有不同的社會認同。
首先,由于延遲退休年齡政策的焦點之一就是退休年齡的劃定,因此年齡是重點考察的變量。以十年為一代,將勞動力劃分為不同年代,如“70后”勞動力、“80后”勞動力等,分別考察不同年齡段勞動力對于延遲退休政策的認同情況。在此基礎上提出第一個研究假設H1:不同年齡階段的勞動力對于延遲退休年齡政策的社會認同存在顯著差異,且年齡越小的勞動力越不認同延遲退休年齡政策。
其次,考慮到勞動力對于延遲退休年齡政策的認同情況與勞動力個人在勞動力市場的受益與受損情況密切相關,在“利益受益—利益受損”的研究框架下,在勞動力就業市場中的利益受益方會贊成延遲退休年齡政策,而利益受損方則不贊成延遲退休年齡政策,因此,選取勞動力就業能力作為影響延遲退休政策的重要變量。一般認為勞動力的就業能力越高,則在勞動力市場競爭力越強,也就傾向于不認同延遲退休年齡政策。衡量就業能力的指標包括受教育年限、職業類別與收入狀況。因此,我們提出第二個研究假設H2:勞動力的就業能力對于延遲退休年齡政策社會認同具有顯著影響。該假設可以操作化為3個具體假設:
H2a受教育年限越多的勞動力,越不認同延遲退休年齡政策;endprint
Hab收入越高的勞動力,越不認同延遲退休年齡政策;
H2a從事不同職業的勞動力對于延遲退休年齡政策有顯著差異。
最后,從社會政策的效應來看,勞動力的當前社會認知會影響到勞動力對于延遲退休年齡政策的社會認同。因此,我們提出第三個研究假設H3:勞動力的社會認知對于延遲退休年齡政策認同具有顯著影響。該假設可以操作化為4個具體假設:
H3a生活幸福感越高的勞動力,越認同延遲退休年齡政策;
H3b生活滿意度越高的勞動力,越認同延遲退休年齡政策;
H3c主觀社會地位越高的勞動力,越認同于延遲退休年齡政策;
H3a家庭經濟狀況滿意度越高的勞動力,越認同延遲退休年齡政策。
三、數據、變量與方法
本研究采用“中國勞動力動態調查”(CLDs)數據。這是中山大學主持的我國第一個以勞動力為主題的全國性跟蹤調查。“中國勞動力動態調查”(CLDS)樣本覆蓋了我國29個省市,調查對象為樣本家庭戶中的全部勞動力,在抽樣方法上,采用多階段、多層次與勞動力規模成比例的概率抽樣方法。2012年第一次全國性調查完成,2014年第一輪追蹤調查完成。CLDS(2014)共收集到23 594條數據。
(一)因變量
因變量是勞動力對于延遲退休年齡政策的認同情況,在調查問卷中用于測量因變量的問題是“您是否贊同延遲退休年齡政策?”對于該問題的回答分為“非常贊同”“較贊同”“無所謂”“較不贊同”“非常不贊同”等5類,在統計分析時分別賦值為1到5。由于因變量是秩序類別變量,因此宜采用定序logit統計分析,定序logit是二分類logit模型的自然延伸運用,這種模型又被稱為累積(cumulative)logit模型。對于模型的建構采用stata12.0版本執行。
(二)自變量
眾所周知,測量勞動力就業能力的變量主要包括教育、職業與收入等,其中,教育變量涵蓋了文盲到博士11個種類。在統計分析時,本文將教育變量重新編碼為受教育年限,其中普通高中、職業高中、技校、中專與大專的受教育年限都設置為12年。
在統計分析的過程中為了滿足收入變量符合正態性要求,校對收入變量取對數,把職業變量分為11種:黨政機關、人民團體、軍隊;國有/集體事業單位;國營企業;集體企業;村居委會等自治組織;民營、私營企業;外資、合資企業;民辦非企業、社團等社會組織;體工商戶;務農(農林牧副漁業生產);自由工作者等;并對職業變量進行編碼。
由于延遲退休年齡政策的核心變量是年齡,因此重點考察不同年齡段者對于延遲退休年齡政策的社會認同情況。因為年齡是連續性變量,所以在統計分析的過程中,根據不同年齡段將該變量重新編碼為90后、80后、70后、60后、50后、40后、30后與20后等。
勞動力對于延遲退休年齡政策的社會認同受到當前社會認知的影響,其中社會認知變量包括勞動力的主觀地位、幸福感、滿意度與經濟狀況評價等。
在調查問卷中勞動力幸福感變量通過“總的來說,您認為您的生活過得是否幸福”來測量,幸福感在1-5之間,非常不幸福=1,非常幸福=5。
在調查問卷中勞動力生活滿意度變量通過“總體來說,您對您的生活狀況感到滿意么”來測量,滿意度在1-5之間,非常不滿意=1,非常滿意=5。
在調查問卷中勞動力家庭經濟滿意度通過“總體來說,您對您的家庭經濟狀況感到滿意么”來測量,滿意度在1-5之間,非常不滿意=1,非常滿意=5。
在調查問卷中勞動力主觀地位變量通過“您認為您自己目前在哪個等級上”來測量,最高的“10”分代表最頂層,最低的“1”分代表最底層。
(三)控制變量
在統計分析中的控制變量主要包括性別、戶口性質等。兩者均為類別變量,性別分為男性(男性=1)與女性(女性=0),戶口性質包括農業戶口、非農戶口與居民戶口等。
本研究所選用的基本變量如表1所示。
四、數據分析結果
調查結果顯示,在6252名接受調查的勞動力中,1867名被調查者認為理想退休年齡應該是60歲,占比29.86%;1465名被調查者認為理想退休年齡應該是55歲,占比23.43%;1890名被調查者認為理想退休年齡應該是50歲,占比30.23%。
(一)勞動力對延遲退休年齡政策認同現狀
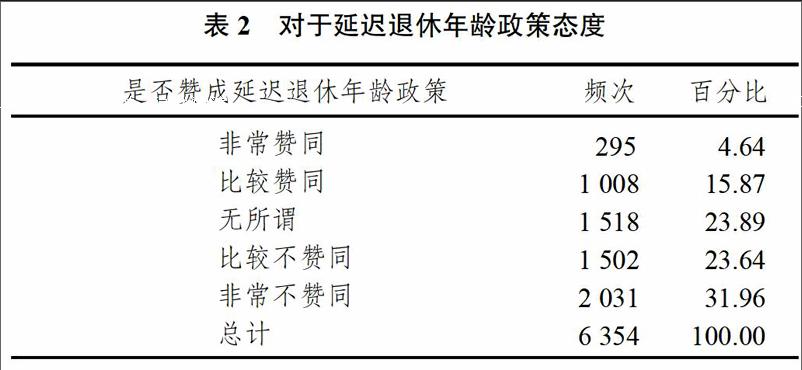
從工作社會學的角度來看,工作對于不同的勞動力來說具有不同內涵,并形成了兩種截然不同的觀點。第一種觀點是部分勞動力從負面角度視工作為一種懲罰與控制;第二種觀點是部分勞動力從正面角度認為工作是一項責任與事業,是實現自我的重要表達方式。因此,勞動力對于工作的態度將直接影響到他們對于延遲退休政策的社會認同情況。中國勞動力調查(CLDS)問卷設置了是否贊成延遲退休年齡政策的問題,調查結果如表2所示。在調查的6354名受訪者中,認同延遲退休年齡政策的勞動力占比20.51%,不認同延遲退休年齡政策的勞動力占比55.60%,持無所謂態度的勞動力占比23.89%。由此可知,不認同延遲退休年齡政策的勞動力是認同者的2倍以上。在這種背景下,了解影響延遲退休態度的因素就顯得十分必要,同時制定延遲退休政策應該注重與勞動力的溝通與討論,采取更為積極穩妥的方式推進。
(二)勞動力延遲退休年齡政策認同的影響因素
為了考察勞動力對延遲退休年齡政策的社會認同受哪些因素影響,本文選用累計Logit模型來檢驗相關的研究假設。在統計分析上,本文構建了四種嵌套模型,分別是只包括控制變量的基準模型1;在基準模型基礎之上重點考察不同年齡段勞動力對于延遲退休政策看法的模型2;加入勞動力就業能力變量的模型3;與加人勞動力社會認知變量的模型4。相關統計分析結果如表3所示。endprint
通過表3可知,模型的虛擬判定系數在模型l到模型4中不斷上升,說明模型的解釋力在不斷上升。第一,在控制其他變量的情況下,性別的系數為負數,且在統計上顯著,說明相對于女性勞動力,男性勞動力更加傾向于贊成延遲退休年齡政策,這可能與長期以來男性主導勞動力市場,所以男性自然不愿意退出勞動力市場有關。第二,在控制其他變量的情況下,戶口性質的系數為正,且在統計上顯著,說明相對于農業戶口勞動力,非農戶口與居民戶口勞動力都傾向于不贊成延遲退休政策;在農業戶口勞動力看來,延遲退休政策對于農業戶口的沖擊要弱于非農戶口與居民戶口。
年齡方面,在控制其他變量不變的情況下,出生于不同年代的勞動力對于延遲退休年齡政策的社會認同存在顯著差異。相對于90后出生的勞動力來說,60后勞動力、70后勞動力與80后勞動力都傾向于不贊成延遲退休年齡政策,在統計上顯著。相對于90后勞動力,40后勞動力與50后勞動力都比較贊同延遲退休年齡政策。但是當加入其他變量后,年齡變量在統計上變得不顯著。相對于90年代出生的勞動力,20年代與30年代出生的勞動力比較贊成延遲退休年齡政策,但是在統計上并不顯著。統計結果支持了研究假設H1。
勞動力就業能力方面,在控制其他變量不變的情況下,第一,受教育年限變量的系數為正,并在統計上顯著,說明教育程度越高的勞動力越不贊同延遲退休政策;第二,在職業方面,相對于在機關單位工作的勞動力,國營企業、外資企業與私營企業的系數為正,說明這些職業的勞動力更加不贊同延遲退休政策,且在統計上顯著,要理解這一差異,可能要考慮到機關單位退休后與企業退休之后的所面臨待遇問題,如果退休前后,待遇相差不大,則退休的意愿越強;第三,研究發現,收入變量在統計上并不顯著,這一點有悖于之前的研究假設,說明勞動力的收入水平對于是否認同延遲退休年齡政策沒有影響。因此,統計結果基本支持了研究假設H2a與H2c,但是不支持研究假設H2b。
當前社會認知變量層面,在控制其他變量不變的情況下,第一,幸福感變量與主觀地位在統計上顯著,且系數為正,說明幸福感越高的勞動力,越不贊同延遲退休政策,這可能是緣于幸福感并非由工作帶來所致;而主觀地位越高的勞動力,越傾向于贊同延遲退休政策,這意味著主觀地位越高的勞動力,更渴望留在職場;第二,家庭經濟狀況越好的家庭,越傾向于贊同延遲退休政策,這可能是由于勞動力一旦退休,家庭經濟狀況就會走弱;第三,生活滿意度變量在統計上不顯著,說明勞動力的生活滿意度對于延遲退休政策沒有顯著影響。因此,統計結果支持了研究假設H3a、H3c和H3d,但是并不支持研究假設H3b。
(三)勞動力延遲退休年齡政策的實現方式
為了調查勞動力傾向于何種延遲退休年齡政策的實現方式,在調查問卷中通過問題“如果一定要實施延遲退休政策的話,您愿意選擇哪一種”,考察勞動力對于延遲退休政策的接受方式,調查結果如表4所示。
在6354名接受調查的對象中,892人愿意選擇一步到位;1413人愿意選擇逐步延遲退休年齡;896人主張老人老制度,新人新制度;2814人認為給一個退休年齡范圍,自己自由選擇退休年齡;還有339人選擇其他方式。通過調查可知,接近一半(44.29%)的被調查者認為比較能接受給定一個退休年齡范圍,自由選擇退休年齡。
五、研究結論與對策建議
(一)研究結論
通過“中國勞動力調查”CLDS(2014)數據考察延遲退休年齡政策的社會認同與影響因素,本研究的主要結論有兩點。
第一,總體來看,我國勞動力對于延遲退休年齡政策的社會認同并不高。這意味著出臺延遲退休年齡政策必須經過充分的調查論證,針對勞動力對于延遲退休政策抱有較低的社會認同這一現狀,建議通過工作擴展與工作豐富提高工作滿意度,同時加強政策的宣傳,降低這一政策的負面效應。
第二,在影響延遲退休年齡政策社會認同的相關因素分析中發現,首先,因延遲退休而利益受損的年齡段傾向于不認同該項政策,如相對于90后60后、70后與80后都不贊成延遲退休年齡;其次,受教育年限越多的勞動力越不贊成延遲退休年齡政策;再次,不同職業對于延遲退休的態度存在差異;最后,主觀地位越高的勞動力與家庭經濟狀況越好的勞動力對延遲退休持支持態度,而幸福感高的勞動力并不認同這一政策。
(二)對策建議
通過大規模的社會調查有助于了解勞動力對于延遲退休年齡政策的社會認同,在此基礎上本文從兩個方面提出針對性的對策建議。
1.根據不同年齡采取差異化延遲退休年齡政策
通過研究發現,不同勞動力對于延遲退休年齡政策的社會認同存在顯著差異。相關部門在研究制定延遲退休年齡政策時,應根據勞動力對該項政策的社會認同差異,在頂層設計層面制定更為健全的延遲退休年齡政策,盡量降低政策的負面效應。延遲退休制度應針對誰應該延遲退休,誰愿意延遲退休,充分考慮到不同年齡段、不同受教育年限和不同職業勞動力的利益訴求,區分不同群體的差別化剛性指標,采取差異化的延遲退休年齡政策。
2.采取更具彈性的延遲退休年齡政策
調查顯示目前勞動力對于延遲退休年齡政策的社會認同偏低。在這種背景下,如果實行延遲退休年齡政策,相關部門需要充分回應勞動力的政策訴求,考慮到接近一半的勞動力傾向在一定退休年齡范圍內自由選擇退休年齡,應該更具彈性的延遲退休政策,在這方面可借鑒其他國家的成功經驗。退休年齡的延長不是跳躍式的,而是逐步實現,政府在出臺延遲退休年齡政策的基礎上,可配套出臺具有激勵性質的制度。endprint

