兔出血癥病毒感染機體后炎性因子的檢測分析
仇汝龍++范志宇++王芳++胡波++宋艷華++魏后軍++劉星++徐為中+薛家賓
摘要:兔出血癥病毒(RHDV)感染成年兔可以誘導兔體內產生強烈的炎性反應,是病毒感染后急性死亡的重要原因之一。為揭示病毒感染機體后體內重要炎性因子的表達情況,采用熒光定量PCR方法檢測RHDV感染后6、12、24、30、36 h兔外周血、肝臟和脾臟內病毒增殖情況以及IL-6、IL-10、TNF-α和IFN-γ炎性因子的表達情況。結果表明,兔出血癥病毒拷貝數在外周血、肝臟和脾臟內隨著感染時間的變化呈快速上升的趨勢。外周血、肝臟和脾臟在病毒感染中,促炎性因子IL-6和TNF-α表達水平都明顯上調。肝臟促炎性因子IL-6在30 h左右達到最大值,而在外周血和脾臟中則持續上調。抑炎因子IL-10隨著炎性因子的上調也隨之上升,但其表達水平只有較低程度的上調。IFN-γ相對表達水平在肝臟和脾臟有短暫的上調,在外周血中則持續下調。
關鍵詞:兔出血癥病毒;炎性因子;熒光定量PCR;外周血;脾臟;肝臟
中圖分類號: S852.65;S858.291文獻標志碼: A文章編號:1002-1302(2016)02-0238-03
收稿日期:2016-01-20
基金項目:現代農業產業技術體系建設兔體系病毒病預防與控制崗位專項(編號:CARS-44-C-1);公益性行業(農業)科研專項(編號:201303046);江蘇省自然科學基金(編號:BK20140740)。
作者簡介:仇汝龍(1988—),男,山東濟寧人,碩士研究生,助理研究員,主要從事家兔疾病防治與獸醫生物技術研究。E-mail:qrl8891@163.com。
通信作者:王芳,博士,研究員,主要從事家兔重要疫病致病機制及防控技術的研究。E-mail:rwangfang@126.com。
兔出血癥(RHD)是對野兔和家兔具有高度傳染性的疾病,其病原是兔出血癥病毒(RHDV),屬于杯狀病毒家族的兔病毒屬[1]。感染兔出血癥病毒的成年兔在48~72 h內死亡[2],死亡原因主要為肝臟快速衰竭并伴隨強烈的炎癥反應。在免疫反應中,調節炎癥反應的正是信號通路及細胞因子。
細胞因子是調節性蛋白,在調節免疫反應中的細胞反應階段有著重要的作用,包括淋巴細胞的激活、增殖、分化、存活和凋亡[3]。它們是低分子量蛋白,主要是由淋巴細胞、抗原呈遞細胞、單核細胞、內皮細胞和纖維細胞等分泌。細胞因子可分為不同的類別,比如白介素、干擾素、腫瘤壞死因子和趨化因子等。細胞因子相互作用,施展極化效應于T細胞并且調整免疫反應[4]。CD4+亞群(Th細胞)根據自身所分泌的細胞因子,分為Th1和Th2亞群。Th1細胞分泌IFN-γ、淋巴毒素和IL-2,可以刺激炎癥反應,比如遲發型超敏反應,促進補體的產生和細胞毒性T細胞分化。Th2細胞分泌IL-4、IL-5和IL-10等,調節體液免疫反應[5-6]。多數研究證明宿主感染的程度以Th1和Th2細胞為基礎[7]。IL-1、IL-2、IL-4、IL-6、IL-8、IL-10、IFN-γ和TNF-α等[8-11]兔細胞因子序列的發表,促使檢測兔細胞因子的分子生物學試驗的產生。熒光定量PCR具有敏感性和結果快速性,可以作為檢測細胞因子的方法。本研究通過熒光定量的方法,檢測感染RHDV兔體內病毒拷貝數和炎性因子的變化,為研究兔出血癥病毒的感染及致病機制奠定基礎。
1材料與方法
1.1病毒和試驗兔
兔出血癥病毒(由江蘇省農業科學院獸醫研究所保存);新西蘭成年白兔40只,購自南京金陵種兔場。
1.2主要試劑和儀器
Trizol RNAiso plus,反轉錄試劑盒PrimeScript RT reagent Kit with gDNA Eraser(Perfect Real Time)和熒光定量試劑SYBR Premix EX Taq,均購自Takara公司。pMD18-T Vector和大腸桿菌DH5α均購自南京基天生物公司,熒光定量機器Stepone 7300,人外周血淋巴細胞分離液,購自天津市灝洋生物制品有限責任公司。
1.3引物
炎性因子IL-6、IL-10、IFN-γ和TNF-α的檢測引物[12]見表1,VP60模板引物及VP60檢測引物建立標準曲線和檢測樣品[13]。引物由Invitrogen公司合成。
1.4試驗動物分組和取樣
將40只新西蘭兔分為5組,每組5只攻毒兔和3只對照兔,兔攻毒采用頸部皮下注射0.5 mL HA為28 RHDV的肝懸液。5組兔分別在攻毒后6、12、24、30、36 h取樣后殺死。血液通過心臟采血,采集后立即分離淋巴細胞和血清,肝臟和脾臟則保存于-70 ℃備用。
1.5RNA的提取及反轉錄
1.5.1炎性因子RNA提取外周血淋巴細胞、肝臟和脾臟的RNA提取采用Trizol法。按照6、12、24、30、36 h取樣,取外周血3 mL采用淋巴細胞分離液分離淋巴細胞后提取RNA。肝臟和脾臟則稱取0.5g勻漿提取RNA。提取的RNA進行反轉錄。
1.5.2病毒RNA提取病毒拷貝數的定量,采用外周血血清提取RNA,組織則采用0.5 g肝臟和脾臟的勻漿上清液來提取RNA[14]。提取的RNA進行反轉錄。
1.6熒光定量PCR檢測和計算
1.6.1炎性因子的檢測炎性因子檢測的熒光定量體系:SYBR Mix 10 μL,PCR上下游引物(10 μmol/L)各0.4 μL,ROX 0.4 μL,DNA 模板2 μL,ddH2O 6.8 μL。程序:95 ℃預變性30 s;95 ℃ 5 s,60 ℃ 30 s,循環40次;熔解曲線默認設置。分析數據:細胞因子數據分析采用2-ΔΔCT方法,計算相對表達水平。
1.6.2病毒拷貝數的檢測病毒拷貝數的檢測需要進行絕對定量,定量體系和程序見“1.6.1”節。結果根據標準曲線計算。
2結果與分析
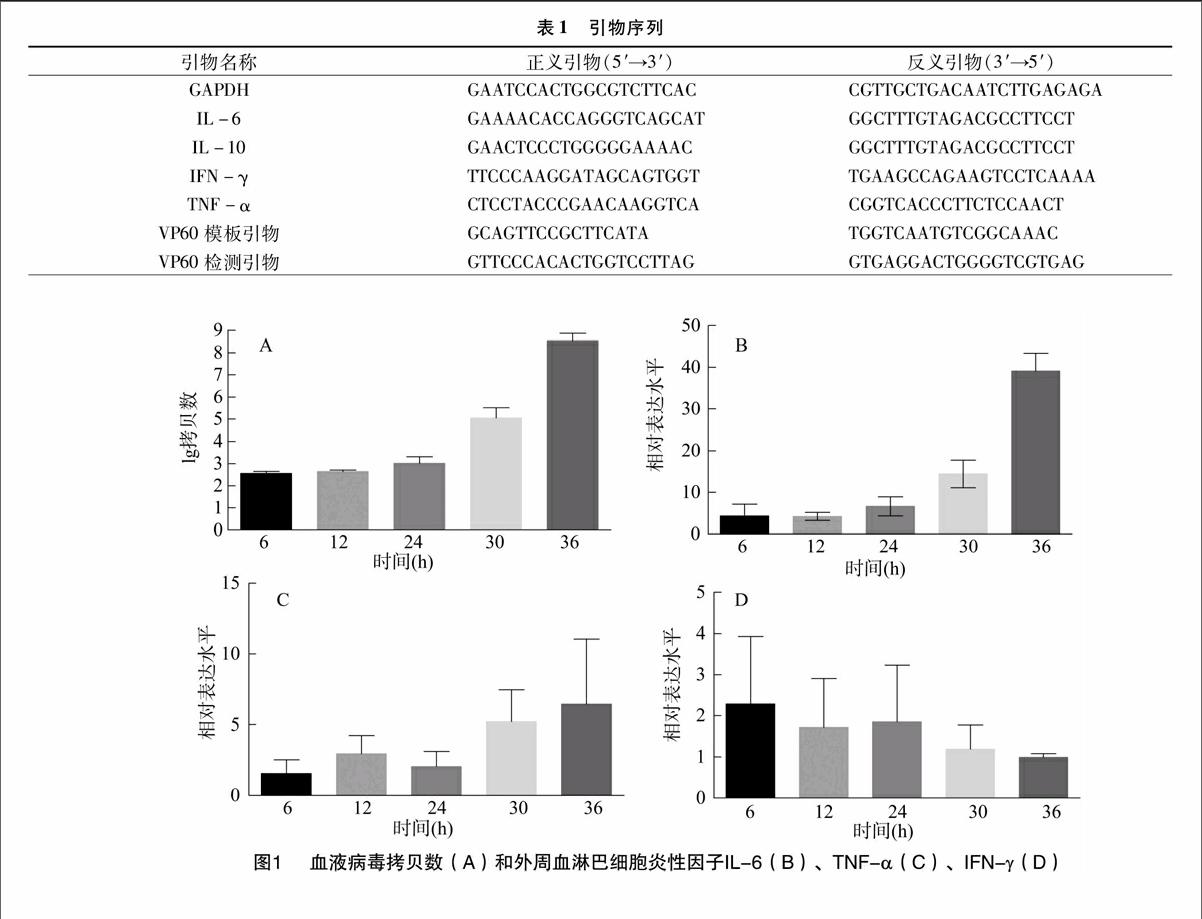
2.1外周血淋巴細胞的炎性因子和外周血病毒拷貝數
感染RHDV的兔外周血中的病毒拷貝數迅速上升,導致病毒隨血液在兔體內傳播(圖1-A)。炎性因子IL-6和TNF-α表達水平則持續上升直到36 h(圖1-B和圖1-C),說明炎癥反應加劇,而抗炎因子IL-10作為最重要的保護性因子,在外周血淋巴細胞中并沒有檢測出其mRNA的表達。IFN-γ在感染病毒的外周血中持續下調(圖1-D)。
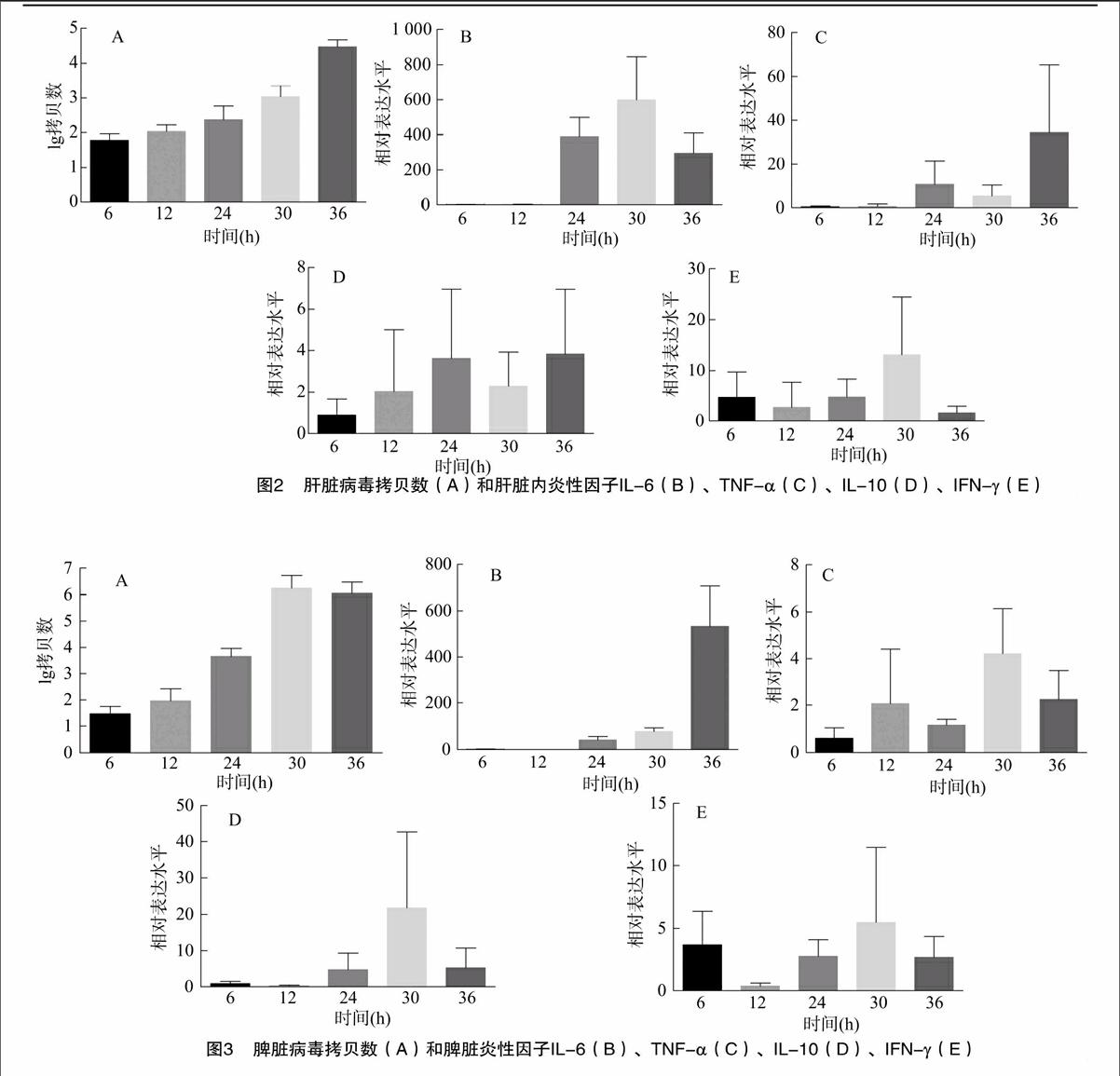
2.2肝臟炎性因子和病毒拷貝數
肝臟作為RHDV感染中急性衰竭的部位,病毒拷貝數快速上升直到36 h(圖2-A),炎性因子IL-6和TNF-α也快速上升,表明炎癥反應加劇,IL-6相對表達水平在30 h達到最大值,之后則相對表達水平大大降低(圖2-B和圖2-C)。不同于外周血,抗炎因子IL-10在肝臟中相對表達水平持續處于上調的趨勢(圖2-D)。IFN-γ在肝臟30 h則有短暫的上調(圖2-E)。
2.3脾臟細胞因子和病毒拷貝數
兔體感染RHDV后,脾臟內病毒的拷貝數也持續上升并在30 h達到較高水平(圖3-A)。炎性因子IL-6和TNF-α同肝臟一樣,處于較高水平的表達(圖3-B和圖3-C),不同的是脾臟IL-6持續升高直到36 h。抗炎因子IL-10表達水平也有上調,在30 h達到最大值(圖3-D)。脾臟的IFN-γ相對表達水平與肝臟相似在30 h都有短暫的上調,然后迅速下調(圖3-E)。
3討論
近年來的研究表明,炎性因子(IL-1β、IL-6、TNF-α等)的急性升高在“暴發性肝臟衰竭” 中有著重要作用,是RHDV感染引起重癥炎癥反應的關鍵因素。對炎性因子的研究,可以闡述細胞免疫在RHDV感染病毒清除和肝損傷中的作用,深化免疫損傷理論認識,為發展特異性免疫治療手段提供了科學依據。炎性因子作為調節性因子存在于整個免疫反應階段,通過熒光定量PCR對炎性因子的跟蹤檢測可以對RHDV感染引發的炎癥反應進行深入的研究和了解。
本研究發現,通過實時熒光定量PCR的方法,對感染RHDV的兔體內病毒拷貝數和炎性因子進行檢測,結合感染后不同時間點的相關結果分析,可以對RHDV感染兔體后的體內傳播和引發的炎癥反應有較為深刻的了解。
兔出血癥病毒在感染成年兔后,體內病毒隨血液到達全身,并且快速增殖直到36 h,作為靶器官的肝臟和脾臟內病毒積累量快速上升。病毒量在靶器官增多的同時,炎性因子IL-6和TNF-α的相對表達水平在外周血、肝臟和脾臟中都大幅度上調,暗示炎癥反應的加劇。隨著炎癥反應的加劇,保護性抗炎因子IL-10相對表達水平也有一定程度的上調,以調節炎癥反應。但是炎癥反應一直處于加劇的趨勢,說明炎癥反應沒有得到有效的控制。肝臟和脾臟中具有抗病毒能力的IFN-γ雖然有一定程度的上調,并不能阻止病毒在兩者中的增殖。感染兔出血癥病毒的兔體內暴發炎癥反應,導致免疫反應的失衡,抗炎因子無法起到保護作用,從而導致肝臟等組織器官衰竭和死亡[15]。總之,感染RHDV的兔體內炎癥反應的不斷加劇,病毒的快速增殖和在靶器官的不斷積累可能最終是導致兔快速死亡的重要原因。本研究為兔出血癥病毒感染和致病機制的研究奠定了基礎。
參考文獻:
[1]Granzow H,Weiland F,Strebelow H G,et al. Rabbit hemorrhagic disease virus (RHDV):ultrastructure and biochemical studies of typical and core-like particles present in liver homogenates[J]. Virus Research,1996,41(2):163-172.
[2]Ohlinger V F,Haas B,Meyers G,et al. Identification and characterization of the virus causing rabbit hemorrhagic disease[J]. Journal of Virology,1990,64(7):3331-3336.
[3]Giulietti A,Overbergh L,Valckx D,et al. An overview of real-time quantitative PCR:applications to quantify cytokine gene expression[J]. Methods,2001,25(4):386-401.
[4]Boeuf P,Vigan-Womas I,Jublot D,et al. CyProQuant-PCR:a real time RT-PCR technique for profiling human cytokines,based on external RNA standards,readily automatable for clinical use[J]. Bmc Immunology,2005,6(1):1-14.[5]Abbas A K,Murphy K M,Sher A . Functional diversity of helper T lymphoctes[J]. Nature,1996,383(6603):787-793.
[6]Mena A,Ioannou X P,Kessel A V,et al. Th1/Th2 biasing effects of vaccination in cattle as determined by real-time PCR[J]. Journal of Immunological Methods,2002,263(1/2):11-21.
[7]Dinarello C A. Proinflammatory and anti-inflammatory cytokines as mediators in the pathogenesis of septic shock[J]. Chest,1997,112(6):321-329.
[8]Cannon J G,Clark B D,Wingfield P,et al. Rabbit IL-1 Cloning,expression,biologic properties,and transcription during endotoxemia[J]. Journal of Immunology,1989,142(7):2299-2306.
[9]Shakhov A N,Kuprash D V,Azizov M M,et al. Structural analysis of the rabbit TNF locus,containing the genes encoding TNF-β(lymphotoxin) and TNF-α(tumor necrosis factor)[J]. Gene,1990,95(2):215-221.
[10]Isono T,Nagano Y,Seto A. Expression of the interferon-gamma and interleukin-10 genes in rabbit HTLV-Ⅰ-transformed T-cell lines[J]. Immunogenetics,1996,44(4):306-308.
[11]Perkins H,Van L B C,Kerr P. The complete cDNA sequences of IL-2,IL-4,IL-6 AND IL-10 from the European rabbit (Oryctolagus cuniculus)[J]. Cytokine,2000,12(6):555-565.
[12]Liu W K,Dang R Y,Wang X L. Development of a SYBR-based real-time PCR to detect rabbit hemorrhagic disease virus (RHDV) and analyze its tissue distribution in experimentally infected rabbits[J]. Virol Sin,2015,30(3):228-30.
[13]Espino A M,Rivera F. Quantitation of cytokine mRNA by real-time RT-PCR during a vaccination trial in a rabbit model of fascioliasis[J]. Vet Parasitol,2010,169(1/2):82-92.
[14]Duarte M D,Carvalho C L,Barros S C,et al. A real time Taqman RT-PCR for the detection of rabbit hemorrhagic disease virus 2 (RHDV2)[J]. J Virol Methods,2015,219:90-5.
[15]Abrantes J,Loo W V D,Pendu J L,et al. Rabbit haemorrhagic disease (RHD) and rabbit haemorrhagic disease virus (RHDV):a review[J]. Veterinary Research,2012,43(6):162-172.黃銀云,胡新崗,郭廣富,等. 櫻桃谷肉鴨大腸桿菌病PCR鑒定及治療藥物篩選與應用[J]. 江蘇農業科學,2016,44(2):241-243.

