miRNA146a對軟骨細胞VEGF表達的影響
張清,楊靜,陳經勇,李鐘,張鵬,畢夢娜,張上上,朱江偉,魯麗莎(四川省骨科醫院老年骨科,四川成都 610000)
?
miRNA146a對軟骨細胞VEGF表達的影響
張清,楊靜*,陳經勇,李鐘,張鵬,畢夢娜,張上上,朱江偉,魯麗莎
(四川省骨科醫院老年骨科,四川成都610000)
摘要:目的研究在正常軟骨細胞及中期和晚期骨關節炎(osteoarthritis,OA)軟骨細胞中激活或抑制miRNA146a后血管內皮生長因子(vascular endothelial groxth factor,VEGF)表達的變化規律,探索miRNA146a在OA發生、發展中的作用。方法收集正常人膝關節軟骨4例,OA患者膝關節軟骨12例。OA組又依據Kellgren-Lawrence的放射學診斷標準分為中期和晚期OA。通過化學轉染的方法轉染miRNA146amimic或miRNA146a inhibitor于各組軟骨細胞,測定激活或抑制miRNA146a后,VEGF蛋白水平表達的變化。結果正常人軟骨細胞中激活miRNA146a后,VEGF的蛋白水平較對照組及抑制組均出現明顯的上升,結果具有統計學意義(P<0.05);抑制miRNA146a后,VEGF蛋白水平下降,結果沒有統計學意義(P≥0.05)。中期OA軟骨細胞表達VEGF水平高于晚期OA軟骨細胞,差異具有統計學意義(P<0.05)。中期OA軟骨細胞激活miRNA146a后,VEGF的蛋白水平上升,結果具有統計學意義(P<0.05);抑制miRNA146a后,VEGF的蛋白水平下降,結果具有統計學意義(P<0.05)。晚期OA軟骨細胞激活miRNA146a后,VEGF的蛋白水平上升,結果具有統計學意義(P<0.05);晚期OA軟骨細胞抑制miRNA146a后,VEGF的蛋白水平下降,結果不具有統計學意義(P≥0.05)。結論miRNA146a可調控軟骨細胞VEGF表達,從而參與OA的發生、發展。
關鍵詞:骨關節炎;miRNA146a;血管內皮生長因子;RNA干擾
骨關節炎(osteoarthritis,OA)是由全身易感因素和局部機械因素相互作用導致的一種以關節軟骨退變為主的常見老年性骨與關節退行性疾病。其主要的臨床表現為:關節疼痛、腫脹、畸形、活動受限,X線片的主要表現為關節間隙變窄、軟骨下骨硬化、周圍骨贅形成。在軟骨發育過程中,血管內皮生長因子(vascular endothelial groxth factor,VEGF)在促進新生血管形成、維持軟骨細胞存活和軟骨基質代謝等方面具有十分重要的作用。
近年來,生物醫學研究發現真核生物普遍存在miRNAs的轉錄后調控作用。研究顯示[1]成人關節軟骨細胞中激活miRNA146a后可以引起VEGF表達水平升高,并且誘導軟骨細胞肥大化最終發生凋亡,促使軟骨退變。miRNA146a調控VEGF與人類OA軟骨細胞退變的作用機制尚不明確。本研究旨在探討miRNA146a調控VEGF在正常軟骨細胞及不同階段OA軟骨細胞中的作用及機制,對探索OA的發病機理及為將來基因治療提供理論依據。
1資料與方法
1.1對象于因外傷行截肢的患者取膝關節正常軟骨4例,根據病史、X線片、術中肉眼觀察、術后鏡下病理學排除標本退行性變、腫瘤、結核、感染、明顯骨質疏松以及合并免疫系統疾病、糖尿病等全身性疾病。根據美國風濕病學會1995年修訂的膝關節OA診斷標準診斷為膝關節OA需行全膝關節置換術患者股骨髁軟骨12例,并根據Kellgren-Lawrence的放射學診斷標準分為中期OA組(3級)6例和晚期OA組(4級)6例。
收集患者一般資料,其中正常組男性4例,平均32.2歲(29~37歲),左側1例,右側3例;OA組12例,男4例,女8例,平均68.1歲(57~85歲),左側8例,右側4例。
1.2方法
1.2.1軟骨細胞培養用含青霉素(100 U/mL)、鏈霉素(100μg/mL)的PBS緩沖液沖洗膝關節軟骨組織數次后,在盛有DMEM/F12培養基的無菌培養皿中將軟骨修剪至1mm3大小;軟骨碎片放入50mL離心管中,低溫離心(1 000 r/min)5min;去除上清液,加入3倍體積的胰蛋白酶,于37℃消化振蕩40min,去除上清液,加雙抗的PBS液沖洗3次;然后添加3倍體積的Ⅱ型膠原酶消化,于37℃振蕩4~6 h后,低溫離心(2 800 r/min)5 min,去除上清液,再用DMEM/F12培養液沖洗3次;加入含10%胎牛血清的DMEM/F12培養基終止消化,用吸管輕輕吹打,使細胞懸液分布均勻;將細胞接種于25 cm2培養瓶內(5mL/瓶),將培養瓶置于37℃,5% CO2,飽和濕度培養箱內培養。此后定期于倒置相差顯微鏡下觀察細胞形態和貼壁生長情況,待細胞貼壁后換液,以后每2~3天換液一次。原代培養細胞的覆蓋面積超過瓶子底部的80%時即可傳代。傳代時,PBS液清洗2次,加入0.25%胰蛋白酶1.5mL,在室溫下振蕩2~5 min;倒置相差顯微鏡下觀察貼壁細胞有收縮,成圓形,一些細胞開始漂浮時即加入含胎牛血清培養液終止消化;加入新的培養液,輕輕吹打以使細胞分布均勻,從培養瓶的底壁使細胞完全脫落,收集細胞混合液,低溫離心(1 000 r/min)3min;去除上清液,PBS液清洗兩次,轉入含有10%胎牛血清DMEM/F12培養基,將細胞懸浮液接種于培養瓶內繼續培養以用于進一步實驗。
1.2.2轉染轉染前一天,于細胞培養板接種適當數量的細胞,細胞培養板每孔中加入不含抗生素的培養基,使細胞密度達到30%~50%,以便轉染;在1 500μL培養基含有細胞的培養孔中加入miRNA146amimic/inhibitor-lipo 2 000混合液混合均勻;培養6 h后將含mimic/inhibitor-lipo 2 000混合液的培養基移去,更換新鮮培養基;于37℃的CO2培養箱中培養48~96 h。
各組使用的試劑及劑量:對照組:含10%FBS的DMEM (L)培養基培養;上調組:miRNA146a mimic 2.5μg+Lipo2000 5μg+10%的DMEM(L)2 mL;下調組:miRNA146a inhibitor 75pmol+Lipo2000 7.5μL+10%的DMEM(L)2mL。1.2.3 Western-Blot檢測VEGF蛋白表達每條泳道以40 μg蛋白量上樣,行7.5%SDS-聚丙烯酰胺凝膠電泳分離蛋白,濕法轉移將蛋白電轉到聚偏二氟乙烯(polyvinylidene di fluoride,PVDF)膜上,用5%脫脂奶粉封閉1 h,加入指定的一抗4℃孵育過夜,雜交反應。以GADPH為內參。
1.3統計學分析每組實驗均重復3次及以上,所有數據均以(±s)表示,采用SPSS17.0統計學軟件進行方差分析,P<0.05表示差異有統計學意義。
2結 果
2.1正常軟骨細胞干擾miRNA146a后VEGF的表達變化正常人類軟骨細胞中,上調miRNA146a后,VEGF的蛋白水平較正常及抑制組均出現明顯的上升,結果具有統計學意義;抑制miRNA146a后,VEGF蛋白水平下降,結果沒有統計學意義(見圖1)。
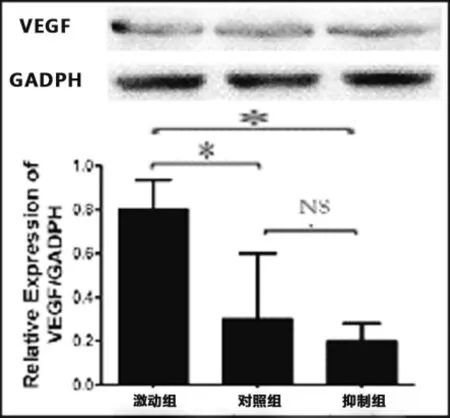
圖1 干擾正常軟骨細胞miRNA146a后VEGF變化
2.2中期和晚期OA軟骨細胞干擾miRNA146a后VEGF的表達變化中期OA軟骨細胞表達VEGF水平高于晚期OA軟骨細胞,差異具有統計學意義(見圖2)。中期和晚期OA軟骨細胞中,上調miRNA146a后,VEGF的蛋白水平較對照組及抑制組均出現相應的上升,結果具有統計學意義。且晚期OA軟骨細胞的VEGF的上升幅度大于中期OA軟骨細胞。中期OA軟骨細胞中,抑制miRNA146a后,VEGF的蛋白水平較對照組及激活組均出現相應的下降,結果具有統計學意義。晚期OA軟骨細胞中,抑制miRNA146a后,VEGF的蛋白水平叫對照組下降,結果不具有統計學意義(見圖3)。

圖2 上調中期、晚期OA軟骨細胞miRNA146a后VEGF變化
3討 論
Taganov等[2]通過篩查人單核細胞中表達的200個miRNAs,發現miRNA146a/b是內毒素響應性基因,可被微生物基質和前炎癥因子等所誘導;通過啟動子的分析,發現miRNA146a是依賴NF-κB的基因;通過miRNAs數據庫預測miRNA146a/b與IL-1受體相關激酶1(Interleukin 1 receptor related kinases,IRAK1)和TNF受體相關因子6(tumor necrosis factor receptor-associated factor,TRAF6)的3'端不翻譯區(untranslated region,UTRs)匹配,這些UTRs抑制了相連報告基因的表達,它們編碼了兩個關鍵銜接分子:Toll樣受體和細胞因子受體的下游區,同時發現IRAK1和TRAF6基因是miRNA146a/b體內轉錄后抑制的靶點。另外,Yamasaki等[3]對OA患者軟骨細胞miRNA146a的基因表達譜的研究發現,miRNA146a在患輕度OA的軟骨細胞有很高的表達,并且miRNA146a的表達同樣受白介素1(interleukin-1,IL-1)的影響。高表達miRNA146可以減少IL-1β調控的表達產物腫瘤壞死因子(tumor necrosis factor,TNF),炎癥因子作為分解代謝因子在OA軟骨的退變中發揮著重要的作用。因此,miRNA146a在OA軟骨中表達,并參與了OA軟骨的分解代謝與合成代謝平衡。研究結果表明,miRNA146a是OA發生中軟骨病變的基因作用靶點。此外,Li[4]研究還證實miRNA146a對維持膝關節軟骨和滑膜的代謝平衡起著重要作用,并且通過調節炎癥反應對OA所產生的疼痛起著重要作用,從而認為miRNA146a是OA軟骨退變和關節疼痛的潛在治療靶點。
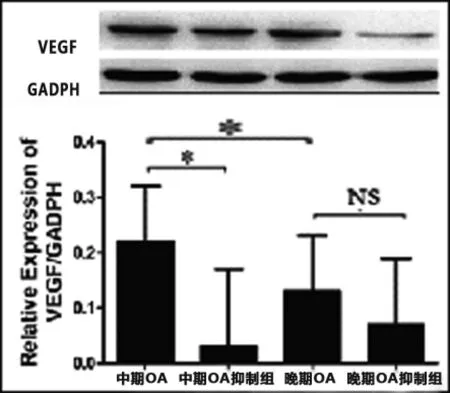
圖3 下調中期、晚期OA軟骨細胞miRNA146a后VEGF變化
有研究顯示,VEGF參與了OA中軟骨細胞的退變。VEGF在較低Mankin評分(Mankin評分小于8分)的OA患者脛骨平臺軟骨的淺表層中存在較高表達,而在較高Mankin評分(Mankin評分9~14分)的OA患者軟骨中卻極少發現由VEGF誘導的血管化[6],這一表達規律與miRNA146a的表達規律相符合。那么,miRNA的能否影響VEGF的表達水平呢?我們的結果顯示,上調正常軟骨細胞miRNA146a后,[5]VEGF的蛋白水平較正常及抑制組均出現明顯的上升;中期和晚期OA軟骨細胞中,上調miRNA146a后,VEGF的蛋白水平出現相應的上升;而抑制miRNA146a后,中期OA軟骨細胞VEGF的蛋白水平出現相應的下降。從而說明miRNA146a可以影響VEGF水平,進一步提示miRNA46a可以通路此途徑對OA的一系列病理過程產生影響。
有學者通過動物實驗發現,軟骨內VEGF表達水平與OA的嚴重程度成正比[7]。同時Saito發現,VEGF是OA病理過程中骨贅形成的最主要調節因子之一[8]。VEGF能促進內皮細胞分化、增生、遷移、浸潤,維持內皮細胞功能,調控血管生成,并可增加血管通透性等。在OA軟骨中可以檢測出大量促炎因子和血管形成因子,這些因子作用于血管內皮細胞誘導產生水解酶并使血管基底膜降解,這一過程是新生血管形成的最基本過程,其中VEGF是最重要的調控血管形成因子[9]。
正常的成熟關節軟骨少量VEGF表達。而OA患者的軟骨和滑膜中VEGF及其受體的表達均明顯升高,參與血管化和炎癥反應[9]。當發生OA時,關節軟骨中抗血管生成因子的數量明顯減少,促血管生成因子如VEGF的數量明顯增加。關節軟骨中抗血管生成因子和促血管生成因子之間的平衡被破壞,導致血管從軟骨下骨長入到關節軟骨中,進一步加劇了OA的發展。我們的實驗結果證實,VEGF在中期OA軟骨細胞的表達水平高于晚期OA,這可能是因為OA的較早階段,炎癥反應劇烈,VEGF等因子大量表達,參與血管化進程,而到了OA晚期,軟骨已發生不可逆轉的變化,相關因子數量下降。miRNA146a調控的VEGF可能在OA病理過程中的炎癥反應和病理性血管化具有重要作用[10]。
許多因子均可影響VEGF水平,例如LI-1、IL-17、TNFα、一氧化氮、活性氧等[11],這些因子可能通過不同的途徑調節VEGF的表達。除了血管內皮細胞和軟骨細胞,成骨細胞也是VEGF的靶點,其誘導成骨細胞趨化運動和增殖[12],從而參與OA骨贅形成。Hashimoto[13]使用免疫組化檢測得出骨贅中的肥大軟骨細胞表達VEGF,也得出VEGF在骨贅形成的血管化中產生作用。另有文獻報道,VEGF可在體外水平上調軟骨細胞基質金屬蛋白酶-1、3、13水平,下調基質金屬蛋白酶抑制劑-1、2水平,引起細胞外基質降解增加[14]。
VEGF在OA患者的滑膜和軟骨細胞中表達升高。一方面,升高的VEGF參與了OA病程的炎癥反應和病理性血管化;另一方面,VEGF也可導致軟骨細胞肥大化、軟骨基質降解和軟骨細胞凋亡,這些均是OA的重要病理表現。肥大軟骨細胞高表達VEGF,參與調控血管侵入軟骨、分泌MMPs和細胞外基質重建,最終導致軟骨細胞凋亡。可見VEGF可上調基質金屬蛋白酶并參與了骨贅的生成,在此低氧、機械應力等情況下,抑制VEGF有望成為OA治療的途徑。本次試驗結果也得出,miRNA146a可對VEGF的表達產生影響,可能具有重要的意義。抑制miRNA146a后,中期OA軟骨細胞VEGF的蛋白水平出現相應的下降,為miRNA146a通過VEGF干預OA的病程提供了依據,探索了OA的基因治療的可能性。
參考文獻:
[1]Li J,Huang J,Dai L,et al.miRNA146a,an IL-1βresponsive miRNA,induces vascular endothelial growth factor and chondrocyte apoptosis by targeting Smad4 [J].Arthritis research&therapy,2012,14(2):75.
[2]Taganov KD,Boldin MP,Chang KJ,et al.NF-kappaB-dependent induction ofmicroRNAmiR-146,an inhibitor targeted to signaling proteins of innate immune responses[J].Proc Natl Acad Sci USA,2006,103(33): 12481-12486.
[3]Yamasaki K,Nakasa T,Miyaki S,et al.Expression of microRNA‐146a in osteoarthritis cartilage[J].Arthritis&Rheumatism,2009,60(4):1035-1041.
[4]Li X,Gibson G,Kim JS,etal.MicroRNA-146a is linked to pain-related pathophysiology of osteoarthritis[J].Gene,2011,480(1-2):34-41.
[5]Murata M,Yudoh K,Masuko K.The potential role of vascular endothelial growth factor(VEGF)in cartilage:how the angiogenic factor could be involved in the pathogenesis of osteoarthritis?[J].Osteoarthritis Cartilage,2008,16(3):279-286.
[6]Smith JO,Oreffo RO,Clarke NM,et al.Changes in the antiangiogenic properties of articular cartilage in osteoarthritis[J].JOrthop Sci,2003,8(6):849-857.
[7]Yamairi F,UtsumiH,Ono Y,etal.Expression of vascular endothelial growth factor(VEGF)associated with histopathological changes in rodent models of osteoarthritis[J].J toxicologic pathology,2011,24(2):137.
[8]Saito T,Fukai A,Mabuchi A,et al.Transcriptional regulation of endochondral ossification by HIF-2alpha during skeletal growth and osteoarthritis development[J].Nat Med,2010,16(6):678-686.
[9]Fransès RE,McWilliams DF,Mapp PI,et al.Osteochondral angiogenesis and increased protease inhibitor expression in OA[J].Osteoarthritis and Cartilage,2010,18(4):563-571.
[10]Walsh DA,McWilliams DF,Turley MJ,et al.Angiogenesis and nerve growth factor at the osteochondral junction in rheumatoid arthritis and osteoarthritis[J].Rheumatology(Oxford),2010,49(10):1852-1861.
[11]Murata M,Yudoh K,Nakamura H,etal.Dis-tinctsignaling pathways are involved in hypoxia-and IL-1-induced VEGF expression in human articular chondrocytes[J].JOrthop Res,2006,24(7):1544-1554.
[12]Pufe T,Scholz-Ahrens KE,Franke A,et al.The role of vascular endothelial growth factor in glucocorticoid-induced bone loss:evaluation in a minipig model[J].Bone,2003,33(6):869-876.
[13]Hashimoto S,Creighton-Achermann L,Takahashi K,et al.Development and regulation of osteophyte formation during experimentalosteoarthritis[J].Osteoarthritis and cartilage,2002,10(3):180-187.
[14]Pais H,Nicolas FE,Soond SM,etal.AnalyzingmicroRNA expression identifies Smad3 as amiRNA-140 target regulated only at protein level[J].RNA,2010,16(3): 489-494.
The M echanism ofm iRNA 146a Regulating VEGF in the Degenerative Process of OA Chondrocyte
Zhang Qing,Yang Jing,Chen Jingyong,et al
(Department of Elderly Orthopaedics,Sichuan Orthpaedics Hospital,Chengdu 610000,China)
Abstract:Objective To Study the expression changes of VEGF after up-regulated or down-regulated themiRNA146a in the normal chondrocytes and themiddle and late stage of the OA chondrocytes.To explore the role ofmiRNA146a in the development and progression of osteoarthritis.Methods We collected 4 cases of normal cartilage and 12 cases of arthritic cartilage which were divided intomiddle stage and late stage by Kellgren-Lawrence Imaging protocol.miRNA146amimic ormiRNA146a inhibitorwas chemically transfected to every group of chondrocyes.Then,we studied the changes of VEGF after up-regulating or down-regulating themiRNA146a chondrocytes.Results miRNA146a mimic increased the expression level of VEGF in the normal chondrocytes.The resultwas stastically significant(P<0.05).While miRNA146a inhibitor acted in a conversemanner.The resultwas not statistically significant(P≥0.05).The protein expression level of VEGFwas higher in themiddle stage OA chondrocytes than that of the late OA stage chondrocytes,and the resultwas statistically significant(P<0.05).miRNA-book=238,ebook=50146amimic increased the expression level of VEGF inmiddle and late stage of the OA chondrocytes.The resultwas stastically significant(P<0.05).While miRNA146a inhibitor acted in a converse manner,and the result was stastically significant in middle stage of OA chondrocytes but isn't stastically significant in late stage of OA chondrocytes.ConclusionmiRNA146a may contribute to OA pathogenesis by regulating VEGF levels in chondrocytes.
Key words:osteoarthritis;miRNA146a;vascular endothelial groxth factor;RNA interference
作者簡介:張清(1987-),男,醫師,四川省骨科醫院老年骨科,610000。
收稿日期:2015-07-06
中圖分類號:R329.2+5
文獻標識碼:A
基金項目:四川省科技廳科技支撐項目(2011FZ0040);*本文通訊作者:楊靜

