柑橘CitSERK—LIKE基因原核表達載體的構建與表達
葛曉霞
摘要:用RT-PCR擴增伏令夏橙體細胞胚發(fā)生類受體蛋白激酶(somatic embryogenesis receptor-like kinase,SERK)基因ORF區(qū)全長,克隆入載體,酶切后亞克隆入原核表達載體,并用SDS-PAGE觀察CitSERK-LIKE基因的原核表達情況。結果顯示,成功構建了pET-CitSERK1-like原核表達重組質粒,該重組質粒在大腸桿菌中可經(jīng)IPTG誘導表達分子量約為69 ku的融合蛋白,與預測蛋白一致。
關鍵詞:柑橘;CitSERK1-like;表達載體;構建;原核表達
中圖分類號: S188;S666.01
文獻標志碼: A
文章編號:1002-1302(2016)04-0022-03
植物體細胞胚胎發(fā)生作為植物細胞全能性的一種表達方式,是高等植物合子胚發(fā)育早期事件中基因表達調控研究的理想模型[1]。體細胞胚發(fā)生類受體蛋白激酶(somatic embryogenesis receptor-like kinase)是在體細胞胚發(fā)生過程中發(fā)揮重要作用的一類激酶,屬于LRR-RLK亞家族。Schmidt等首先從胡蘿卜懸浮培養(yǎng)的胚性細胞中分離出第1個SERK基因,并發(fā)現(xiàn)它只在胚性細胞內(nèi)表達且只表達到體細胞胚的球形期[2]。在其他物種中,體細胞胚發(fā)生過程與SERK基因緊密地聯(lián)系在一起,相繼在多個物種中克隆并鑒定了SERK基因,如鴨茅[3]、苜蓿[4-5]、水稻[6]、小麥[7]、馬鈴薯[8]、柑橘[9-10]、仙客來[11]、菠蘿[12-13]等。
本研究在前期克隆獲得柑橘體細胞胚發(fā)生類受體蛋白激酶基因CitSERK1-like的基礎上[10],構建了CitSERK1-like的原核表達載體,為今后大量表達、純化CitSERK1-like蛋白和開展相關的功能研究奠定了基礎。
1 材料與方法
1.1 pMD-CitSERK1-like克隆載體的獲得
根據(jù)GenBank登錄的CitSERK-like基因序列 (登錄號為FJ851422),設計正反向引物,F(xiàn)P:5′-ATGAAGACTAAGGTTTGGGCT-3′;RP:5′-TCACCTTGGACCAGATAACTC-3′。PCR 反應在 PTC-200 Thermocycler 中進行。20 μL反應體系為:0.2 μmol/L dNTP,1.5 mmol/L MgCl2,1 U Ex Taq DNA 聚合酶 (TaKaRa,Japan) ,1×buffer,正反向引物各 0.4 μmol/L,50ng模板cDNA。擴增程序為:94℃變性5 min;94 ℃變性30 s,58 ℃退火30 s,72 ℃延伸45 s,33個循環(huán);72 ℃延伸10 min,4 ℃保存。擴增產(chǎn)物在1.8%瓊脂糖凝膠上分離后,用E.Z.N.ADNA 回收試劑盒 (Omega,USA) 回收備用。載體的連接參照TaKaRa公司的pMD18-T Vector試劑盒說明書進行,經(jīng)PCR檢測、測序驗證pMD-CitSERK1-like重組質粒構建成功。
1.2 pET-CitSERK-like原核表達載體的構建
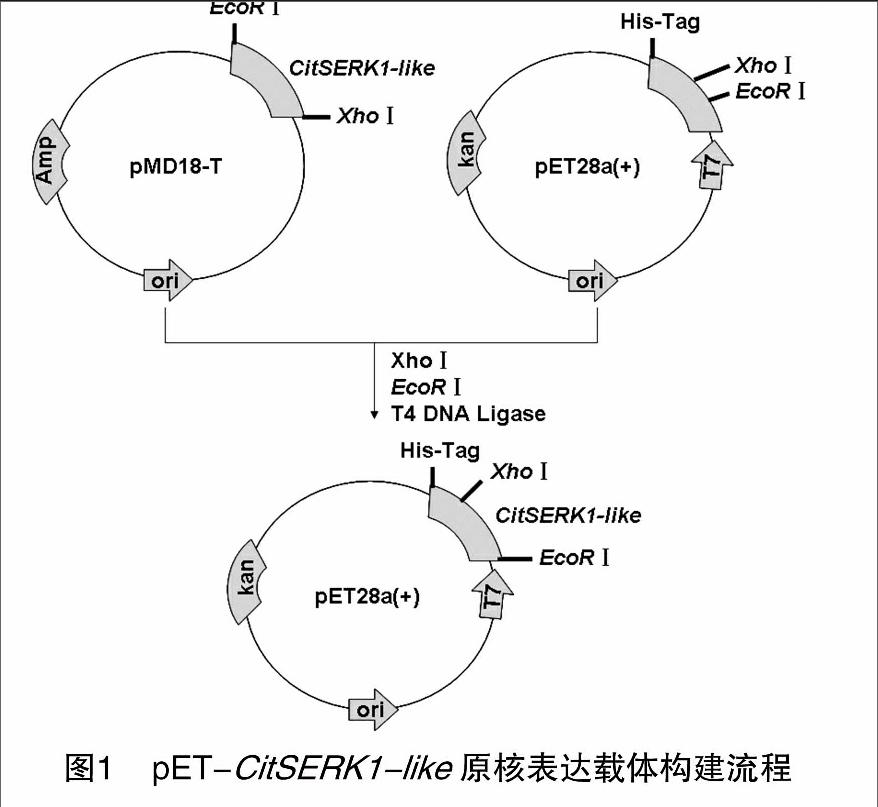
構建CitSERK1-like原核表達載體引物序列為:YHF:5′-CGGAATTCATGAAGACTAAGGTTTGGGCT-3′ (EcoRⅠ),YHR:5′-GCCTCGAGTCACCTTGGACCAGATAAC-3′ (XhoⅠ),以稀釋的質粒pMD-CitSERK1-like為模板進行PCR擴增:94 ℃ 5 min;94 ℃ 30 min,55 ℃ 45 s,72 ℃ 1 min,35個循環(huán);72 ℃延伸10 min。將PCR產(chǎn)物電泳檢測回收、測序,用EcoRⅠ、XhoⅠ雙酶切質粒,回收酶切片段,與經(jīng)EcoRⅠ、XhoⅠ雙酶切的pET-28a (+) 載體進行連接,獲得重組質粒pET-CitSERK1-like,構建流程參見圖1。經(jīng)PCR檢測、酶切、測序驗證ORF正確后用于蛋白表達。
1.3 pET-CitSERK-like原核表達載體的誘導表達
將重組質粒pET-CitSERK1-like和空白載體pET-28a (+) 分別轉化表達菌株E. coli BL21,挑取陽性克隆,接種于3 mL LB液體培養(yǎng)基 (含卡那霉素),37 ℃振蕩培養(yǎng)過夜,按1 ∶100的比例接種于新鮮LB液體培養(yǎng)基中,于37 ℃振蕩培養(yǎng)至D600 nm約為0.6~1.0時,加IPTG 1.0 mmol/L分別誘導0、1、2、3、4、5、6、7 h。其間收集菌液,4 ℃、12 000 g離心1 min,棄上清液,沉淀用100 μL SDS凝膠加樣緩沖液 (Tris-HCl 50 mmol/L,pH值6.8;SDS 2%;二硫蘇糖醇100 mmol/L;溴酚藍0.1%;甘油10%) 重懸,混勻后沸水浴5 min,12 000 g 離心1 min,取20 μL上清液于12%的SDS-PAGE電泳檢測。樣品在濃縮膠中以40 V電壓電泳,當溴酚藍到達分離膠和濃縮膠界面時,將電壓調至80 V,直至溴酚藍接近凝膠邊緣時,停止電泳,取出凝膠。切除濃縮膠,將分離膠置于考馬斯亮藍R-250染色液中染色,脫色后進行觀察。
2 結果與分析
2.1 pMD-CitSERK1-like克隆載體的獲得
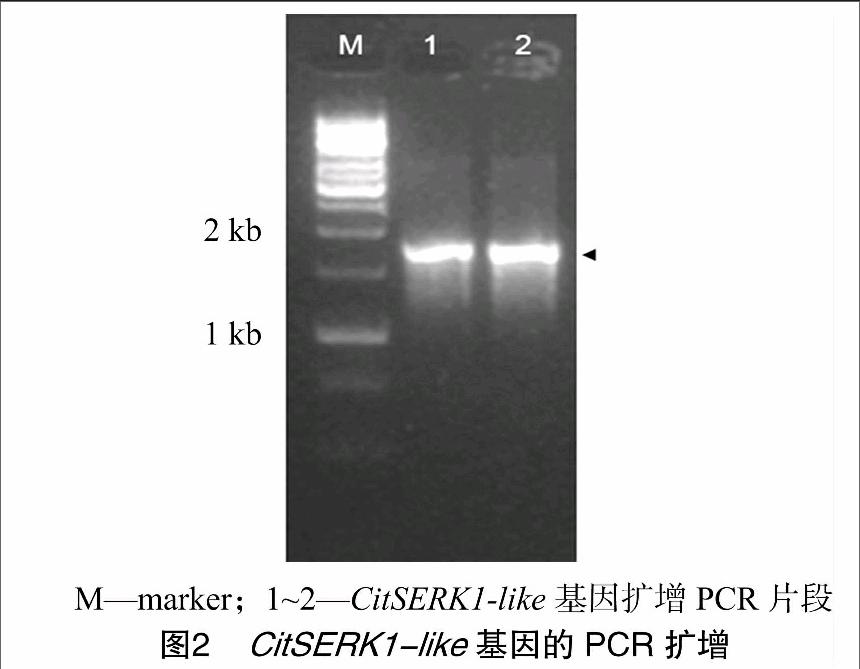
從伏令夏橙甘油誘導1個月的胚性愈傷中克隆SERK基因,隨機挑取多個克隆測序,獲得包含完整的SERK ORF cDNA序列的單克隆。序列分析結果表明,CitSERK1-like cDNA 序列長度為1 866 bp (圖2),編碼621個氨基酸,預測分子量均為69.125 ku。
2.2 pET-CitSERK-like原核表達載體構建
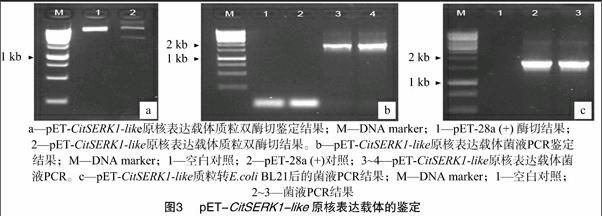
用分別帶有EcoRⅠ、XhoⅠ酶切位點的1對引物擴增CitSERK-like基因的編碼區(qū)全長,擴增產(chǎn)物在用EcoRⅠ、XhoⅠ酶切與純化后,連接到使用同樣2個酶酶切、純化過的pET-28a (+) 載體上,構建獲得原核表達載體pET-CitSERK1-like。含該表達載體的克隆經(jīng)PCR檢測、酶切驗證,圖3結果表明,PCR擴增片段、酶切片段與CitSERK-like基因編碼區(qū)片段大小相同。測序確認讀碼框正確后,轉化至大腸桿菌菌株BL21中誘導蛋白表達。
2.3 CitSERK-like基因的原核表達與SDS-PAGE分析
重組質粒pET-CitSERK1-like轉入E.coli BL21后,用IPTG誘導其表達。結果表明,pET-CitSERK1-like能夠表達1條約69 ku的特異蛋白 (箭頭所示),與預測的含有六聯(lián)組氨酸標簽 (6×His Tag) 的融合蛋白的分子量大小吻合,而空白對照pET-28a (+) 質粒表達的蛋白中沒有此帶(圖4)。
3 討論
在高等植物中,體細胞胚發(fā)生為基因工程、細胞工程等生物技術改良品種提供了良好的試驗體系[14]。體細胞胚發(fā)生類受體蛋白激酶在植物生命活動中是極其重要的一類激酶,目前,擬南芥[15]、水稻[6]、萵苣[16]等多個物種中相繼獲得轉基因植株,證明該基因在植物體細胞胚發(fā)生過程中發(fā)揮重要作用。同時,該基因在參與植物生命活動,如植物發(fā)育[4,17]、激素信號轉導[18-19]和抗逆反應[6]等方面具有非常重要的生理功能。雖然在不同物種中已分離鑒定出眾多體細胞胚發(fā)生類受體蛋白激酶,但目前對其信號轉導和配體識別等方面了解還并不清晰,要闡明體細胞胚類受體蛋白激酶在體胚發(fā)生過程中的作用,還需從蛋白質水平進一步研究。本研究構建了柑橘CitSERK-like基因的原核表達載體,經(jīng)IPTG誘導,在大腸桿菌中成功表達了含His-tag的融合蛋白,為進一步進行蛋白純化以及驗證CitSERK1-like蛋白功能創(chuàng)造了條件。
參考文獻:
[1]Zimmerman J L. Somatic embryogenesis:a model for early development in higher plants[J]. The Plant Cell,1993,5(10):1411-1423.
[2]Schmidt E D,Guzzo F,Toonen M A,et al. A leucine-rich repeat containing receptor-like kinase marks somatic plant cells competent to form embryos[J]. Development,1997,124(10):2049-2062.
[3]Somleva M N,Schmidt E D L,de Vries S C. Embryogenic cells in Dactylis glomerata L. (Poaceae) explants identified by cell tracking and by SERK expression[J]. Plant Cell Reports,2000,19(7):718-726.
[4]Nolan K E,Irwanto R R,Rose R J. Auxin up-regulates MtSERK1 expression in both Medicago truncatula root-forming and embryogenic cultures[J]. Plant Physiology,2003,133(1):218-230.
[5]Nolan K E,Kurdyukov S,Rose R J. Expression of the SOMATIC EMBRYOGENESIS RECEPTOR-LIKE KINASE1 (SERK1) gene is associated with developmental change in the life cycle of the model legume Medicago truncatula[J]. Journal of Experimental Botany,2009,60(6):1759-1771.
[6]Hu H,Xiong L,Yang Y. Rice SERK1 gene positively regulates somatic embryogenesis of cultured cell and host defense response against fungal infection[J]. Planta,2005,222(1):107-117.
[7]Singla B,Khurana J P,Khurana P. Characterization of three somatic embryogenesis receptor kinase genes from wheat,Triticum aestivum[J]. Plant Cell Reports,2008,27(5):833-843.
[8]Sharma S K,Millam S,Hein I,et al. Cloning and molecular characterisation of a potato SERK gene transcriptionally induced during initiation of somatic embryogenesis[J]. Planta,2008,228(2):319-330.
[9]Shimada T,Hirabayashi T,Endo T,et al. Isolation and characterization of the somatic embryogenesis receptor-like kinase gene homologue (CitSERK1) from Citrus unshiu Marc.[J]. Scientia Horticulturae,2005,103(2):233-238.
[10]Ge X X,F(xiàn)an G E,Chai L J,et al. Cloning,molecular characterization and expression analysis of a SOMATIC EMBRYOGENESIS RECEPTOR-LIKE KINASE gene (CitSERK1-like) in Valencia sweet orange[J]. Acta Physiologiae Plantarum,2010,32(6):1197-1207.
[11]Savona M,Mattioli R,Nigro S,et al. Two SERK genes are markers of pluripotency in Cyclamen persicum Mill[J]. Journal of Experimental Botany,2012,63(1):471-488.
[12]Ma J,He Y,Hu Z,et al. Characterization and expression analysis of AcSERK2,a somatic embryogenesis and stress resistance related gene in pineapple[J]. Gene,2012,500(1):115-123.
[13]Ma J,He Y H,Wu C H,et al. Cloning and molecular characterization of a SERK gene transcriptionally induced during somatic embryogenesis in Ananas comosus cv. Shenwan[J]. Plant Molecular Biology Reporter,2012,30(1):195-203.
[14]Guo W W,Li D L,Duan Y X. Citrus transgenics:current status and prospects[J]. Transgenic Plant Journd,2007,1:202-209.
[15]Hecht V,Vielle-Calzada J P,Hartog M V,et al. The arabidopsis SOMATIC EMBRYOGENESIS RECEPTOR KINASE 1 gene is expressed in developing ovules and embryos and enhances embryogenic competence in culture[J]. Plant Physiology,2001,127(3):803-816.
[16]Santos M O,Romano E,Vieira L S,et al. Suppression of SERK gene expression affects fungus tolerance and somatic embryogenesis in transgenic lettuce[J]. Plant Biology,2009,11(1):83-89.
[17]Albrecht C,Russinova E,Hecht V,et al. The Arabidopsis thaliana SOMATIC EMBRYOGENESIS RECEPTOR-LIKE KINASES1 and 2 control male sporogenesis[J]. The Plant Cell,2005,17(12):3337-3349.
[18]Albertini E,Marconi G,Reale L,et al. SERK and APOSTART:candidate genes for apomixis in Poa pratensis[J]. Plant Physiology,2005,138(4):2185-2199.
[19]Albrecht C,Russinova E,Kemmerling B,et al. Arabidopsis SOMATIC EMBRYOGENESIS RECEPTOR KINASE proteins serve brassinosteroid-dependent and-independent signaling pathways[J]. Plant Physiology,2008,148(1):611-619.賀 容,張生珍,王 超,等. 羊種布氏桿菌3型Omp25基因序列及其表達蛋白生物信息學分析[J]. 江蘇農(nóng)業(yè)科學,2016,44(4):25-28.

