TNFAIP1對肝癌細胞HepG2細胞增殖及凋亡的影響
莫莉樺+劉寧+尋禹+胡翔+何自力+向雙林
摘 要 為了深入探討肝癌的發生機制并尋找肝癌的潛在治療手段,研究了TNFAIP1基因對肝癌細胞HepG2的細胞增殖及細胞凋亡產生的影響.MTT實驗發現過表達TNFAIP1基因或干擾TNFAIP1的表達可以顯著地抑制或促進HepG2細胞的生長,這表明TNFAIP1基因對肝癌細胞的增殖具有抑制作用.而流式細胞技術則證實過表達TNFAIP1能顯著地促進肝癌細胞HepG2的細胞凋亡.
關鍵詞 TNFAIP1;HepG2;細胞增殖;細胞凋亡
中圖分類號 R7357 文獻標識碼 A 文章編號 1000-2537(2016)03-0014-04
Abstract To investigate the molecular mechanisms of hepatocellular carcinoma(HCC) progression and develop novel potential therapeutic method for treatment of HCC, in the study, the role of TNFAIP1 in the cell proliferation and apoptosis to HepG2 cells was determined. MTT assay showed that overexpression and knockdown of TNFAIP1 gene could significantly inhibit and promote cell growth of HepG2 cell lines, respectively. These results imply that TNFAIP1 is involved in the inhibition of cell proliferation in HCC. Moreover, FACS assay indicated that overexpression of TNFAIP1 significantly induced cell apoptosis in HepG2 cell lines.
Key words TNFAIP; HepG2; cell proliferation; cell apoptosis
肝細胞肝癌(hepatocellular carcinoma, HCC)是目前最常見的惡性腫瘤之一,嚴重威脅著人類的生命健康[1-2].肝癌的死亡率常年居高不下,雖然近年來我國的醫護工作者一直致力于肝癌的研究,但由于其高復發率和轉移率,對于肝癌患者來說手術治療后長期的預后工作仍然是一個很大的挑戰[3-4].腫瘤壞死因子α誘導蛋白1 (Tumor necrosis factor-alpha-induced protein 1, TNFAIP1),又稱為B12,是最早被鑒定受腫瘤壞死因子α (tumor necrosis factor α, TNFα) 誘導的蛋白[5].研究表明,TNFAIP1基因在人類[5]、小鼠[5]、大鼠[6]及線蟲[7]等多個物種中分布廣泛,并且在人體內各個組織器官中也有廣泛表達,如在腦組織和心臟組織中其表達量非常豐富[5],暗示TNFAIP1可能在這兩種器官的發育過程中扮演了重要的角色.TNFAIP1可能與神經發育相關,有實驗證實TNFAIP1在小鼠海馬中表達量很高,同時發現雌激素可以調節其中TNFAIP1的表達,由于海馬和雌激素在阿爾茲海默癥(AD)中至關重要,因此該結果表明,TNFAIP1與海馬相關疾病(如AD)之間的潛在聯系可能會受到雌激素水平的影響[8].在TNFAIP1對乙肝病毒(Hepatitis B Virus, HBV)免疫性的調查中發現,HBV先天免疫的人群其TNFAIP1的表達水平明顯高于普通人群,這表明TNFAIP1在對HBV的先天免疫中可能扮演了重要的角色[9].TNFAIP1還可能參與了調控多種腫瘤的發生發展過程.在紫杉醇耐藥性研究中發現,TNFAIP1與紫杉醇競爭性地結合β-tubulin,因此可以抑制紫杉醇誘導的微管蛋白聚合,使細胞周期停滯并最終導致細胞死亡.在異種移植的小鼠模型中發現,增強TNFAIP1的表達能降低紫杉醇對腫瘤的作用,反之,抑制TNFAIP1的表達則可以增強紫杉醇對腫瘤的作用[10-12].還有研究證明RhoB能夠直接與TNFAIP1相互作用并促進HeLa細胞的凋亡,說明TNFAIP1可能參與調控宮頸癌的發展過程[13].總之,以上這些研究結果共同表明TNFAIP1可能在器官發育和腫瘤發生過程中發揮了重要的作用.
然而,對于TNFAIP1在肝細胞肝癌的發生發展過程中是否具有調控作用,目前并未有文獻進行明確報道.因此,本文以HepG2細胞系為研究對象,探討TNFAIP1對其細胞增殖及細胞凋亡的影響.
1 實驗部分
1.1 實驗材料
HepG2細胞系,pCMV-Myc質粒,pCMV-Myc-TNFAIP1質粒均為本實驗室保存.NC siRNA及TNFAIP1 siRNA由上海生工生物工程股份有限公司合成.DMEM培養液、胎牛血清FBS購自Hyclone公司,轉染試劑脂質體LipofectamineTM 2000購自Invitrogen公司.抗Myc-tag的單克隆抗體及抗β-actin的單克隆抗體均購自Santa Cruz公司,抗TNFAIP1的多克隆抗體購自上海薩博生物有限公司公司.凋亡檢測試劑盒購自美國BD公司.其他常規試劑均購自上海生工公司.
1.2 實驗方法
1.2.1 細胞培養及轉染 細胞于含10%胎牛血清(FBS)的DMEM完全培養基中進行培養,當細胞長至80%~90%后,用0.2%胰酶消化傳代,于含5%CO2的細胞培養箱中37 ℃培養過夜.若轉染質粒,當細胞密度長至80%~90%時,用LipofectamineTM 2000說明書提供的步驟,轉染前2 h將培養基換成不含血清及抗生素的培養液.用等體積的opti-MEM分別稀釋脂質體和質粒,充分混勻,然后將脂質體溶液逐滴加入稀釋的質粒中,充分混勻后靜止20 min.將混合溶液滴加入培養皿中,培養4~6 h后換成含血清的完全培養基繼續培養.若轉染RNA,當細胞長至50% 左右時用同樣的方法轉染,但操作時要使用RNA-Free的槍頭及EP管.
1.2.2 Western Blot分析 首先按照實驗室提供的濃縮膠和分離膠的配方配好所需濃度的聚丙烯酰胺凝膠,待用.然后用胰酶消化收集細胞,用1×PBS洗兩遍,4 ℃,800 g離心2 min,棄上清.沉淀用RIPA裂解液 (含1% Triton X-100, 150 mmol/L NaCl, 50 mmol/L Tris-HCl(pH 7.2), 1%Sodium Dexycholate, 0.1% SDS, 1 mmol/L PMSF) 重懸裂解細胞,4 ℃,13 000 r/min離心15 min,將上清置于一新的EP管中.蛋白定量后加入6×SDS點樣緩沖液,105 ℃金屬浴煮10 min,保存待用.將電流設置為每塊膠15~20 mA, 上樣后接通電源跑電泳,采用濕轉法轉膜將蛋白轉移到PVDF膜上,牛奶封閉后孵育稀釋好的一抗工作液 (TNFAIP1抗體按1∶300稀釋,β-actin抗體按1∶2 000稀釋,Myc抗體按1∶300稀釋).用TTBS洗膜10 min×3次后孵育二抗 (稀釋比例為1∶2 000).用TTBS洗膜10 min×4次后顯影,拍照后記錄數據并分析.
1.2.3 MTT法檢測細胞增殖 24孔板中按濃度梯度分別為每孔0,0.2,0.4,0.6 μg轉染Myc-TNFAIP1質粒(用pCMV-Myc空載體補平以保證轉染質粒的量相同),另一組則轉染1 μL的NC siRNA或TNFAIP1 siRNA [1 μL siRNA (15 pmol)∶1.5 μL脂質體].每組均設3個平行組.轉染6 h后換成含10% FBS的完全培養基繼續培養.培養24 h后每孔加50 μL MTT溶液(濃度為5 g/L)繼續孵育4 h,然后終止培養,小心吸去孔內培養基,每孔加900 μL DMSO,置于搖床上避光震蕩10 min,使結晶充分溶解.選擇570 nm (630 nm校準) 的波長,用酶標儀測定每孔的OD值,記錄結果并分析數據.
1.2.4 流式細胞技術(FACS)檢測細胞凋亡 6孔板中分別轉染pCMV-Myc空質粒或Myc-TNFAIP1質粒2.5 μg,6 h后換成完全培養基繼續培養.24 h后,用不含EDTA的胰酶消化收集細胞.4 ℃,500 g離心5 min,棄培養基.用預冷的PBS洗滌2次,1 000 g離心3 min收集細胞.按照凋亡檢測試劑盒提供的步驟,首先用300 μL 1×Binding Buffer懸浮細胞,然后在細胞懸液中加入3 μL Annexin V-FITC,輕輕混勻后置于冰上避光孵育15 min.再加入3 μL PI后輕柔混勻,置于冰上避光孵育5 min.最后用流式細胞儀檢測細胞是否凋亡,記錄數據并分析.
1.2.5 統計學分析 所得數據用SPSS11.5統計學軟件進行統計分析,均用平均值±標準差的形式表示,兩組之間平均值的差異采用t檢驗,顯著水平定為p<0.05.
2 實驗結果
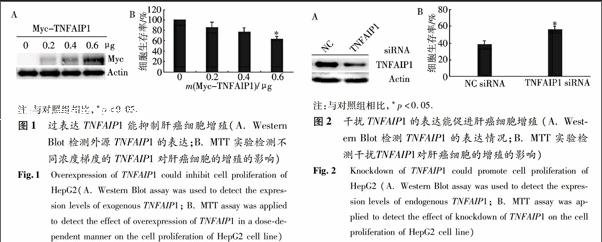
2.1 過表達TNFAIP1能顯著抑制肝癌細胞的增殖
分別轉染0,0.2,0.4,0.6 μg的Myc-TNFAIP1質粒進入HepG2細胞中(用pCMV-Myc空載體補平以確保轉染的質粒量相同),使其過表達TNFAIP1蛋白,首先用Western Blot方法檢測了外源TNFAIP1的表達情況,以β-actin為內參,分別用Myc單抗和β-actin單抗檢測.接下來MTT實驗結果顯示TNFAIP1過表達的HepG2細胞的生存率呈下降趨勢,且轉染0.6 μg Myc-TNFAIP1質粒的HepG2細胞的生存率明顯低于對照組,這表明TNFAIP1過表達可以抑制肝癌細胞的增殖(圖1).
2.2 干擾TNFAIP1能促進肝癌細胞的增殖
為了進一步證明TNFAIP1對肝癌細胞增殖的影響,作者轉染了TNFAIP1 siRNA進入HepG2細胞中以抑制TNFAIP1的表達,同時轉染陰性對照siRNA (NC siRNA)作為對照組.首先用Western Blot方法檢測內源的TNFAIP1的表達,以β-actin為內參,分別用TNFAIP1多抗和β-actin單抗檢測.然后通過MTT實驗檢測發現TNFAIP1 siRNA組可顯著地促進細胞的增殖(圖2).
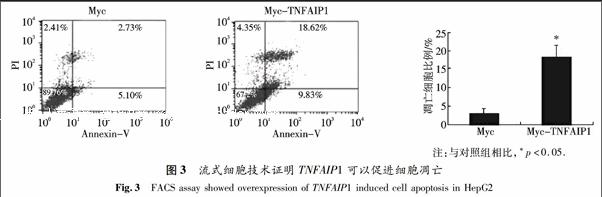
2.3 TNFAIP1對肝癌細胞的凋亡具有促進作用
在六孔板中分別轉染2 μg pCMV-Myc空質粒或等量的Myc-TNFAIP1質粒到HepG2細胞中,用流式細胞儀檢測TNFAIP1基因對肝癌細胞的凋亡的影響.結果發現,轉染Myc空載體后細胞凋亡的比例為2.73%,而轉染了Myc-TNFAIP1質粒后,其凋亡比例上升到18.62%,并且統計學分析發現結果具有顯著意義.因此,相對于轉染了Myc空載體的對照組,Myc-TNFAIP1能明顯促進HepG2細胞的凋亡(圖3).這說明TNFAIP1具有促進肝癌細胞凋亡的作用.
3 討論
TNFAIP1是一個重要的腫瘤抑制因子,是首個被確定為受TNFα誘導的蛋白,它的合成同時也受IL-6的誘導[5].TNFAIP1在腦組織和心臟組織中的表達量非常豐富,并且實時定量PCR證明它在其他組織如胃、肝、宮頸等中均有表達.前人的研究發現,TNFAIP1在肝癌細胞系HepG2中的表達量很低[14],這暗示TNFAIP1可能參與了肝癌的發展過程.結構研究發現TNFAIP1分子中包含非常保守的結構域[4],這表明TNFAIP1可能在腫瘤的發生發展過程中起到非常重要的作用.此外,還有實驗證實TNFAIP1在骨肉瘤組織中的表達水平顯著增加,而抑制TNFAIP1的表達能抑制骨肉瘤細胞的增殖及侵襲能力并促進細胞凋亡[15].這說明TNFAIP1基因在腫瘤發展過程中的作用具有組織特異性,然而該特異性的分子機制尚有待進一步研究.目前對于TNFAIP1在癌癥發生作用中的分子機制的研究尚不明確,并且對于它在肝癌發生過程中的作用也并未有文獻進行明確報道.
因此,本文主要從細胞增殖及細胞凋亡的角度,研究TNFAIP1基因對肝癌細胞系HepG2作用.從MTT及流式細胞技術這一系列實驗分析發現,TNFAIP1能夠顯著地抑制HepG2細胞的增殖并促進其細胞凋亡,而其抑制增殖并促進凋亡的分子機制尚有待進一步研究.這些實驗結果與TNFAIP1作為潛在的腫瘤抑制因子的結論相符,這一發現也有助于揭示肝癌的發生機制,為肝細胞癌的臨床分子診斷提供新的理論依據并為肝癌的治療提供新的策略.
參考文獻:
[1] JEMAL A, SIEQEL R, XU J, et al. Cancer statistics, 2010 [J]. CA Cancer J Clin, 2010,60(5):277-300.
[2] 范莎莎, 李愛民, 李 榮,等. IL-17在肝癌患者血清中表達增高對肝癌診斷的研究 [J]. 湖南師范大學自然科學學報, 2014,37(3):19-23.
[3] TANG Z Y. Hepatocellular carcinoma-cause, treatment and metastasis [J]. World J Gastroenterol, 2001,7:445-454.
[4] TANG Z Y. Hepatocellular carcinoma surgery-review of the past and prospects for the 21st century [J]. J Surg Oncol, 2005,91(2):95-96.
[5] WOLF F W, MARKS R M, SARMA V, et al. Characterization of a novel tumor necrosis factor-alpha-induced endothelial primary response gene [J].J Biol Chem, 1992,267(2):1317-1326.
[6] ZHOU J, HU X, XIONG X, et al. Cloning of two rat PDIP1 related genes and their interactions with proliferating cell nuclear antigen [J]. J Exp Zoolog A Comp Exp Biol, 2005,303(3):227-240.
[7] LINK C D, TAFT A, KAPUKLIN V, et al. Gene expression analysis in a transgenic Caenorhabditis elegans Alzheimers disease model [J]. Neurobiol Aging, 2003,24(3):397-413.
[8] LIU H, YANG L, ZHAO Y, et al. Estrogen is a novel regulator of Tnfaip1 in mouse hippocampus [J]. Int J Mol Med, 2014,34(1):219-227.
[9] LIN M C, LEE N P, ZHENG N, et al. Tumor necrosis factor-alpha-induced protein 1 and immunity to hepatitis B virus [J]. World J Gastroenterol, 2005,11(48):7564-7568.
[10] STORDAL B, HAMON M, MCENEANEY V, et al. Resistance to paclitaxel in a cisplatin-resistant ovarian cancer cell line is mediated by P-glycoprotein [J]. PLoS One, 2012,7(7):1-13.
[11] YIN S, BHATTACHARYA R, CABRAL F. Human mutations that confer paclitaxel resistance [J]. Mol Cancer Ther, 2010,9(2):327-335.
[12] ZHU Y, YAO Z, WU Z, et al. Role of tumor necrosis factor alpha-induced protein 1 in paclitaxel resistance [J]. Oncogene, 2014,33(25):3246-3255.
[13] KIM D M, CHUNG K S, CHOI S J, et al. RhoB induces apoptosis via direct interaction with TNFAIP1 in HeLa cells [J]. Int J Cancer, 2009,125(11):2520-2527.
[14] 楊利平,周愛冬,李 紅,等. TNFAIP1基因在常見細胞系中的表達 [J]. 遺傳, 2006, 28(8):918-922.
[15] ZHANG C L, WANG C, YAN W J, et al. Knockdown of TNFAIP1 inhibits growth and induces apoptosis in osteosarcoma cells through inhibition of the nuclear factor-κB pathway [J]. Oncol Rep, 2014,32(3):1149-1155.
(編輯 WJ)

