脂多糖對體外培養豬顆粒細胞增殖、凋亡和雌二醇分泌的影響
果雙雙,李 輝,施振旦,馬衛明*
(1.山東農業大學動物科技學院,泰安 271018; 2.江蘇省農業科學院畜牧研究所,南京 210014)
?
脂多糖對體外培養豬顆粒細胞增殖、凋亡和雌二醇分泌的影響
果雙雙1,李輝2,施振旦2,馬衛明1*
(1.山東農業大學動物科技學院,泰安 271018; 2.江蘇省農業科學院畜牧研究所,南京 210014)
摘要:旨在探討脂多糖(LPS)對豬顆粒細胞增殖、凋亡及雌二醇(E2)分泌的影響。采用不同濃度的LPS(0、500、1 000和2 000 ng·mL-1)處理體外培養的豬顆粒細胞,并測定細胞增殖、凋亡及相關基因FN1、IGF2、IGFBP2、CyclinD1、CyclinD2和P27kip的表達,同時對E2的分泌及P450arom的表達進行檢測。結果表明,1 000或2 000 ng·mL-1LPS均可顯著促進顆粒細胞增殖、抑制細胞凋亡、提高活細胞百分率(P<0.05)。而500 ng·mL-1LPS即可促進與細胞生長增殖、周期相關基因FN1(P<0.01),IGF2、IGFBP2(P<0.05),CyclinD1、CyclinD2(P<0.01)的表達,抑制阻礙細胞周期的基因P27kip(P<0.01)的表達,同時可以通過強烈抑制芳香化酶P450arom基因的表達(P<0.01),顯著抑制E2的分泌(P<0.01)。綜上表明,LPS可以促進顆粒細胞增殖并抑制細胞凋亡,同時抑制顆粒細胞分泌E2的功能。
關鍵詞:顆粒細胞;LPS;細胞增殖;細胞凋亡;基因表達;E2
內毒素化學本質是脂多糖(Lipopolysaccharide,LPS),是革蘭陰性菌細胞壁的組成成分,也是醫學上引起機體“發燒”的熱源。LPS在細菌正常生活狀態時并不釋放,僅在細菌自溶或人工方法裂解菌體后才釋放出來[1-2]。LPS在動物體內普遍存在,具有多種來源途徑,如環境、飼料、消化道內細菌解體、患病、創傷、交配以及分娩過程等[3-5]。大多數內毒素感染在初期并無明顯癥狀,隨著時間延長,逐漸表現出不良反應[6-7]。LPS在生殖方面造成的不良影響主要表現為卵巢活動受到抑制、類固醇激素分泌能力下降、胚胎發育受阻、黃體機能降低、抑制胚胎著床和引發流產等[8-9],最終導致動物繁殖性能下降。在奶牛研究中,LPS可以通過影響動物下丘腦-垂體促性腺激素的釋放而造成內分泌紊亂,最終抑制LH/FSH分泌的脈沖波并能夠推遲或完全抑制排卵前高峰的出現[10-11],阻礙E2分泌并抑制排卵。LPS對動物繁殖活動的影響,也表現在卵泡發育的方面。如具有正常周期性卵巢活動的健康牛卵泡液中LPS含量很低,平均為(0.06±0.04)ng·mL-1,而患有子宮內膜炎、缺乏周期性卵巢活動的牛卵泡液中LPS含量很高,平均為(176.1±112) ng·mL-1,最高可達875.2 ng·mL-1[12]。
卵泡顆粒細胞在卵泡發育和排卵過程中起著極其重要的作用,其通過微絨毛與卵母細胞發生內分泌聯系,并對后者提供營養支持。顆粒細胞通過不斷增殖、分泌類固醇激素、分泌細胞外基質蛋白、血管生成因子、免疫和趨化因子,促進卵泡的生長、發育和成熟,并通過影響垂體促性腺激素的分泌進行卵泡的募集、選擇和成熟排卵等[13]。有研究顯示,當LPS作用于牛顆粒細胞時,能激活TLR-4并上調一系列炎癥因子如IL-1β、IL-6和TNFα等的表達,同時抑制顆粒細胞E2的分泌[14-16]。LPS對動物繁殖性能的負面影響,除通過下丘腦和垂體的間接作用降低促性腺激素分泌之外[17],是否直接影響卵泡顆粒細胞增殖及其功能?為此本研究采用LPS直接處理離體培養的豬顆粒細胞的方法,通過測定細胞增殖、凋亡、相關基因表達及激素分泌水平等來闡明。
1材料與方法
1.1試驗材料
選取15~20頭180日齡左右的健康商品母豬,采集卵巢置于37 ℃生理鹽水中,2 h內帶回實驗室。
1.2豬顆粒細胞的原代培養
用無菌生理鹽水沖洗卵巢2~3次,滅菌紗布拭干卵巢表面,選取直徑>2 mm的卵泡,用10 mL注射器配10號針頭抽取卵泡液(注意避開血管)。將收集的卵泡液置于37 ℃水浴中靜置5~10 min,收集上清離心,將收集到的細胞用PBS(Gibco)重懸兩次。用DMEM/F12培養液(Gibco)重懸細胞,臺盼藍染色計數后調整細胞密度至1×106個·mL-1,添加含10%胎牛血清FBS(Gibco),1%青鏈霉素(MP)的DMEM/F12培養基并置于37 ℃、5% CO2條件下培養。培養24 h后用PBS輕輕洗去未貼壁細胞,更換新鮮的含有10%FBS,1%青鏈霉素,豬垂體來源FSH(1 ng·mL-1,Sigma),雄烯二酮(0.1 μmol·L-1,Sigma)且含有不同濃度LPS(0、500、1 000和2 000 ng·mL-1,Extracted fromE.coli055:B5,sigma)的新鮮培養液對細胞進行刺激。E2測定組,在細胞培養24 h換液時,更換為含有2%FBS的上述培養液。
1.3細胞增殖檢測
LPS處理細胞48 h,利用CCK8試劑盒(上海翊圣)處理細胞[18-19],在培養箱內孵育4 h后,利用全波長酶標儀測定在450 nm處的吸光度。其吸光度數值與細胞增殖成正比。
1.4細胞凋亡檢測
LPS處理細胞48 h,用不含EDTA的胰酶消化并收集細胞,用FITC Annexin V細胞凋亡檢測試劑盒(BD Pharmingen)處理細胞,避光孵育15 min后,通過分析型流式細胞儀檢測細胞凋亡。
1.5基因相對表達量檢測
在LPS處理細胞24及48 h時,分別利用細胞總RNA提取試劑盒(北京天根)提取細胞總RNA,并利用反轉錄試劑盒(TaKaRa)將其反轉錄為cDNA,利用ABI7500進行qRT-PCR(試劑購自Transgen Biotech)檢測細胞生長增殖相關(FN1、IGF2、IGFBP2),增殖周期相關(CyclinD1、CyclinD2、P27kip)以及芳香化酶P450arom基因的相對表達量。qRT-PCR相關引物序列見表1。
1.6E2測定
LPS處理細胞48 h后回收培養液,用PBS溶液1∶5進行稀釋,利用E2定量測定試劑盒(北京北方生物),采用酶聯免疫競爭法檢測細胞培養液中E2含量,經顯色后在酶標儀測定吸光值(OD值),通過擬合濃度—吸光度曲線,計算出待測細胞培養液中E2含量。
表1qRT-PCR相關引物
Table 1Primers used in the real-time quantitative PCR assay
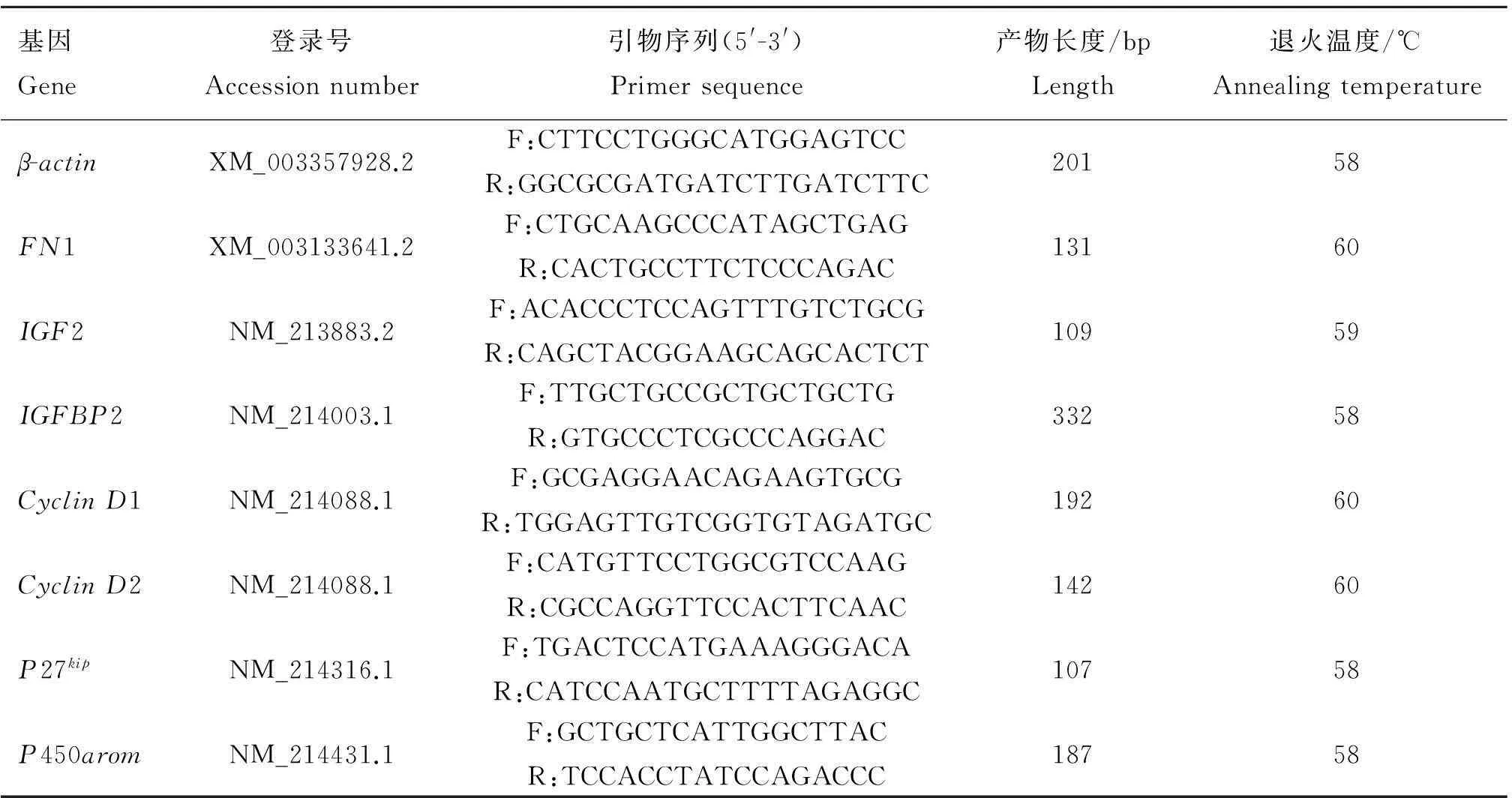
基因Gene登錄號Accessionnumber引物序列(5'-3')Primersequence產物長度/bpLength退火溫度/℃Annealingtemperatureβ-actinXM_003357928.2F:CTTCCTGGGCATGGAGTCCR:GGCGCGATGATCTTGATCTTC20158FN1XM_003133641.2F:CTGCAAGCCCATAGCTGAGR:CACTGCCTTCTCCCAGAC13160IGF2NM_213883.2F:ACACCCTCCAGTTTGTCTGCGR:CAGCTACGGAAGCAGCACTCT10959IGFBP2NM_214003.1F:TTGCTGCCGCTGCTGCTGR:GTGCCCTCGCCCAGGAC33258CyclinD1NM_214088.1F:GCGAGGAACAGAAGTGCGR:TGGAGTTGTCGGTGTAGATGC19260CyclinD2NM_214088.1F:CATGTTCCTGGCGTCCAAGR:CGCCAGGTTCCACTTCAAC14260P27kipNM_214316.1F:TGACTCCATGAAAGGGACAR:CATCCAATGCTTTTAGAGGC10758P450aromNM_214431.1F:GCTGCTCATTGGCTTACR:TCCACCTATCCAGACCC18758
1.7統計分析
qRT-PCR統計結果以0添加組為對照,運用2-△△Ct的方法計算各檢測基因的相對表達量,用內參β-actin進行標準化處理。數據處理采用SPSS Statistics 17.0的單因素方差分析,不同處理間的顯著性檢驗采用Duncan式多重比較。采用Origin 8.6作圖。結果采用“平均值±標準誤”表示,P<0.05表示差異顯著,P<0.01表示差異極顯著。
2結果
2.1LPS 對顆粒細胞增殖的影響
不同濃度LPS處理細胞48 h對細胞增殖產生的影響。由圖1可以看出,隨著LPS濃度的升高,反映細胞增殖活力的CCK8 OD值呈現出劑量依賴性上升趨勢,尤其當添加濃度達到1 000和2 000 ng·mL-1時,細胞增殖顯著高于對照組及500 ng·mL-1處理組(P<0.01)。
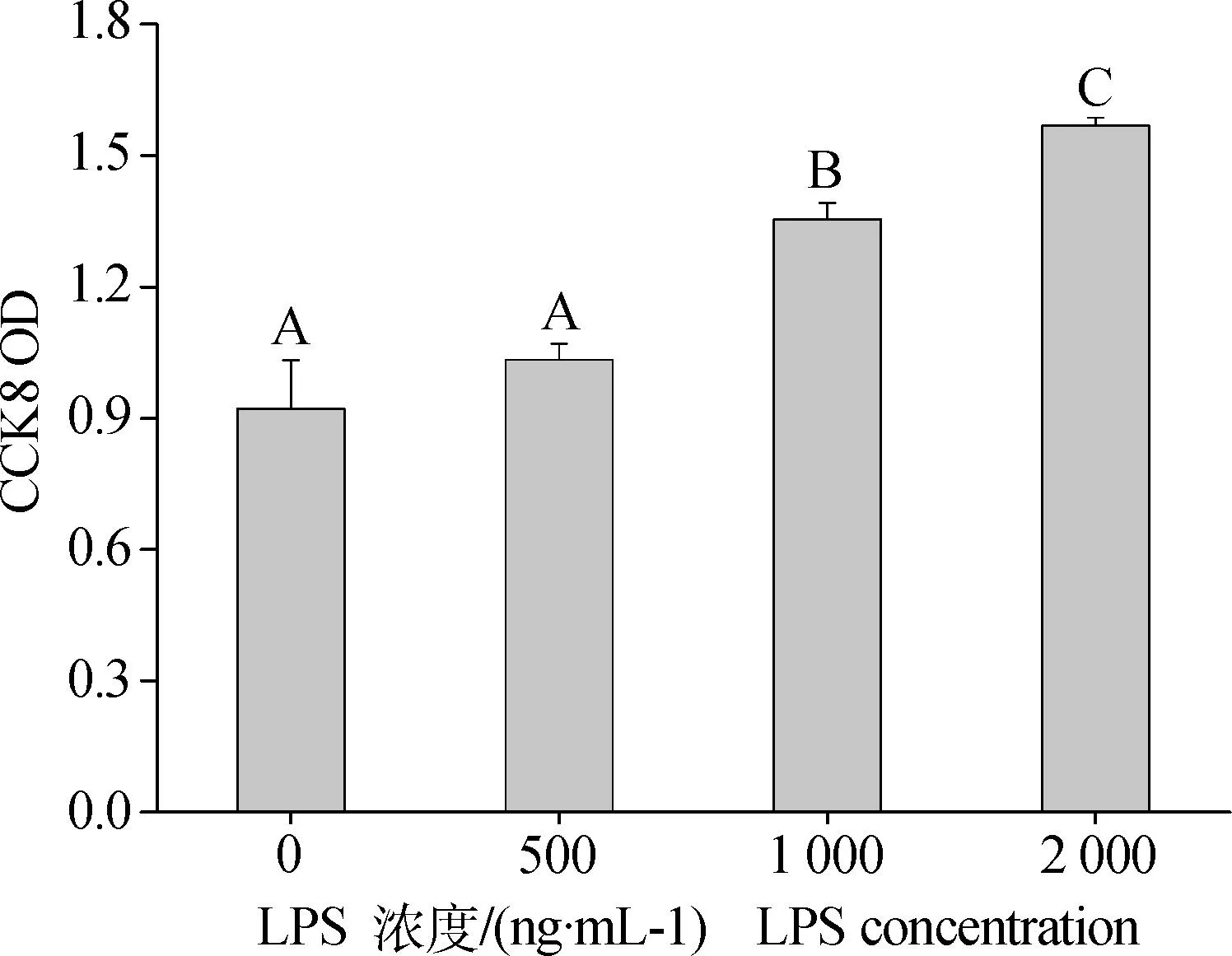
(n=3,P<0.01)圖1 不同濃度LPS對顆粒細胞增殖的影響Fig.1 Dose-effect of LPS on Granulosa cells proliferation
2.2LPS對顆粒細胞凋亡的影響
通過分析型流式細胞儀檢測細胞凋亡發現,LPS可以一定程度地抑制細胞凋亡,且隨濃度的逐漸升高,凋亡細胞明顯減少。圖2顯示,經LPS處理48 h后,流式細胞儀檢測的顆粒細胞中活細胞和凋亡細胞情況。圖2A~D顯示,隨LPS添加量逐漸升高,凋亡細胞逐漸減少(右上和右下兩個象限),活細胞數逐漸增多(左下象限)。圖2E,F結果表明,添加1 000和2 000 ng·mL-1LPS濃度處理組的活細胞率顯著高于對照組及LPS濃度為500 ng·mL-1處理組(P<0.05),添加1 000和2 000 ng·mL-1LPS濃度處理組間差異不顯著。LPS添加對培養的豬顆粒細胞的總凋亡細胞百分率影響則恰恰相反。LPS添加濃度為1 000和2 000 ng·mL-1時,總凋亡細胞百分率處理組明顯低于對照組及LPS濃度為500 ng·mL-1處理組(P<0.05)。
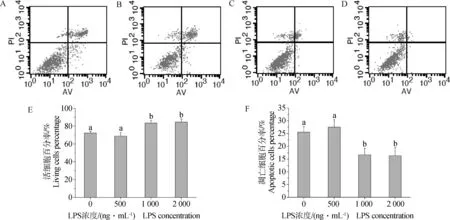
A.空白對照組;B.500 ng·mL-1LPS;C. 1 000 ng·mL-1LPS;D.2 000 ng·mL-1LPS;E.活細胞百分率;F.凋亡細胞百分率(n=3)。不同小寫字母表示差異顯著。下同A.Blank control group;B.500 ng·mL-1LPS;C.1 000 ng·mL-1LPS;D.2 000 ng·mL-1LPS;E.Percentage of living cells;F.Percentage of apoptotic cells(n=3).Different small letters show significant difference (P<0.05).The same as below圖2 不同濃度LPS對顆粒細胞凋亡的影響Fig.2 Dose-effect of LPS on granulosa cells apoptosis
2.3LPS對顆粒細胞增殖及周期相關基因表達的影響
圖3A顯示,LPS處理細胞24 h,與增殖相關的基因FN1、IGF2和IGFBP2,與周期相關的基因CyclinD1、CyclinD2和P27kip的相對表達量。圖3B顯示,LPS處理細胞48 h各基因的相對表達量。由圖3可知,LPS處理細胞24 及48 h能夠顯著上調促進細胞增殖的基因FN1(P<0.01,圖3A;P<0.05,圖3B)和IGF2(P<0.01)的相對表達量,且IGF2基因相對表達量呈現劑量依賴性上調。LPS處理24 h顯著(P<0.05,圖3A)促進IGFBP2的基因相對表達量,48 h差異不顯著(圖3B)。
圖3A顯示,促進細胞周期的基因CyclinD1,CyclinD2在LPS處理24 h時,基因相對表達量差異不顯著,而圖3B顯示LPS處理48 h時兩基因相對表達量極顯著上調(P<0.01)。抑制細胞周期的基因P27kip在LPS處理24和48 h時都出現了極顯著下調(P<0.01)。
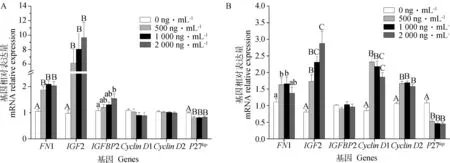
A.LPS處理24 h時各基因相對表達量;B.LPS處理48 h時各基因相對表達量。不同大寫字母表示差異極顯著。下同A.Relative expression ratio of genes treated by LPS for 24 h;B.Relative expression ratio of genes treated by LPS for 48 h.Different capital letters show extremely significant difference (P<0.01).The same as below圖3 不同濃度LPS對顆粒細胞增殖及周期相關基因表達的影響(n=9)Fig.3 Dose-effect of LPS on granulosa cells proliferation and cells cycle genes expression (n=9)
2.4LPS對顆粒細胞E2分泌和芳香化酶表達的影響
LPS處理顆粒細胞48 h后,測定培養液中E2結果見圖4A,LPS各處理組顆粒細胞E2分泌量極顯著低于對照組(P<0.01),各處理組間差異不顯著。與E2分泌相關的芳香化酶P450arom基因相對表達量測定結果見圖4B。經LPS處理后,各處理組中P450arom基因相對表達量受到抑制,與對照組差異極顯著(P<0.01)。

A.顆粒細胞E2分泌量(n=3);B.P450arom基因表達量 (n=9)A.E2secretion of Granulosa cells(n=3);B.Relative expression ratio of P450arom gene (n=9)圖4 不同濃度LPS對顆粒細胞E2分泌量和P450arom基因表達量的影響Fig.4 Dose-effect of LPS on Granulosa cells estradiol secretion and P450arom gene expression
3討論
在畜牧業生產中,各種原因造成的微生物過度繁殖,使大量LPS進入動物體內,導致多種疾病發生,嚴重損害動物的生產繁殖性能,帶來不可估量的經濟損失[20-21]。本研究根據LPS對顆粒細胞增殖及E2分泌的直接影響,通過不同的試驗手段,發現LPS處理離體豬顆粒細胞后,一定程度地促進細胞增殖及抑制細胞凋亡。促進細胞增殖的基因FN1、IGF2、IGFBP2及促進細胞分裂周期的基因CyclinD1、CyclinD2的相對表達量呈現顯著上調,抑制細胞周期的基因P27kip顯著下調。以上基因的相對表達量變化說明添加LPS對細胞增殖及周期的基因表達產生影響,從而引起細胞的增殖及凋亡。有研究報道顯示,LPS能夠促進小膠質細胞[22]、卵巢細胞[23]、小腸上皮細胞[24]等多種細胞的增殖。也有試驗表明,LPS能夠促進小鼠的睪丸支持細胞增殖[25-26]。在本研究中,LPS能夠顯著地促進豬顆粒細胞的增殖,抑制細胞的凋亡,推測可能是LPS通過模式識別受體TLR-4途徑[7,27]激活下游NF-κB通路導致的。有相關文獻證實,LPS能夠經由TLR-4途徑促進大鼠血管平滑肌細胞[28]和肝癌細胞[29]等增殖。以及激活下游NF-κB通路導致細胞呈現增殖,這在Hela細胞研究中有所報道[30],NF-κB也直接參與調控細胞的增殖凋亡基因的表達等[31-32]。NF-κB通路能夠促進一系列抗炎因子及腫瘤壞死因子的表達[16],其中,由TNFα介導的細胞凋亡途徑被激活,而LPS能夠通過激活NF-κB途徑抑制TNFα導致的細胞凋亡現象[33-34],已經在肝細胞[35]、角質細胞[36]、內皮細胞[37]等多種細胞中被證實。本研究通過CCK8和流式細胞儀的檢測結果也證實LPS具有促進豬顆粒細胞增殖和抑制凋亡的作用,且與增殖及增殖周期相關基因相對表達量的結果相吻合。
LPS在影響顆粒細胞的正常增殖凋亡程序時,也強烈地抑制顆粒細胞分泌E2的功能。P450arom由CyP19A1基因編碼,是雄激素向雌激素轉化的關鍵酶,在顆粒細胞分泌E2中起重要作用。本研究發現LPS能夠直接抑制其基因表達,導致E2分泌減少。此結果與K.Onnureddy[14]及T.Shimizu[15]等在牛顆粒細胞上得到的結果相似,證明LPS確實可以直接抑制顆粒細胞分泌E2的功能。而E2的正常分泌被抑制將導致動物生殖內分泌的紊亂,繼發一系列不良反應。這一結果也解釋了因疾病或因環境問題而引起的LPS感染所造成的安靜發情、斷續發情、卵泡發育受阻、排卵數下降、產后乏情、產仔數下降等現象。
4結論
LPS通過顆粒細胞的分子調控及基因表達影響其正常的增殖、凋亡,同時LPS可以直接抑制顆粒細胞分泌雌二醇。
參考文獻(References):
[1]李桂杰,朱瑞良,郭寶聚.細菌內毒素的研究進展[J].山東農業大學學報,1999,30(2):93-98.
LI G J,ZHU R L,GUO B J.Advances on the study of bacterial endotoxin[J].JournalofShandongAgriculturalUniversity, 1999,30(2):93-98.(in Chinese)
[2]郭萌,李冠民,黃清泉.細菌內毒素研究進展[J].中國實驗動物學報,2009,17(5):397-400.
GUO M,LI G M,HUANG Q Q.Advances in research of bacterial endotoxin[J].ActaLaboratoriumAnimalisScientiaSinica, 2009,17(5):397-400.(in Chinese)
[3]MARCHESINI G,DE NARDI R,GIANESELLA M, et al. Effect of induced ruminal acidosis on blood variables in heifers[J].BMCVetRes,2013,9:98.
[4]GILBERT R O.The effects of endometritis on the establishment of pregnancy in cattle[J].ReprodFertilDev,2011,24(1):252-257.
[5]江丹莉,張鑫杰,潘遠基,等.水面載鵝密度對水體細菌生長、鵝血液內毒素含量、種鵝繁殖性能和雛鵝生長性能的影響[C].哈爾濱:第十四次全國家禽科學學術討論會,2009:618-623.
JIANG D L,ZHANG X J,PAN Y J, et al.Effects of surface water load density on the growth of bacteria,the content of blood endotoxin,the breeding performance and the growth performance of geese[C].Harbin:Fourteenth National Symposium on Poultry Science,2009:618-623.(in Chinese)
[6]BILODEAU-BOURGEOIS L,BOSWORTH B G,PETERSON B C.Differences in mortality,growth,lysozyme,and toll-like receptor gene expression among genetic groups of catfish exposed to virulent Edwardsiella ictaluri[J].FishShellfishImmunol,2008,24(1):82-89.
[7]BEUTLER B.Inferences,questions and possibilities in Toll-like receptor signalling[J].Nature,2004,430(6996):257-263.
[8]施振旦,李孝偉,田允波,等.奶牛繁殖殺手——內毒素[J].中國奶牛,2007(3):29-32.
SHI Z D,LI X W,TIAN Y B,et al.The killer of dairy cattle breeding----endotoxin[J].ChinaDairyCattle,2007(3):29-32.(in Chinese)
[9]郭文軍,施振旦,梅承,等.提高奶牛受胎率的卵泡和黃體活動調控研究[J].中國奶牛,2006(6):7-11.
GUO W J,SHI Z D,MEI C,et al.Study on regulating ovarian and luteal activities in improving conception rate in holstein cows[J].ChinaDairyCattle, 2006(6):7-11.(in Chinese)
[10]SUZUKI C,YOSHIOKA K,IWAMURA S,et al.Endotoxin induces delayed ovulation following endocrine aberration during the proestrous phase in Holstein heifers[J].DomestAnimEndocrinol,2001,20(4):267-278.
[11]BATTAGLIA D F,KRASA H B,PADMANABHAN V,et al.Endocrine alterations that underlie endotoxin-induced disruption of the follicular phase in ewes[J].BiolReprod,2000,62(1):45-53.
[12]HERATH S,WILLIAMS E J,LILLY S T, et al.Ovarian follicular cells have innate immune capabilities that modulate their endocrine function[J].Reproduction,2007,134(5):683-693.
[13]MCNATTY K P,HEATH D A,HENDERSON K M,et al.Some aspects of thecal and granulosa cell function during follicular development in the bovine ovary[J].JReprodFertil, 1984,72(1):39-53.
[14]ONNUREDDY K,RAVINDE R,ONTERU S K, et al.IGF-1 attenuates LPS induced pro-inflammatory cytokines expression in buffalo (Bubalusbubalis) granulosa cells[J].MolImmunol,2015,64(1):136-143.[15]SHIMIZU T,MIYAUCHI K,SHIRASUNA K, et al. Effects of lipopolysaccharide (LPS) and peptidoglycan (PGN) on estradiol production in bovine granulosa cells from small and large follicles[J].Toxicolinvitro,2012,26(7):1134-1142.
[16]YENUGANTI V R,RAVINDER R,SINGH D.Conjugated linoleic acids attenuate LPS-induced pro-inflammatory gene expression by inhibiting the NF-kappaB translocation through PPARgamma in buffalo granulosa cells[J].AmJReprodImmunol,2014,72(3):296-304.
[17]BATTAGLIA D F,BEAVER A B,HARRIS T G,et al.Endotoxin disrupts the estradiol-induced luteinizing hormone surge:interference with estradiol signal reading,not surge release[J].Endocrinology,1999,140(6):2471-2479.
[18]WANG J,CHEN X,SU L, et al. MicroRNA-126 inhibits cell proliferation in gastric cancer by targeting LAT-1[J].BiomedPharmacother,2015,72:66-73.
[19]LIU W,KONG H,ZENG X,et al.Iptakalim inhibits PDGF-BB-induced human airway smooth muscle cells proliferation and migration[J].ExpCellRes,2015,336(2):204-210.
[20]JIANG D L,LIU L,WANG C L,et al.Raising on water stocking density reduces geese reproductive performancesviawater bacteria and lipopolysaccharide contaminations in “geese-fish” production system[J].AgrSciChina,2011,10(9):1459-1466.
[21]施振旦,劉麗,孫愛東.“禽-魚”高密度養殖對水禽生產性能危害的研究[J].中國家禽,2011,33(13):1-3.SHI Z D,LIU L,SUN A D.Study on ‘bird--fish’ high density cultivation on production performance of waterfowl harm[J].ChinaPoultry,2011,33(13):1-3.(in Chinese)
[22]張思思,蔡江暉,萬敬員,等.羥基積雪草苷對LPS誘導小膠質細胞增殖的抑制作用及機制研究[J].中國病理生理雜志,2015,31(3):428-434.
ZHANG S S,CAI J H,WANG J Y,et al.Inhibitory effect of madecassoside on LPS-stimulated microglia[J].ChineseJournalofPathophysiology,2015,31(3):428-434.(in Chinese)
[23]CHAKRAVORTTY D,KATO Y,SUGIYAMA T, et al.Inhibition of p38 mitogen-activated protein kinase augments lipopolysaccharide-induced cell proliferation in CD14-expressing Chinese hamster ovary cells[J].InfectImmun,2001,69(2):931-936.
[24]OLAYA J,NEOPIKHANOV V,URIBE A.Lipopolysaccharide ofEscherichiacoli,polyamines,and acetic acid stimulate cell proliferation in intestinal epithelial cells[J].invitroCellDevBiolAnim,1999,35(1):43-48.
[25]PETERSEN C,FR?YSA B,S?DER O.Endotoxin and proinflammatory cytokines modulate Sertoli cell proliferationinvitro[J].JReprodImmunol,2004,61(1):13-30.
[26]PETERSEN C,SVECHNIKOV K,FROYSA B,et al.The p38 MAPK pathway mediates interleukin-1-induced Sertoli cell proliferation[J].Cytokine,2005,32(1):51-59.
[27]TAKEUCHI O,AKIRA S.Pattern recognition receptors and inflammation[J].Cell,2010,140(6):805-820.[28]YANG G,ZHOU X,CHEN T, et al.Hydroxysafflor yellow A inhibits lipopolysaccharide-induced proliferation and migration of vascular smooth muscle cells via Toll-like receptor-4 pathway[J].IntJClinExpMed,2015,8(4):5295-5302.
[29]WANG L,ZHU R,HUANG Z, et al.Lipopolysaccharide-induced toll-like receptor 4 signaling in cancer cells promotes cell survival and proliferation in hepatocellular carcinoma[J].DigDisSci,2013,58(8):2223-2236.
[30]HAO H,XU F,HAO J,et al.Lipoxin A4 suppresses lipopolysaccharide-induced hela cell proliferation and migration via NF-κB pathway[J].Inflammation, 2015,38(1):400-408.
[32]CHANG C F,ZHAO W M,MEI J X,et al. Branches of NF-κb signaling pathway regulate hepatocyte proliferation in rat liver regeneration[J].GenetMolRes,2015,14(3):7643-7654.
[33]MANNA S K,AGGARWAL B B.Lipopolysaccharide inhibits TNF-induced apoptosis:role of nuclear factor-kappaB activation and reactive oxygen intermediates[J].JImmunol,1999,162(3):1510-1518.
[34]AGGARWAL B B.Apoptosis and nuclear factor-kappa B:a tale of association and dissociation[J].BiochemPharmacol,2000,60(8):1033-1039.
[35]XU Y,BIALIK S,JONES B E,et al.NF-κB inactivation converts a hepatocyte cell line TNF-α response from proliferation to apoptosis[J].AmJPhysiol, 1998,275(4 Pt 1):C1058-C1066.
[36]QIN J Z,CHATURVEDI V,DENNING M F,et al.Role of NF-kappaB in the apoptotic-resistant phenotype of keratinocytes[J].JBiolChem,1999,274(53):37957-37964.
[37]ZEN K,KARSAN A,STEMPIEN-OTERO A,et al.NF-kB activation is required for human endothelial survival during exposure to tumor necrosis factor-α but not to interleukin-1β or lipopolysaccharide[J].JBiolChem,1999,274(40):28808-28815.
(編輯程金華)
Effects of Lipopolysaccharide on Proliferation,Apoptosis and Estradiol Secretion ofinvitroCultured Porcine Granulosa Cells
GUO Shuang-shuang1,LI Hui2,SHI Zhen-dan2,MA Wei-ming1*
(1.CollegeofAnimalScienceandVeterinaryMedicine,ShandongAgriculturalUniversity,Tai’an271018,China;2.InstituteofAnimalScience,JiangsuAcademyofAgriculturalSciences,Nanjing210014,China)
Abstract:In order to study the effects of Lipopolysaccharide(LPS) on proliferation,apoptosis and estradiol (E2) secretion of porcine granulosa cells.Primary porcine granulosa cells were culturedinvitroand treated by LPS at different concentrations (0,500,1 000 and 2 000 ng·mL-1).Then cell proliferation,apoptosis,secretion of E2and related gene expressions,FN1,IGF2,IGFBP2,CyclinD1,CyclinD2,P27kipandP450aromwere determined individually.The results showed that cell proliferation and survival ratio were significantly promoted at LPS concentrations of 1 000 or 2 000 ng·mL-1(P<0.05),on the contrary,cell apoptosis was inhibited.However,gene expression levels ofFN1 (P<0.01),IGF2,IGFBP2 (P<0.05),CyclinD1 andCyclinD2 (P<0.01) were up-regulated at 500 ng·mL-1of LPS,P27kip(P<0.01) which hindered cell cycle was inhibited.P450aromgene expression was decreased,resulting the inhibition of E2secretion when treated by LPS.These results suggested that granulosa cell proliferation could be promoted by LPS,while cell apoptosis and E2secretion were inhibited.
Key words:granulosa cells;LPS;cell proliferation;cell apoptosis;gene expression;E2
doi:10.11843/j.issn.0366-6964.2016.04.008
收稿日期:2015-09-25
基金項目:江蘇省自然科學基金(BK20151365);國家自然科學基金(31402080);江蘇省農業科學院基本科研業務專項[ZX(15)4031]
作者簡介:果雙雙(1989-),女,山東濟南人,碩士生,主要從事動物繁殖內分泌學研究, E-mail: qicaitianping7777@163.com *通信作者:馬衛明,副教授,E-mail: mawm@sdau.edu.cn
中圖分類號:S828;S814.1
文獻標志碼:A
文章編號:0366-6964(2016)04-0693-07

