窖泥變質前后細菌群落差異分析
于春濤,劉 超,孫鳳娥,劉振江(.滄州醫學高等專科學校,河北滄州0600;.河北省寧晉縣泥坑酒業有限責任公司,河北石家莊054000)
?
窖泥變質前后細菌群落差異分析
于春濤1,劉超1,孫鳳娥1,劉振江2
(1.滄州醫學高等專科學校,河北滄州061001;2.河北省寧晉縣泥坑酒業有限責任公司,河北石家莊054000)
摘要:通過提取窖泥細菌總DNA,擴增16S rDNA構建基因文庫,采用高通量測序的方法,對窖泥變質前后細菌群落進行分析。結果表明,窖泥變質前后細菌群落存在較大差異,共檢測出16個門、174個種屬。選取優勢種屬進行比較,窖泥變質前優勢菌屬為:動球菌屬(22.63%)、芽孢桿菌屬(12.95%)、紫單胞菌科(12.45%)、芽孢八疊球菌屬(10.60%)等;窖泥變質后優勢菌屬為:芽孢八疊球菌屬(61.34%)、嗜冷桿菌屬(10.42%)、未分類菌屬(5.45%)、子單胞菌屬(5.02%)等。本研究初步揭示了窖泥變質前后細菌群落種類和數量的差異,為窖泥變質研究提供理論基礎。
關鍵詞:窖泥;變質;細菌群落;差異分析;高通量測序
優先數字出版時間:2016-04-25;地址:http://www.cnki.net/kcms/detail/52.1051.TS.20160425.0956.001.html。
窖泥在濃香型白酒生產中扮演了極其重要的角色,其中復雜的菌群與濃香型白酒中復雜的呈香呈味物質的形成直接相關[1-4]。在釀酒過程中,環境因素影響窖泥的細菌群落結構,菌群結構差異將影響窖泥的老熟或變質,從而影響酒的質量和風格。窖池中窖泥細菌群落結構分析和研究對于了解窖泥質量及其酒的香味和風格形成發揮著非常重要的作用,由于大多數窖泥中細菌是無法培養的,因此采用傳統的細菌分離培養方法研究窖泥細菌群落存在很大的局限性[5-8]。
近年來,隨著基于PCR擴增技術的各種微生物免培養方法應用于土壤微生物區系研究,有些學者嘗試借助于現代分子生物學技術研究窖泥微生物群落。如:鄧依等[9]采用16S-23S rRNA ITS-AFLP指紋圖譜分析窖泥原核微生物多樣性,陜小虎等[10]對利用PCR-DGGE技術研究窖泥微生物的電泳條件進行了優化和探討,張文學等[9]利用16S rDNA克隆文庫技術研究白酒發酵糟醅中微生物區系的構成及演變過程。利用高通量測序技術分析窖泥變質前后的細菌群落差異的研究相對較少。鑒于此,本實驗使用某酒廠提供變質前后的兩種窖泥,提取總DNA,經過兩輪PCR擴增構建基因文庫,通過高通量測序得到窖泥中90%以上相關細菌信息。
1材料與方法
1.1樣品采集
窖泥樣品取自河北某知名酒廠釀酒車間優質窖泥(FNK1)和變質窖泥(PNK1)。取樣方法是FNK1從窖池的窖壁和窖底各取三點共100 g、PNK1從窖池的窖壁和窖底各取三點共100 g,分裝后密封冷凍保存。
1.2實驗方法
1.2.1窖泥預處理及總DNA提取[11]
稱取0.2 g樣品放入含有0.5 g磁珠的5 mL離心管中,加入1 mL SLX-mLus Buffer,漩渦2 min。經OMEGA土壤DNA提取試劑盒,反復凍融、離心,收集上清液。粗提的窖泥DNA通過PCR產物純化試劑盒純化,純化后的窖泥DNA PCR擴增效果良好,Qubit2.0檢測DNA濃度,瓊脂糖凝膠檢測DNA完整性。
1.2.2 PCR擴增及對產物進行瓊脂糖凝膠電泳
PCR擴增引物選用已經融合了Miseq測序平臺的16S rDNAV3-V4通用引物,341F引物:CCTACACGACGCTCTTCCGATCTN(barcode)CCTACGGGNGGCWGCAG,805R引物:GACTGGAGTTCCTTGGCACCCGAGAATTCCAGACTACHVGGGTATCTAATCC。PCR體系按照如下進行:10×PCR buffer 5 μL,dNTP(10 mM each)0.5 μL,Genomic DNA 10 ng,Bar-PCR primer F (50 μM)0.5 μL,Primer R(50 μM)0.5 μL,Plantium Taq (5 U/μL)0.5μL,H2O add to 50 μL。配制好的PCR體系按照如下反應條件進行擴增:94℃變性3 min,做5個循環,分別是94℃變性30 s,45℃退火20 s,65℃延伸30 s;再做20個循環,分別是94℃變性20 s,55℃退火20 s,72℃延伸30 s,72℃延伸5 min,然后進行第2輪擴增,引入lllumina橋式PCR兼容引物。PCR結束后,產物進行瓊脂糖凝膠電泳,對DNA進行回收。
1.2.3 16S rDNA擴增片段的測序、質控和聚類
采用Misep測序平臺對擴增片段進行雙端測序,測得的基因序列經質量控制軟件Prinsep處理,去除barcode、兩端primer以及部分低質量基因序列,經質控后的基因序列長度大部分分布在400~600 bp之間,基本滿足分析需要。
對測得的基因序列采用uclust軟件進行OUT聚類,通常域值的序列相似性定位0.97,操作分類單元被認為可能屬于屬。
1.2.4對處理后序列進行物種分類,比較窖泥變質前后菌群結構差異
物種分類采用的軟件為RDP classifier,基于OUT聚類的結果,獲取每一個OUT聚類的代表序列,分別是長度最長序列(length)、豐度最大序列(abundance)和所有序列(ALL)形成3份結果,并對各類RDP分析。本文所有的展示,均使用OUT_ALL中的數據,genus水平進行展示,采用柱形圖及表格的形式對比窖泥變質前后群落結構差異。
2結果與分析
2.1窖泥變質前后細菌16SrDNAV3—V4電泳圖譜(圖1)

圖1 細菌16S rDNAV3—V4電泳圖譜
結合圖1中的3條泳道對比得知,泳道1和泳道2有較清晰地條帶,條帶大小位于400~600 bp之間,DNA提取時一般都通過試劑盒過柱提取,這種柱子有固定孔徑,從而決定了基因組片段的大小。泳道1比泳道2亮,說明窖泥變質后細菌數量和豐度均有所提高。
2.2窖泥變質前后16S rDNA多樣性分析
擴增后的PCR產物去除嵌合體和靶區域序列,得到的基因序列數見表1。
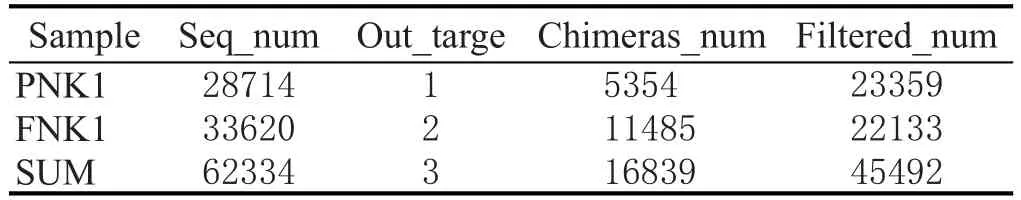
表1 處理后基因序列統計表
將多條序列按其序列間的距離對它們進行聚類,后根據序列之間的相似性作為域值分成操作分類單元(OTU),通常域值的序列相似性定為0.97,操作分類單元被認為屬于屬[21-23]。采用OUT VENN分析圖統計樣本中共有的和獨有的OUT數目,直觀展示出窖泥變質前后OUT數目的差異(圖2)。PNK1有2857個OTUs,FNK1 有2344個OTUs,兩者共有553個OTUs。說明窖泥變質后,細菌的種類和豐度有所提高。

圖2 窖泥變質前后OUT數
2.3細菌群落結構分析
對處理后序列,采用RDP classifier軟件對每條序列在genus水平上計算其分配到此rank中的概率值,一般概率值大于0.8,即RDP分類域值[24-25]。根據分類學分析結果,可以得知樣品在屬分類水平的數據,樣本中菌群的reads數目,也就是菌群的豐度值(表2、表3)。
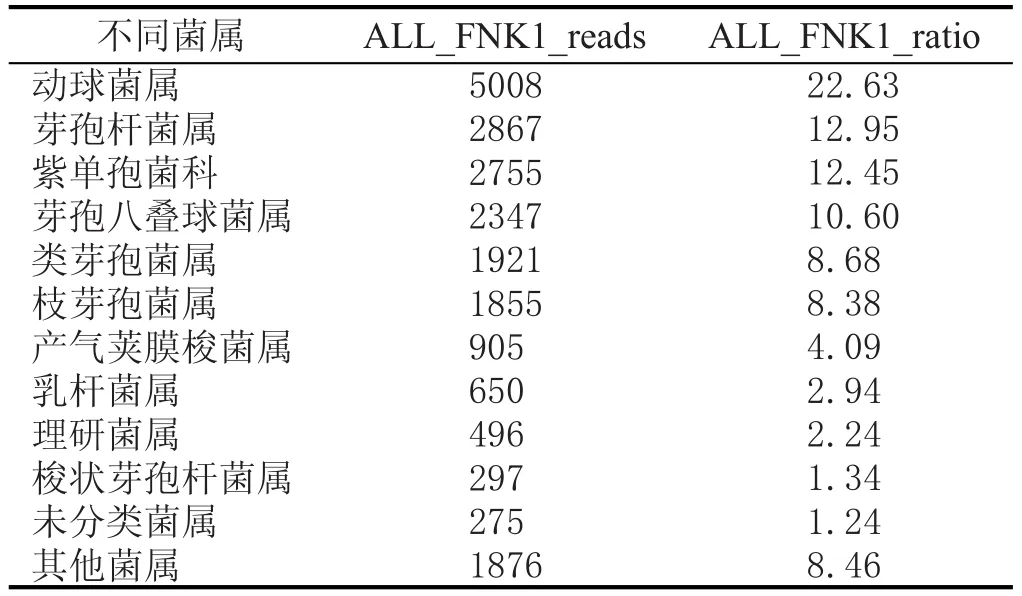
表2 窖泥變質前細菌種類及豐度值
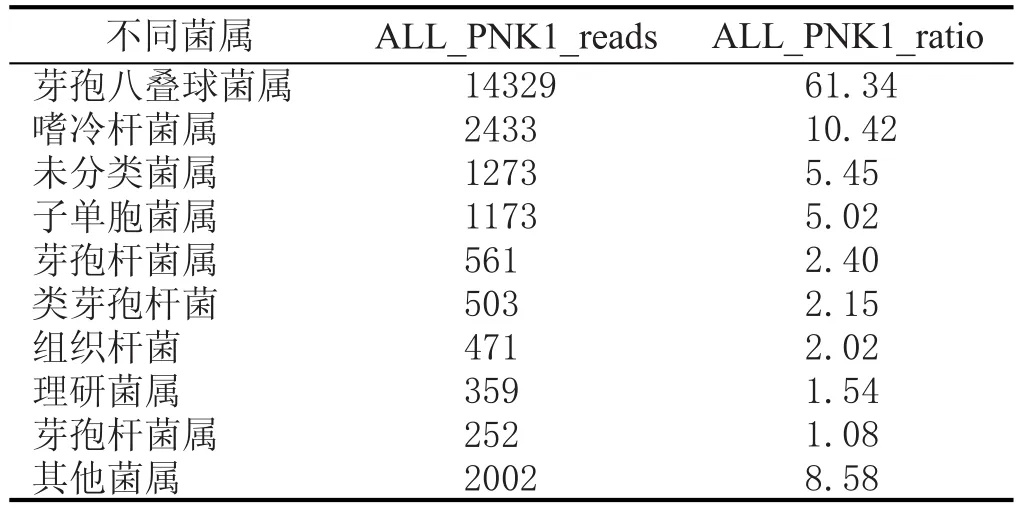
表3 窖泥變質后細菌種類及豐度值
采用柱形圖比較FNK1和PNK1種屬豐度值(圖3)。
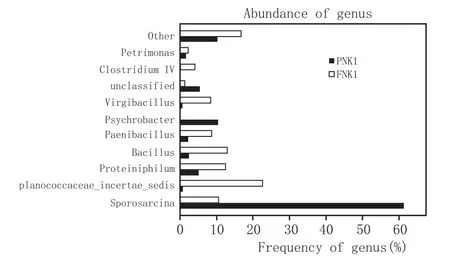
圖3 FNK1和PNK1細菌種屬豐度值對比
結合表2、表3、圖3可知,窖泥變質前后細菌群落結構、豐度差異較大,選擇優勢菌群進行比較。芽孢八疊球菌屬(Sporosarcina)在FNK1和PNK1所占比例為10.60%和61.34%,動球菌屬(Planococcaceae incertae sedis)在FNK1和PNK1所占比例為22.63%和0.75%,紫單胞菌科(Proteiniphilum)在FNK1和PNK1所占比例為12.45%和5.02%,芽孢桿菌屬(Bacillus)在FNK1和PNK1所占比例為12.95%和2.40%,類芽孢菌屬(Paenibacillus)在FNK1和PNK1所占比例為8.68%和2.15%,嗜冷桿菌屬(Psychrobacter)在FNK1和PNK1所占比例為0%和10.42%,枝芽孢菌屬(Virgibacillus)在FNK1和PNK1所占比例為8.38%和0.63%,未分類菌屬(unclassified)在FNK1和PNK1所占比例為1.24%和5.45%,產氣莢膜梭菌屬(Clostridium IV)在FNK1和PNK1所占比例為4.09%和0.10%。
3 討論
窖池窖泥發酵是中國白酒生產工藝的特色之一,對窖泥中微生物群落結構的研究可為進一步正確認識白酒風味因子形成機理、窖泥微生物分布、窖泥變質微生物分析有著積極的意義。本研究通過高通量測序的方法分析濃香型白酒窖池窖泥中細菌群落結構,重點分析了窖泥變質前后細菌群落差異[12-16]。變質后的窖泥出現板結堅硬、白色鹽析、腐臭味的現象,原因是釀酒車間環境和窖泥營養條件的變化導致微生物菌群結構發生變化,最終導致物質代謝發生改變,致使窖泥變質[17-20]。16S rDNA序列分析表明,窖泥變質前后細菌菌群均比較豐富。窖泥變質前優勢菌屬為動球菌屬(22.63%)和芽孢八疊球菌屬(10.60%),窖泥變質后的細菌豐度有顯著升高,優勢菌屬為芽孢八疊球菌屬(61.34%)和嗜冷桿菌屬(10.42%)。
芽孢八疊球菌屬為有機化能營養,產生能量的代謝是嚴格的呼吸型代謝,氧是最終電子受體,嚴格需氧。此屬包含2種為人所知的種類:脲芽孢八疊球菌和嗜鹽八疊球菌,后者起于海洋,生長過程中需要Na+;脲芽孢八疊球菌能有效的把尿素降解為CO2和NH3,這樣使得無緩沖能力的培養基的pH值顯著升高。嗜冷桿菌屬在窖泥變質后含量有較大幅度的提升,查閱資料沒有找到其相關信息。
本研究只分析了窖泥變質前后細菌的群落組成,課題組將繼續研究窖泥古生菌和真菌群落差異,以期獲得窖泥微生物全貌,為研究窖泥變質原因提供參考。
參考文獻:
[1]杜禮泉,羅惠波,黃治國,等.不同質量窖泥古菌群落的研究[J].釀酒科技,2015(2):58.
[2]李家民,鄒永芳,王海英,等.DGGE法初步解析沱牌酒廠窖底泥微生物群落結構[J].釀酒科技,2013(3):36-39.
[3]何翠容,吳冬梅,鄭佳,等.濃香型白酒窖池細菌與古菌隨窖齡變化的特征[J].釀酒科技,2013(1):27-30.
[4]羅青春,劉超蘭,吳正云,等.不同年份窖泥中主要產甲烷菌的熒光定量PCR研究[J].釀酒科技,2013(12):17-19.
[5]陶勇,徐占成,李東訊,等.窖泥細菌群落結構演替及其與環境因子的相關性[J].釀酒科技,2011(9):42-46.
[6]Kobayashi T,Yan F,Takahashi S,et al. Effect of starch addition on the biological conversion and microbial community in a methanol-fed UASB reactor during long-term continuous operation[J].Bioresource Technol,2011,102:7713-7719.
[7]王明躍,張文學,王海英,等.不同窖齡窖泥細菌的系統發育多樣性分析[J].食品科學,2013(11):177-181.
[8]王濤,田時平,趙東,等.宜賓濃香型白酒窖泥中細菌的系統發育多樣性[J].食品與發酵工業,2011,37(10):11-18.
[9]鄧依,唐云容,張文學.16S-23S rRNAITS-AFLP指紋圖譜分析在白酒窖泥原核微生物多樣性分析中的應用[J].釀酒科技,2010(3):46-48.
[10]陜小虎,敖宗華,周健,等.濃香型白酒窖泥原核微生物DGGE電泳條件的優化[J].釀酒科技,2011(1):37-40.
[11]黃永光,黃平,涂華彬.窖泥微生物總DNA的提取純化研究[J].釀酒科技,2004(3):41-42.
[12]陶勇,芮俊鵬,李家寶,等.濃香型白酒窖泥中細菌和古菌的組成與多樣性[J].化工學報,2014,65(5):1800-1804.
[13]Lee S H,Kang H J,Lee Y H,et al. Monitoring bacterial community structure and variability in time scale in full-scale anaerobic digesters[J].J Environ Monit,2012,14(7):1893-1905.
[14]曾祥勇,董雅舒,胡貝,等.不同年份窖泥細菌16S rDNA系統發育分析[J].四川大學學報,2014(9):71-74.
[15]易彬,任道群,唐玉明,等.不同窖齡窖泥微生態變化研究[J].釀酒科技,2011(6):32-34.
[16]楊冰,盧向陽,田云.甲烷八疊球菌屬研究進展[J].化工與生物工程,2012(29):12.
[17]吳三多,賴凳燡,溫寬和,等.北方地區窖泥退化原因及管理養護的研究[J].釀酒科技,2014(9):71-74.
[18]Good I J. The population frequencies of species and the estimation of population parameters[J].Biometrika,1953,40:237-264.
[19]羅惠波,甄攀,黃治國.濃香型白酒窖池細菌群落[J].微生物學通報,2010,37(11):1621-1627.
[20]謝玉球,林洋,周二干,等.人工窖泥的制作和養護[J].釀酒科技,2013(2):67-70.
[21]Deng B,Shen C H,Shan X H,et al. PCR-DGGE analysis on microbial communities in pit mud of cellars used for different periods of time[J].Journal of the Institute of Brewing,2012,118(1):120-126.
[22]Yannarell AC,Triplett E W. Geographic and environmental sources of variation in lake bacterial community composition [J].Applied and Environmental Microbiology,2005,71(1):227-239.
[23]Madigan M T,Martinko J M,Stahl D,et al. Brock Biology of Microorganisms[M].13th ed. San Francisco:Pearson,2010.
[24]Sun Y Z,Mao S Y,Zhu WY. Rumen chemical and bacterial changes during stepwise adaptation to a high-concentrate diet in goats[J].Animal,2010,4(2):210-217.
[25]Westerholm M,Roos S,Schnurer A. Syntrophaceticus schinkii gen. nov.,sp. nov.,an anaerobic,syntrophic acetateoxidizing bacterium isolated from a mesophilic anaerobic filter[J].FEMS Microbiol Letters,2010,309(1):100-104.
中圖分類號:TS261.1;Q93-3;TS262.3;TS261.4
文獻標識碼:A
文章編號:1001-9286(2016)05-0061-04
收稿日期:2016-03-17
作者簡介:于春濤(1979-),男,河北人,碩士,研究方向為微生物發酵,E-mail:aimiao818@163.com。
Analysis of the Difference in Bacterial Communities in Pit Mud Before and After the Deterioration
YU Chuntao1,LIU Chao1,SUN Feng'e1and LIU Zhenjiang2
(1.Cangzhou Medical College,Cangzhou,Hebei 061001;2.Ningjin Nikeng Distillery Co. Ltd.,Shijiazhuang,Hebei 054000,China)
Abstract:The bacterial communities in pit mud before and after the deterioration were analyzed by high throughput sequencing DNA technology through the extraction of total bacterial DNA and the construction of gene library by amplification of 16S rDNA. The results showed that,there were significant difference in bacterial communities in pit mud before and after the deterioration,bacteria of 16 phylum and 174 genus in total were detected,the dominant bacteria in pit mud before the deterioration included Planococcaceae(22.63%),Bacillus(12.95%),Proteiniphilum(12.45%),Sporosarcina(10.60%)etc.,and the dominant bacteria in pit mud after the deterioration included Sporosarcina(61.34%),Psychrobacter(10.43%),unclassified bacteria(5.45%),Proteiniphilum(5.02%)etc. This study provided a theoretical base for the research on pit mud deterioration.
Key words:pit mud;deterioration;bacterial community;analysis of the difference;high throughput sequencing

