羊棲菜多糖通過VEGF途徑抑制胃癌細(xì)胞誘導(dǎo)的腫瘤血管內(nèi)皮細(xì)胞增殖的實(shí)驗(yàn)研究
陳慧玲,李培飛,陳聲燦,況 煒,郭俊明
羊棲菜多糖通過VEGF途徑抑制胃癌細(xì)胞誘導(dǎo)的腫瘤血管內(nèi)皮細(xì)胞增殖的實(shí)驗(yàn)研究
陳慧玲,李培飛,陳聲燦,況 煒,郭俊明
目的 研究羊棲菜多糖(SFPS)抑制腫瘤血管內(nèi)皮細(xì)胞增殖的作用機(jī)制。方法 采用實(shí)時(shí)細(xì)胞分析系統(tǒng)監(jiān)測不同濃度SFPS對腫瘤血管內(nèi)皮細(xì)胞增殖的影響,酶聯(lián)免疫吸附法(ELISA)測定腫瘤細(xì)胞培養(yǎng)上清液VEGF-A的分泌,實(shí)時(shí)熒光定量PCR檢測腫瘤細(xì)胞VEGF-AmRNA及腫瘤血管內(nèi)皮細(xì)胞VEGFR-2mRNA的水平。結(jié)果 SFPS可抑制腫瘤血管內(nèi)皮細(xì)胞的增殖,并呈濃度和時(shí)間依賴性。300、1 000 mg/L SFPS作用12 h即出現(xiàn)抑制作用(均<0.05),30、100 mg/L SFPS作用24 h表現(xiàn)抑制作用(均<0.05),而作用36及48 h各濃度組SFPS與對照組差異均有統(tǒng)計(jì)學(xué)意義(均<0.05)。SFPS(30、100、300mg/L)作用36h后,能明顯降低MGC-803細(xì)胞培養(yǎng)上清VEGF-A的含量(均<0.05)。PCR結(jié)果顯示,100、300mg/LSFPS能降低MGC-803細(xì)胞VEGF-A及腫瘤血管內(nèi)皮細(xì)胞VEGFR-2的轉(zhuǎn)錄水平(均<0.05)。結(jié)論 SFPS具有抑制腫瘤血管內(nèi)皮細(xì)胞增殖的作用,其作用機(jī)制與下調(diào)腫瘤細(xì)胞VEGF-A和腫瘤血管內(nèi)皮細(xì)胞VEGFR-2的表達(dá)有關(guān)。
羊棲菜;多糖類;胃腫瘤;癌;內(nèi)皮,血管;血管內(nèi)皮生長因子
[Modem Piactical Medicine, 2016,28(6):710-712]
羊棲菜多糖(SFPS)提取自海藻羊棲菜,體內(nèi)外研究均表明SFPS具有顯著的抗腫瘤活性[1-3],但其作用機(jī)制尚未明確。筆者前期研究發(fā)現(xiàn),SFPS可通過抑制腫瘤血管內(nèi)皮細(xì)胞的增殖而抑制腫瘤的生長[4]。本實(shí)驗(yàn)擬利用人胃癌MGC-803細(xì)胞誘導(dǎo)的血管內(nèi)皮細(xì)胞模型,進(jìn)一步探討SFPS對腫瘤血管內(nèi)皮細(xì)胞增殖的作用機(jī)制。報(bào)道如下。
1 資料與方法
1.1 材料 人胃癌細(xì)胞MGC-803,人臍靜脈血管內(nèi)皮細(xì)胞HUVECs,均來源于中國科學(xué)院上海細(xì)胞庫;SFPS由浙江大學(xué)藥學(xué)院藥物分析中心提供,多糖含量53%。
1.2 主要試劑與儀器 RPMI1640培養(yǎng)基、人內(nèi)皮細(xì)胞無血清培養(yǎng)基(HESFM),小牛血清(美國Gibco),總 RNA提取試劑 TRIzol(美國 Ambion),VEGF-A、VEGFR-2和 -actin引物(上海Sangon);人VEGF-A定量ELISA檢測試劑盒(美國R﹠amp;D systems),逆轉(zhuǎn)錄、qRT-PCR反應(yīng)試劑盒(美國Promega);xCELLigence實(shí)時(shí)細(xì)胞分析系統(tǒng)、E-plate96孔板(美國ACEA Biosciences),Modle500酶聯(lián)免疫檢測儀(美國Bio-Rad),Mx3005P熒光定量PCR儀(美國Stratagene)。
1.3 方法
1.3.1 細(xì)胞培養(yǎng) 在37℃、5%CO2及飽和濕度的條件下,人胃癌細(xì)胞 MGC-803于含 10%小牛血清的RPMI 1640培養(yǎng)基中傳代培養(yǎng),人臍靜脈血管內(nèi)皮細(xì)胞HUVECs培養(yǎng)于含10%小牛血清的HESFM培養(yǎng)基。
1.3.2 腫瘤條件培養(yǎng)基制備 參照Tu等[5]的腫瘤條件培養(yǎng)基制備方法并進(jìn)行改良,待MGC-803細(xì)胞生長融合至70%時(shí),將培養(yǎng)瓶中的培養(yǎng)基更換為無血清的1640培養(yǎng)基,48h后收集上清液,2000r/min離心10min去除細(xì)胞碎片,并以0.22m微孔濾膜過濾除菌,―70℃保存?zhèn)溆谩J褂脮r(shí),將上述MGC-803細(xì)胞上清液與HESFM培養(yǎng)基以1︰1比例混合,即為腫瘤條件培養(yǎng)基,實(shí)驗(yàn)中用以HUVECs的誘導(dǎo)培養(yǎng)。
1.3.3 實(shí)時(shí)監(jiān)測細(xì)胞增殖活性 E-plate每孔加入100l腫瘤條件培養(yǎng)基以測定背景值,然后再向E-plate每孔加入100l HUVECs細(xì)胞懸液(1×104細(xì)胞/孔),并將E-plate置于xCELLigence實(shí)時(shí)細(xì)胞分儀上。培養(yǎng)20 h待細(xì)胞生長穩(wěn)定后,加入不同濃度SFPS(終濃度分別為10、30、100、300和1000mg/L),并設(shè)空白對照組,每組6個(gè)復(fù)孔。儀器每隔15 min檢測一次細(xì)胞指數(shù)(cell index,CI),監(jiān)測48 h。
1.3.4ELISA法檢測VEGF-A釋放 MGC-803細(xì)胞以1×104細(xì)胞/孔的密度接種于96孔板,細(xì)胞生長達(dá)到飽和狀態(tài)時(shí),更換為無血清1640培養(yǎng)基,同步培養(yǎng)12h后,加入終濃度分別為30、100和300mg/L的SFPS,同時(shí)設(shè)空白對照,每組6復(fù)孔。作用36 h后,收集細(xì)胞培養(yǎng)上清液,按照ELISA試劑盒說明書進(jìn)行VEGF含量檢測。
1.3.5 實(shí)時(shí)熒光定量PCR法檢測VEGF-A和VEGFR-2的 mRNA表達(dá) 分別收集經(jīng)30、100和300 mg/L濃度的SFPS作用36h后的MGC-803和HUVECs細(xì)胞,TRIzol法提取各組細(xì)胞的總RNA,按照試劑盒說明逆轉(zhuǎn)錄為cDNA,進(jìn)行熒光定量PCR擴(kuò)增,各樣本重復(fù)3次。PCR引物序列見表1,以 -actin為內(nèi)參。反應(yīng)條件如下:95℃預(yù)變性5min,94℃變性15 s,55℃退火30 s,72℃延伸30 s,共45個(gè)循環(huán)。目標(biāo)基因表達(dá)的相對水平分析采用2-△△CT法[6]。
1.4 統(tǒng)計(jì)方法 數(shù)據(jù)采用SPSS16.0軟件進(jìn)行分析,計(jì)量數(shù)據(jù)以均數(shù)±標(biāo)準(zhǔn)差表示,多組間比較采用檢驗(yàn),多重比較采用LSD-檢驗(yàn)。<0.05為差異有統(tǒng)計(jì)學(xué)意義。
2 結(jié)果
2.1 SFPS對 MGC-803胃癌細(xì)胞誘導(dǎo)的血管內(nèi)皮細(xì)胞增殖活性的影響 實(shí)時(shí)細(xì)胞分析系統(tǒng)檢測結(jié)果表明,SFPS在30~1000mg/L濃度范圍內(nèi)作用24h以上對人胃癌MGC-803細(xì)胞誘導(dǎo)的HUVECs增殖具有明顯的抑制作用(≥3.25,均<0.01),并呈濃度-時(shí)間相關(guān)性(封二彩圖1)。而作用36h、48h,各濃度SFPS組與對照組差異均有統(tǒng)計(jì)學(xué)意義(≥3.76,均<0.01)。此外,高濃度(300、1000 mg/L)SFPS作用12h即出現(xiàn)明顯的抑制作用(≥2.24,均<0.05)。
2.2 SFPS對MGC-803胃癌細(xì)胞分泌VEGF-A的影響 與空白對照組比較,SFPS作用 36 h后,MGC-803細(xì)胞上清液中VEGF-A的含量明顯降低,30、100及300 mg/L濃度組與對照組差異均有統(tǒng)計(jì)學(xué)意義(≥2.82,均<0.05),見表2。
2.3 SFPS對MGC-803胃癌細(xì)胞VEGF-A表達(dá)水平的影響 熒光實(shí)時(shí)定量RT-PCR檢測結(jié)果表明,SFPS作用36 h后,VEGF-A在 MGC-803胃癌細(xì)胞中的mRNA水平有所下降,其中100及300 mg/L濃度組與對照組差異均有統(tǒng)計(jì)學(xué)意義(≥3.43,均<0.05),見封二彩圖2。

表1 引物序列
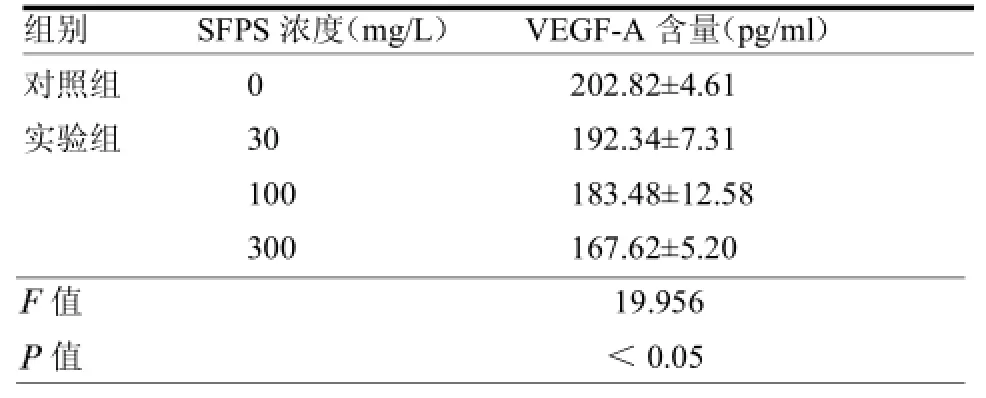
表2 SFPS對MGC-803細(xì)胞上清液中VEGF-A含量的影響(=6)
2.4 SFPS對 MGC-803胃癌細(xì)胞誘導(dǎo)的血管內(nèi)皮細(xì)胞 VEGFR-2表達(dá)水平的影響 SFPS作用于MGC-803誘導(dǎo)的血管內(nèi)皮細(xì)胞36h后,采用RT-PCR進(jìn)行檢測,結(jié)果發(fā)現(xiàn)VEGFR-2的mRNA水平在血管內(nèi)皮細(xì)胞中顯著下降,對照組與100及300 mg/L濃度組差異均有統(tǒng)計(jì)學(xué)意義(≥4.11,均<0.05),見封二彩圖3。
3 討論
血管生成是腫瘤發(fā)生發(fā)展的重要環(huán)節(jié),腫瘤的生長、侵襲以及轉(zhuǎn)移均有賴于新生血管的形成來提供足夠的營養(yǎng)物質(zhì)。腫瘤血管生成起始于腫瘤細(xì)胞釋放促血管生成的調(diào)節(jié)因子,進(jìn)而誘導(dǎo)血管內(nèi)皮細(xì)胞增殖、遷移并形成管腔[7]。VEGF是目前發(fā)現(xiàn)的作用最強(qiáng)的促血管生成的誘導(dǎo)因子,其生物學(xué)效應(yīng)是由相應(yīng)受體介導(dǎo)而實(shí)現(xiàn)的。在VEGF家族中,VEGFA及其受體VEGFR-2主要參與血管生成的調(diào)控,成為調(diào)節(jié)內(nèi)皮細(xì)胞增殖和移動的關(guān)鍵因素[8]。因此,通過阻斷或干擾VEGF-A及其受體的作用,抑制血管內(nèi)皮細(xì)胞增殖,可達(dá)到抗腫瘤血管生成的目的。
本研究利用胃癌MGC-803細(xì)胞培養(yǎng)上清液制備的腫瘤條件培養(yǎng)基,建立腫瘤細(xì)胞誘導(dǎo)的腫瘤血管內(nèi)皮細(xì)胞模型。腫瘤細(xì)胞培養(yǎng)上清液含有多種細(xì)胞因子,可明顯促進(jìn)血管內(nèi)皮細(xì)胞的增殖和遷移能力[9],使正常的血管內(nèi)皮細(xì)胞表現(xiàn)腫瘤血管內(nèi)皮細(xì)胞的特性[10]。實(shí)時(shí)細(xì)胞監(jiān)測結(jié)果證實(shí),多組SFPS對MGC-803胃癌細(xì)胞誘導(dǎo)的腫瘤血管內(nèi)皮細(xì)胞增殖具有抑制作用,并有劑量和時(shí)間相關(guān)性,此結(jié)果與項(xiàng)目組前期發(fā)現(xiàn)的結(jié)果一致[4]。ELISA法檢測結(jié)果顯示,SFPS可降低MGC-803細(xì)胞上清液中VEGF-A的含量。而實(shí)時(shí)熒光定量PCR檢測結(jié)果表明,SFPS也可降低MGC-803胃癌細(xì)胞中VEGF-A的mRNA表達(dá)水平,同時(shí)也降低了MGC-803誘導(dǎo)的腫瘤血管內(nèi)皮細(xì)胞中VEGFR-2的mRNA水平。以上結(jié)果提示,SFPS對腫瘤血管內(nèi)皮細(xì)胞的增殖抑制作用與VEGF途徑密切相關(guān),SFPS不僅直接導(dǎo)致腫瘤血管內(nèi)皮細(xì)胞的VEGFR表達(dá)水平顯著下降,也使腫瘤細(xì)胞的VEGF表達(dá)和分泌水平下降。
綜上所述,SFPS可通過VEGF途徑干擾腫瘤細(xì)胞與血管內(nèi)皮細(xì)胞之間的相互作用,抑制腫瘤血管內(nèi)皮細(xì)胞的增殖。此效應(yīng)提示SFPS具有抑制腫瘤血管生成的作用,切斷腫瘤組織的營養(yǎng)供給,抑制腫瘤的生長和轉(zhuǎn)移,但其具體的分子機(jī)制還有待于進(jìn)一步的研究分析。
[1]Ji YB, Ji CF, Yue L. Human gastric cancer cell line SGC-7901 apoptosis induced by SFPS-B2 via a mitochondrial-mediated pathway [J].Biomed Mater Eng, 2014, 24(1):1141-1147.
[2]Chen X, Nie W, Yu G, et al. Antitumor and immunomodulatory activity of polysaccharides from Sargassum fusiforme[J]. Food Chem Toxicol, 2012, 50(3/4):695-700.
[3]欒志偉,東方,季宇彬,等.羊棲菜多糖抗腫瘤作用的研究進(jìn)展[J].黑龍江醫(yī)藥,2013,26(4):592-594.
[4]況煒,陳慧玲.羊棲菜多糖對人肺癌細(xì)胞及腫瘤血管內(nèi)皮細(xì)胞模型增殖活性的影響[J].現(xiàn)代實(shí)用醫(yī)學(xué),2011,23(3):256-257,267.
[5]Tu ML, Wang HQ, Chen LJ, et al. Involvement of Akt1/protein kinase Balpha in tumor conditioned medium-induced endothelial cell migration and survival in vitro[J]. J Cancer Res Clin Oncol, 2009, 135(11):1543-1550.
[6]Sun WL, Wu YB, Yu X, et al. Decreased expression of long noncoding RNA AC096655.1-002 in gastric cancer and its clinical significance[J]. Tumour Biol, 2013, 34(5):2697-2701.
[7]Gupta MK, Qin RY. Mechanism and its regulation of tumor-induced angiogenesis[J]. World J Gastroenterol, 2003, 9(6):1144-1155.
[8]董宏超,翟校楓.VEGFA-VEGFR2相關(guān)信號蛋白作用機(jī)制的研究進(jìn)展[J].現(xiàn)代腫瘤醫(yī)學(xué),2014,22(9):2231-2233.
[9]張婷,蔣春雷.腫瘤條件培養(yǎng)基對人臍靜脈內(nèi)皮細(xì)胞增殖、黏附、遷移能力的調(diào)節(jié)[J].生理學(xué)報(bào),2011,63(3):256-260.
[10]向邦德,呂明德,黃潔夫,等.誘導(dǎo)正常血管內(nèi)皮細(xì)胞具備腫瘤血管特性的研究[J].中山大學(xué)學(xué)報(bào):醫(yī)學(xué)科學(xué)版,2005,26(3):354-357.
Inhibition of Sargassum fusiforme polysaccharides on the proliferation of tumor vascular endothelial cells induced by gastric tumor cells via regulating vascular endothelial growth factor
CHEN HuiLing,LI Feifei, CHEN Shengcan, KUANG Wei, GUO Junming (Ningbo College of Heahh Sciences, Ningbo 315010, Zhging, China)
Objective To investigate the inhibition and its mechanism of Sargassum fusiforme polysaccharides (SFPS) on the proliferation of tumor vascular endothelial cells.Methods Real time Cellular Analysis was performed to observe the effect of SFPS on the proliferation of tumor vascular endothelial cells. VEGF-A in the supernatant of tumor cells was measured by ELISA. Quantitative real-time reverse transcription-polymerase chain reaction was employed to detect the mRNA levels of VEGF-A in tumor cells and VEGFR-2 in tumor vascular endothelial cells. Results SFPS inhibited the proliferation of tumor vascular endothelial cells in a dose and time dependent manner. After treatment for 12 h, 300 mg/L and 1000 mg/L SFPS could inhibit the cells growth ( P< 0.05). And 30 mg/L and 100 mg/L SFPS inhibited the cells growth after treatment for 24 h ( P< 0.01). While after treatment of SFPS for 36 h and 48 h, the proliferation of cells significantly decreased (all 0.01). VEGF-A in the supernatant of MGC-803 cells was obviously lower after treatment of SFPS (30, 100, 300 mg/L) for 36 h ( P< 0.05). SFPS at 300mg/L and 1000mg/L concentration could reduce the expression of VEGF-A in MGC-803 cells and VEGFR-2 in tumor vascular endothelial cells (all P< 0.05) .Conclusions SFPS could inhibit the proliferation of tumor vascular endothelial cells by reducing the expressions of VEGF-A in tumor cells and VEGFR-2 in tumor vascular endothelial cells.
Sargassum fusiforme Polysaccharides; Gastric neoplasm; Carcinoma; Endothelium; Vascular; Vascular endothelial growth factor
10.3969/j.issn.1671-0800.2016.06.005
R331.3+2
A
1671-0800(2016)06-0710-03
2016-03-14
(本文編輯:鐘美春)
寧波市自然科學(xué)基金(2013A610214);浙江省高等學(xué)校訪問學(xué)者發(fā)展項(xiàng)目(FX2013259)
315104寧波,寧波衛(wèi)生職業(yè)技術(shù)學(xué)院(陳慧玲、況煒);寧波大學(xué)醫(yī)學(xué)院(李培飛、陳聲燦、郭俊明)
況煒,Email:kwei93@126.com

