腸內代謝物腹腔注射對大鼠神經內分泌和行為學的影響*
白志余,周東蕊,張仁敏,李娜,白志茂,張紅琳,張麗玲,龐桂芬
(1.承德醫學院附屬醫院呼吸內科,河北 承德 067000;2.東南大學學習科學研究中心,江蘇 南京 210000;3.東南大學公共衛生學院,江蘇 南京 210000;4.南京曉莊學院,江蘇 南京 210017)
腸內代謝物腹腔注射對大鼠神經內分泌和行為學的影響*
白志余1,周東蕊2,張仁敏2,李娜2,白志茂3,張紅琳4,張麗玲4,龐桂芬1
(1.承德醫學院附屬醫院呼吸內科,河北 承德 067000;2.東南大學學習科學研究中心,江蘇 南京 210000;3.東南大學公共衛生學院,江蘇 南京 210000;4.南京曉莊學院,江蘇 南京 210017)
目的觀察腸內代謝物對大鼠行為學的影響,并初步探討其可能機制。方法采集健康兒童新鮮糞便,用低溫高速離心法提取腸內代謝物。將26只SD大鼠隨機分為兩組(對照組10只,實驗組16只),實驗組大鼠于腹腔注射腸內代謝產物(0.5ml/只),對照組大鼠用生理鹽水處理。采用高架十字迷宮實驗觀察兩組大鼠行為學差異,并測定其腦組織海馬區、下丘腦、紋狀體內5-羥色胺(5-HT)及多巴胺(DA)表達水平。結果實驗組與對照組SD大鼠行為學比較,發現進臂總次數[實驗組(38.00±7.51)次、對照組(14.75±8.62)次]和開臂時間比例[實驗組(36.24±12.30)%、對照組(21.37±8.32)%]比較,差異有統計學意義(P<0.05)。海馬和下丘腦內5-HT含量、海馬和紋狀體內DA含量比較,差異有統計學意義(P<0.05)。結論健康兒童腸內代謝物使大鼠行為學明顯改變,并對腦內神經遞質有一定影響。
腸內代謝物;腹腔注射;大鼠行為學;5-羥色胺;多巴胺
腸內代謝產物是消化系統內消化酶與腸道菌群共同代謝的產物,既有對機體有益的營養物質、生物因子,也有一些有毒物質[1-2]。當飲食相同的情況下,除遺傳基因個體差異外,代謝產物的差異主要取決于機體腸道微生物群落結構的差異。腸道微生物是存在于宿主消化道內的微生物群落,數量極其龐大,人體腸道微生物細菌數量是人體細胞的10倍[3],其編碼基因約為人體編碼基因的100倍[4]。這么龐大一個微生物群體起著營養物質降解與消化吸收,合成人體需要的某些免疫因子、神經遞質及前體物質等重要作用。腸道微生物及其代謝產物對機體免疫和神經信號傳導等起重要的調節作用[5-6]。多項研究表明,腸道和大腦之間通過腸道微生物的分泌與代謝作用,以及腸道微生物對腸神經和免疫系統的刺激作用,來完成重要的雙向調節功能,稱為菌群腦腸軸[7],如腸道微生物及其代謝產物直接參與某些神經與免疫的關鍵信號通路傳導[8],參與大腦與神經的發育,以及調節人體的行為表現等[9]。健康狀態下腸道微生物組成一個復雜而穩定的微生態環境,起重要的腸黏膜屏障作用。當機體受創,免疫功能缺損或胃腸功能紊亂,腸黏膜屏障受損的情況下,本不能通過腸黏膜屏障的代謝物就會突破腸黏膜屏障,使機體出現病變。多項研究發現,功能性胃腸疾病患者多數存在焦慮、抑郁等情緒行為異常[10-11]。自閉癥作為一項廣泛性神經發育異常疾病,近年來發病率逐年增高。自閉癥兒童多數具有胃腸道問題,如反復的胃腸炎癥及腸漏[12]。腸黏膜的通透性增加,腸內代謝物及一些有毒分子進入血液循環,某些分子甚至能夠通過血腦屏障作用于大腦,引起行為學及腦神經遞質的變化[13]。本實驗通過對大鼠腹腔注射腸內代謝物,避開腸黏膜屏障,建立腸漏模型,進一步了解腸內代謝產物對大鼠行為及腦神經遞質分泌,如5-羥色胺(Serotonin,5-HT)、多巴胺(Dopamine,DA)的影響。為自閉癥等神經發育障礙性疾病的發病機制提供理論依據。
1 材料與方法
1.1材料與試劑
無特定病原體級SD大鼠,26只,10 d大小,南京青龍山動物飼養廠提供。標準品5-HT、5-羥吲哚乙酸、3,4-二羥基苯甲胺氫溴酸鹽,購自美國Sigma aldrich公司,乙腈(色譜純)購自山東禹王實業公司化學試劑廠,乙二胺四乙酸、庚烷磺酸鈉購自上海化學試劑研究所,石蠟膜購自美國Alcan Packaging公司。
1.2儀器與設備
低溫高速離心機Eppendorf 5804R購自德國Eppendorf公司,旋渦振蕩器Vortex-2 Genie購自美國Scientific Industries公司,大鼠高架十字迷宮(elevated plus maze,EPM)購自上海精宏實驗設備有限公司,LC-20AD高效液相色譜儀、L-ECD-6A電化學檢測器、LC-20AD雙泵購自日本島津公司。
1.3實驗方法
1.3.1腸內代謝物的提取將采集的健康兒童新鮮糞便用一定體積的無菌0.9%生理鹽水溶解1.0∶0.5(重量g∶體積ml),混勻,低溫4℃、500r/min離心5min。取上清液,低溫4℃、5000r/min離心10min。取上清液,低溫4℃、8000r/min離心15min。取上清液,低溫4℃、12000r/min離心30min,收集上清液。過濾(0.22μm孔徑),重復2次,將液體4℃保存。整個手動操作過程要在低溫冰上進行,離心過程管口用蠟膜封口,避免揮發性成分揮發。
1.3.2大鼠腹腔注射將26只SD大鼠飼養1周適應環境后,隨機分為兩組(對照組10只,實驗組16只),以腸內代謝物和0.9%生理鹽水按0.5 ml分別注射實驗組和對照組,隔天注射1次,連續注射20d后停止注射,然后飼養半個月。動物房室溫25~30℃。
1.3.3大鼠行為學測試實驗室內光線昏暗并保持恒亮,室溫25℃左右,保持安靜。迷宮測試前將每只大鼠單獨放入塑料盒中,任其自由探究5 min后迅速置于EPM的中央平臺處,使其頭部正對其中一個開放臂,釋放后即開始記錄下述指標:進入開放臂次數(open arm entry,OE)、進入開放臂時間(open arm time,OT)、進入封閉臂次數(close alm entry,CE)、進入封閉臂時間(close arm time,CT)。由以上指標分別計算出:①進入開放臂和封閉臂的總次數(OE+CE);
1.3.4大鼠腦組織神經遞質檢測①大鼠EPM行為學測試結束后,立即斷頭處死,迅速在冰盤上剪開顱蓋和腦膜,然后分離腦組織,包括海馬、下丘腦、紋狀體,迅速置于液氮中冷凍保存;②取各部分組織置于玻璃勻漿器中,加入少量高氯酸(15%),上下勻漿5 min,將勻漿液轉移至1.5 ml離心管中,用15%高氯酸蕩洗勻漿器,洗液并入離心管,用15%高氯酸定容至1ml。腦組織勻漿12000r/min高速離心6min,取上清液,置入-70℃冰箱冷凍保存待測;③樣品測定時取上清液500μl于離心管中,加入10μg/ml內標3,4-二羥基苯甲胺氫溴酸鹽溶液,渦旋,20μl直接進樣,內標法計算樣品中神經遞質5-HT和DA的含量。流動相:30mmol/L檸檬酸,45mmol/L磷酸二氫鈉,2mmol/L庚烷磺酸鈉,0.3mmol/L乙二胺四乙酸,6%(v/v)乙腈,NaOH調pH 4.00;流速為1.0 ml/min,柱溫為30℃,進樣量20μl。
1.4統計學方法
采用SPSS 18統計學軟件進行數據分析,計量資料以均數±標準差(x±s)表示,實驗組與對照組均數間的比較,在方差齊時選用成組t檢驗,方差不齊時選用校正t檢驗,P<0.05為差異有統計學意義。
2 結果
2.1大鼠行為學測試結果
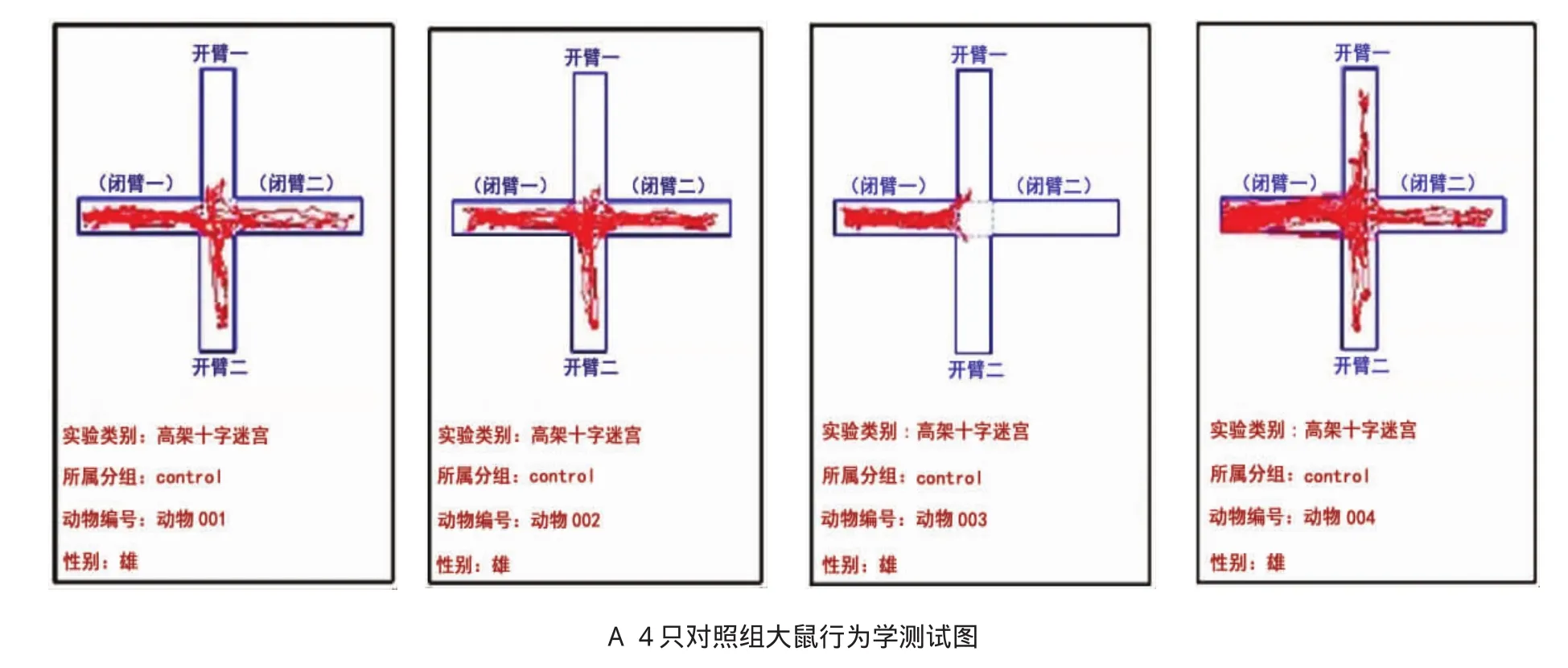
隨機挑選4只對照組大鼠和6只實驗組大鼠進行行為學測試。從EPM視頻采集大鼠運動軌跡分析圖中可知實驗組和對照組大鼠運動軌跡明顯不同。實驗組大鼠進臂總次數為(38.00±7.51)次,對照組大鼠進臂總次數為(14.75±8.62)次,差異有統計學意義(P<0.05),實驗組大鼠進臂總次數高于對照組大鼠進臂總次數。實驗組大鼠進入開臂時間比例為(36.24±12.30)%,對照組大鼠進入開臂時間比例為(21.37±8.32)%,差異有統計學意義(P<0.05),實驗組大鼠進入開臂時間比例比對照組大鼠高。見表1和附圖。
表1 兩組大鼠高架迷宮行為學測試結果(±s)
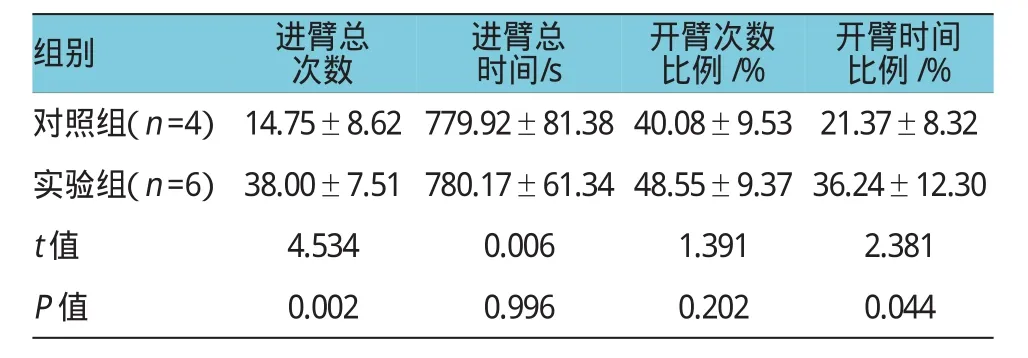
表1 兩組大鼠高架迷宮行為學測試結果(±s)
組別進臂總次數進臂總時間/s開臂次數比例/%開臂時間比例/%對照組(n=4)實驗組(n=6)14.75±8.62 38.00±7.51 779.92±81.38 780.17±61.34 40.08±9.53 48.55±9.37 21.37±8.32 36.24±12.30 t值4.5340.0061.3912.381 P值0.0020.9960.2020.044
2.2SD大鼠腦神經遞質表達水平
兩組大鼠腦組織內神經遞質表達水平明顯不同,實驗組和對照組大鼠海馬內5-HT含量分別為(54.21±19.68)和(147.59±74.63)ng/g,差異有統計學意義(P<0.05),實驗組大鼠海馬內5-HT含量低于對照組。實驗組和對照組大鼠下丘腦內5-HT含量分別為(116.09±57.70)和(577.34±340.97)ng/g,差異有統計學意義(P<0.05),實驗組大鼠下丘腦內5-HT含量低于對照組。實驗組和對照組大鼠海馬內DA含量分別為(18.78±14.08)和(68.34±30.09)ng/g,差異有統計學意義(P<0.05),實驗組大鼠海馬內DA含量低于對照組。實驗組和對照組大鼠紋狀體內DA含量分別為(274.11±180.78)和(736.37±204.68)ng/g,差異有統計學意義(P<0.05),實驗組大鼠紋狀體內DA含量低于對照組,表明腸內代謝物對腦部神經遞質有顯著影響。見表2、3。

附圖 SD大鼠行為學測試結果(軌跡圖)
表2 兩組大鼠腦組織內5-HT含量比較(ng/g±s)
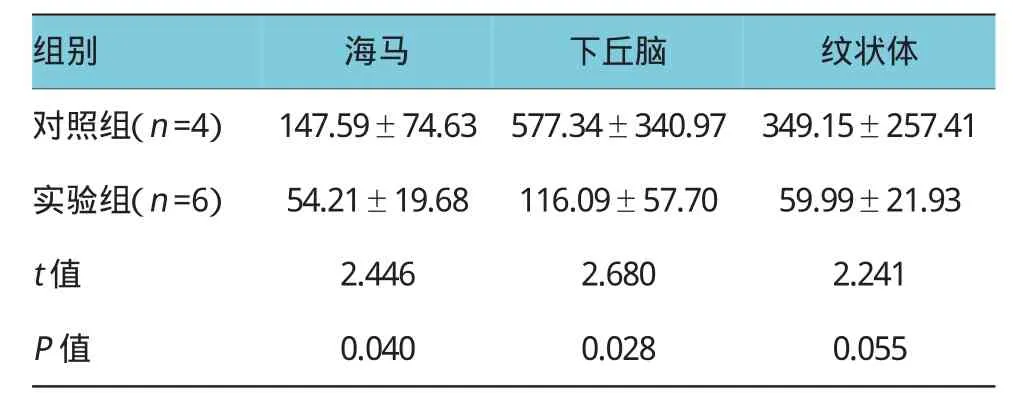
表2 兩組大鼠腦組織內5-HT含量比較(ng/g±s)
組別海馬下丘腦紋狀體對照組(n=4)147.59±74.63577.34±340.97349.15±257.41實驗組(n=6)54.21±19.68116.09±57.7059.99±21.93 t值2.4462.6802.241 P值0.0400.0280.055
表3 兩組大鼠腦組織內DA含量比較(ng/g±s)
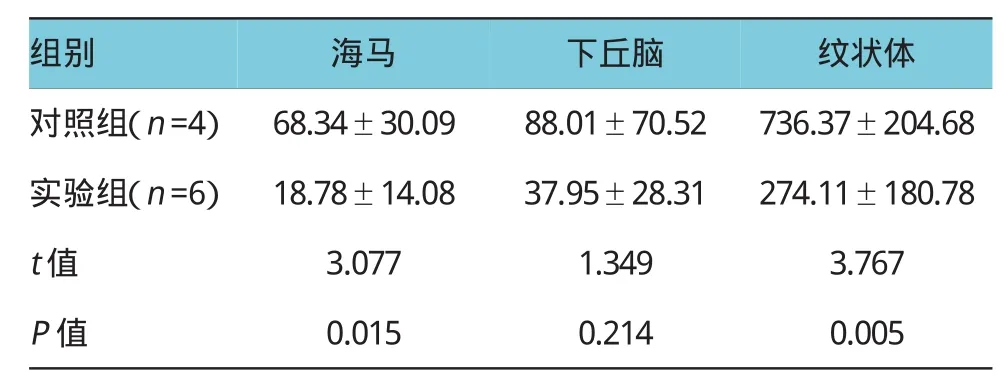
表3 兩組大鼠腦組織內DA含量比較(ng/g±s)
組別海馬下丘腦紋狀體對照組(n=4)68.34±30.0988.01±70.52736.37±204.68實驗組(n=6)18.78±14.0837.95±28.31274.11±180.78 t值3.0771.3493.767 P值0.0150.2140.005
3 討論
本研究以腸內代謝產物對SD大鼠進行腹腔注射,避開腸黏膜屏障,模擬腸黏膜通透性較大時,腸內代謝物易位進入機體內,從而對大鼠行為及神經遞質表達的影響。通過EPM實驗發現,腸內代謝產物可以導致SD大鼠行為學明顯改變,并使腦組織內神經遞質(5-HT、DA)的表達出現顯著變化。
EPM模型為抗焦慮研究中公認的非條件反射模型。以進入開放臂的百分數和在開放臂停留時間的百分數為實驗指標,來反映動物的焦慮狀態。如果一個因素增加動物對開臂的偏愛(即增加進入開臂的次數和在開臂內滯留時間),卻不改變入臂總次數和入臂總時間,即開臂進入次數百分比和開臂滯留時間百分比升高,則認為該因素具有抗焦慮的作用。實驗組與對照組開臂時間比例比較,差異有統計學意義,說明實驗組未出現對照組應有的焦慮狀態。人類和嚙齒類動物的焦慮情緒及焦慮樣行為基本機制可能不同。嚙齒類動物的焦慮樣行為是反應探索和逃避危險之間的平衡。本研究的實驗組比對照組焦慮行為減弱的現象,不能單純的看做抗焦慮作用,可能實驗組大鼠沒有正常大鼠的恐懼感或不能如正常大鼠那樣識別危險,而孤獨癥兒童有時也不能識別危險[14]。因此筆者推測腸內代謝物毒素可能導致大鼠孤獨癥癥狀類似的情緒、行為異常狀態。
5-HT是單胺類中樞神經遞質,通過受體介導調節情緒、睡眠、食欲、痛覺等。DA也是單胺類中樞性神經遞質,通過多巴胺轉運體作用于多巴胺受體,在認知、情感等中樞神經系統功能過程中發揮作用。孤獨癥等精神障礙疾病患者存在腦神經遞質的變化。比如孤獨癥兒童存在單胺類神經遞質異常,部分孤獨癥兒童腦內多巴胺能神經系統存在異常,也有報道稱,孤獨癥兒童腦內5-HT表達出現異常[15-16]。但孤獨癥亞型非常多,病因及患病機制都非常復雜,臨床癥狀也不盡相同,至今仍存在爭論,沒有統一的共識。雖有報道稱,約30%的孤獨癥兒童腦中5-HT較正常兒童高[17],部分患兒腦內多巴胺轉運體增高,可見不是全部孤獨癥兒童都會5-HT過度表達,也不是全部孤獨癥兒童都會多巴胺轉運體增高。而可以肯定的是,該類患者腦神經遞質都會出現或多或少的異常表達。本研究實驗組與對照組比較大鼠海馬中的5-HT、海馬、紋狀體內的DA含量,差異有統計學意義,說明腸內代謝物確實可以導致單胺類神經遞質出現異常表達。
腸道微生物及其代謝產物可以影響腸道黏膜免疫系統,影響腸黏膜屏障功能。正常情況下,腸黏膜有選擇性通透,允許營養物質及部分生物因子通過,阻礙有毒物質的通過。大量研究證明,孤獨癥、焦慮、抑郁等疾病會引起腸道菌群失衡,進而影響腸道黏膜免疫,出現慢性炎癥表現,破壞腸黏膜屏障功能,使腸道通透性增加,允許細菌產物,細胞因子和趨化因子,進入流通和跨血腦屏障,影響大腦和行為[18]。近幾年,研究越來越多地考慮到腸道菌群與腦功能及心理構成之間的相互關系[19]。對于腸道菌群及其代謝物通過菌群腦腸軸來調節大腦的發育及行為表現的研究也越來越深刻。研究發現,可以通過影響小鼠腸道菌群代謝產物來改變其行為[20];增加益生菌可修復腸黏膜屏障,恢復其通透性[21];孤獨癥兒童口服萬古霉素治療可明顯改善其行為、認知及胃腸道癥狀[22]。上述研究都進一步佐證腸道菌群紊亂、腸黏膜屏障受損導致其通透性增大后,腸道微生物及其代謝產物會引起或加重行為學及腦神經遞質的異常變化,即佐證本實驗的科學性、合理性。
在進一步的研究中,筆者將會將不同疾病類型的代謝物通過腹腔注射和大鼠行為學實驗,來驗證不同代謝物對大鼠行為學與神經內分泌的影響,并找出影響大鼠反應的有效物,為各類精神疾病研究與治療提供更為有價值的理論依據,并且筆者會進一步完善實驗方法,比如增加5-HT和DA組織切片,為實驗結論提供更為有說服力的實驗依據。
[1]HIROSHI S,HIDEKO M,TAMON K,et al.Analysis of malodorous substances of human feces[J].Journal of Health Science, 2002,48(2):179-185.
[2]HIROSHI S,TORU H,TAMON K,et al.Analysis of malodorous volatile substances of human waste:feces and urine[J].Journal of Health Science,2001,47(5):483-490.
[3]QIN J,LI R,RAES J,et al.A human gut microbial gene catalogue established by metagenomic sequencing[J].Nature,2010, 464(7285):59-65.
[4]XU J,GORDON J.Inaugural article:honor thy symbionts[J].Proc Nat Acad Sci USA,2003,100(18):10452-10459.
[5]LUNA R A,FOSTER J A.Gut brain axis:diet microbiota inter actions and implications for modulation of anxiety and depression[J]. Current opinion in biotechnology,2015,32(4):35-41.
[6]FORSYTHE P,KUNZE W.Voices from within:gut microbes and the CNS[J].Cell Mol Life Sci,2013,70(1):55-69.
[7]ANASTASIA I,PETRA,SMARO,et al.Gut-microbiota-brain axis and its effect on neuropsychiatric disorders with suspected immune dysregulation[J].Clinical Therapeutics,2015,37(5):984-995.
[8]KANAUCHI O,ANDOH A,MITSUYAMAK.Effects of the modulation of microbiota on the gastrointestinal immune system and bowel function[J].J Agric Food Chem,2013,61(42):9977-9983.
[9]CHEN X,DSOUZA R,HONG S.The role of gut microbiota in the gut-brain axis:current challenges and perspectives[J].Protein Cell,2013,4(6):403-414.
[10]MAGDY E S.Recent developments in the pathophysiology of irritable bowel syndrome[J].World Journal of Gastroenterology, 2015,25:7621-7636.
[11]PARK C H,JOO Y E,CHOI S K,et al.Activated mast cells infiltrate in close proximity to enteric nerves in diarrheapredominant irritable bowel syndrome[J].J Korean Med Sci,2003,18: 204-210.
[12]BUIE T,CAMPBELL D B,FUCHS G J,et al.Evaluation,diagnosis,and treatment of gastrointestinal disorders in individuals with ASDs:a consensus report[J].Pediatrics,2010,125:S1-S18.
[13]SANTOS J,YANG P C,SODERHOLM J D,et al.Role of mast cells in chronic stress induced colonic epithelial barrier dysfunction in the rat[J].Gut,2001,48(5):630-636.
[14]尹愛蘭.Ras/Raf/Erk1/2信號通路過度表達與自閉癥的相關性研究[D].廣東:南方醫科大學,2012.
[15]XU J,XU H,LIU Y,et al.Vanillin-induced amelioration of depressionlike behaviors in rats by modulating monoamine neurotransmitters in the brain[J].Psvchiatrv Res,2015,225(3):509-514.
[16]HAMILTON PJ,CAMPBELL NG,SHARMA S,et al.Drosophila melanogaster:a novel animal model for the behavioral characterization of autism-associated mutations in the dopamine transporter gene[J].Mol Psychiatry,2013,18(12):1235.
[17]AZMITIA E C,SINGH J S,WHITAKER-AZMITIA P M.Increased serotonin axons(immunoreactive to 5-HT transporter)in postmortem brains from young autism donors[J].Neuropharmacology,2011,60(7/8):1347-1354.
[18]BANKS W A,ERICKSON M A.The blood-brain barrier and immune function and dysfunction[J].Neurobiology of Disease, 2010,37(1):26-32.
[19]MAYER E A.Gut feelings:the emerging biology of gut-brain communication[J].Nat Rev Neurosci,2011,12(8):453-466.
[20]LUNA R A,FOSTER J A.Gut brain axis:diet microbiota interactions and implications for modulation of anxiety and depression[J].Current Opinion in Biotechnology,2015,32:35-41.
[21]RAMAKRISHNA B S.Probiotic-induced changes in the intestinal epithelium:implications in gastrointestinal disease[J].Tropical Gastroenterology,2009,30(2):76-85.
[22]SANDLER R H,FINEGOLD S M,BOLTE E R,et al.Short-term benefitfrom oralvancomycintreatmentofregressive-onset autism[J].Journal of Child Neurology,2000,15(7):429-435.
(童穎丹編輯)
Effects of intraperitoneal injection of intestinal metabolite on neurotransmitters and behavior in rats*
Zhi-yu Bai1,Dong-rui Zhou2,Ren-min Zhang2,Na Li2,Zhi-mao Bai3, Hong-lin Zhang4,Li-ling Zhang4,Gui-fen Pang1
(1.Department of Respiratory Medicine,the Affiliated Hospital of Chengde Medical College,Chengde,Hebei 067000,China;2.Research Center for Learning Science,Southeast University,Nanjing,Jiangsu 210000,China;3.School of Public Health,Southeast University,Nanjing,Jiangsu 210000,China;4.Nanjing Xiaozhuang University,Nanjing,Jiangsu 210017,China)
Objective To observe the effects of intestinal metabolites on behavior of rats,and explore its possible mechanism.Methods Fresh feces of healthy children was collected.The intestinal metabolites were extracted with high-speed centrifugation at low temperature.Twenty-six SD rats were randomly divided into 2 groups(10 in control group,16 in experimental group).The rats of the experimental group in the hippocampus and striate body had significant differences between the experimental group and the control group(P<0.05).Conclusions Intestinal metabolites of healthy children can change the behavior of rats,and have certain influence on neurotransmitters in the brain.
intraperitoneal injection of intestinal metabolites(0.5 ml/rat),and the control group rats were treated with normal saline instead.The overhead cross maze experiment was used to observe the differences in behavior between the two groups.And 5-hydroxytryptamine(5-HT)and dopamine(DA)expression levels were determined in the hypothalamus,hippocampus and striate body of the rats.Results There were significant differences in the total number of reaching-in arm[(38.00±7.51)vs(14.75±8.62)]and open arm residence time[(36.24±12.30)vs(21.37±8.32)]bwteen the experimental group and the control group(P<0.05).The content of 5-HT and DA
intestinal metabolite;intraperitoneal injection;behavior;serotonin;dopamine
R 749;R 363
A
10.3969/j.issn.1005-8982.2016.19.004
1005-8982(2016)19-0017-06
2016-03-29
江蘇省蘇州市科技支撐計劃(No:SS201337、SNG201449)
龐桂芬,E-mail:pang-gf@sohu.com

