雙歧桿菌對大鼠抑郁樣行為及單胺神經遞質的影響
羅國帥,楊建立,王承展,司紀劍,王麗莉
(1.天津醫科大學研究生院,天津300070;2.天津市安定醫院精八科,天津300074)
論著
雙歧桿菌對大鼠抑郁樣行為及單胺神經遞質的影響
羅國帥1,楊建立2,王承展1,司紀劍2,王麗莉2
(1.天津醫科大學研究生院,天津300070;2.天津市安定醫院精八科,天津300074)
目的:觀察雙歧桿菌對抑郁模型大鼠行為學及前額葉皮質(PFC)、紋狀體(ST)、杏仁核(AM)、海馬(HIP)等腦區單胺遞質及代謝產物的影響,探討雙歧桿菌潛在的抗抑郁作用及機制。方法:選取成年雄性SD大鼠40只,采用隨機數字表法隨機分為模型組、氟西汀組、雙歧桿菌組、對照組,每組10只,對照組標準環境每籠5只群養6周,另3組釆用連續6周慢性輕度不可預見性應激(CUS)的方法建立慢性抑郁大鼠模型,并于第3周末至第6周末對雙歧桿菌組和氟西汀組分別給予雙歧桿菌和氟西汀灌胃,模型組和對照組給予同體積溶劑灌胃;CUS前、后及干預后以糖水消耗實驗、體質量測量、曠場實驗對大鼠行為進行評估,以庫侖陣列電化學高效液相色譜法測定各組抑郁模型大鼠前額葉(PFC)、紋狀體(ST)、杏仁核(AM)和海馬(HIP)區單胺遞質(NE、5-HT、DA)的濃度及其代謝產物(DOPAC、HVA、5-HIAA)的濃度。結果:(1)CUS后CUS組、雙歧桿菌組、氟西汀組大鼠較對照組大鼠糖水消耗少、體質量增加少、水平運動距離小、直立次數少、糞便粒數多(均P<0.05)。(2)干預后對照組、雙歧桿菌組、氟西汀組大鼠較CUS組大鼠糖水消耗多、體質量增加多、水平運動距離大、直立次數多、糞便粒數少(均P<0.05)。(3)與對照組相比,模型組大鼠PFC、ST、AM、HIP等腦區單胺神經遞質NE、DA和5-HT濃度明顯降低(均P<0.05);與模型組相比,除外AM區5-HT濃度下降(P<0.05),雙歧桿菌組、氟西汀組PFC、ST、AM、HIP等腦區單胺神經遞質DA、NE、5-HT濃度及部分代謝產物的濃度顯著升高(均P<0.05)。結論:雙歧桿菌和氟西汀均可以有效改善抑郁模型大鼠的抑郁行為,并在總體上提高PFC、HIP、AM、ST等腦區單胺神經遞質NE、5-HT、DA的濃度,說明雙歧桿菌抗抑郁作用和可能機制與氟西汀類似。
抑郁癥;雙歧桿菌;大鼠;氟西汀;慢性不可預見性刺激
抑郁癥是一種常見的精神科疾病,它是由各種原因引起的以抑郁情緒為主要癥狀的一組心境障礙或情感性疾病,臨床上主要表現為情緒低落、思維遲緩、興趣喪失、意志活動減退和軀體癥狀等[1]。抑郁癥嚴重危害人類心身健康,已經成為一個全球性公共衛生問題。腸道系統因其獨特的作用機制,被稱為人類的“第二大腦”。2007年底美國國立衛生研究院(NIH)宣布將投入1.15億美元正式啟動“人類微生物組計劃”(Human Microbiome Project,HMP)。近年來隨著對腸道微生物生態學研究的深入,許多研究發現腸道微生物菌群結構與多種慢性病密切相關,如肥胖、心血管疾病、皮膚病、陰道感染、炎癥性腸病(IBD)、結直腸腫瘤以及精神疾病[2]等。有研究顯示,抑郁癥的發生與胃腸炎癥、自身免疫疾病、心血管疾病、神經變性疾病、2型糖尿病以及癌癥等相關,其中與慢性胃腸道炎癥顯著關聯[3]。另一些研究表明,腸道局部炎癥通過細胞因子、神經肽和類花生酸類物質的釋放,亦可影響大腦及其他器官的功能,從而出現抑郁癥狀[4]。這種作用可能是一個雙向機制,提示抑郁癥的發生、發展,可能與腸道微生物的改變有著密切的聯系,抑郁癥的發生原因可能是“腸-腦軸”的功能障礙。然而國內外有關抑郁癥患者腸道微生物的研究并不多。基于以上,我們通過腸道益生菌雙歧桿菌對抑郁模型大鼠進行灌胃干預后行為學、腦組織中5-羥色胺(5-HT)、去甲腎上腺素(NE)和多巴胺(DA)及其代謝產物等濃度的改變,探討雙歧桿菌對抑郁癥的作用,以期找到抑郁癥治療的新方案。
1 材料和方法
1.1材料本研究起止時間為2015年7月1日-10月25日,并經天津醫科大學倫理委員會、天津市安定醫院倫理委員會批準。
1.1.1實驗動物清潔級成年雄性SD大鼠40只(許可證號:SYXK(京)2011-0039,北京維通利華實驗動物技術有限公司),體質量為180~200 g,喂養于濕度40%~50%,溫度(20±2)℃的獨立通氣籠(individual ventilated cages,IVC)系統,晝夜比為12 h/12 h(光照時間為7:00~19:00),食物和水充分供給,自由攝取。大鼠在動物房適應飼養3 d后正式開始實驗。本研究所有對動物的實驗操作,均遵守中國國家科學技術委員會頒布的中華人民共和國《實驗動物管理條例》。
1.1.2藥品及試劑雙歧桿菌:來自天津中醫藥大學現代中藥制劑中心。氟西汀(fluoxetine hydrochloride,FLX):購自禮來蘇州制藥有限公司,劑型20 mg/R。0.9%注射用生理鹽水(0.9%saline,N.S):購自北京化工廠。去甲腎上腺素(NE)、多巴胺(DA)、5-羥色胺(5-HT)、5-羥基吲哚乙酸(5-HIAA)、高香草酸(HVA)、3,4-二羥基苯乙酸(DOPAC):購自Sigma公司。其余試劑均為實驗室自制。
1.1.3主要設備與儀器Med曠場測驗箱:購自美國MED Associates公司;電子秒表(型號HS-80TW-1DF):購自日本CASIO公司;-80℃低溫冰箱(MDF-C8V(N)):購自日本SANYO公司;冷凍高速離心機(Himac CR 22):購自日本HITACHI公司;臺式高速離心機(Eppendorf):購自日本HITACHI公司;組織勻漿器(ModelPR O 2000):購自美國Pro Scientific公司;振蕩儀(Vortex-Genie 2):購自美國Scientific Industries公司;ESAModel5600A-HPLC系統:購自美國惠澤(ESA)公司;AG285電子分析天平等。
1.2方法
1.2.1動物分組40只SD大鼠適應性喂養3 d,按照隨機數字表法分為對照組(Cotrol)、模型組(CUS)、雙歧桿菌組(bifidobacterium,Bif)、氟西汀組(FLX),每組10只。對照組飼養6周,模型組、雙歧桿菌組及氟西汀組單籠孤養并接受6周CUS,于第3周末至第6周末分別給予氟西汀組、雙歧桿菌組以氟西汀、雙歧桿菌灌胃。
1.2.2 CUS參考Liu等[5]的抑郁癥造模方法:隨機給予7種應激因子,每天1種,相同刺激不可連續出現,使大鼠不能預料刺激的發生,以避免產生適應性反應。應激方法包括:熱應激(45℃,5 min/次,每天1次);潮濕墊料24 h;明暗顛倒24 h;夾尾巴(每次1min,尾部近體端1/3處,每天1次);禁食24 h;禁水24 h;電擊足底(電壓60 V,每次電擊10次,每次間隔5 s,每只大鼠每天10次)。
1.2.3干預方法(1)雙歧桿菌給藥劑量:將含有1×1010個活菌細胞的雙歧桿菌粉劑溶于50 mL生理鹽水中,每天早上9:00-10:00灌胃;(2)氟西汀給藥劑量:每天10 mg/kg氟西汀對應激所致的抑郁模型大鼠神經遞質改變有較好的效果[6],因此氟西汀組均以該劑量溶于50 mL生理鹽水中,每天早上9:00-10:00灌胃;(3)對照組及模型組均給予相同體積(50mL)的生理鹽水,每天早上9:00-10:00灌胃。
1.2.4行為評估采用體質量測量、糖水消耗實驗和曠場實驗分別于CUS前后、干預后對大鼠行為進行評估。(1)體質量測量[7]:記錄CUS前體質量,CUS后和干預后分別以本次體質量減上一次體質量,記錄為體質量增加量;(2)糖水消耗實驗[8]:禁水24 h后將所有大鼠均置于單籠內,給與1%濃度蔗糖水200 mL,1 h后取出水瓶并測量剩余糖水體積,糖水消耗量=消耗糖水體積/大鼠體質量×100 g;(3)曠場試驗[9]:曠場設置于暗室,由不透明鋼板制成,大小100 cm×100 cm×40 cm(長×寬×高),實驗時將大鼠置于曠場的中心,由攝像機拍攝,Smart virsion2.5軟件記錄并分析大鼠5 min內的行為并記錄大鼠運動的總路程,人工同步記錄大鼠直立次數、糞便數。實驗之前預跑30 s,每次實驗后打掃曠場,清除糞便,并用醫用酒精擦拭以消除大鼠遺留氣味。
1.2.5大鼠處死及樣本采集(1)大鼠最后一次行為學測試后各組大鼠斷頭取腦,置于預冷的PBS沖液中浸泡5 min,隨即迅速于冰面上分離出前額葉(PFC)、紋狀體(ST)、杏仁核(AM)和海馬(HIP)組織,并根據實驗要求分裝2份于凍存管中,置于液氮中保存待測;(2)庫倫列陣高效液相色譜法測定各組抑郁模型大鼠各腦區單胺遞質(NE、5-HT、DA)的濃度及其代謝產物(DOPAC、HVA、5-HIAA)的濃度。
1.3統計學處理數據錄入后使用excel 2010進行整理,采用SPSS16.0軟件統計分析,以均值±標準差表示,實驗數據均采用單因素方差分析(ANOVA),若存在差異,則進一步進行LSD法兩兩比較。以P<0.05為差異具有統計學意義。
2 結果
2.1 CUS前大鼠行為學評估各組大鼠在糖水消耗量、體質量、水平運動距離、直立次數以及糞便粒數之間,差異均無統計學意義,各組大鼠抑郁樣行為基本一致,結果見表1。
2.2 CUS后大鼠行為學評估第21天后,CUS組、雙歧桿菌組、氟西汀組組間比較顯示,大鼠糖水消耗量、體質量增加、水平運動距離、直立次數、糞便粒數的差異均無統計學意義(P>0.05),3組大鼠抑郁樣行為基本一致;而與對照組比較大鼠糖水消耗量少、體質量增加少、水平運動距離短、直立次數多、糞便粒數多,差異均具有統計學意義(P<0.05),表示CUS組、雙歧桿菌組、氟西汀組大鼠抑郁樣行為較對照組明顯,造模成功,結果見表2。
表1 CUS前各組大鼠行為學測試(±s±s)Tab 1 Behavioral assessment of rats before CUS(±s±s)
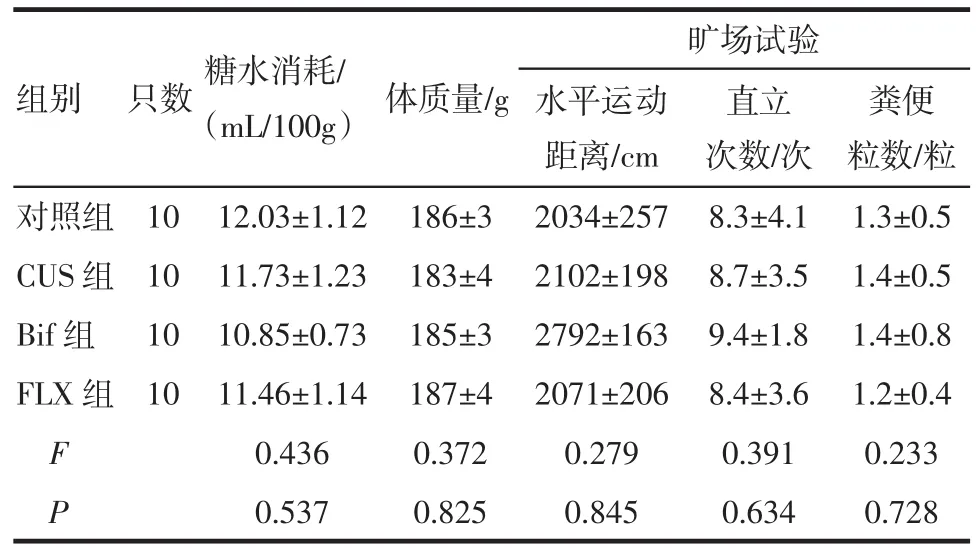
表1 CUS前各組大鼠行為學測試(±s±s)Tab 1 Behavioral assessment of rats before CUS(±s±s)
組別只數糖水消耗/(mL/100g)體質量/g 糞便粒數/粒對照組10 12.03±1.12 186±3 2034±257 8.3±4.1 1.3±0.5 CUS組10 11.73±1.23 183±4 2102±198 8.7±3.5 1.4±0.5 Bif組10 10.85±0.73 185±3 2792±163 9.4±1.8 1.4±0.8 FLX組10 11.46±1.14 187±4 2071±206 8.4±3.6 1.2±0.4 F 0.436 0.372 0.279 0.391 0.233 P 0.537 0.825 0.845 0.634 0.728曠場試驗水平運動距離/cm直立次數/次
表2 CUS后各組大鼠行為學測試(±s±s)Tab 2 Behavioral assessm ent of rats after CUS(±s±s)
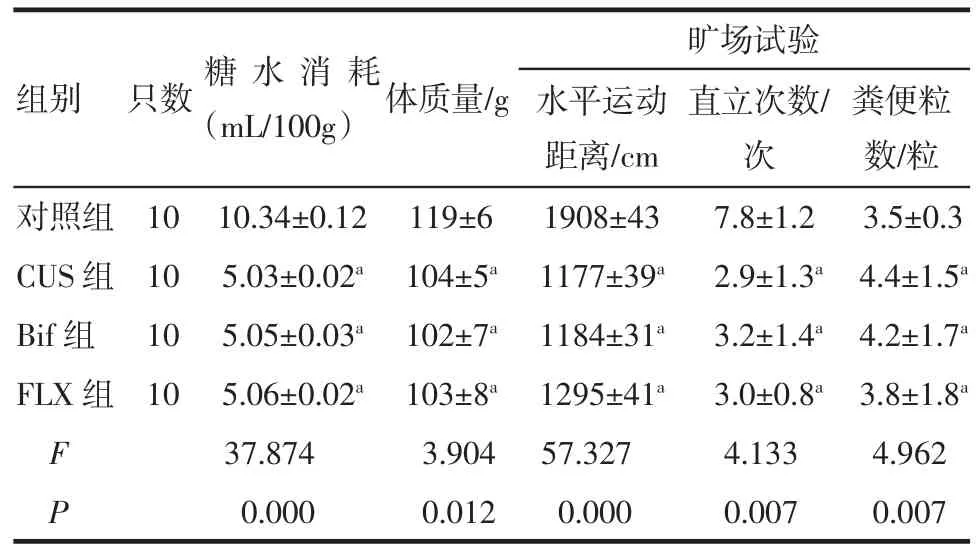
表2 CUS后各組大鼠行為學測試(±s±s)Tab 2 Behavioral assessm ent of rats after CUS(±s±s)
與對照組相比較,aP<0.05
組別只數糖水消耗(mL/100g)體質量/g 糞便粒數/粒對照組10 10.34±0.12 119±6 1908±43 7.8±1.2 3.5±0.3 CUS組10 5.03±0.02a104±5a1177±39a2.9±1.3a4.4±1.5aBif組10 5.05±0.03a102±7a1184±31a3.2±1.4a4.2±1.7aFLX組10 5.06±0.02a103±8a1295±41a3.0±0.8a3.8±1.8aF 37.874 3.904 57.327 4.133 4.962 P 0.000 0.012 0.000 0.007 0.007曠場試驗水平運動距離/cm直立次數/次
2.3干預后大鼠行為評估與CUS組相比,對照組、雙歧桿菌組、氟西汀組的糖水消耗量多、體質量增加多、水平運動距離大、直立次數多、糞便粒數少(均P<0.05)。而雙歧桿菌組、氟西汀組較對照組的糖水消耗量少、體質量增加少、水平運動距離小(均P<0.05),雙歧桿菌組與氟西汀組相比糖水消耗量、體質量增加量、水平運動距離、直立次數、糞便粒數等差異不明顯(均P>0.05),提示CUS組大鼠抑郁樣行為較另外3組明顯,而雙歧桿菌組、氟西汀組抑郁樣行為基本一致但較對照組明顯。結果見于表3。
表3 干預后各組大鼠行為評估結果(±s±s)Tab 3 Behavioral assessm ent of rats after interv-ention(±s±s)
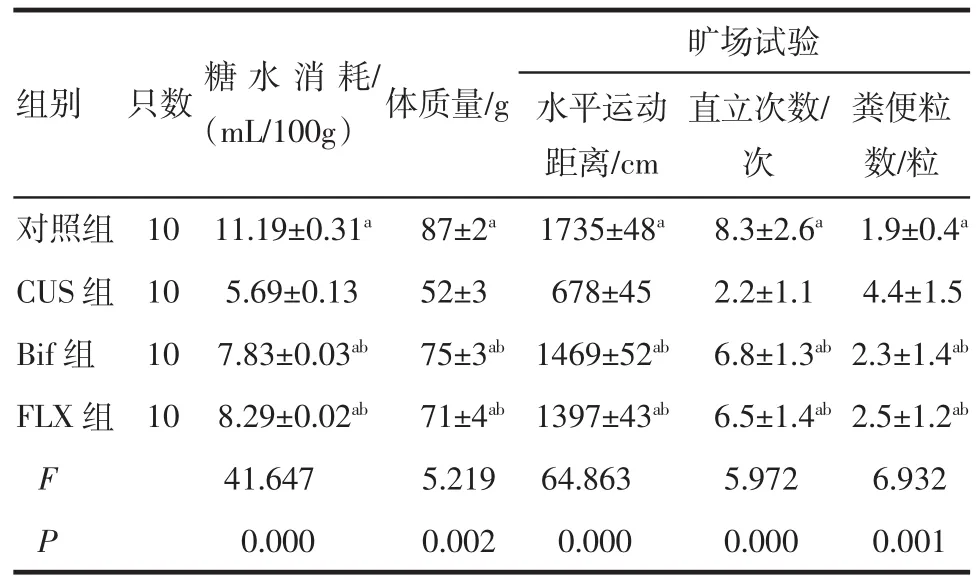
表3 干預后各組大鼠行為評估結果(±s±s)Tab 3 Behavioral assessm ent of rats after interv-ention(±s±s)
與CUS組相比,aP<0.05;與對照組相比,bP<0.05
組別只數糖水消耗/(mL/100g)體質量/g 糞便粒數/粒對照組10 11.19±0.31a87±2a1735±48a8.3±2.6a1.9±0.4aCUS組10 5.69±0.13 52±3 678±45 2.2±1.1 4.4±1.5 Bif組10 7.83±0.03ab75±3ab1469±52ab6.8±1.3ab2.3±1.4abFLX組10 8.29±0.02ab71±4ab1397±43ab6.5±1.4ab2.5±1.2abF 41.647 5.219 64.863 5.972 6.932 P 0.000 0.002 0.000 0.000 0.001曠場試驗水平運動距離/cm直立次數/次
2.4干預后大鼠各腦區單胺類神經遞質及其代謝產物結果分析
2.4.1各組大鼠單胺神經遞質及其代謝產物濃度(DA、NE、5-HT、5-HIAA、DOPAC、HVA)總體上差異顯著(均P<0.05)。與對照組相比,CUS組大鼠PFC區DA、NE、5-HT、5-HIAA、DOPAC、HVA濃度均減少,差異具有統計學意義(均P<0.05);杏仁核區DA、NE、5-HIAA、DOPAC濃度均減少,5-HT濃度增加,差異具有統計學意義(均P<0.05);海馬區DA、NE、5-HT濃度減少,差異顯著(均P<0.05);紋狀體區DA、NE、5-HT、HVA、5-HIAA濃度減少,差異顯著(均P<0.05)。
2.4.2與CUS組相比,雙歧桿菌組、氟西汀組大鼠PFC區單胺神經遞質DA、NE、5-HT濃度增加,5-HIAA濃度減少,差異均具有統計學意義(均P<0.05);杏仁核區DA、NE濃度增加,5-HT、DOPAC濃度減少,差異均具有統計學意義(均P<0.05);海馬區DA、NE、5-HT濃度增加,差異均具有統計學意義(均P<0.05);紋狀體區DA、NE、5-HT、HVA、5-HIAA濃度增加,差異均具有統計學意義(均P<0.05)。
2.4.3與雙歧桿菌組相比,氟西汀組大鼠在PFC區、杏仁核區、海馬區、紋狀體區,DA、NE、5-HT、5-HIAA、DOPAC、HVA濃度增高,但差異不明顯(均P>0.05)。結果見表4、5。
表4 各組大鼠各腦區單胺神經遞質濃度(±s±s)Tab 4 Monoam ine neurotransm itter of brain region in rats(±s±s)
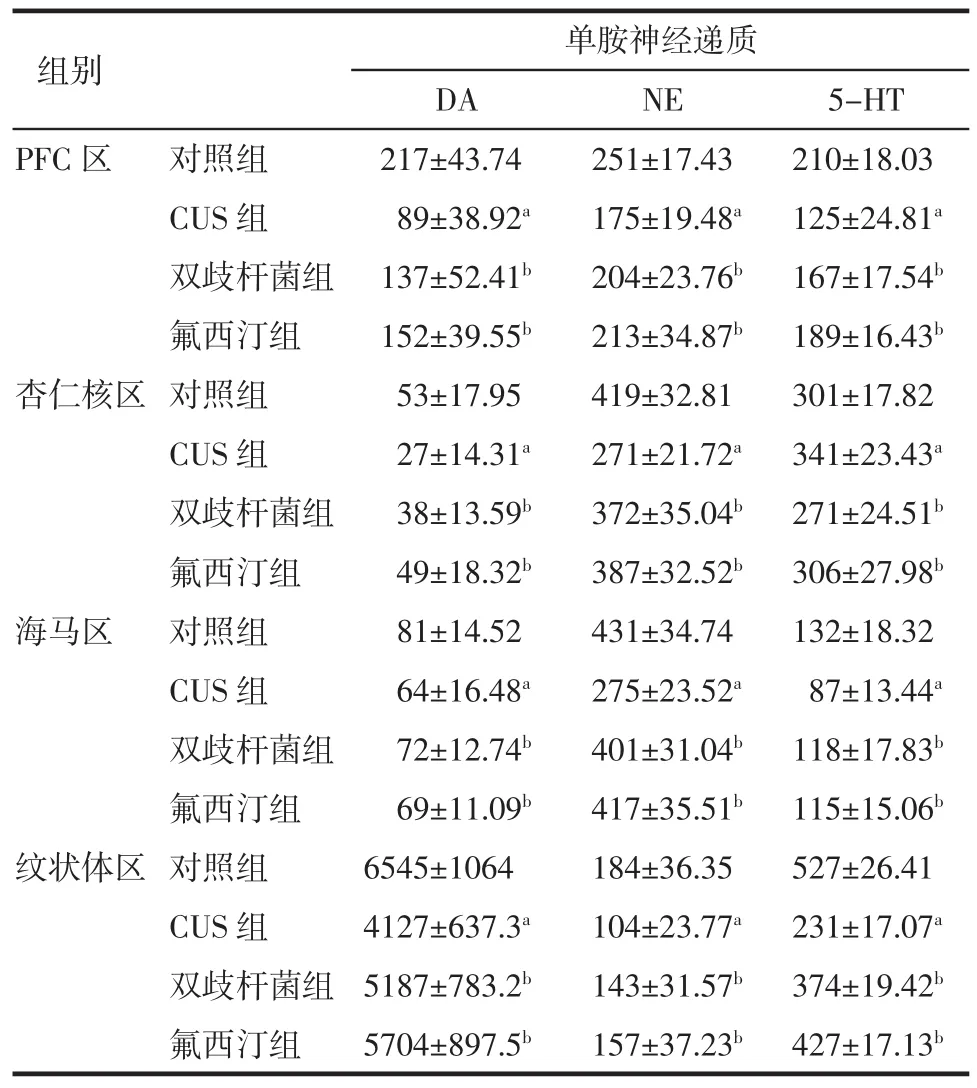
表4 各組大鼠各腦區單胺神經遞質濃度(±s±s)Tab 4 Monoam ine neurotransm itter of brain region in rats(±s±s)
與對照組相比,aP<0.05;與CUS組相比,bP<0.05
組別單胺神經遞質DA NE 5-HT PFC區對照組217±43.74 251±17.43 210±18.03 CUS組89±38.92a175±19.48a125±24.81a雙歧桿菌組137±52.41b204±23.76b167±17.54b氟西汀組152±39.55b213±34.87b189±16.43b杏仁核區對照組53±17.95 419±32.81 301±17.82 CUS組27±14.31a271±21.72a341±23.43a雙歧桿菌組38±13.59b372±35.04b271±24.51b氟西汀組49±18.32b387±32.52b306±27.98b海馬區對照組81±14.52 431±34.74 132±18.32 CUS組64±16.48a275±23.52a87±13.44a雙歧桿菌組72±12.74b401±31.04b118±17.83b氟西汀組69±11.09b417±35.51b115±15.06b紋狀體區對照組6545±1064 184±36.35 527±26.41 CUS組4127±637.3a104±23.77a231±17.07a雙歧桿菌組5187±783.2b143±31.57b374±19.42b氟西汀組5704±897.5b157±37.23b427±17.13b
表5 各組大鼠各腦區神經遞質代謝產物濃度(±s±s)Tab 5 Metabolites of monoam ine neurotransm itter of brain region in rats(±s±s)
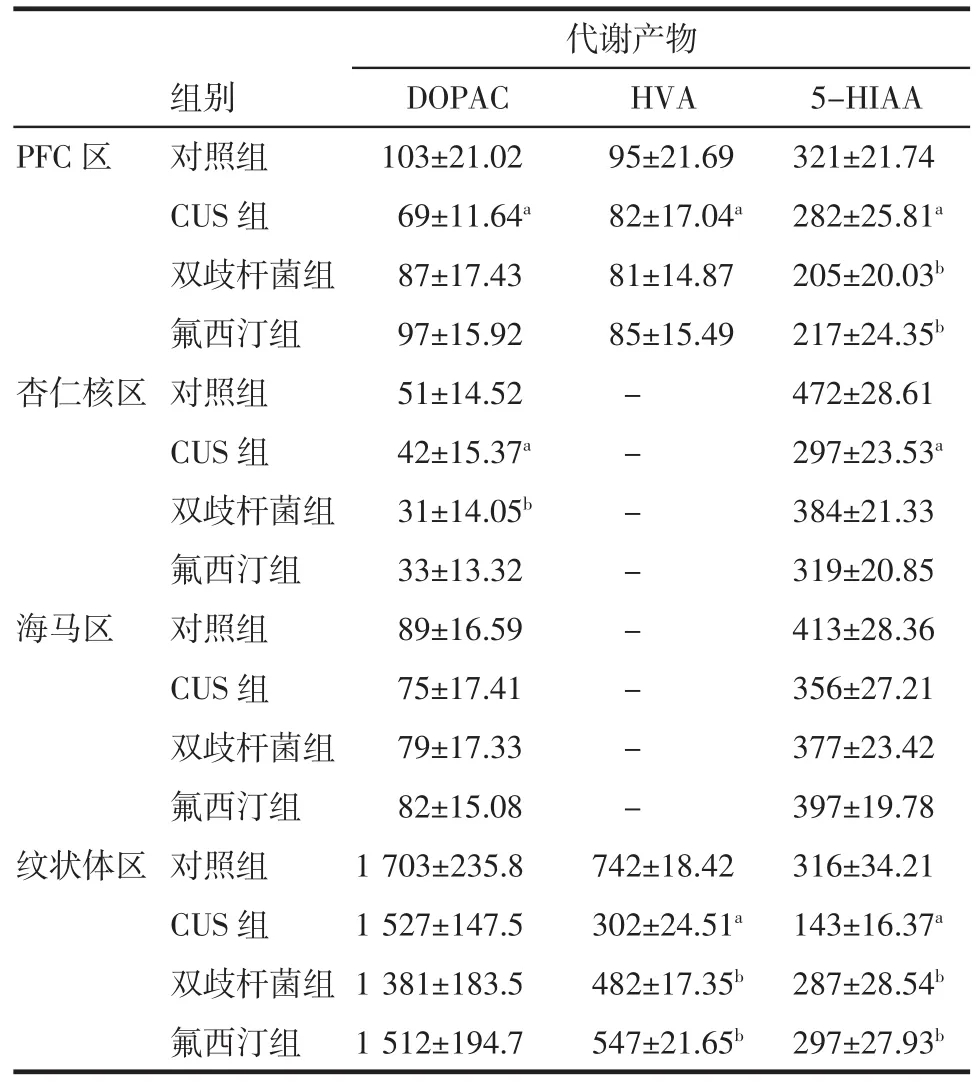
表5 各組大鼠各腦區神經遞質代謝產物濃度(±s±s)Tab 5 Metabolites of monoam ine neurotransm itter of brain region in rats(±s±s)
與對照組相比,aP<0.05;與CUS組相比,bP<0.05
代謝產物組別DOPAC HVA 5-HIAA PFC區對照組103±21.02 95±21.69 321±21.74 CUS組69±11.64a82±17.04a282±25.81a雙歧桿菌組87±17.43 81±14.87 205±20.03b氟西汀組97±15.92 85±15.49 217±24.35b杏仁核區對照組51±14.52-472±28.61 CUS組42±15.37a-297±23.53a雙歧桿菌組31±14.05b-384±21.33氟西汀組33±13.32-319±20.85海馬區對照組89±16.59-413±28.36 CUS組75±17.41-356±27.21雙歧桿菌組79±17.33-377±23.42氟西汀組82±15.08-397±19.78紋狀體區對照組1 703±235.8 742±18.42 316±34.21 CUS組1 527±147.5 302±24.51a143±16.37a雙歧桿菌組1 381±183.5 482±17.35b287±28.54b氟西汀組1 512±194.7 547±21.65b297±27.93b
3 討論
我們根據Desbonnet等[10]的研究,設計了本實驗,結果顯示首次行為評估各組大鼠行為差異無統計學意義;3周CUS后行為提示CUS可引起大鼠抑郁樣行為;干預后的行為評估,CUS組大鼠抑郁樣行為較對照組抑郁樣行為多,提示CUS組抑郁樣行為得到維持;CUS組大鼠抑郁樣行為較雙歧桿菌組、氟西汀組多,提示雙歧桿菌、氟西汀均可能逆轉CUS組大鼠抑郁樣行為。其中,氟西汀對CUS大鼠抑郁樣行為的作用與國內張國棟等[11]的研究一致,雙歧桿菌對CUS組大鼠抑郁樣行為的作用與Desbonnet等的研究一致,雙歧桿菌組與氟西汀組相比差異無統計學意義,提示雙歧桿菌對CUS大鼠抑郁樣行為的逆轉效果與氟西汀類似,這也進一步從行為學方面印證了Desbonnet等的研究結果。
既往研究指出,應激刺激如強迫游泳所產生的行為反應由大腦中神經回路調節,這種調節機制在很大程度上是通過神經內分泌、自主神經系統和免疫系統的作用[12]。Desbonnet等[10]的研究發現,雙歧桿菌可降低外周白細胞介素(IL-6)的釋放,導致正常化的免疫反應,同時細胞因子的濃度改變刺激下丘腦-垂體-腎上腺(HPA)軸,使腦中單胺類神經遞質的含量發生變化。與CUS組大鼠行為學表現相比,雙歧桿菌組在干預后行為學的改變,也是由中樞神經系統調節的。必須強調的是,這種行為學改變已被證明在抗抑郁藥理方面是特別有效的評估[13]。與CUS組相比,雙歧桿菌組、氟西汀組在前額葉區5-HT濃度增加,5-HIAA濃度減少。以往的研究數據充分表明,前額葉皮質血清素調節焦慮和情緒狀態。前額葉區5-HT濃度增加而5-HIAA水平減少,表明這一腦區血清素降解降低,可能由于單胺氧化酶的活性降低。類似額葉皮層5-HIAA水平減少,與多種抗抑郁藥干預Sprague-Dawley大鼠后的研究一致,如丙咪嗪[14]、氟西汀[15]。杏仁核參與大腦對記憶與情感反應的處理,主要功能有產生情緒、識別情緒和調節情緒、控制學習和記憶等。與CUS組相比,雙歧桿菌組、氟西汀組在杏仁核DA濃度增加而DOPAC濃度減少。鑒于有研究顯示,抑郁癥在中腦邊緣系統多巴胺能活性異常[16],有可能雙歧桿菌及氟西汀是通過抑制杏仁核DA代謝來達到抗抑郁作用的。這種結果與一些文獻相悖[17],其結果顯示氟西汀可提高杏仁核DA代謝。所以還需進一步研究來揭示抗抑郁劑對杏仁核DA代謝的作用機制。海馬是應激反應的作用靶區,參與情緒反應、學習、記憶、認知、行為和免疫調節等多種基本生理調節。雙歧桿菌與氟西汀,可以有效提高大鼠大腦ST區NE、5-HT和DA等遞質濃度,而發揮其抗抑郁作用。現有研究表明,這一大腦區域的單胺類神經遞質減少與抑郁癥的發病有關,海馬NE濃度的增加,可以改善抑郁模型大鼠的學習任務[18]。紋狀體作為基底神經節的主要組成部分,包括豆狀核和尾狀核,作為邊緣系統-皮層-紋狀體神經環路的組成部分,參與抑郁癥病理生理改變。CUS組大鼠大腦紋狀體區存在5-HT、DA、NE等神經遞質功能的降低,與CUS組相比雙歧桿菌、氟西汀可以有效提高大鼠大腦紋狀體區5-HT、DA、NE等遞質濃度,并且雙歧桿菌、氟西汀可以改善5-HT的5-HIAA和DA的DOPAC、HVA代謝通路活性,從而發揮其抗抑郁作用。
本研究的不足之處:(1)樣本量較小,仍需更多、更可靠的研究結果支持雙歧桿菌對抑郁癥的治療效果;(2)初步闡明雙歧桿菌抗抑郁的神經內分泌機制,仍需從免疫學、影像學、基因組學等方面進一步探討。
[1]沈漁邨.精神病學[M].北京:人民衛生出版社,2009:548
[2]Qin J,Li Y,Cai Z,et a1.A metagenome-wide association study of gut microbiota in type 2 diabetes[J].Nature,2012,490(7418):55
[3]周政,王巧民,宋繼中.腸易激綜合征與抑郁癥關系研究[J].安徽醫藥,2009,13(3):337
[4]Song C,Wang H.Cytokines mediated inflammation and decreased neurogenesis in animal models of depression[J].Prog Neuropsychopharmacol Biol Psychiatry,2011,35(3):760
[5]Liu D,Wang Z,Gao Z,et al.Effects of curcumin on learning and memory deficits,BDNF,and ERK protein expression in rats exposed to chronic unpredictable stress[J].Behav Brain Res,2014,271:116
[6]Bianchi M,Shah A J,Fone K C,et al.Fluoxetine administration modulates the cytoskeletal microtubular system in the rat hippocampus[J].Synapse,2009,63(4):359
[7]Ge J F,Qi C C,Zhou J N.Imbalance of leptin pathway and hypothalamus synaptic plasticity markers are associated with stressinduced depression in rats[J].Behav Brain Res,2013,249:38
[8]郭曉云,崔東紅,傅迎美,等.文拉法辛對慢性輕度應激鼠海馬基因表達的基因芯片研究[J].中華精神科雜志,2011,44(3):169
[9]葉緣苑,王高華,王惠玲,等.腦源性神經營養因子對慢性不可預見性溫和應激大鼠行為和海馬膠質纖維酸性蛋白表達的影響[J].中華精神科雜志,2012,45(5):299
[10]Desbonnet L,Garrett L,Clarke G,et al.Effects of the probiotic Bifidobacterium infantis in the maternal separation model of depression[J].Neuroscience,2010,170(4):1179
[11]張國棟,董嬌,李晏,等.慢性應激抑郁模型大鼠海馬組織S100B表達及氟西汀的干預作用[J].中華行為醫學與腦科學雜志,2013,22(11):978
[12]Herman J P,Cullinan W E.Neurocircuitry of stress:central control ofthe hypothalamo-pituitary-adrenocorticalaxis[J].Trends Neurosci,1997,20(2):78
[13]Cryan J F,Page M E,Lucki I.Differential behavioral effects of the antidepressants reboxetine,fluoxetine,and moclobemide in a modied forced swim test following chronic treatment[J].Psychopharmacology,2005,182(3):335
[14]Xu Y,Ku J S,Yao H Y,et al.Antidepressant effects of curcumin in the forced swim test and olfactory bulbectomy models of depression in rats[J].Pharmacol Biochem Behav,2005,82(1):200
[15]Shishkina G T,Iudina A M,Dygalo N N.Effects of fluoxetine on locomotor activity:possible involvement of dopamine[J].Zh Vyssh Nerv Deiat Im I P Pavlova,2006,56(4):523
[16]Klimek V,Schenck J E,Han H,et al.Dopaminergic abcontrolities in amygdaloid nuclei in major depression:a postmortem study[J].Biol Psychiatry,2002,52(7):740
[18]Srikumar B N,Raju T R,Shankaranarayana Rao BS.The involvement of cholinergic and noradrenergic systems in behavioural recovery following oxotremorine treatment to chronically stressed rats[J].Neuroscience,2006,143:679
(2016-02-04收稿)
Effect of bifidobactera on behavior and monoam ine neurotransm itters in rats w ith unpredictable chronic stress
LUO Guo-shuai1,YANG Jian-li2,WANG Cheng-zhan1,SI Ji-jian2,WANG Li-li2
(1.Graduate School,Tianjin Medical University,Tianjin 300070,China;2.The Eighth Department of Psychiatry,Tianjin Anding Hospital,Tianjin 300074,China)
Objective:To investigate the changes in the behavior and the monoamine neurotransmitters in prefrontal cortex(PFC),striatum(ST),amygdala(AM)and hippocampus(HIP),and to explore the anti-depressive effect and the possible mechanisms related to bifidobacteria.M ethods:Forty male SD rats were divided into chronic unpredictable stress(CUS)group,control group,bifidobacteria group(Bif),fluoxetine group(FLX)and random ly according to random number table(n=10 each).Rats in CUS group,Bif group and FLX group were all fed separately and
CUS for 6 weeks.Rats in control group were fed in groups(5 rats in every cage)in standard environment for 6 weeks.Rats in Bif group and FLX group had a lavage with bifidobacteria and fluoxetine respectively during the last 3 weeks every day,while the CUS group and control group were given the same volume of solvent.Each rat went through a behavioral assessment before and after CUS and after intervention.Behavioral assessment included sucrose water consumption test,weight measurement and open field test(horizontal moving distance,number of vertical,number of faece).The concentration of the monoamine neurotransmitters(NE,5-HT,DA)and its metabolites(DOPAC,HVA,5-HIAA)in prefrontal cortex(PFC),striatum(ST),amygdala(AM)and hippocampus(HIP)with CoulArray HPLC were measured at last.Results:(1)Behavioral assessment after CUS:consumption of sucrose water,gain of body weight,distance of horizontal moving and number of vertical of rats in CUS group,Bif group and FLX group were all less than rats in control group,while the number of faece were more than rats in control group.(2)Behavioral assessment after intervention:consumption of sucrose water,gain of body weight,distance of horizontal moving and number of vertical of rats in control group,Bif group and FLX group were all higher than rats in CUS group while the number of faece were less than rats in control group.(3)Neurotransmitter index:Compared with the control group,the CUS group had significantly decreased monoamine neurotransmitter NE,DA and 5-HT and some of its metabolites in the brain region PFC,ST,AM and HIP.Compared with the CUS group,Bif group and FLX group had significantly increased monoamine neurotransmitter NE,DA and 5-HT and some of its metabolites in the brain region PFC,ST,AM and HIP(except the 5-HT decreased significantly in AM).
Conclusion:Bifidobactera and fluoxetine can effectively improve the depressive behavior of the CUS rats,increase the content of monoamine neurotransmitter NE,5-HT,DA and its metabolites in the PFC,AM,ST and HIP brain regions,indicating that the antidepressant effect and possible mechanism of bifidobactera is similar to fluoxetine and may be related to the neurotransmitters.
depression;bifidobactera;rats;fluoxetine;chronic unpredictable stress
R749
A
1006-8147(2016)05-0401-05
羅國帥(1988-),男,碩士在讀,研究方向:精神病的發病機制及臨床治療;通信作者:楊建立,E-mail:yangjianli0722@163.com。
[17]楊怡.茶氨酸對抑郁模型大鼠行為學、神經遞質的影響[D].長沙:中南大學,2013.10.7666/d.y2423469

