動脈瘤性蛛網膜下腔出血后并發腦血管痙攣的影響因素
時 雷
山東泰安市中醫醫院神經外科 泰安 271000
?
動脈瘤性蛛網膜下腔出血后并發腦血管痙攣的影響因素
時 雷
山東泰安市中醫醫院神經外科 泰安 271000
目的 探討動脈瘤性蛛網膜下腔出血(aSAH)后并發腦血管痙攣(CVS)的影響因素。方法 回顧性分析237例aSAH患者的臨床資料,對比并發CVS和無CVS患者的年齡、性別、Hunt-Hess分級、Fisher分級、血壓、血脂、白細胞計數等資料,并將有統計學意義的影響因素進行多因素Logistic回歸分析,確定獨立危險因素和保護因素。結果 237例aSAH患者中65例并發CVS,發生率27.43%;并發CVS和無CVS患者嗜煙、高血脂、高血壓、白細胞計數升高、Hunt-Hess分級≥Ⅲ級、Fisher分級≥Ⅲ級、使用小劑量尼莫地平差異有統計學意義(P<0.05);Logistic回歸分析顯示,嗜煙、高血脂、高血壓、白細胞計數升高、Hunt-Hess分級≥Ⅲ級、Fisher分級≥Ⅲ級是aSAH患者出血后并發CVS的獨立危險因素(P<0.05),而使用小劑量尼莫地平是其保護因素(P<0.05)。結論 臨床對于嗜煙、高血脂、高血壓、白細胞計數升高、Hunt-Hess分級和Fisher分級較高的aSAH患者應加強早期監測,積極防治CVS的發生。
動脈瘤性蛛網膜下腔出血;腦血管痙攣;危險因素
動脈瘤性蛛網膜下腔出血(aneurysmal subarachnoid hemorrhage,aSAH)是因腦血管有動脈瘤的存在,且由于某些事件導致動脈瘤破裂而發生出血,血液順著解剖路徑流入蛛網膜下腔的一種腦血管病癥[1]。腦血管痙攣(cerebral vasospasm,CVS)是aSAH最為嚴重的一種并發癥,可引起局部腦組織嚴重的缺血缺氧,嚴重者甚至發生腦梗死,對患者的生命健康造成嚴重的威脅[2]。因此,了解aSAH后并發CVS的相關危險因素,對該病的防治、降低aSAH患者的致死和致殘率具有積極意義。本研究通過回顧性分析我院收治的237例aSAH患者的臨床資料,分析aSAH患者并發CVS的危險因素,為該病的防治提供科學依據。
1 資料與方法
1.1 一般資料 回顧性分析我院2012-07—2015-07收治的237例aSAH患者的臨床資料,男68例,女169例,年齡31~80(54.37±11.4)歲。入選標準:(1)入院經顱腦CT檢查明確診斷為蛛網膜下腔出血,并經數字減影血管造影(DSA)或CT血管造影顯像檢查確診有腦血管動脈瘤;(2)無其他臟器嚴重疾病;(3)住院時間>7 d。237例aSAH患者中65例并發CVS,發生率27.43%,男21例,女44例;無CVS患者172例,男47例,女125例。
1.2 CVS診斷標準 患者發病后3周內,經積極的治療病情基本穩定后再出現病情加重和惡化,經超聲檢查顱部內大腦中動脈血流≥120 cm/s,且加重的癥狀不能以腦部血腫、水腫、出血、電解質紊亂等進行解釋,即判定為CVS。
1.3 觀察指標 對比并發CVS和無CVS患者的年齡、性別、煙酒嗜好,高血壓、高血脂、高血糖史和現狀,動脈瘤所在部位、WBC計數、血鈣、血鈉、血小板計數、Hunt-Hess分級、Fisher分級、尼莫地平(0.2~0.5 mg/h)使用情況等。Hunt-Hess分級按臨床表現分為Ⅰ~Ⅴ級:Ⅰ級為無癥狀或僅有輕微頭痛癥狀或頸強直癥狀;Ⅱ級為頭痛和頸強直明顯,其余神經麻痹癥狀不明顯;Ⅲ級為患者出現意識障礙,有嗜睡、煩躁不安等;Ⅳ級為患者接近昏迷、不能活動、有早期去皮質強直、出現植物神經障礙;Ⅴ級為患者深度昏迷、有去皮質強直、處于瀕死狀態。Fisher分級依照顱部CT檢查結果判定:Ⅰ級為無積血;Ⅱ級為積血厚度<1 mm,無血凝塊;Ⅲ級為積血厚度≥1 mm;Ⅳ級為顱內出現血腫或有腦室內出血。
1.4 統計學處理 使用SPSS 17.0統計軟件進行統計分析,率的比較使用卡方檢驗,危險因素的相關程度分析使用多因素Logistic回歸分析,P<0.05為差異有統計學意義。
2 結果
2.1 并發CVS的單因素分析 并發CVS和無CVS患者嗜好吸煙、高血脂、高血壓、白細胞計數升高、Hunt-Hess分級≥Ⅲ級、Fisher分級≥Ⅲ級、使用小劑量尼莫地平差異有統計學意義(P<0.05)。見表1。
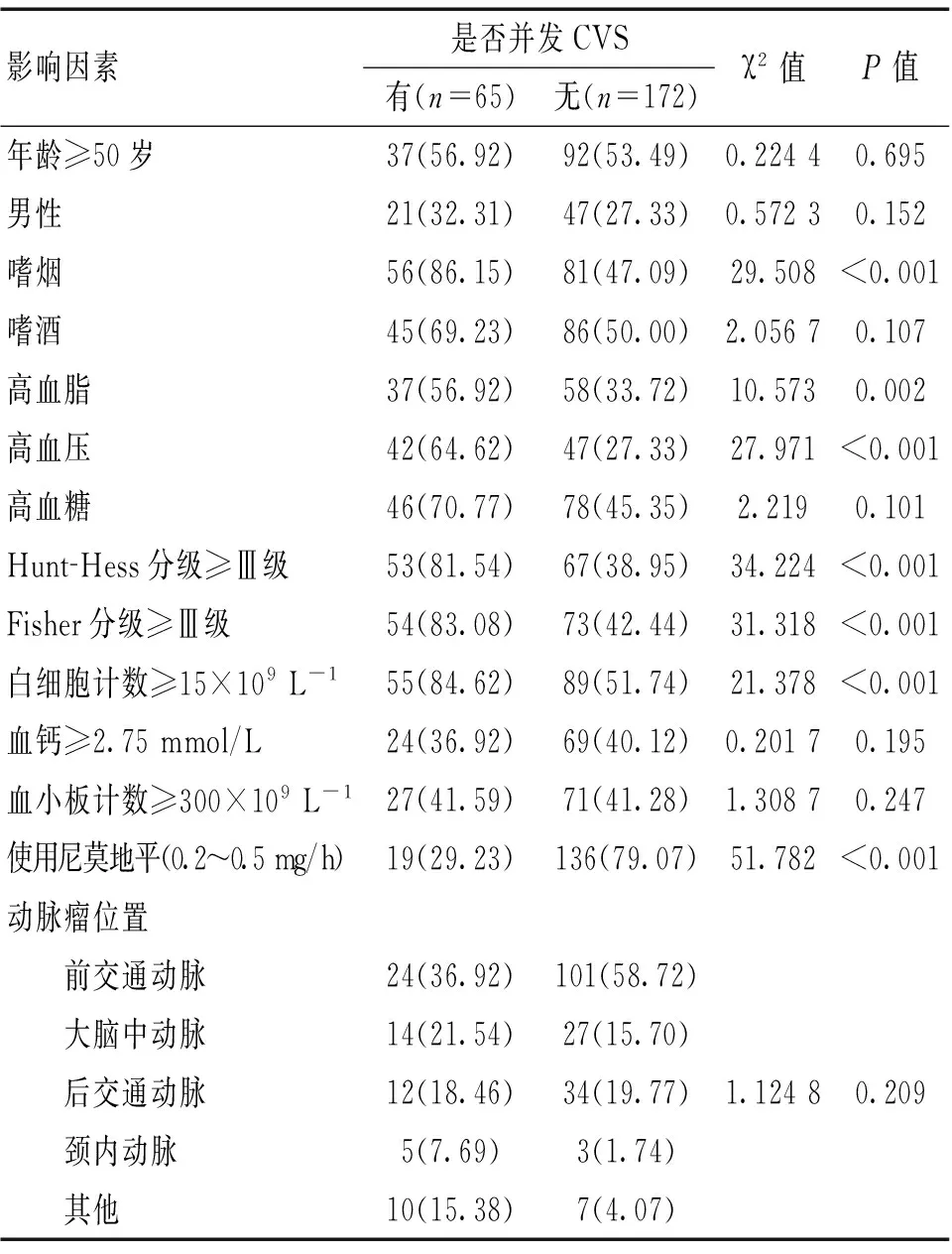
表1 并發CVS與無CVS患者的臨床資料對比 [n(%)]
2.2 Logistic回歸分析 以具有統計學意義的影響因素作為自變量,以發生CVS與否作為應變量,納入Logistic回歸方程分析,結果顯示,嗜煙、高血脂、高血壓、白細胞計數升高、Hunt-Hess分級≥Ⅲ級、Fisher分級≥Ⅲ級均是aSAH患者并發CVS的獨立危險因素(P<0.05),而使用小劑量尼莫地平是其保護因素(P<0.05)。見表2。
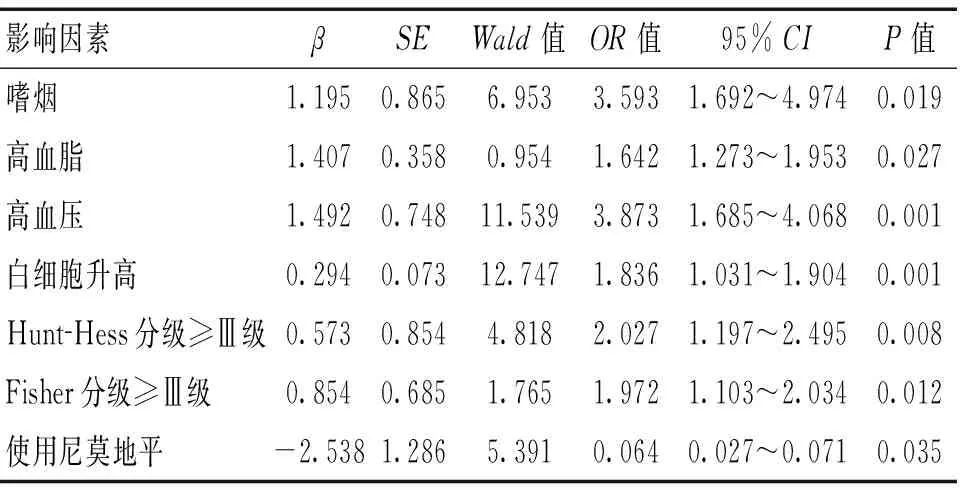
表2 aSAH后并發CVS的多因素Logistic回歸分析
3 討論
導致蛛網膜下腔出血的原因包括動脈瘤、高血壓、動脈硬化、顱腦腫瘤、動脈炎、血液病、顱底異常血管網癥等,但其中最主要的原因是顱內動脈瘤破裂導致。文獻[3-5]顯示,aSAH后并發CVS的幾率20%~50%,也有文獻[6]報道整體發生率50%左右,估計發生率20%~100%。本研究顯示,CVS發生率27.43%,相對來說較低,可能是由于本組研究對象的Hunt-Hess分級和Fisher分級多為Ⅲ級,而達到Ⅳ級的患者相對較少。發生CVS的患者往往癥狀較為嚴重,可出現腦梗死癥狀,其致殘和致死率均較高,致殘的患者往往生活自理能力差,甚至發生癱瘓,認知功能也嚴重下降。因此,尋找到較確定的aSAH后并發CVS的危險因素和保護因素,能夠為該病的預防和治療提供較好的理論支撐。
本研究單因素及多因素Logistic回歸分析顯示,嗜煙、高血脂、高血壓、白細胞計數升高、Hunt-Hess分級≥Ⅲ級、Fisher分級≥Ⅲ級是aSAH患者出血后并發CVS的獨立危險因素,而使用小劑量尼莫地平是其保護因素。其中,高血壓患者發生aSAH后并發CVS的相對危險度為3.873,吸煙患者發生aSAH后并發CVS的相對危險度為3.593,與李喜鵬、張翼等[7-8]的報道相似。分析原因:高血壓患者由于平常的血壓值較高,對血管壁的不良刺激增加,使得血管壁變薄或損傷。而嗜好吸煙的患者血管易受煙霧中一氧化碳、焦油等的刺激,導致血管長期處于缺氧狀態,在高血壓刺激和缺氧的刺激下血管脆性增加,容易硬化,導致動脈瘤的形成,且患者的血管對于刺激的敏感性較強,動脈瘤破裂后發生應激反應,體內釋放氧合血紅蛋白、組胺等物質可能導致血管強烈收縮從而發生CVS。
本研究中高血脂患者出現aSAH后并發CVS的相對危險度為1.642,而Leclerc等[9]研究顯示,高血脂不是aSAH后并發CVS的獨立危險因素,這可能與本研究樣本含量較小有關,對于高血脂是否為一項獨立因素有待于進一步研究。Ostrowski等[10]研究顯示,CVS患者白細胞可在血管壁黏附聚集,將CVS患者離體的白細胞注射入實驗小鼠腹腔能夠引起CVS的發生,且當白細胞總數超過15×109L-1時,患者發生CVS的風險可增高數倍。本研究顯示,白細胞計數升高時,發生CVS的相對危險度為1.836。白細胞能夠在人體發生感染、炎癥、應激時大量增加,能夠合成和釋放白細胞介素、組織胺與5-羥色胺等多種細胞因子,而組織胺、5-羥色胺等具有較強烈的收縮血管作用,因此,aSAH伴白細胞升高可能更容易并發CVS。
Fisher分級較高是發生CVS的危險因素,文獻[11-13]顯示,FisherⅢ、Ⅳ級患者發生CVS的幾率高達90%以上,而FisherⅠ、Ⅱ級患者發生CVS的幾率僅10%~20%,本研究結果顯示,Fisher分級≥Ⅲ級患者的OR值為1.972。Fisher分級是反映蛛網膜下腔積血量的指標,積血量越多則Fisher的分級越高,說明患者的病情程度越嚴重,體內產生的對血管具有刺激作用的組胺等物質可能更多,機體耐受能力也更差,從而更容易發生CVS,因此可以確定Fisher分級越高,患者發生CVS的危險性越大。文獻[14]顯示,Hunt-Hess分級(Ⅳ~Ⅴ)是患者發生CVS的獨立危險因素。本文顯示,Hunt-Hess分級≥Ⅲ級的患者,其并發CVS的相對危險度是其他患者的2.027倍。Hunt-Hess分級是評估神經功能的分級,可用于評價aSAH患者嚴重程度,一般患者大腦神經功能越差,Hunt-Hess分級越高。大腦神經功能較差,表示機體自我平衡調節能力不佳,發生aSAH后,其神經調節可能發生紊亂,從而導致CVS發生。
尼莫地平作為一種較新型的鈣離子通道阻滯劑,臨床用于CVS的治療較常見,本研究將其前瞻性地用在發生CVS前,結果顯示,使用尼莫地平的患者相對未使用尼莫地平的患者,多因素Logistic回歸分析OR值為0.064,提示小劑量預防性使用尼莫地平是CVS的保護因素。
CVS作為aSAH后出現的一種嚴重并發癥,影響因素較多,發生的機制也相當復雜,其中還有較多不甚明了之處[15],有待于在該領域進行更多深入的研究。另外,患者發病后盡早入院、入院后選擇合適的時機手術以及早期加強相關危險因素的監測等能夠提升患者預后。本研究為回顧性分析,且樣本含量較小,具有一定的局限性,有待于今后深入研究和完善。
[1] 張鈴鐺,宋毅,馮清林,等.蛛網膜下腔出血患者繼發癥狀性腦血管痙攣的相關危險因素分析[J].中國卒中雜志,2014,9(5):394-398.
[2] Sehba FA,Hou J,Pluta RM,et al.The Importance of Early Brain Injury after Subarachnoid Hemorrhage[J].Prog Neurobiol,2012,97(1):14-37.
[3] 黃國棟,李維平,付友增,等.顯微手術治療顱內動脈瘤后腦血管痙攣和預后的影響因素分析[J].中華神經醫學雜志,2011,10(7):705-708.
[4] Brown RJ,Kumar A,Dhar R,et al.The Relationship Between Delayed Infarcts and Angiographic Vasospasm After Aneurysmal Subarachnoid Hemorrhage[J].Neurosurgery,2013,72(5):702-708.
[5] 郭文才,吳勇,李銳,等.顱內動脈瘤性蛛網膜下腔出血術后癥狀性腦血管痙攣的影響因素分析[J].中國現代醫生,2015,53(5):7-9.
[6] 王琳璽,廉慶北,徐善才,等.動脈瘤性蛛網膜下腔出血的治療進展與探討[J].現代生物醫學進展,2015,15(13):2 540-2 542;2 502.
[7] 李喜朋.動脈瘤性蛛網膜下腔出血后腦血管痙攣的影響因素[J].南方醫科大學學報,2010,30(4):917-918.
[8] 張翼,陳繼華,夏明萬,等.動脈瘤性蛛網膜下腔出血患者死亡的相關因素分析[J].中國當代醫藥,2014,21(12):34-36.
[9] Leclerc JL,Blackburn S,Neal D,et al.Haptoglobin phenotype predicts the development of focal and global cerebral vasospasm and may influence outcomes after aneurysmal subarachnoid hemorrhage[J].Proc Natl Acad Sci USA,2015,112(4):1 155-1 160.
[10] Ostrowski RP,Zhang JH.Hyperbaric Oxygen for Cerebral Vasospasm and Brain Injury Following Subarachnoid Hemorrhage[J].Transl Stroke Res,2011,2(3):316-327.
[13] D'Souza S.Aneurysmal Subarachnoid Hemorrhage[J].J Neurosurg Anesthesiol,2015,27(3):222-240.
[11] 戴永建,羅俊杰,劉岳,等.蛛網膜下腔出血致腦血管痙攣的相關影響因素研究[J].現代中西醫結合雜志,2015,24(6):646-648.
[12] 張震宇,葉新運,蔣秋華,等.重癥動脈瘤性蛛網膜下腔出血后危險因素的Logistic回歸分析[J].吉林醫學,2012,33(9):1 848-1 849.
[14] Dabus G,Nogueira RG.Current Options for the Management of Aneurysmal Subarachnoid Hemorrhage-Induced Cerebral Vasospasm:A Comprehensive Review of the Literature[J].Interv Neurol,2013,2(1):30-51.
[15] Garzon-Muvdi T,Pradilla G,Ruzevick JJ,et al.A Glutamate Receptor Antagonist,S-4-Carboxyphenylglycine(S-4-CPG),Inhibits Vasospasm After Subarachnoid Hemorrhage in Haptoglobin 2-2 Mice[J].Neurosurgery,2013,73(4):719-728.
(收稿2015-09-25)
R743.35
A
1673-5110(2016)19-0043-03

