基于碘酸鉀基準試劑直接法配制碘標準溶液
晁 輝,戴興德
(甘肅醫學院, 甘肅 平涼 744000)
?
基于碘酸鉀基準試劑直接法配制碘標準溶液
晁 輝,戴興德
(甘肅醫學院, 甘肅 平涼 744000)
本文基于碘酸鉀基準試劑完成碘標準溶液直接配制,建立了一種快速配制碘標準溶液的新方法,操作簡單,安全性高.基于此法測定了市售維生素C樣品中抗壞血酸含量,RSD=0.18%,回收率在98.38%~100.8%之間,快速準確,穩定性好.
碘酸鉀;碘標準溶液;抗壞血酸;滴定
當前,分析化學實驗教材中碘標準溶液配制均采用間接法[1-3],即在碘化鉀強制溶解后用三氧化二砷基準物質標定或標準硫代硫酸鈉標準液比較標定.三氧化二砷劇毒,學生實驗很少使用;硫代硫酸鈉溶液穩定性差且配制麻煩,在配置過程中易造成誤差累積;碘溶液易揮發,難保存,配制時所用試劑多,操作費時.采用碘酸鉀基準試劑直接法配制碘標準溶液,完成抗壞血酸含量測定,實驗結果符合滴定分析要求[4].
1 實驗部分
1.1 實驗用品
1mol/L鹽酸,0.5%淀粉指示劑,抗壞血酸,碘化鉀,維生素C片.
1.2 實驗原理
5I-+IO3-+6H+=3I2+3H2O
CI2=3×CKIO3
C6H8O6+I2=C6H6O6+2HI
mC6H8O6=CI2VI2×176×10-3
1.3 配制方法
碘酸鉀標準溶液(0.1675mol/L):精密稱定3.5667g經105℃烘干2小時的碘酸鉀(優級純),溶解于水,移入100mL容量瓶中,再用水定容.
碘標準溶液(0.05000mol/L):稱取碘化鉀固體6.0g,加水溶解后,準確移入10.00mL碘酸鉀標準溶液,加鹽酸10mL,充分攪拌,轉移至100mL容量瓶,加水定容,靜置1分鐘.
1.4 滴定方法
準確稱取0.15~0.3g抗壞血酸標準物質(維生素C藥劑),加新煮沸且已冷卻的純化水溶解,加入2mL淀粉指示劑.用新配制碘標準溶液滴定,當溶液變藍且1分鐘內顏色不消失,即達到終點.計算抗壞血酸質量,并進行方法學驗證.
2 結果與討論
2.1 酸性條件選擇
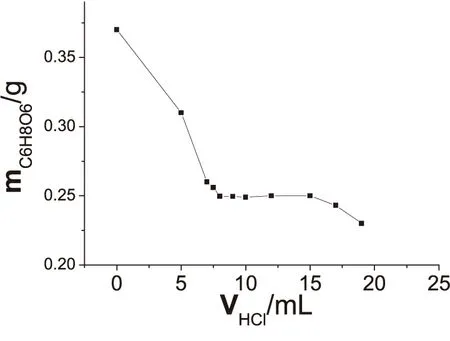
圖1 鹽酸加入量對測定結果影響
KIO3與I-的反應必須在酸性條件下進行,準確稱取0.2500g抗壞血酸標準物質,改變混合液中的鹽酸加入量,按1.4步驟操作,結果見圖1.當
VHCl<8mL時,溶液酸度太低,KIO3氧化能力減弱,所得碘溶液濃度偏小,造成正誤差;VHCl=9~15mL時,所測結果比較穩定,誤差控制在0.2%以內;當VHCl>15mL時,高酸度導致部分碘離子被氧化,所得碘溶液濃度偏大,測定結果誤差反向增大.故可選取鹽酸溶液加入量為10mL.
2.2 KI用量選擇
準確稱取0.2500g抗壞血酸標準物質,改變KI用量,按1.4步驟操作,結果見圖2.當KI用量超過4g時,滴定誤差較小并趨于恒定,誤差損失小于0.2%,滿足容量分析的要求;當KI用量低于4g時,碘酸鉀反應不徹底,碘溶解不均勻,標準溶液用量偏大,出現了明顯正誤差,顯然,碘酸鉀與抗壞血酸有反應,但反應計量關系復雜;KI用量增加基本無影響.因此,本實驗確定KI用量為6g.
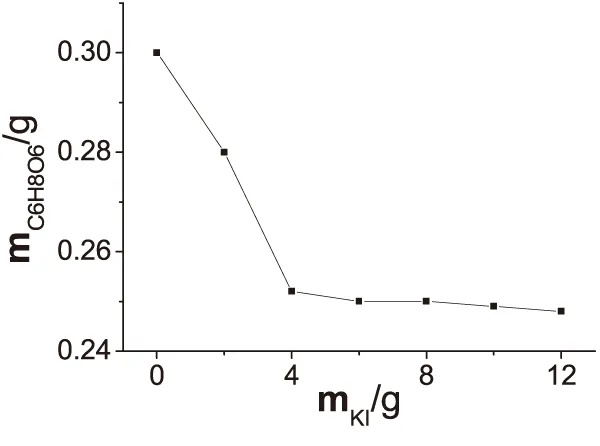
圖2 碘化鉀加入量對測定結果影響
2.3 靜置時間選擇
改變混合液靜置時間,用新制碘標準溶液測定同質量抗壞血酸標準樣品(m=0.2000g),所得結果表明,靜置時間對測定結果影響不大,但若放置時間過長,測定結果略有偏小(圖3),即碘濃度變大,故可將碘酸鉀標準溶液(0.1675mol/L)作為儲備液,碘標準溶液隨用隨配.
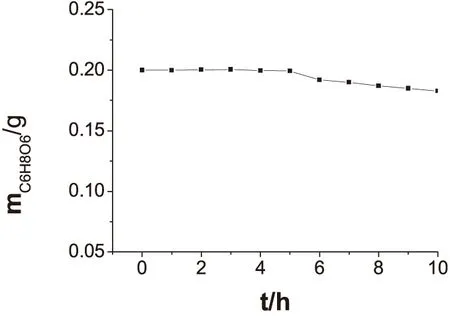
圖3 新制碘標準溶液靜置時間對測定結果影響
2.4 精密度考察
2.5 加樣回收試驗

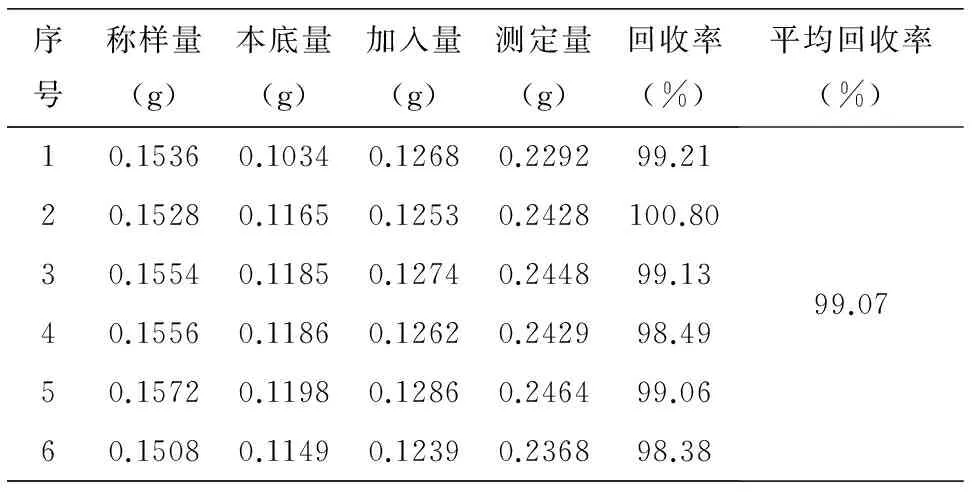
表1 加樣回收率測定
3 結論
基于碘酸鉀基準試劑完成碘標準溶液直接配制,避免使用強毒性物質三氧化二砷和穩定性較差的硫代硫酸鈉溶液,克服存放過程中碘溶液揮發損失,隨用隨配,操作簡化,安全性高,值得推廣應用.
[1]劉燕娥.分析化學[M].西安:第四軍醫大學出版社,2012:97-98.
[2]王仁國.無機及分析化學實驗[M].成都:四川科學技術出版社,2003:130-131.
[3]武漢大學.分析化學實驗[M].武漢:武漢大學出版社,2003:131-132.
[4]武漢大學.分析化學[M].北京:高等教育出版社,2005:16-18.
(責任編輯:王海波)
10.13877/j.cnki.cn22-1284.2016.08.019
2016-05-10
晁輝,男,本科,實驗師.
戴興德,學士,副教授.
G808
A
1008-7974(2016)04-0058-02

