siRNA干擾FOXF2對人宮頸癌SiHa細胞體外轉移的影響
劉麗敏++++++史文娟++++++何芳++++++伍雪梅
[摘要]目的 研究siRNA干擾叉頭框轉錄因子F2(FOXF2)對人宮頸癌SiHa細胞體外轉移能力的影響及其作用機制。方法 采用RT-PCR、Western blot分別檢測siRNA-FOXF2轉染前后,SiHa細胞中FOXF2 mRNA、蛋白的表達變化;同時用劃痕試驗和Transwell侵襲試驗分別檢測siRNA-FOXF2轉染前后細胞的遷移和侵襲能力,CCK8檢測siRNA-FOXF2轉染前后細胞的增殖能力。結果 SiHa細胞內FOXF2敲除后,RT-PCR、WB檢測顯示siRNA-FOXF2轉染組FOXF2的蛋白、mRNA均明顯下降;劃痕試驗和Transwell侵襲試驗顯示細胞侵襲、遷移能力增強;CCK8檢測顯示siRNA-FOXF2轉染組促進細胞增殖能力(P<0.01)。結論 siRNA干擾FOXF2促進SiHa細胞的體外轉移能力及細胞增殖能力,進而促進宮頸癌的發生發展。
[關鍵詞]宮頸癌;叉頭框轉錄因子F2;SiHa細胞;細胞遷移;細胞侵襲;細胞增殖
[中圖分類號] R737.3 [文獻標識碼] A [文章編號] 1674-4721(2017)03(c)-0004-04
[Abstract]Objective To explore the effect of siRNA silencing FOXF2 on invitro metastasis of human cervical carcinoma SiHa cells and its mechanism.Methods The expression of FOXF2 mRNA and protein in SiHa-siRNA-FOXF2 cells and negative control cells were detected by RT-PCR and Western blot respectively. The migration and invasion ability of cells were detected by wound-healing assay and Transwell assay before and after siRNA-FOXF2 transfection.CCK8 was used to detect the proliferation of cells before and after siRNA-FOXF2 transfection.Results The expression of FOXF2 mRNA and protein in siRNA-FOXF2 transfected group was significantly decreased after FOXF2 knockout in SiHa cells by RT-PCR and WB detection;the invasion and migration were enhanced by wound-healing assay and transwell assay.After transfection of siRNA-FOXF2 into cervical cancer SiHa cell lines,the capability of cell proliferation was significantly enhanced (P<0.01).Conclusion siRNA-FOXF2 can promote the invitro metastasis and proliferation of SiHa cells,and promote the development of cervical cancer.
[Key words]Cervical cancer;FOXF2;SiHa cells;Cell invasion;Cell migration;Cell proliferation
宮頸癌是臨床常見的婦科惡性腫瘤,其發病率居女性惡性腫瘤第3位,死亡率居第4位[1],且發病趨勢呈低齡化[2]。目前主要的治療方法是宮頸癌根治術和放化療,其對早期患者的治愈率高達80%~95%,但對于晚期和復發轉移的患者仍無令人滿意的治療方法。因此,從分子水平研究宮頸癌的發病和預防機制,采取針對性的靶向治療迫在眉睫。叉頭框轉錄因子F2(forkhead boxF2,FOXF2)蛋白為FOX轉錄因子家族中的成員之一,主要存在于泌尿道、呼吸道和消化道等系統器官的鄰近上皮間質細胞,其參與細胞外基質(extracellular matrix,ECM)合成[3]、胚胎及組織發育[4]以及上皮與間質之間的相互轉化[5]等。有研究報道,FOXF2的低表達與乳腺癌的發生和轉移密切相關[6],FOXF2高表達于正常前列腺組織和前列腺良性腫瘤,低表達于前列腺癌及淋巴結轉移[7-8]。但目前有關FOXF2基因在宮頸癌分子機制研究的相關報道較少。本研究旨在探討FOXF2干擾宮頸癌SiHa細胞的分子機制,為臨床治療宮頸癌的靶點提供理論依據,現報道如下。
1材料與方法
1.1材料
人宮頸癌細胞株SiHa購自中國科學院上海生命科學研究院生物化學與細胞生物學研究所細胞庫;DMEM購自美國Gibco;胎牛血清(fetal bovine serum,FBS,natocor)、Transwell小室購自美國Corning公司。轉染試劑脂質體Lipofectamine TM 3000(LTP03000)和OptiMEMⅠ Medium購自美國Invitrogen公司;Matrigel基質膠購自美國BD公司。FOXF2 siRNA由上海吉瑪制藥技術有限公司合成,包含3對目的siRNA,1對陰性對照siRNA。Si-FOXF2 1415序列為:5′-GCGUCUGUCAGGAUAUUAATT-3′;Si-FOXF2 1305序列為:5′-GCAUCACUCUACUCCAGUGTT-3′;Si-FOXF2 650序列為:5′-CCAGCGAGUUCAUGUUCGATT-3′;干擾陰性對照組siRNA序列為:5′-UUCUUCGAACGUGUCACGUTT-3′,RT-PCR試劑Takara,日本。
1.2方法
1.2.1細胞培養 SiHa細胞復蘇后,加入含10%FBS、100 U/ml青霉素及100 μg/ml鏈霉素的DEME中培養,置入37℃、5%CO2培養箱內,24 h內換液。取對數生長期的細胞,用0.25%胰酶消化、傳代、凍存。
1.2.2細胞轉染 將培養SiHa細胞分為5組:轉染陰性對照組(陰性)、Si-FOXF2 1415組(1415)、Si-FOXF2 1305組(1305)、Si-FOXF2 650組(650)及未經任何處理的SiHa細胞作為對照組(NC)。轉染前一天將SiHa細胞接種于6孔板中,轉染時細胞融合達到30%~50%,PBS清洗3遍,每孔加入900 μl無血清培養基。將5 μl的siRNA和3 μl的Lipo3000分別與50 μl的OptiMEMⅠMedium混懸,輕輕混勻后靜置5 min。將含有siRNA和Lipo3000的OptiMEMⅠ Medium輕輕混勻后靜置20 min。將每孔100 μl混勻的DNA脂質體復合物均勻滴入含有無血清培養基的細胞中。48 h后終止提樣。
1.2.3 RT-PCR檢測各組FOXF2 mRNA的表達 終點提取RNA,采用紫外/可見光分光光度儀測量細胞樣品總RNA的濃度和純度[D(260 nm)/D(280 nm)分析RNA濃度在1.9~2.1之間提示RNA質量良好]。隨后按Takara反轉錄試劑盒說明書將RNA逆轉錄為cDNA。設計引物序列為:FOXF2上游:5′-TCGCTGGAGCAGAGCTACTT-3′;下游:5′-CCCATTGAAGTTGAGGACGA-3′;GAPDH上游:5′-CGGAGTCAACGGATTTGGTCGTAT-3′,下游:5′-AGCCTTCTCCATGGTGGTGAAGAC-3′。最終獲得轉染率最高的SI-FOXF2序列。
1.2.4蛋白印跡法檢測篩選后的3組FOXF2蛋白的表達 按上述方法轉染細胞,分為Si-FOXF2陰性對照組、Si-FOXF2組和未經任何處理的SiHa細胞作為對照組。72 h后用全蛋白提取試劑盒(江蘇凱基生物技術股份有限公司,南京)提取蛋白,BCA蛋白試劑盒(北京康為世紀生物科技有限公司,北京)測蛋白濃度,以GAPDH為內參,按10%分離膠、6%濃縮膠濃度制膠,按濃縮膠80 V、分離膠120 V恒壓電泳,200 mA轉膜1 h,5%BSA封閉2 h,TBST洗滌后孵一抗(兔抗人FOXF2 1∶1000,兔抗人GAPDH 1∶10000,Abcam)4℃過夜,次日洗滌后二抗(羊抗兔1∶2000,CST)1 h,洗滌,ECL顯影(merckmillipore)。實驗重復3次。
1.2.5細胞劃痕實驗 待轉染后細胞數達90%生長融合時,用200 μl移液槍頭沿培養板底部呈一字型劃痕,用PBS洗3遍,換上無血清的培養基,分別于培養0、12、24、36、48 h在倒置顯微鏡下(10×10)測量劃痕的寬度。細胞遷移率(%)=(1-即時劃痕寬度/原始劃痕寬度)×100%。
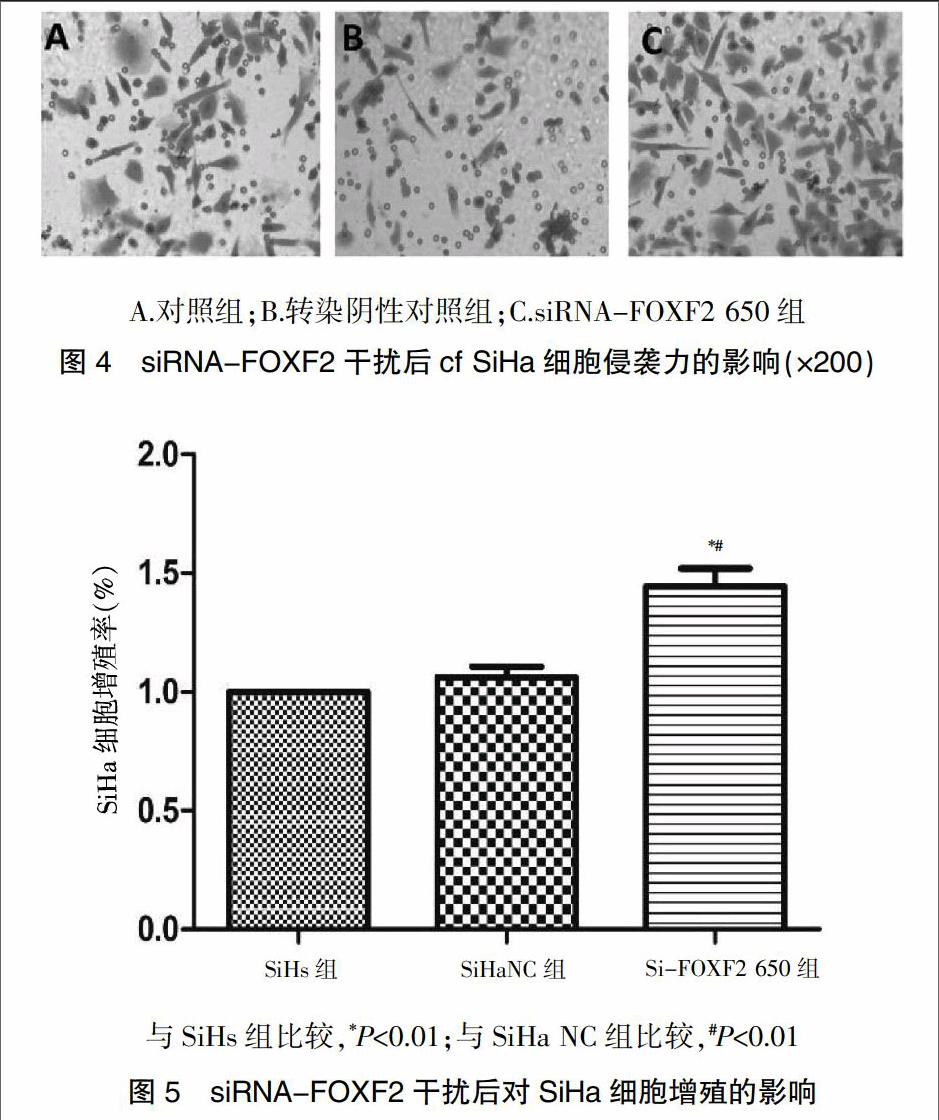
1.2.6 Transwell侵襲試驗 用50 μl Matrigel稀釋液(1∶4)包被Transwell小室。取Si-FOXF2陰性對照組(Si-Ha NC組)、Si-FOXF2 650組和未處理SiHa組(SiHs組)的細胞,用無血清培養基重懸細胞,上室加入200 μl(3×104)細胞懸液,下室加入含20%FBS的DMEM培養液500 μl,每組重復3孔,培養箱內常規培養48 h。取出小室,PBS洗滌3遍,4%多聚甲醛固定30 min,PBS洗滌3遍,用棉簽擦去上室細胞,結晶紫染色30 min,洗滌,倒置,風干,顯微鏡下拍照。每個濾膜隨機選取5個200倍視野,計數穿膜細胞數,以此表示腫瘤細胞的侵襲能力。
1.2.7 CCK8檢測細胞增殖實驗 取轉染24 h后Si-FOXF2陰性對照組(SiHs組)、si-FOXF2 650組和未處理SiHa組的細胞(SiHa Nc組),用10%FBS血清培養基重懸細胞,在96孔板中加入100 μl(9×103)的細胞懸液,將培養板在培養箱預培養24 h。PBS洗滌3遍,將每孔加入10 μl CCK8及90 μl無血清培養液的混合液,避光,將培養板在培養箱內孵育1~4 h。酶標儀測定450 nm處的吸光值。計算細胞活性公式:細胞增值率(%)=[處理組D(450 nm)-空白孔D(450 nm))/(空白對照組D(450 nm)-空白孔D(450 nm)]×100%。
1.2.8統計學處理 采用GraphPad Prism軟件進行統計分析,計量資料用均數±標準差(x±s)表示,組間比較采用t檢驗。以P<0.05為差異有統計學意義。
2結果
2.1 siRNA-FOXF2干擾對SiHa細胞FOXF2 mRNA表達的影響
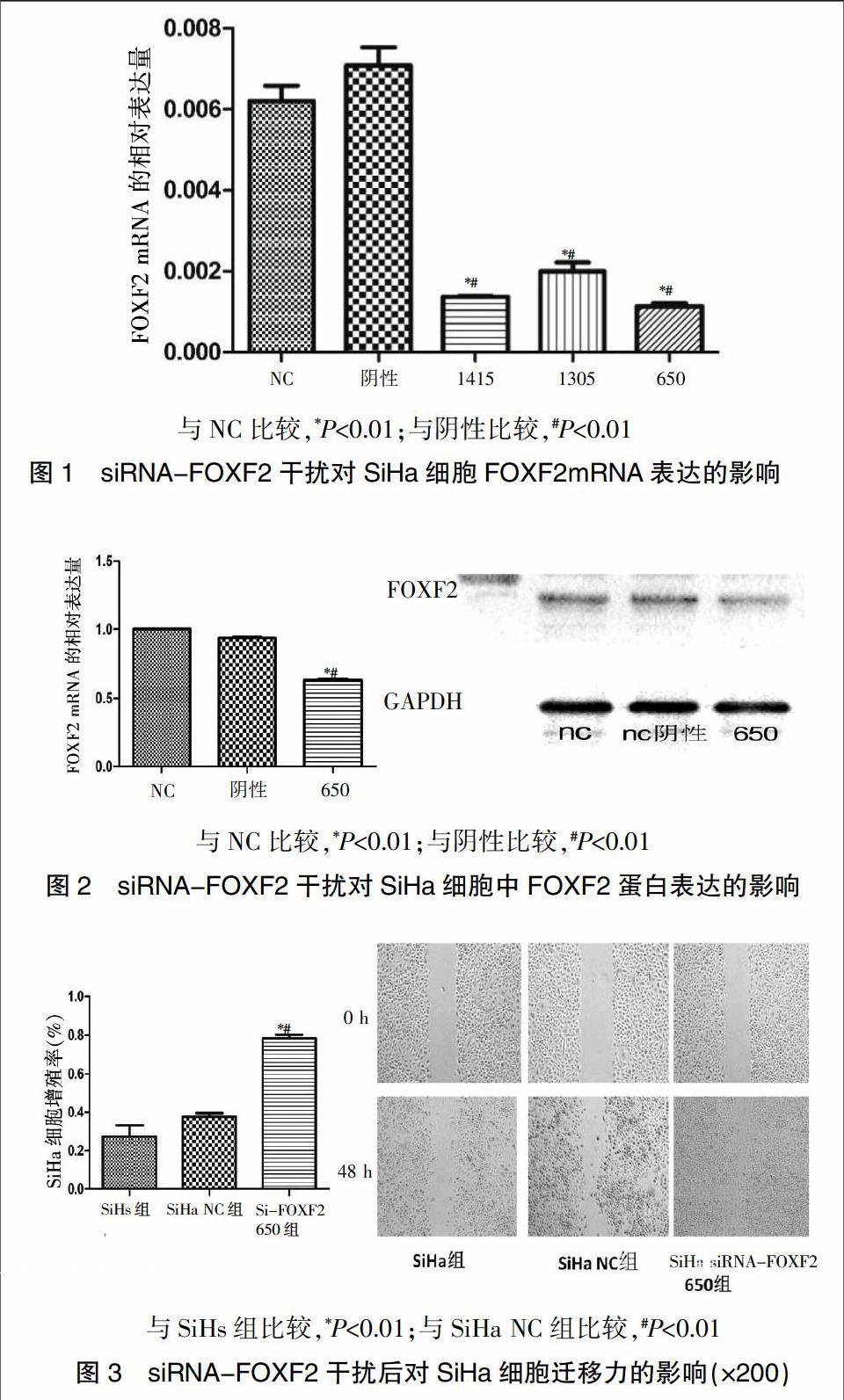
RT-PCR結果顯示:3對目的siRNA-FOXF2干擾后FOXF2 mRNA較轉染陰性對照組及對照組明顯下降(70%~85%),siRNA-FOXF2 650鏈下降最明顯,差異有統計學意義(P<0.01)。選取siRNA-FOXF2 650鏈進行后續實驗(圖1)。
2.2 siRNA-FOXF2干擾對SiHa細胞FOXF2蛋白表達的影響
Western blot結果顯示:siRNA-FOXF2 650干擾后,siRNA-FOXF2 650組細胞FOXF2蛋白表達水平明顯低于轉染陰性對照組及對照組,差異有統計學意義(P<0.01),進一步證實轉染成功(圖2)。
2.3 siRNA-FOXF2干擾對SiHa細胞遷移力的影響
細胞劃痕試驗顯示,siRNA-FOXF2干擾后,siRNA-FOX F2 650組細胞的遷移能力明顯高于轉染陰性對照組及對照組(P<0.01)(圖3)。
2.4 siRNA-FOXF2干擾對SiHa細胞侵襲力的影響
Transwell侵襲試驗顯示,轉染組穿過小室濾膜的SiHa細胞數明顯多于轉染陰性對照組及對照組,即siRNA-FOXF2 650組細胞侵襲能力高于轉染陰性對照組及對照組(圖4)。
2.5 CCK8檢測siRNA-FOXF2干擾對SiHa細胞增殖的影響
CCK8實驗結果顯示:siRNA-FOXF2 650組細胞增殖率明顯高于陰性轉染對照組及對照組(P<0.01)(圖5)。
3討論
宮頸癌嚴重威脅女性健康,發病率逐漸上升,僅次于乳腺癌,且呈現年輕化趨勢[9-10]。宮頸癌的侵襲性強,發生盆腔轉移的宮頸癌患者其術后復發率約為70%[11]。宮頸癌變是外源性和內源性多個致癌因素致使抑癌基因失活以及致癌基因激活作用下形成的一個漫長復雜的過程[12]。臨床追蹤觀察所顯示,一般從宮頸癌前病變逐漸演變成宮頸癌的時間大約為10年[13]。從這一時間來看宮頸癌是可以預防、早期發現且可以治愈的腫瘤。防治的突破點在于宮頸癌前病變的及時發現、及時治療,阻斷其向宮頸癌的進一步發展,因此探索宮頸癌發生及發展的分子機制對于宮頸癌的治療有著至關重要的意義。
FOXF2基因位于人染色體6p25.3,編碼一含有444個氨基酸的DNA結合蛋白,其分子量大約為46 KD[14]。FOXF2是間質特異性的轉錄因子,主要存在于泌尿道、呼吸道和消化道等器官的鄰近上皮間質細胞,其參與ECM合成[3]、胚胎及組織發育[4]、以及上皮與間質之間的相互轉化[5]等。FOXF2通過調節細胞的極性進而維持組織的穩態,其在胚胎發育及組織分化的過程中發揮著重要作用[15]。FOXF2作為FOX家族中的一員,對抑制惡性腫瘤的發生發展起著重要的作用,而且發現FOXF2在許多惡性腫瘤中的表達較低[16],而且FOXF2的低表達加快了腫瘤的生長、進展,預示著患者預后較差[17]。也有研究報道FOXF2基因低表達能夠促進小鼠腸道腺瘤的形成和生長[18]。siRNA干擾FOXF2在小細胞肝癌中促進細胞增殖和抗細胞凋亡[6],這與本研究結果一致,干擾FOXF2后促進SiHa細胞的遷移、侵襲、增殖。siRNA干擾FOXF2,促進細胞的侵襲及增殖,加快腫瘤的發展,預示著預后不良。從這一角度為宮頸癌轉移的分子機制提供了理論證據。但本研究仍有一定的局限性,僅在體外細胞水平得到了驗證,體內實驗有待進一步驗證,進而判斷其是否可以作為臨床評估宮頸癌的預后指標。下一步將研究上調FOXF2基因對宮頸癌SiHa細胞作用的分子機制,進而為FOXF2基因的靶點腫瘤防治研究提供進一步的的實驗依據和新思路。
[參考文獻]
[1]Oei AL,van Leeuwen CM,Ten CR,et al.Hyperthermia selectively targets human papillomavirus in cervical tumors via p53-dependent apoptosis[J].Cancer Res,2015,75(23):5120-5129.
[2]韓娜娜,邵文裕,劉開江,等.Ib2期巨塊型宮頸癌術前不同治療方法的療效觀察[J].中國癌癥雜志,2015,25(1):56-62.
[3]Ormestad M,Astorga J,Landgren H,et al.Foxf1 and Foxf2 control murine gut development by limiting mesenchymal Wnt signaling and promoting extracellular matrix production[J].Development,2006,133(5):833-843.
[4]Wang T,Tamakoshi T,Uezato T,et al.Forkhead transcription factor Foxf2(LUN) -deficient mice exhibit abnormal development of secondary palate [J].Dev Biol,2003,259(1):83-94.
[5]Aitola M,Carlsson P,Mahlapuu M,et al.Forkhead transcription factor FoxF2 is expressed in mesodermal tissues involved in epithelio-mesenchymal interactions[J].Dev Dyn,2000,218(1):136-149.
[6]Shi Z,Liu J,Yu X,et al.Loss of FOXF2 expression predicts poor prognosis in hepatocellular carcinoma patients[J].Annals Surg Oncology,2016,23(1):211-217.
[7]Heul NL,Hendriksen PJ,Kwast TH,et al.Gene expression profiling of the human prostate zones[J].BJU Int,2006,98(4):886-897.
[8]Hirata H,Ueno K,Shahryari V,et al.MicroRNA-182-5p promotes cell invasion and proliferation by down regulating FOXF2,RECK and MTSS1 genes in human prostate cancer[J].PLoS One,2013,8(1):e55502.
[9]劉赟赟,王克芳,邱淑蘭,等.腺苷酸活化蛋白激酶α在宮頸癌中的表達及其作用機制[J].中國醫藥,2016,11(3):419-423.
[10]Lertkhachonsuk AA,Yip CH,Khuhaprema T,et al.Cancer prevention in Asia: resource-stratified guidelines from the Asian Oncology Summit 2013[J].Lancet Oncol,2013,14(12):497-507.
[11]Arbyn M,Castellsagué X,De SS,et al.Worldwide burden of cervical cancer in 2008[J].Ann Oncol,2011,22(12):2675-2686.
[12]趙金燕,陳慶,符生魚,等.siRNA干擾MeCP2基因對宮頸癌Hela細胞的生物學影響[J].蘭州大學學報(醫學版),2016,42(4):27-32.
[13]Peirson L,Fitzpatrick Lewis D,Ciliska D,et al.Screening for cervical cancer:a systematic review and meta-analysis[J].Syst Rev,2013,2(1):1-14.
[14]Tian HP,Lun SM,Huang HJ,et al. DNA methylation affects the SP1-regulated transcription of FOXF2 in breast cancer cells[J].J Biol Chem,2015,290(31):19173-19183.
[15]Cai J,Tian AX,Wang QS,et al.FOXF2 suppresses the FOXC2-mediated epithelial-mesenchymal transition and multidrug resistance of basal-like breast cancer[J].Cancer Lett,2015,367(2):129-137.
[16]Myatt SS,Lam EWF.The emerging roles of forkhead box(Fox)proteins in cancer[J].Nat Rev Cancer,2007,7(11):847-859.
[17]Kong PZ,Yang F,Li L,et al. Decreased FOXF2 mRNA expression indicates early-onset metastasis and poor prognosis for breast cancer patients with histological grade Ⅱ tumor[J].Plos One,2013,8(4):e61591.
[18]Nik AM,Reyahi A,Pontén F,et al.Foxf2 in intestinal fibroblasts reduces numbers of Lgr5(+)stem cells and adenoma formation by inhibiting Wnt signaling[J].Gastroenterology,2013,144(5):1001-1011.

