喜炎平注射液符合說明書適應癥用藥安全性的系統評價
陳媛媛+謝雁鳴+廖星+陳紅玉
[摘要]系統評價喜炎平注射液符合說明書適應癥用藥的安全性。計算機檢索國內、外8個數據庫中有關喜炎平注射液符合說明書適應癥(支氣管炎、扁桃體炎、細菌性痢疾)用藥的臨床研究,根據納排標準篩選文獻,按照國際公認的評價標準進行質量評估,提取數據,并做分析。納入118個研究,最終分析94個研究,包括70個隨機對照試驗,8個非隨機對照試驗,16個病例報告,共4716名患者使用喜炎平注射液,發生0例不良事件(AE),148例不良反應(ADR)。其中15例嚴重不良反應,包括1例植物狀態,4例過敏性休克及其他心血管一般損害等;133例一般ADR中以腹瀉最多,皮疹次之。大部分研究按說明書劑量使用。現有證據表明,臨床應用中不合理配伍及使用可能導致部分ADR。大部分研究無法獲知具體用藥過程及患者情況,不能明確推測ADR與年齡、溶媒等關系。建議臨床工作者按相關規定及標準判讀因果關系,并上報不良反應報告,為評價此藥安全性提供更多有力證據。
[關鍵詞]喜炎平;說明書用藥;系統評價;不良反應/事件;安全性
喜炎平注射液榮獲多項國家專利,2010年獲國藥準字,擁有自主知識產權。最新版說明書記載其是一種具有清熱解毒、止咳止痢功效,用于治療支氣管炎、扁桃體炎、細菌性痢疾等疾病的中藥注射劑,成分為穿心蓮內酯磺化物。上市30多年,臨床應用廣泛,其安全性也備受關注,國家食品藥品監督管理總局于2012年6月25日發布《藥品不良反應信息通報》(第48期)“警惕喜炎平注射液和脈絡寧注射液的嚴重過敏反應”中提及喜炎平注射液嚴重不良反應中過敏反應所占比例較大。
迄今為止有許多臨床試驗或系統評價對喜炎平注射液的有效性及安全性進行了評價,但此類評價主要針對某類疾病,側重于有效性,對安全性重視不足。有多篇關于喜炎平不良反應的文獻分析,其納入文獻多為病例報告。2011年已有研究者發表了喜炎平不良反應的系統評價,依據PRIZMA評價標準,該研究報告質量偏低,且時隔4年,有新的安全性相關數據可供再分析。2012年江西青峰藥業有限公司對喜炎平注射液說明書進行修訂,由之前的“小兒酌減或遵醫囑”具體規定了小兒1日劑量為5~10mg·kg-1。基于上述情況,有必要更新喜炎平安全性的系統評價。本研究將全面收集符合喜炎平注射液說明書適應癥用藥情況下的安全性或不良反應方面的數據及文獻信息,進行系統評價,為臨床應用提供安全性評價證據。
1材料與方法
1.1檢索策略
以“xiyanping”,“xiyanping injection”為檢索詞檢索Cochrane圖書館,Embase,Web of science,Med.line。以“喜炎平”為檢索詞檢索中國期刊全文數據庫(CNKI),中國生物醫學文獻數據庫(CBM),萬方數據庫,中文科技期刊全文數據庫(VIP),ClinicalTrials,檢索位置為題名。檢索時間均為建庫時間至2015年10月。碩博士論文及會議摘要等文獻在上述前3個中文數據庫中已檢索。
1.2納入與排除標準
1.2.1納入標準
研究對象:臨床應用喜炎平注射液的患者,疾病診斷為支氣管炎、扁桃體炎、細菌性痢疾,不限年齡、性別;干預措施:單獨使用或與其他藥物聯用,給藥方式不限;結局指標:研究結果報道的不良反應/不良事件;研究類型:隨機對照試驗、非隨機對照試驗、隊列研究、病例系列、病例對照、病例報告。
1.2.2排除標準
研究對象:臨床診斷為說明書以外疾病應用喜炎平注射液的患者;研究類型:動物實驗、基礎研究、綜述類評論性文獻;重復的文獻、重復發表或所用數據有重疊的文獻;文中未涉及喜炎平“安全性”、“不良反應”或“副作用”;數據無法提取的文獻;相關的橫斷面研究,如一些基于個別醫院的調研。
1.3數據提取及文獻質量評價
利用NoteExpress3軟件對檢索結果進行篩選,2個人(陳媛媛、陳紅玉)根據篇名和摘要信息分別獨立排除不符合納入標準的文獻,對于符合納入標準或不確定的文獻,下載全文信息進一步確定。分別篩選完成后進行核對,針對有歧義的文獻,找第3方(謝雁鳴、廖星)定奪。
隨機對照試驗文獻質量按Cochrane Reviewer'sHandbook 5.1評價標準條目和工具,根據“偏倚風險的評估工具(Version5.1.0)”評價;非隨機對照試驗文獻質量參照TREND聲明評估;觀察性研究如隊列、病例對照等按照STROBE進行質量評價;病例報告參考CARE進行質量評價。
1.4信息提取
在Excel中制定“文獻信息提取表”,主要提取:研究一般情況、研究類型、疾病、總樣本量、年齡、用藥情況、給藥方式、療程、劑量、溶媒、觀察的安全性結局指標、實際報告的ADR和AE。提取數據時特殊情況根據Cochrane手冊處理,如①3組對照試驗:2組未使用喜炎平的試驗合在一起對比喜炎平組,2組均使用喜炎平但劑量不同按病例系列提取;②隨機對照試驗:2組均用喜炎平但用法用量不同降級為2個病例系列提取,2組均用喜炎平且用法用量相同合并為1個病例系列。
2結果
2.1文獻檢索結果
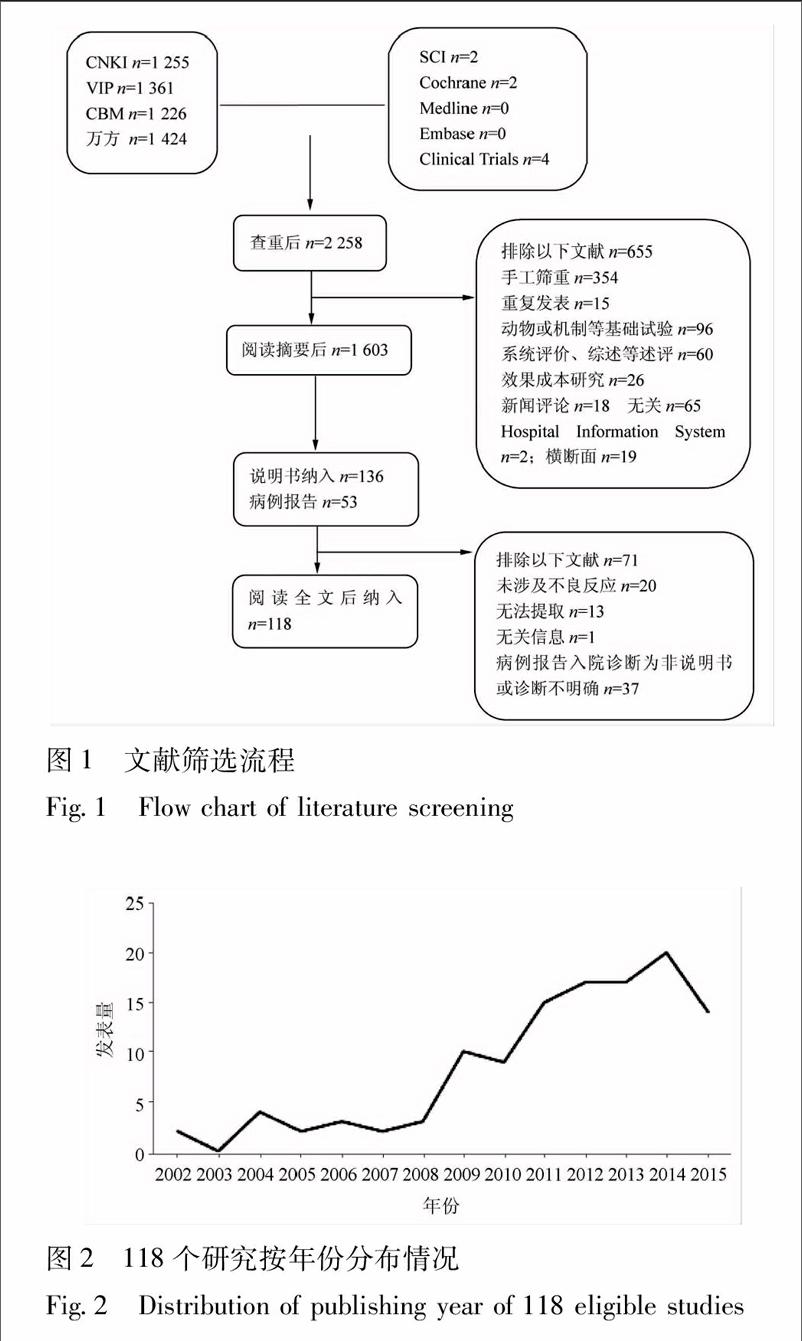
初檢中文文獻5266篇,英文文獻8篇。剔除重復后剩余2258篇,閱讀摘要剔除明顯不符合納入標準的文獻655篇,符合納入標準或需要進一步下載全文確定的文獻189篇,閱讀全文后排除71篇,最終納入文獻118篇。均為中文文獻。詳細流程見圖1,文獻發表量見圖2。
2.2納入研究的一般情況
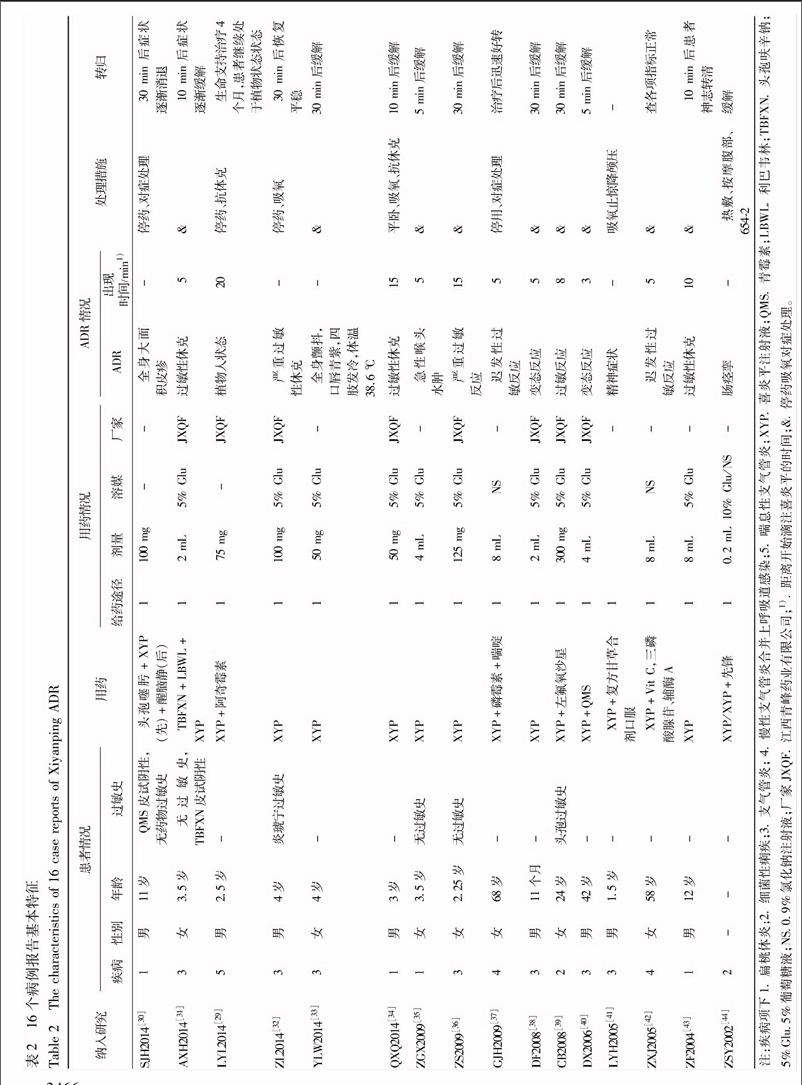
共納入118個研究,其中24個研究觀察指標和結果未提及ADR/AE,而在討論中有“該藥副作用小、安全性高”等相關描述,此類研究不做質量評價和信息提取。共分析94個研究,包括70個隨機對照試驗,8個非隨機對照試驗,16個病例報告,再無其他類型的研究。所納入分析的94個研究中43個研究報道發生不良反應,僅1個研究報道發生不良事件為0。共4716名患者使用喜炎平注射液,發生不良反應的有148例,占總人數3.14%。94個研究中17個研究報告了安全性指標,其余均未提及。納入研究一般情況見表1。
2.3納入研究的質量評價
70個隨機對照試驗按照Cochrane手冊“偏倚風險的評估工具(Version5.1.0)”進行方法學質量評價:1個研究使用隨機數字表分組,且采用單盲;15個研究告知隨機分配方法,7個研究低偏倚風險,8個研究高偏倚風險,其余54個研究僅提及隨機但未告知具體分配方法;均未提及分配隱藏;因未得知每個研究的研究方案,故不清楚結局數據是否完整、是否存在選擇性報告和其他偏倚。評價結果:8個研究為B級,62個研究為C級。8個非隨機對照試驗:根據TREND聲明評價,12分以上為高質量研究。評價結果:均為低質量研究。
16個病例報告:按照CARE評價,7分以上為高質量研究。評價結果:只有1個為高質量研究,其余均為低質量研究。
2.4 ADR/AE結果分析
16個病例報告與78個其他類型研究相比,患者情況、用藥及ADR描述差異較大,因此分為兩部分分析,
2.4.1 16個病例報告基本特征具體情況見表2。
2.4.2 16個病例報告一般情況
納入16個病例報告涉及16名患者共發生16例不良反應。不良反應按照國家藥品不良反應報告和監測管理辦法分級,共14例嚴重不良反應,2例一般不良反應。按照《WHO不良反應術語集》累及系統劃分,不良反應主要表現在心血管系統、全身損害、皮膚及其附件損害、呼吸系統和胃腸損害等。
2.4.2.1嚴重不良反應發生情況14例嚴重不良反應中最嚴重的1例是植物狀態,患者無藥物過敏史,未與其他藥物聯用,推測與喜炎平關系較大;嚴重不良反應中過敏性休克較常見,共4個研究,3個研究單獨用藥,1個研究與其他藥物聯用,但先使用喜炎平且不良反應出現在使用喜炎平過程中,推測與喜炎平相關;中樞及外周神經系統不良反應較少見,僅1例,與復方甘草酸苷合用,原始研究者認為不良反應與喜炎平相關;呼吸系統不良反應1例,單獨用藥,推測與喜炎平關系較大。
2.4.2.2一般不良反應發生情況2例一般不良反應中1例。。全身大面積皮疹,原始研究者不能確定是其他藥物引發還是與喜炎平合用引發;1例腸痙攣,具體用藥不明確,無法推測其與喜炎平關系,具體見表3。
2.4.2.3不良反應與過敏史關系6個研究報告了過敏史情況,占37.5%。其中嚴重不良反應報道5例,2個研究有炎琥寧和頭孢過敏史,3個研究無過敏史;一般不良反應報道1例,患者無過敏史。由于樣本量小且報道不全,不能明確不良反應與過敏史關系。
2.4.2.4不良反應與劑量關系嚴重不良反應中1個研究未標明劑量,9個5歲以下兒童,兒童用藥劑量按體重換算,僅2個研究說明體重,參照WHO兒童體重標準換算后,僅有1個研究用藥劑量輕微超出說明書具體標準;一般不良反應中2個研究劑量未超出說明書使用。由有限數據推測,尚不能推測不良反應與劑量有關系。
2.4.2.5不良反應發生時間
有4個研究未報道不良反應出現時間,1個研究描述不準確,其他研究不良反應出現時間在滴注喜炎平20min之內,其中5 min最為常見,共5個研究,占31.25%。
2.4.2.6不良反應愈后16個研究均說明了愈后情況,除1例“持續植物狀態”,其他均緩解好轉。
2.4.3其他研究類型結果
2.4.3.1部分研究數據處理對于RCT中治療組、對照組均使用喜炎平治療但劑量、給藥途徑不同的研究降級為病例系列提取數據;RCT中治療組、對照組均使用喜炎平且用法用量相同的研究合并為1個病例系列提取;分為3組對比研究的按以下處理:①2組未使用喜炎平的試驗合在一起對比喜炎平組;②2組均使用喜炎平但劑量不同按病例系列提取。因此將78個研究進行拆分和轉換后,共得到83個研究,包括64個隨機對照試驗,7個非隨機對照試驗,12個病例系列。
有2個研究描述為“高劑量組不良反應4例,嘔吐伴腹瀉1例,輕度腹瀉4例”,提取數據時按照“共發生不良反應4例,發生輕度腹瀉4例次,嘔吐伴腹瀉1例次”。
2.4.3.2 64個隨機對照試驗基本特征64個研究涉及3 621名患者,均為聯合用藥;7個研究使用霧化吸入,1個研究未報告給藥途徑,1個研究給藥途徑為靜脈滴注或肌肉注射;僅1個研究報告發生0例不良事件,其余均為不良反應,43個研究報告未出現不良反應,21個研究報告不良反應78例。10個研究報告了處理措施,治療后均好轉。
2.4.3.3 7個非隨機對照試驗基本特征具體見表4,12個病例系列見表5。
2.4.4其他類型研究一般情況
共分析83個研究,涉及4 700名患者,僅1個研究提及不良事件為0,不良反應4例;其他研究均為不良反應。共發生132例不良反應,1個研究“發生1例過敏反應”,未進行描述,將其他不良反應按照國家藥品不良反應報告和監測管理辦法分級,有1例嚴重不良反應,131例一般不良反應;按照《WHO不良反應術語集》累及系統劃分,不良反應主要表現在胃腸損害、皮膚及附件損害、用藥部位損害、呼吸系統損害和中樞及外周神經系統損害。
2.4.4.1是否聯合用藥83個研究中僅1個研究單獨用藥,其他研究均與其他藥物或常規治療聯合使用,無法具體明確不良反應與喜炎平關系。
2.4.4.2不良反應發生情況納入83個研究中1個研究未描述其不良反應,其余82個研究,131例不良反應中,有1例嚴重不良反應,表現為呼吸困難;一般不良反應中以腹瀉最常見,占30.12%,皮疹次之,寒顫高熱較少見,具體見表6。
2.4.4.3不同給藥途徑ADR結果分析83個研究中,1個研究未報告給藥途徑,1個研究給藥途徑為靜脈滴注或肌肉注射,未進行數據分析。其他研究包括靜脈滴注、霧化吸入2種給藥途徑,以靜脈滴注為主,占91.64%。霧化吸入不良反應發生頻率低,僅0.52%。說明書中未將霧化吸入作為喜炎平注射液的給藥途徑。
2.4.4.4不同劑量ADR結果分析按給藥途徑分不同劑量對比結果,73個研究采用靜脈滴注,其中1個研究未報告劑量,1個研究劑量不明確,未進行數據分析,靜脈滴注出現不良反應最多的劑量為0.4 mL·kg-1·d-1,占30.23%;用量最多為500mg,未見不良反應。8個研究采用霧化吸入,霧化吸入用量為50 mg,出現不良反應2例,具體見表7。
2.4.4.5不同年齡ADR結果分析83個研究涉及4700名患者,其中5個研究描述為“治療組小于1歲8例,1~6歲28例,大于6歲24例”,無法獲得確切數據;13個研究未報告具體年齡;年齡區間跨度較大,無法明確推測不良反應與年齡關系。
2.4.4.6不同溶媒ADR結果分析73個研究使用靜脈滴注,10個研究未報告溶媒,7個研究使用“5%葡萄糖或生理鹽水”或“10%葡萄糖或生理鹽水”,分析3281名患者數據,其中以5%葡萄糖作為溶媒使用最多,占91.71%,不良反應發生頻率為2.69%;0.9%氯化鈉作為溶媒使用較少,占1.83%,不良反應發生頻率為0;說明書未將10%葡萄糖列為溶媒,具體見表8。
3討論
3.1不良反應/事件評定
本研究共分析94個研究,僅1個研究提及不良事件,其余均為不良反應。根據《現代藥學名詞手冊》收錄的WHO定義,不良反應是“藥物在正常的人用劑量下,用于疾病的預防、診斷、治療或調節生理功能時發生的有害的或非預期的反應”不良事件定義相對于不良反應“在國際上有一種習慣,把與藥物有一定關系出現的非用藥目的的反應稱不良反應,而不能與用藥肯定相關及不可能相關發生的反應稱為不良事件”。國際ADR因果關系評價方法大多以Karch和Lasagna評定辦法引為基本準則,我國ADR因果關系參考依據主要是《藥品不良反應報告和監測管理辦法》,其于2012年再次修訂,但大部分研究并沒有說明按照相關參考依據進行因果關系評定,建議臨床工作者及時按照相關規定上報不良反應并規范報告標準,為評價藥品安全性提供可靠依據。
3.2不良反應原因探討
3.2.1常見不良反應原因
根據上述分析結果可知,喜炎平不良反應中最常見為腹瀉,有動物試驗研究喜炎平的急性毒性和長期毒性,結果顯示其主要不良反應在胃腸道和注射部位,血清學、尿液、心電圖及眼科檢查未見明顯異常,出現一過性的嘔吐或腹瀉的動物經組織病理學檢查未發現胃腸異常變化,原始研究者推測與藥物性質寒涼有關;其次為皮疹,有研究進展指出中藥注射劑過敏反應很大部分屬于類過敏反應,就癥狀而言其與過敏反應高度相似,以皮損癥狀居多,首次用藥即可出現速發性變態反應癥狀。其中有動物研究對喜炎平的皮膚類過敏反應進行分析,結果指出,“喜炎平過敏反應為陰性,臨床劑量下類過敏反應為強陽性,隨劑量增加而加重”。
3.2.2不良反應與藥物配伍
有研究報道喜炎平注射液與頭孢他啶、利巴韋林等16種藥物聯合使用后不溶微粒數量明顯增加,且均超出藥典規定數量,也有研究提出了相關配伍禁忌,提醒醫務工作者按照說明書警告不要將喜炎平與上述藥物在同一容器混合使用。
3.2.3不良反應與溶媒
納入研究中絕大部分使用5%葡萄糖作為溶媒,有研究表明作為稀釋劑藥液,相同濃度下0.9%氯化鈉產生的不溶微粒較5%葡萄糖少;用藥濃度對不溶微粒也有較大影響,隨著藥液使用量增加不溶微粒也逐漸增多。本次研究中發現使用0.9%氯化鈉為溶媒不良反應發生頻率小于5%葡萄糖,但因只有60人使用0.9%氯化鈉作為溶媒,且無法獲知放置時間,尚不能推測不良反應與溶媒關系;該研究同時發現不溶微粒隨放置時間延長而增加,為確保臨床安全用藥,建議放置時間不宜超過4 h,藥液使用量不宜大于20mL。
3.2.4不良反應與劑量
納入94個研究中僅1個用藥輕微超出標準劑量,以現有研究難以推測不良反應與劑量的關系。有基于真實世界的喜炎平注射液HIS臨床劑量應用分析的研究也得出相同結論。
3.2.5不良反應與年齡
納入研究的樣本量年齡跨度大,且無法明確發生不良反應患者的年齡,無法明確推測不良反應與年齡關系。
3.3本研究與喜炎平注射液說明書對比
本研究限定說明書適應癥,而對超出說明書的溶媒、給藥方式等使用喜炎平時所發生的ADR,也納入本研究分析,歸為廣義ADR。喜炎平在臨床使用中除說明書用藥外,主要用于手足口病、上呼吸道感染、腸炎等,2010年將喜炎平列入治療手足口的中成藥,治療甲型H1N1流感的中藥注射劑,也被列為治療發熱伴血小板減少的推薦用藥;用法方面,臨床應用霧化吸人治療上呼吸道感染等,療效較好,安全性有待進一步佐證,建議做相關研究以增加臨床用藥途徑和安全性;本研究結果顯示喜炎平的不良反應中胃腸系統損害為51.81%,而說明書中并未體現腹瀉、惡心、嘔吐等,出現4例過敏性休克,說明書也尚未記載。
3.4本研究局限性
本研究盡量全面檢索符合說明書適應癥的臨床研究,但納入研究質量偏低,且主要是研究有效性,不良反應事件常為次要指標,無法明確滴速、用藥濃度、患者具體情況,不能明確不良反應與以上因素的因果關系,仍需要開展以安全性為主要結局指標的大樣本、多中心、長期性的研究提供有力證據。另外,本研究不涉及相關利益沖突。

