反式雄烯二酮對食蚊魚的生長發育和第二性征的影響
古明宗 曾科 楊華杰 方貴楨 侯麗萍
摘 要:為了研究反式雄烯二酮(ADD)長期暴露對食蚊魚(Gambusia affinis)生長發育和第二性征的影響,分別用不同濃度的ADD(50、200、500、2 000 μg/L)對食蚊魚進行60 d的水浴暴露處理,以0.1%甲醇和清水作對照,考察食蚊魚形態特征、組織結構以及生長和生殖相互關系的變化情況。結果表明:雌性食蚊魚的各項生理指標均受水體中雄性激素ADD的影響,且影響程度隨著ADD濃度的增加而增加。隨著雄性激素ADD的加入,食蚊魚的體長和臀鰭長變短,體重、性腺重和肝重變輕,卵子數量變少;卵細胞發生了形變、腫脹,甚至退化;肝細胞的細胞核偏移中央,細胞腫大,出現了空泡結構,細胞脂質化程度逐漸加深;鰓絲長短不一,排列不整齊,甚至出現了退化現象;臀鰭出現上短下長,尖端分叉的現象。總體來講,水體中雄性激素ADD會引發雌性食蚊魚出現雄性化的第二性征。
關鍵詞:雄激素;反式雄烯二酮(ADD);食蚊魚;生長發育
中圖分類號:S949 文獻標識碼:A 文章編號:1006-060X(2017)01-0063-05
Abstract: In order to study the trans androstenedione (ADD) long exposure to Gambusia affinis growth and the influence of the secondary sex characteristic, with different concentrations of the ADD (50, 200, 500, 2 000 g/L) to 60 d water bath exposed mosquito fish processing, 0.1% methanol and water as contrast, Gambusia affinis morphological characteristics, organization structure and the relationship between growth and reproduction was studied. The results showed that the female Gambusia affinis of various physiological indexes under the influence of male hormones in the water, ADD, and influence degree increase with the increased concentration of the ADD. As the male hormone ADD to join, the Gambusia affiniss body length and anal fin length shorter, lighter weight, gonad weight and liver weight, less number of eggs; the egg deformation happened, swelling, or even degradation; the central nucleus of liver cell migration, cell swelling, a cavity structure, degree of cell lipid change gradually deepened; the gill filament length is differ, untidy, even the degradation phenomenon appeared; the anal fin on next short length, cutting-edge forked phenomenon. In general, male hormones in the water, ADD cause female Gambusia affinis appear male secondary sex characteristic.
Key words: androgen; trans-androstenedione; Gambusia affinis; growing development
內分泌干擾物(EDCs),也稱為環境激素,是一種干擾內分泌系統的外源性化學物質。這類物質在環境中即使數量極少,也能干擾人類或動物內分泌系統諸環節并導致異常效應,進而影響生物的生長發育及生殖[1]。近年來,很多國家和地區陸續在城市水環境中檢測到雄激素物質。這些環境雄激素可損害水生生物正常的內分泌系統,使雌魚出現雄性第二性征,一方面導致雌性水生生物生殖能力下降,另一方面引起某些水生生物雌雄比例發生改變[2-4]。反式雄烯二酮就是這樣一種雄激素,它廣泛存在于地表水中,但目前尚未有與其相關的毒理數據。
食蚊魚(Gambusia affinis)是原產于北美洲的著名入侵種,屬鳉形目胎鳉科,廣泛分布在我國華南地區的淡水水體中,容易捕撈,也易于在實驗室飼養。因此,食蚊魚被當作模式生物廣泛用于化合物的各種毒性測試,是研究內分泌干擾作用和水體污染監測的理想指示生物[5]。
為進一步探討反式雄烯二酮的環境毒理效應,篩選出相應的生物標志物,研究以食蚊魚為對象,探討了反式雄烯二酮長期暴露對其生理活動及生長發育的影響。
1 材料與方法
1.1 試驗材料
供試食蚊魚購自廣州花鳥魚蟲市場,供試試劑為反式雄烯二酮母液(ADD,分析純)和甲醇(分析純)。
1.2 暴露處理
挑選大小相似的雌性食蚊魚210條,分6個魚缸分別編號1~6,每個魚缸35條,培養1個月,讓雌魚適應該魚群密度。暴露處理:編號1~4的魚缸中分別添加反式雄烯二酮50、200、500和2000 μg/L;5號魚缸為藥劑對照組,加入0.01%甲醇;6號魚缸為空白對照組,不加藥劑。暴露試驗開始后,隔天換1/2體積的水,換水后添加適當的反式雄烯二酮使水中濃度保持一致,培養2個月[6]。
1.3 測定指標及方法
從形態學觀測記錄食蚊魚各生長指標,從毒理學方面觀測各組織切片中細胞和結構的變化。
1.3.1 形態學和生理學測定 暴露結束后,將食蚊魚埋入冰中致死。從低濃度開始測量觀察,測量每條食蚊魚的體長、體重和臀鰭數。對食蚊魚進行解剖,迅速取出魚肝、魚鰓及性腺,用濾紙吸取血漬,稱重記錄。
1.3.2 組織切片制作 配置Bouin氏液:稱取2.25 g苦味酸固體溶解于150 mL蒸餾水中,福爾馬林50 mL,冰醋酸10 mL,攪拌均勻。用Bouin氏液迅速固定稱重之后的魚肝、魚鰓及性腺,封蓋并貼標簽。用濃度梯度遞增的乙醇溶液脫水,至100%乙醇,使脫水硬化,選用二甲苯(xylene)為透明劑。用石蠟作為支持介質并對組織進行石蠟包埋,用切片機切片后,采用蘇木素伊紅染色法(EH染色法)進行染色,后用樹膠和蓋玻片封固。
1.3.3 骨骼制作 將剩下的食蚊魚放置濃度為2%~3%的氫氧化鉀中浸泡12 h,在體式顯微鏡下,剔除魚身上的皮肉,再用1%的茜素紅染色30 min,用清水洗滌,放置體式顯微鏡下觀察,記錄臀鰭的變化特征。
1.3.4 肝體指數(HSI)和性體指數(GSI) HSI=(肝重/魚體重量)×100%,GSI=(性腺重/魚體重量)×100%。
1.4 數據分析
試驗所得數據均用SPSS17.0軟件進行分析,采用單因素方差分析(ANOVA)法來檢驗不同處理下食蚊魚各生理指標的差異,并用LSD對結果進行多重比較。如果P<0.05,則認為處理間差異顯著。
2 結果與分析
2.1 水體中ADD暴露對雌性食蚊魚形態特征的影響
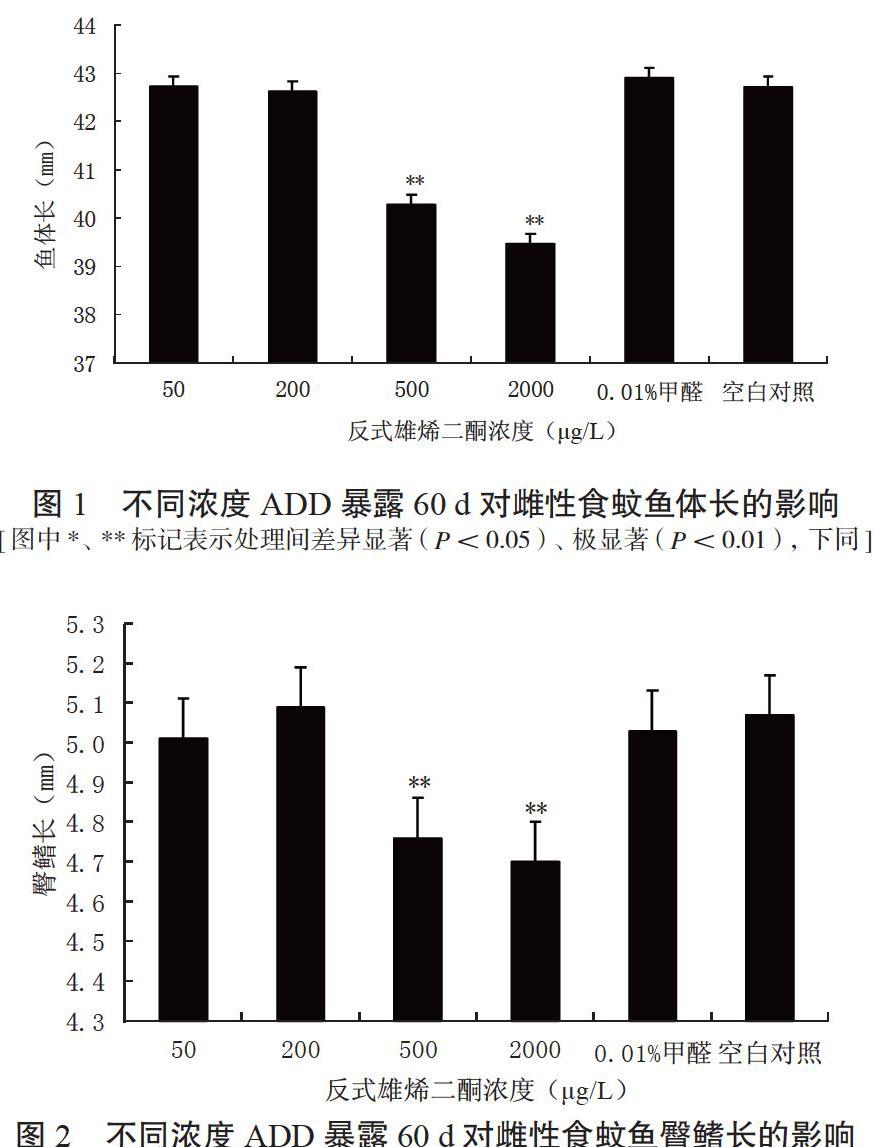
2.1.1 體 長 由圖1可知,當水體中ADD濃度為500和2 000 μg/L時,雌性食蚊魚的體長極顯著短于其他處理,而濃度為50和200 μg/L時,雌性食蚊魚的體長與對照組差異不顯著。因此,可認為雌性食蚊魚在含有500和2 000 μg/LADD的水體中,體長發生了特變。
2.1.2 臀鰭長 由圖2可知,當水體中ADD濃度為500和2 000 μg/L時,雌性食蚊魚的臀鰭長極顯著性短于對照組,而濃度為50和200 μg/L時,雌性食蚊魚的臀鰭長與對照組差異不顯著。因此,可認為ADD對雌性食蚊魚臀鰭的生長發育有顯著影響,但在高濃度下才出現明顯突變。
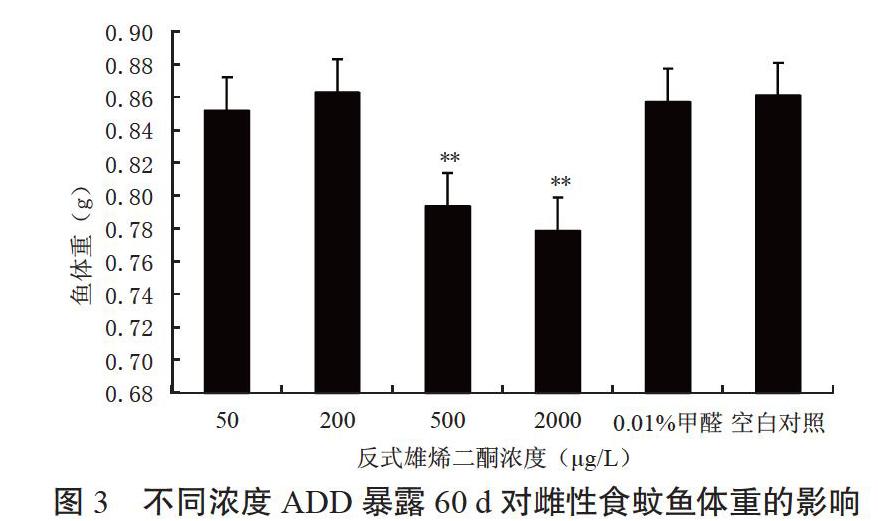
2.1.3 體 重 由圖3可知,當水體中ADD濃度為500和2 000 μg/L時,雌性食蚊魚的體重極顯著性輕于對照,而濃度為50和200 μg/L時,雌性食蚊魚的體重與對照組差異不明顯。因此,可認為雌性食蚊魚在含有500和2 000 μg/LADD的水體中,體重發生了特變;而在50和200 μg/L的ADD條件下,體重與對照組差異不顯著,并未發生特變。
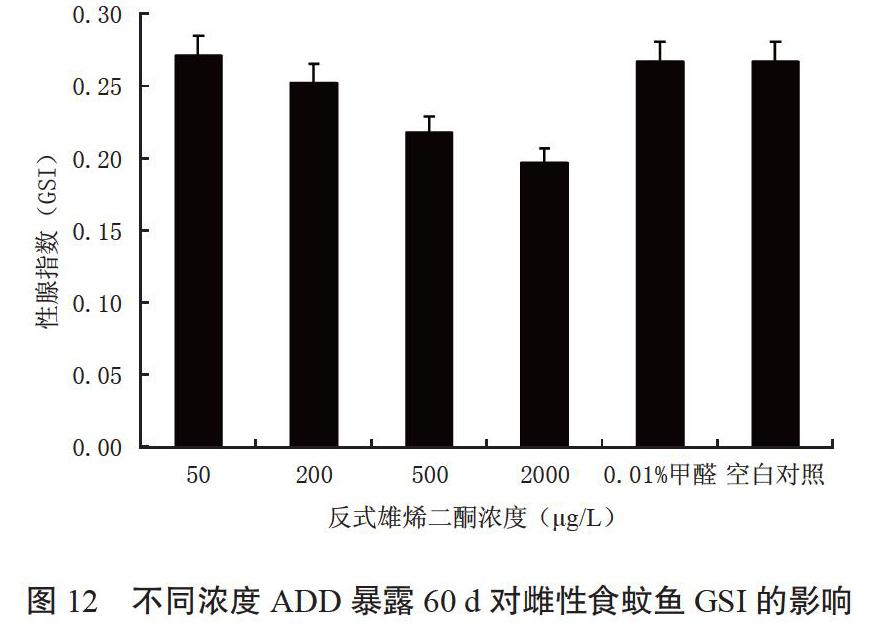
2.1.4 性腺重 由圖4可知,當水體中ADD濃度為500和2 000 μg/L時,雌性食蚊魚的性腺重極顯著性輕于對照,而在濃度為50和200 μg/L時,雌性食蚊魚的性腺重與對照組差異不明顯。這表明ADD對雌性食蚊魚性腺的生長發育有極顯著的抑制作用,但只表現在高濃度下。
2.1.5 肝 重 由圖5可知,當水體中ADD濃度為500和2 000 μg/L時,雌性食蚊魚的肝臟重極顯著性輕于對照,而在濃度為50和200 μg/L時,雌性食蚊魚的肝臟重與對照組差異不明顯,這表明高濃度ADD對雌性食蚊魚肝臟生長發育有極顯著的抑制作用,而在低濃度下無抑制作用。
2.1.6 卵 子 由圖6可知,當水體中ADD濃度為500和2 000 μg/L時,雌性食蚊魚的卵子數量極顯著少于對照,而當濃度為50和200 μg/L時,雌性食蚊魚的卵子數量稍低于對照,但差異不顯著。因此,可認為高濃度的ADD條件下,雌性食蚊魚的卵子數量發生了特變,而低濃度的ADD對雌性食蚊魚卵子數量的影響不顯著。
2.2 水體中ADD暴露對雌性食蚊魚各組織結構的影響
2.2.1 性 腺 卵母細胞的發育可分為6個時期,分別為:I時期,卵原細胞時相;II時期,初級卵母細胞;III時期,卵黃泡出現時期;IV時期,卵黃充滿時相;V時期,成熟卵細胞時相;VI時期,退化吸收時期。圖7中A和B分別為空白對照和藥劑對照的食蚊魚的性腺,為正常狀態下的卵母細胞,包含了I~VI個時期;圖8中C~F為卵黃充滿時期(IV時期),可以看出卵細胞發生了形變、腫脹,甚至出現了退化的卵母細胞,表明在50~2 000 μg/L的ADD作用下,食蚊魚卵細胞發育出現了阻礙和抑制。正常環境中的魚類通過下丘腦分泌促性腺激素釋放激素(GnRH),刺激促性腺激素的分泌,然后促性腺激素促進雌激素的分泌,從而促使性腺發育。該試驗結果顯示,食蚊魚的性腺發育受到ADD的抑制,而且隨著ADD濃度的增加,抑制作用越強。這可能與食蚊魚雌激素的分泌受到抑制或者是與食蚊魚性腺發育有關的激素分泌受到抑制有關。
2.2.2 肝 由圖8A和圖8B可知,正常情況下,食蚊魚的肝細胞排列緊密,細胞質均勻,細胞核位于細胞中心。但水體中加入了ADD之后,從圖8C~F可以看出,肝細胞的細胞核偏移中央,細胞腫大,出現了空泡結構,細胞脂質化程度逐漸加深。其中,圖8E和圖8F的空泡結構較多,肝細胞腫大更嚴重。由此可知,ADD對雌性食蚊魚肝臟的毒害作用較為嚴重。
2.2.3 鰓 正常情況下,食蚊魚的鰓絲排列緊密,整齊,細長均勻,如圖9A~B所示。當水體中出現ADD以后,食蚊魚的鰓絲發生了變化,表現為鰓絲長短不一,排列不整齊,甚至出現了退化現象;且隨著ADD濃度的增加,病變程度越嚴重,如圖9C~F。鰓是魚類的重要呼吸器官,魚體與外環境的氣體交換主要由鰓來完成。當水體中存在ADD時,魚鰓直接暴露于ADD污染下,受其毒害作用而發生病變,而鰓發生病變必然會影響魚類的正常代謝和生長;情況嚴重時,鰓的氣體的交換量(即呼出二氧化碳,吸收水中氧氣)不能維持最低生命活動需要,魚類就會窒息死亡。
2.2.4 臀 鰭 如圖10A所示,正常情況下雌性食蚊魚的臀鰭長度整齊,鰭條尖端分叉少。水體中加入ADD后,食蚊魚的臀鰭出現上短下長,尖端分叉的現象(圖10B)。這表明在ADD的作用下,雌性食蚊魚的臀鰭有雄性化延長的趨勢。
2.3 水體中ADD暴露對雌性食蚊魚生長與生殖相互關系的影響
魚類的生長包括營養生長和生殖生長,肝體指數(HSI)和性體指數(GSI)的變化可以反映出生長與生殖的相互關系,也可以反映卵黃的發生和積累過程。魚類卵黃的發生主要通過兩種形式:一是由卵母細胞自身合成,稱為內源性卵黃合成或自動合成;二是自卵母細胞以外的地方合成,然后進入卵母細胞,稱為外源性卵黃合成。外源性卵黃的形成是在雌激素作用下,肝細胞中首先合成卵黃前體物質(卵黃蛋白原),然后經血液循環運輸到卵巢,再通過微胞飲作用被卵母細胞吸收,最終在卵母細胞中裂解為卵黃蛋白,作為卵母細胞發育與成熟的物質基礎。由圖11~12可以看出,各處理食蚊魚的HSI與GSI的變化趨勢相同,HIS和GSI均隨ADD濃度的增加而不斷降低。這說明在ADD作用下,雌性食蚊魚卵巢的生理功能受到抑制而無法吸收或無法分解由肝細胞合成的卵黃蛋白原,或卵黃蛋白原的輸送受到抑制。
綜上所述,在ADD作用下,雌性食蚊魚的HSI與GSI具有正相關的效應,營養生長與生殖生長均受ADD抑制。
3 結 論
試驗結果表明,雌性食蚊魚的各項生理指標均受水體中雄性激素ADD的影響,且影響程度隨著ADD濃度的增加而增加。從形態特征來看,隨著雄性激素ADD的加入,食蚊魚的體長和臀鰭長變短,體重、性腺重和肝重變輕,卵子數量變少。從組織結構來看,隨著雄性激素ADD的加入,卵細胞發生了形變、腫脹,甚至退化;肝細胞的細胞核偏移中央,細胞腫大,出現了空泡結構,細胞脂質化程度逐漸加深;鰓絲長短不一,排列不整齊,甚至出現了退化現象;臀鰭出現上短下長,尖端分叉的現象。從生長與生殖的相互關系來看,HIS和GSI均隨ADD濃度的增加而不斷降低。總體來講,水體中雄性激素ADD會引發雌性食蚊魚出現雄性化的第二性征。
參考文獻:
[1]張 翔,荊博宇,袁小英,等. 內分泌干擾物對鯉魚器官細胞膜脂肪酸組分的影響[J]. 環境化學,2014,33(5):748-752.
[2]Soto A M,Calabro J M,Prechtl N V,et al. Androgenic and estrogenic activity in water bodies receiving cattle feedlot effluent in easternnebraska,USA[J]. Environmental Health Perspectives,2004,112:346-352.
[3]Orlando E F,Kolok A S,Binzcik G A,et al. Endocrine-disrupting effects of cattle feedlot effluent on an aquatic sentinel species,the fathead minnow[J]. Environmental Health Perspectives,2004,112(3):353-358.
[4]Orn S,Svenson A,Viktor T,et al. Male-biased sex ratios and vitellogenin induction in Zebrafish exposed to effluent Water from a Swedish pulp mill[J]. Archives of Environmental Contamination and Toxicology,2006,51:445-451.
[5]Cody R P,Bortone S A. Masculinization of mosquitofish as an indicator of exposure to kraft mill effluent[J]. Bulletin of Environmental Contamination and Toxicology,1997,58(3):429-432.
[6]侯麗萍,舒 琥,李海鵬,等. 雄烯二酮長期暴露對食蚊魚肝臟生物轉化酶系的影響[J]. 環境化學,2015,34(3):442-447.
(責任編輯:成 平)

