淺談原電池電極反應方程式的書寫方法
張路


摘要: 針對原電池電極反應方程式的書寫這個知識難點,筆者總結出了書寫的三步法,并以兩道例題為例對方法進行了具體的闡述。
關鍵詞 原電池 電極反應方程式 書寫方法
《高中化學新課程標準》 中對原電池這一節的要求是“理解原電池的構成、工作原理及應用,能書寫電極反應和總反應方程式”,說明原電池電極反應方程式的書寫是高考必考的內容。原電池電極反應方程式的書寫一直是學生學習的難點,而要求學生掌握的原電池數目較多,如果單靠記憶,掌握和實際應用的效果都非常差,如果學生能夠掌握書寫的方法,那么這個知識難點將會得到突破,學生學習化學的信心將會得到增強。
通過對近幾年高考試題的分析,筆者認為對于書寫原電池電極反應式的考查主要分為兩種情況,一種是題干所給信息涉及到的是學過的氧化還原反應,學生能夠根據信息判斷出氧化劑還原劑及相應的氧化產物和還原產物,從而判斷出正負極參與反應的主要物質;另一種情況是題干提供一個學生未學過的較復雜的化學電源反應;這兩種情況的電極反應方程式的書寫方法大同小異,接下來以兩道例題為例進行闡述:
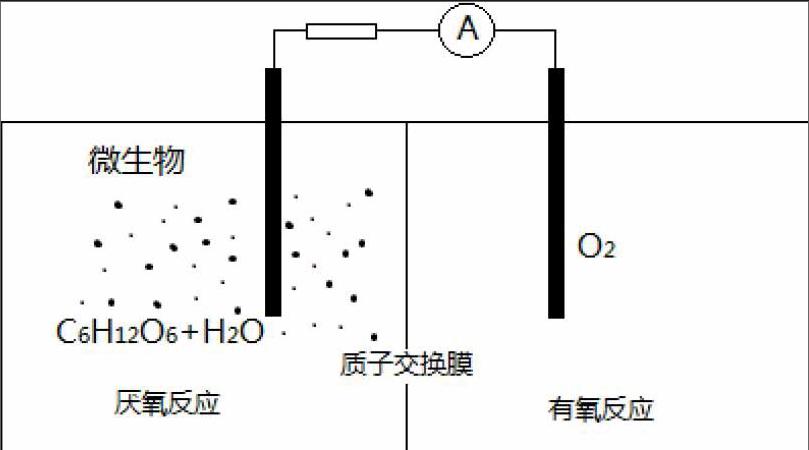
例題1、微生物電池是指在微生物的作用下將化學能轉化為電能的裝置,其工作原理如圖所示。下列有關微生物電池的說法錯誤的是
A.負極反應中有CO2生成
B.微生物促進了反應中電子的轉移
C.質子通過交換膜從負極區移向正極區
D.正極反應為:O2 + 4e- +2H2O4OH?
由題干信息可以看出,該原電池總反應是學生通過已學知識能推出的反應,即C6H12O6在氧氣中的燃燒反應,環境為酸(H+)環境,由此可以分析出還原劑為C6H12O6且對應的產物為CO2(堿環境下生成CO32-),氧化劑為O2,還原產物為H2O,就可以完成書寫電極反應的第一步,確定出參與原電池正負極反應的主要物質,負極為、正極為,再分析化合價確定出電子轉移數目,負極
正極;第二步調整電荷守恒,酸環境用H+,負極 、正極;第三步調整原子個數守恒,負極,正極已經守恒。
例題2、某堿性蓄電池在充電和放電時發生的反應為:
下列說法中正確的是
A.放電時,負極上發生反應的物質是Fe
B.放電時,正極反應是
C.充電時,陰極反應是
D.充電時,陽極附近PH增大
第一步分析化合價,找出得失電子物質,寫出原電池正負極參加反應的主要物質,并分析化合價確定得失電子的數目,即負極、正極;
第二步,調整電荷守恒,用OH-來調整,即負極正極;第三步,調整原子個數守恒,負極已經守恒,不需要再添加,正極。
由此,筆者總結出書寫原電池電極反應的三步:第一步,找出氧化劑、還原產物、還原劑、氧化產物,確定出參與正負極反應的主要物質,并分析化合價,確定出正負極得失電子的數目,即負極、正極;第二步,調整電荷守恒,使得電極反應式箭頭兩邊電荷數相同+,用H+或OH-(取決于環境)調整;第三步,調整原子個數守恒。其中,第二步和第三步僅適用于水溶液中。對于大多數水溶液中的原電池電極反應式的書寫,只要學生掌握了該書寫方法,就能比較輕松應對,并大大減少了要記憶的內容、提高其解決實際問題的能力。尤其是例題2這類題,涉及到的反應都是學生在平常的學習中較少接觸到,掌握了方法,就能減少學生的畏懼心理,提高解題的正確率。endprint

