伴有多種突變基因的初治原發(fā)AML的臨床特征分析
焦 揚(yáng)
(鄭州大學(xué)附屬腫瘤醫(yī)院檢驗(yàn)科,鄭州 450008)
急性髓細(xì)胞白血病(acute myeloid leukemia,AML)是一類由于造血祖細(xì)胞增殖異常且伴分化受阻而導(dǎo)致的血液系統(tǒng)惡性腫瘤。由基因突變而導(dǎo)致細(xì)胞增殖、分化和細(xì)胞凋亡途徑的異常是AML發(fā)病的基礎(chǔ),現(xiàn)普遍認(rèn)為基因突變導(dǎo)致白血病發(fā)病的機(jī)制與“二次打擊模式”有關(guān),多種基因最終突變導(dǎo)致白血病的發(fā)生、發(fā)展。有學(xué)者提出兩類突變的學(xué)說,認(rèn)為AML的發(fā)生至少需要Ⅰ、Ⅱ型突變。Ⅰ型突變的主要作用是異常激活信號(hào)轉(zhuǎn)導(dǎo)通路和誘導(dǎo)細(xì)胞增殖失控,Ⅱ型突變主要作用是影響轉(zhuǎn)錄因子功能和抑制細(xì)胞正常分化[1]。本研究依據(jù)“兩類突變學(xué)說”的思路,把初治原發(fā)AML患者按基因突變數(shù)量(GMN)的不同分組,對比分析他們之間的臨床差異,為AML的診斷分型、治療選擇、隨訪監(jiān)測、預(yù)后估計(jì)及發(fā)病機(jī)制的探討提供參考數(shù)據(jù),現(xiàn)報(bào)道如下。
1 資料與方法
1.1一般資料 收集2015年1月至2016年12月本院血液科所有初治AML住院患者232例,AML的診斷標(biāo)準(zhǔn)參照WHO(2016)造血和淋巴組織腫瘤分類標(biāo)準(zhǔn)[2],除骨髓增生異常綜合征轉(zhuǎn)化型AML、治療相關(guān)AML及其他類型非原發(fā)AML,最終選出144例資料完整的患者納入本研究,其中男76例,女68例,依據(jù)“兩類突變學(xué)說”的思路,把初治原發(fā)AML患者按GMN的不同分為GMN<2個(gè)和GMN≥2個(gè),根據(jù)(美國)西南腫瘤協(xié)作組(SWOG)和(美國)東部腫瘤協(xié)作組(ECOG)制訂的細(xì)胞遺傳學(xué)預(yù)后分層標(biāo)準(zhǔn),將患者分為預(yù)后良好組、預(yù)后中等組和預(yù)后不良組,其中預(yù)后不良組又分為復(fù)雜核型組和非復(fù)雜核型組,以及根據(jù)單體核型有無分為單體核型組和非單體核型組。本研究均獲得患者知情同意,并經(jīng)醫(yī)院醫(yī)學(xué)倫理委員會(huì)批準(zhǔn)。
1.2方法
1.2.1細(xì)胞形態(tài)學(xué)檢查 抽取骨髓液制涂片,快速干燥后進(jìn)行瑞氏染色,根據(jù)需要進(jìn)行特殊細(xì)胞化學(xué)染色,進(jìn)行形態(tài)學(xué)分型。
1.2.2細(xì)胞遺傳學(xué)檢查 通過骨髓細(xì)胞直接法和(或)24 h培養(yǎng)法,按照常規(guī)制備染色體,正常核型至少要分析20個(gè)分裂象,異常核型至少要分析10個(gè)分裂象。核型異常描述依據(jù)《人類細(xì)胞遺傳學(xué)國際命名體制(ISCN 2013)》[3]的規(guī)定進(jìn)行。
1.2.3分子生物學(xué)檢查 通過熒光定量PCR檢測融合基因,采用一代和二代測序方法檢測基因突變。
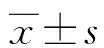
2 結(jié) 果
2.1一般臨床特征分析 144例初治AML患者,男76例,女68例,中位年齡41.50歲,年齡四分位間距為25.25~53.75歲,GMN<2個(gè)105例(72.92%),GMN≥2個(gè)39例(27.08%),正常核型59例(40.97%),異常核型85例(59.03%)。不同年齡組間比較,差異有統(tǒng)計(jì)學(xué)意義(P<0.05);性別、既往病史和常見臨床癥狀等一般資料比較,差異無統(tǒng)計(jì)意義(P>0.05),見表1。
2.2血細(xì)胞常規(guī)和骨髓細(xì)胞形態(tài)分析 骨髓中原始細(xì)胞,外周血白細(xì)胞(WBC)水平比較,差異有統(tǒng)計(jì)意義(P<0.05),紅細(xì)胞(RBC)、血紅蛋白(Hb)和血小板(PLT)水平比較,差異無統(tǒng)計(jì)意義(P>0.05),見表2。
2.3FAB分型分析 按FAB分型,納入研究的144例患者可分為M1、M2a、M2b、M3、M4、M5和M6組,組間比較差異均無統(tǒng)計(jì)學(xué)意義(P>0.05),見表3。
2.4細(xì)胞遺傳學(xué)分析 染色體核型按對預(yù)后影響進(jìn)行分組,分為預(yù)后良好、預(yù)后中等和預(yù)后不良組,預(yù)后不良組按復(fù)雜核型的有無分組和按單體核型有無分組,組間比較差異均無統(tǒng)計(jì)學(xué)意義(P>0.05),見表4。

表1 GMN不同初治原發(fā)AML一般臨床特征[n(%)]

表2 GMN不同初治原發(fā)AML血細(xì)胞常規(guī)和骨髓細(xì)胞形態(tài)分析

續(xù)表2 GMN不同初治原發(fā)AML血細(xì)胞常規(guī)和骨髓細(xì)胞形態(tài)分析

表3 GMN不同初治原發(fā)AML的FAB分型分析[n(%)]

表4 GMN不同初治原發(fā)AML細(xì)胞遺傳學(xué)分析[n(%)]
2.5融合基因分析 檢測到的常見融合基因有AML-ETO、PML-RARA、CBFβ-MYH11和MLL-ELL,組間比較差異均無統(tǒng)計(jì)學(xué)意義(P>0.05),見表5。

表5 GMN不同初治原發(fā)AML融合基因分析[n(%)]
-:采用確切概率法
2.6基因突變分析 對入選患者進(jìn)行基因突變檢測,共檢測到33種基因突變,其中11種組間比較差異均有統(tǒng)計(jì)學(xué)意義(P<0.05),其余22種基因突變組間比較差異均無統(tǒng)計(jì)學(xué)意義(P>0.05),見表6。

表6 GMN不同初治原發(fā)AML基因突變分析(n/n)
-:采用確切概率法
3 討 論
到目前為止,已有大量關(guān)于AML相關(guān)突變基因的研究,但關(guān)于不同GMN對AML的研究少見。本研究把具有不同GMN的AML患者按GMN<2個(gè)和GMN≥2個(gè)分組,通過對其臨床特征差異的對比分析,為AML的診斷分型、治療選擇、隨訪監(jiān)測、預(yù)后估計(jì)及發(fā)病機(jī)制的探討提供參考數(shù)據(jù)。
納入本研究的144例初治原發(fā)AML患者,其中正常核型占40.97%,異常核型占59.03%,符合相關(guān)研究報(bào)道的正常核型的AML占40%~45%[4]。患者一般臨床特點(diǎn)中,性別、既往病史和常見臨床癥狀組間比較差異無統(tǒng)計(jì)學(xué)意義(P>0.05),而年齡比較差異有統(tǒng)計(jì)學(xué)意義(P<0.05)。從整體趨勢可以看出,在GMN<2個(gè)中,AML患者所占比例由60歲以下的77.78% (91/117)降低至60歲以上的51.85% (14/27),而GMN≥2個(gè)中,AML患者所占比例由60歲以下的 22.22% (26/117)升高至60歲以上的48.15%(13/27)。可見,隨著年齡增長,體細(xì)胞突變的概率有增大趨勢,這可能是年齡越大,與外界致突變因素接觸的機(jī)會(huì)越多所致。
對所有患者血細(xì)胞常規(guī)和骨髓細(xì)胞形態(tài)檢查結(jié)果進(jìn)行分析發(fā)現(xiàn),骨髓中原始細(xì)胞,外周血中RBC、Hb和PLT水平組間比較,差異均無統(tǒng)計(jì)意義(P>0.05)。而GMN<2個(gè)外周血WBC低于GMN≥2個(gè)(P<0.05),這與本研究基因突變分析中的GMN≥2個(gè)中NPM1、FLT3-ITD、CEBPA和DNMT3A的突變明顯高于GMN<2個(gè)患者的結(jié)果一致。有文獻(xiàn)報(bào)道,NPMl基因突變陽性AML患者的臨床表現(xiàn)多為初診時(shí)外周血WBC升高[5],F(xiàn)LT3-ITD 突變后患者外周血WBC增高[6],CEBPA基因突變陽性患者往往表現(xiàn)為外周血WBC水平高的特點(diǎn)[7],DNMT3A與高白細(xì)胞、高血小板等檢測指標(biāo)密切相關(guān)[8]。
白血病中常見的基因突變按功能可以分為3類[9]:Ⅰ類是激酶通路信號(hào)轉(zhuǎn)導(dǎo)分子突變,為細(xì)胞提供增殖優(yōu)勢;Ⅱ類是轉(zhuǎn)錄因子突變,導(dǎo)致細(xì)胞的分化和凋亡異常;Ⅲ類是表觀遺傳調(diào)控分子突變,可導(dǎo)致多種基因表達(dá)調(diào)控異常。本研究采用二代測序的方法對144例患者進(jìn)行基因突變檢測,共檢測到33種基因突變,其中11種突變基因在GMN<2個(gè)患者中突變的比例明顯高于GMN≥2個(gè)(P<0.05),根據(jù)以上的基因突變功能分類,這11種突變基因?qū)儆冖耦惖挠蠪LT3-ITD和NRAS;Ⅱ類的有WT1、CEBPA、NPM1、RUNX1和EP300;Ⅲ類的有DNMT3A、IDH1、IDH2和TET2。
Ⅰ類是激酶通路信號(hào)轉(zhuǎn)導(dǎo)分子突變,為細(xì)胞提供增殖優(yōu)勢。本研究GMN≥2個(gè)中共有16例發(fā)生了FLT3-ITD突變。NRAS基因突變在inv(16)/t(16;16)和inv(3)/t(3;3)的AML中多見[10],然而本研究GMN≥2個(gè)中有3例發(fā)生NRAS突變,但無1例有上述染色體異常,究其原因可能是病例收集的時(shí)間和地域跨度小,所以病例覆蓋面較窄,導(dǎo)致NRAS突變基本特征沒有呈現(xiàn)出來。
Ⅱ類是轉(zhuǎn)錄因子突變,導(dǎo)致細(xì)胞的分化和凋亡異常。NPM1突變蛋白能夠通過多種分子機(jī)制來調(diào)控白血病細(xì)胞惡性表型,且已經(jīng)被認(rèn)定為AML中最常見的突變基因,本研究GMN≥2個(gè)中13例發(fā)生NPM1突變。NPM1突變是預(yù)后較好分子標(biāo)志,但其經(jīng)常伴有FLT3-ITD突變,這使NPM1突變陽性患者的預(yù)后降低。CEBPA在造血細(xì)胞分化過程中起重要的調(diào)控作用,過高表達(dá)可見于急性淋巴細(xì)胞白血病,而失活突變常見于AML,本研究GMN≥2個(gè)中有6例發(fā)生CEBPA突變。WT1在AML中發(fā)揮癌基因樣作用,被認(rèn)為是一種“泛白血病”基因標(biāo)志,能夠調(diào)控細(xì)胞的增殖和分化,在AML中表現(xiàn)尤其明顯,WT1 過表達(dá)可在確診的大多數(shù)AML患者中觀察到[11]。本研究144例患者中,發(fā)生WT1突變5例(3.47%);僅1例為正常核型,與上述文獻(xiàn)差異較大,分析其原因,可能是本研究病例數(shù)太少,或是種族和地域差異。本研究GMN≥2個(gè)中4例發(fā)生WT1突變,這與SOLARY等[12]研究結(jié)果一致。RUNX1突變可發(fā)生于編碼區(qū)全長,突變類型可為基因缺失,也可為點(diǎn)突變或短片段的插入/缺失突變,RUNX1突變在多種血液腫瘤中都是預(yù)后不良的指標(biāo)。本研究GMN≥2個(gè)中6例發(fā)生RUNX1突變,對于RUNX1基因,會(huì)想到AML-M2b,因RUNX1-RUNX1T1融合基因很常見。通過本研究分析發(fā)現(xiàn)RUNX1突變常合并的其他基因突變,可對AML的臨床診治有所幫助。在血液系統(tǒng)腫瘤中,EP300的失活突變,導(dǎo)致基因組整體乙酰化水平的降低,基因調(diào)控的異常,潛在地促進(jìn)了腫瘤發(fā)生,也成為這類腫瘤患者一個(gè)治療靶點(diǎn)。本研究納入的144例患者,GMN≥2個(gè)中6例患者發(fā)生EP300突變,EP300突變易合并TET2和IDH2突變,而TET2和IDH2突變則導(dǎo)致基因高甲基化,乙酰化提高基因的空間位阻,使基因沉默,而甲基化則降低空間位阻,使基因活化,可見EP300突變與ET2和IDH2突變會(huì)加劇基因活化異常,從而導(dǎo)致AML的發(fā)生、發(fā)展。
Ⅲ類是表觀遺傳調(diào)控分子突變,可導(dǎo)致多種基因表達(dá)調(diào)控異常,本研究GMN≥2個(gè)中11例發(fā)生DNMT3A突變。DNMT3A和FLT3-ITD、NPM1突變在AML患者中多是共同出現(xiàn)的,且這3種突變分別屬于不同功能的3類突變,這與AML發(fā)病的多重打擊理論是一致的。TET2基因參與調(diào)控造血干細(xì)胞的增殖和分化[13],其表達(dá)水平還與血液腫瘤存在相關(guān)性。本研究GMN≥2個(gè)中9例發(fā)生TET2突變,而TET2突變導(dǎo)致的甲基化異常與EP300突變導(dǎo)致的乙酰化異常經(jīng)常同時(shí)存在,這與本研究關(guān)于EP300突變的分析是一致的。IDH包括IDH1和IDH2,在本研究中2例IDH1突變和3例IDH2突變患者分別發(fā)現(xiàn)于不同個(gè)體,這與同類突變的互斥理論是一致的。
通過以上分析可發(fā)現(xiàn),與伴有1種和不伴有突變基因初治原發(fā)AML患者相比,伴有多種基因突變的初治原發(fā)AML<60歲患者比例降低,≥60歲患者比例增高,且多伴有外周血高WBC,這些經(jīng)常同時(shí)出現(xiàn)的突變基因?yàn)椋孩耦愅蛔僃LT3-ITD和NRAS,Ⅱ類突變WT1、CEBPA、NPM1、RUNX1和EP300,Ⅲ類突變DNMT3A、IDH1、IDH2和TET2,且導(dǎo)致乙酰化異常與甲基化異常的突變基因常常共存。
[1]MARCUCCI G,HAFERLACH T,D?HNER H.Molecular genetics of adult acute myeloid leukemia:prognostic and therapeutic implications[J].J Clin Oncol,2011,29(5):475-486.
[2]ARBER D A,ORAZI A,HASSERJIAN R,et al.The 2016 revision to the World Health Organization classification of myeloid neoplasms and acute leukemia[J].Blood,2016,127(20):2391-2405.
[3]SHAFFER L G,MCGOWAN-JORDAN J,SCHMID M.ISCN(2013):an international system 9 for human cytogenetic nomenclature[M].Basel,Switzerland:Karger,2013:16-31.
[4]蘇龍,李薇,崔久巍,等.正常核型急性髓系白血病NPM1、FLT3-ITD突變與外周血白細(xì)胞數(shù)及骨髓原始細(xì)胞百分比相關(guān)性研究[J].中國實(shí)驗(yàn)血液學(xué)雜志,2013,21(3):571-575.
[5]DUFOUR A,SCHNEIDER F,HOSTER E,et al.Monoallelic CEBPA mutations in normal karyotype acute myeloid leukemia:independent favorable prognostic factor within NPM1 mutated patients[J].Ann Hematol,2012,91(7):1051-1063.
[6]HOU H A,KUO Y Y,LIU C Y,et al.DNMT3A mutations in acute myeloid leukemia:stability during disease evolution and clinical implications[J].Blood,2012,119(2):559-568.
[7]NAOE T,KIYOI H.Gene mutations of acute myeloid leukemia in the genome era[J].Int J Hematol,2013,97(2):165-174.
[8]葉麗,紀(jì)濛濛,孫自敏.急性髓系白血病FLT3基因突變的研究[J].中國實(shí)驗(yàn)血液學(xué)雜志,2015,23(2):322-327.
[9]CHAUHAN P S,IHSAN R,SINGH L C,et al.Mutation of NPM1 and FLT3 genes in acute myeloid leukemia and their association with clinical and immunophenotypic features[J].Dis Markers,2013,35(5):581-588.
[10]FR?HLING S,SCHLENK R F,STOLZE I,et al.CEBPA mutations in younger adults with acute myeloid leukemia and normal cytogenetics:prognostic relevance and analysis of cooperating mutations[J].J Clin Oncol,2004,22(4):624-633.
[11]SCATTONE A,SERIO G,MARZULLO A,et al.High Wilms′ tumour gene (WT1) expression and low mitotic count are independent predictors of survival in diffuse peritoneal mesothelioma[J].Histopathology,2012,60(3):472-481.
[12]SOLARY E,BERNARD O A,TEFFERI A,et al.The ten-eleven translocation-2 (TET2) gene in hematopoiesis and hematopoietic diseases[J].Leukemia,2014,28(3):485.
[13]商臻,王迪,肖敏,等.205例急性髓系白血病患者IDH1基因突變的檢測及其臨床意義分析[J].中國實(shí)驗(yàn)血液學(xué)雜志,2012,20(6):1307-1311.

