PAMD評分在PSA灰區患者行前列腺穿刺活檢中的應用*
伍晟赟,呂 蔡
(1.海南省海口市第三人民醫院泌尿外科 571100,2.中南大學湘雅醫學院 附屬海口醫院泌尿外科,海口 570208)
前列腺穿刺活檢是診斷前列腺癌的金標準[1]。穿刺方法主要包括經直腸和經會陰途徑兩種,目前普遍認可10針以上的前列腺穿刺結果陽性率更高[2]。血清前列腺特異性抗原(prostate specific antigen,PSA)仍是目前篩查前列腺癌的主要指標,針對PSA處于灰區(4~10 ng/mL)的患者是否行穿刺活檢往往還需要參考PSA的衍生指標,如游離PSA(fPSA)與總PSA(tPSA)比值、PSA密度(PSAD)、PSA速率(PSAV)等,但總體陽性率仍偏低。近年來有報道通過對前列腺癌相關影響因素的系統評價有望進一步優化穿刺結果[3-4]。中南大學湘雅醫學院附屬海口醫院自2008年起在省內率先開展經直腸前列腺12針穿刺活檢術,本文總結了具備完整信息且PSA為4~10 ng/mL的患者資料,并探討前列腺體積(prostate volume,PV)、年齡(Age)、核磁共振成像(magnetic resonance imaging,MRI)及肛門指診(degital rectal examination,DRE)4項指標(以下簡稱PAMD)評分對提高前列腺穿刺活檢陽性率的臨床意義。
1 資料與方法
1.1一般資料 選擇2013年1月至2015年6月因可疑前列腺癌且PSA處于灰區在中南大學湘雅醫學院附屬海口醫院行經直腸超聲引導下前列腺穿刺活檢術的患者118例,患者均嚴格按照《中國泌尿外科疾病診治指南》(2014版)前列腺穿刺活檢指征篩選。患者年齡45~88歲,平均(67.18±8.26)歲。術前常規抽取外周血檢測血清tPSA,tPSA水平為4.07~9.93 ng/mL,平均(7.14±1.42)ng/mL;行DRE及MRI分別評價前列腺內有無異常結節,其中DRE結節陽性24例(20.30%)、MRI結節陽性88例(74.60%);行經直腸超聲檢查并計算PV,計算公式為前列腺3個徑線相乘再乘以系數0.52,本組患者PV為15~166 mL,平均(56.57±30.15)mL。
1.2方法
1.2.1穿刺方法 術前腸道準備包括:服用兩聯抗生素3 d,術前晚清潔灌腸,術晨甲硝唑100 mL保留灌腸。選擇腰麻或靜脈麻醉,取截石位,會陰區常規消毒,穿刺前再用聚維酮碘溶液消毒直腸腔。采用日本ALOKA彩超定位儀,配有專用經直腸超聲探頭和穿刺引導架,使用美國Bird穿刺活檢槍,配18G穿刺針。每例患者行系統12針穿刺(傳統6針加上前列腺外周帶底、中、尖部左右各3針)另加可疑結節的靶向穿刺,共穿刺12~15針,各部位穿刺組織分別送病檢,并由兩位病理醫師驗證病理結果。術后給予第2代頭孢菌素聯合甲硝唑靜脈滴注3 d預防感染。
1.2.2PAMD評分系統 PAMD評分中PV<56 mL為2分,≥56 mL為0分;年齡大于或等于67歲為2分,<67歲為0分;MRI結節陽性為2分,結節陰性為0分;DRE結節陽性為1分,結節陰性為0分。將4項指標評分相加,總分為7分,0~<2分為低危組;2~<4分為中危組;≥4分為高危組。
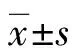
2 結 果
2.1前列腺癌檢出率與患者臨床病理資料的相關性分析 本組118例患者,檢出前列腺腺癌34例(前列腺癌組),陽性率為28.81%。將前列腺增生、前列腺上皮內瘤等其他病理結果歸為非前列腺癌組(n=84)。兩組患者年齡分布、MRI或DRE結節陽性率比較,差異均有統計學意義(P<0.05),但兩組患者的tPSA、fPSA水平及PV比較,差異無統計學意義(P>0.05)。按照本組資料的中位年齡67歲及中位PV 56 mL進一步分組比較,結果顯示,前列腺癌組中年齡大于或等于67歲患者占62.80%,與非癌組比較差異有統計學意義(P=0.019);而前列腺癌組PV<56 mL者占76.47%,與非癌組比較差異也有統計學意義(P=0.000)。兩組患者臨床相關指標比較,見表1。

表1 兩組患者臨床相關指標比較
2.2多變量分析前列腺穿刺陽性率相關影響因素 多元邏輯回歸分析顯示,各變量中PV(≥56 mLvs.<56 mL)、年齡(≥67歲vs.<67歲)、MRI(結節陽性vs.結節陰性)和DRE(結節陽性vs.結節陰性)均可作為獨立的前列腺穿刺陽性率的影響因素,結果見表2。

表2 多變量分析前列腺穿刺陽性率影響因素
2.3PAMD評分系統對前列腺穿刺陽性率的預測價值 按照PAMD評分系統將本組患者分為低、中、高危3組,結果高危組前列腺癌陽性率可達37.00%,明顯高于低、中危組前列腺癌陽性率,見表3。

表3 PAMD評分預測前列腺穿刺陽性率[n(%)]
a:P<0.05,與低危組比較;b:P<0.05,與中危組比較
3 討 論
血清PSA仍是目前篩查前列腺癌的最佳標志物,由于PSA屬于前列腺組織特異性而非前列腺癌特異性,且PSA水平易受到其他因素的干擾,特別是PSA為4~10 ng/mL的灰區時,前列腺癌檢出率普遍偏低。馬宏等[5]報道的365例PSA水平在灰區的患者資料顯示,經直腸前列腺穿刺活檢陽性率為23.84%。本研究結果的前列腺癌檢出率為28.80%(34/118)。為了提高PSA篩查的準確性,往往需要聯合檢測PSA的衍生指標,如fPSA/tPSA、PSAD、PSAV、前列腺健康指數(prostate health index,PHI)[6]等。陳建剛等[3]報道的一組385例患者前列腺癌檢出率為36.1%,通過將年齡、tTPSA、fPSA/tPSA、PV和PSAD等指標作為一個整體來評分(0~5分),結果評分為3~5分的患者前列腺癌檢出率可提高到64%。
近年來隨著MRI技術的不斷進步,其在前列腺穿刺定位中的價值越來越受到重視,如磁共振超聲(MR-US)融合穿刺技術明顯提高了早期前列腺癌的檢出率,但由于需要配備專用軟件,操作較復雜,目前尚處于臨床探索階段[7-9]。而年齡作為前列腺癌發病的主要危險因素已得到公認[10]。此外DRE也是篩查前列腺癌的重要手段之一[11]。本組資料顯示,與非前列腺癌組患者比較,前列腺癌組的年齡分布、MRI結節陽性率及DRE結節陽性率差異均有統計學意義(P<0.05),但兩組間的tTPSA、fPSA水平及PV比較,差異無統計學意義(P>0.05)。按照本組資料中位PV 56 mL進一步分組比較顯示,前列腺癌組PV<56 mL的占76.47%,與非癌組比較差異有統計學意義(P=0.000)。
通過多元邏輯回歸分析結果顯示,本研究中PV(≥56 mLvs.<56 mL)、年齡(≥67歲vs.<67歲)、MRI(結節陽性vs.結節陰性)和DRE(結節陽性vs.結節陰性)均可作為獨立的前列腺穿刺陽性率的影響因素,其OR值分別為4.941(P=0.012)、5.947(P=0.007)、6.010(P=0.023)、39.424(P=0.000)。進一步將PV、年齡、MRI、DRE 4項指標聯合組成PAMD評分系統。結果本組患者高危組前列腺癌陽性率可達37.04%,明顯高于總體陽性率的28.81%及低、中危組的0、12.50%。因此,聯合PV、年齡、MRI、DRE 4項指標的綜合評分體系,相比單一的血清PSA指標,特別是PSA處于灰區的患者,在確定前列腺穿刺時機、提高前列腺穿刺陽性率方面更有優勢,值得臨床應用推廣。
綜上所述,為了提高PSA處于4~10 ng/mL灰區患者的前列腺癌檢出率,減少不必要的穿刺風險及經濟負擔,通過系統評價與前列腺癌篩查密切相關的影響因素,如PAMD評分,有助于指導專科醫師更精準地把握前列腺穿刺適應證和活檢時機。
[1]HEIDENREICH A,BASTIAN P J,BELLMUT J,et al.EAU guidelines on prostate cancer.part 1:screening,diagnosis and local treatment with curative intent-update 2013[J].Eur Urol,2014,65(1):124-137.
[2]山剛志,金杰,郭應祿.不同前列腺穿刺活檢方案檢出前列腺癌的比較[J].中華泌尿外科雜志,2006,27(1):40-42.
[3]陳建剛,陳新鳳,顧棟華,等.建立一種簡易評分系統預測前列腺穿刺活檢前列腺癌陽性率[J].中華男科學雜志,2015,21(1):53-56.
[4]FANG D,REN D,ZHAO C,et al.Prevalence and risk factors of prostate cancer in Chinese men with PSA 4-10 ng/mL who underwent TRUS-guided prostate biopsy:the utilization of PAMD score[J].Biomed Res Int,2015,2015(Suppl 1):596797.
[5]馬宏,萬奔.常規臨床檢查與PSA灰區患者前列腺癌檢出率的關系[J].中華男科學雜志,2013,19(1):40-43.
[6]LUGHEZZANI G,LAZZERI M,HAESE A,et al.Multicenter European external calidation of a prostate health index-based nomogram for predicting prostate cancer at extended biopsy[J].Eur Urol,2014,66(5):906-912.
[7]MARKS L,YOUNG S,NATARAJAN S,et al.MRI-ultrasound fusion for guidance of targeted prostate biopsy [J].Curr Opin Urol,2013,23(1):43-50.
[8]RIDOUT A J,KASIVISVANATHAN V,EMBERTON M,et al.Role of magnetic resonance imaging in defining a biopsy strategy for detection of prostate cancer[J].Int J Urol,2014,21(1):5-11.
[9]SCHOOTS I G,ROOBOL M J,NIEBOER D,et al.Magnetic resonance imaging-targeted biopsy may enhance the diagnostic accuracy of significant prostate cancer detection compared to standard transrectal ultrasound-guided biopsy:a systematic review and meta-analysis[J].Eur Urol,2015,68(3):438-450.
[10]SO W K,CHOI K C,TANG W P,et al.Uptake of prostate cancer screening and associated factors among Chinese men aged 50 or more:a population-based survey[J].Cancer Biol Med,2014,11(1):56-63.
[11]TEOH J Y,YUEN S K,TSU J H,et al.Prostate cancer detection upon transrectal ultrasound-guided biopsy in relation to digital rectal examination and prostate- specific antigen level:what to expect in the Chinese population [J].Asian J Androl,2015,17(5):821-825.

