抑癌基因GKN2在胃癌中的表達及其臨床意義
毛葦 陶力 趙心愷 孔燦燦 鄺繼孫 邱敏霞
胃癌是全球高發的惡性腫瘤,居我國腫瘤發病率的第二位和腫瘤病死率的第三位[1]。胃癌的發病機制目前尚不完全清楚,但原癌基因的激活及抑癌基因的失活是其病變過程中的重要因素。現在已經發現多個特異性基因可能會在胃癌的發病過程中起到重要作用, 其中抑癌基因Gastrokine 2(GKN2)最近受到較多關注。GKN2屬于Gastrokine家族,其特點是家族成員編碼的分泌蛋白中均含有一個保守的BRICHOS結構域[2-3]。BRICHOS結構域是一個保守蛋白結構域,它由約100個氨基酸組成,其保守序列主要位于一對可形成二硫鍵并發揮蛋白折疊作用的半胱氨酸周圍。目前發現含有BRICHOS結構域的蛋白與一系列重大的疾病相關,如BRI2與家族性癡呆有關;ChM-1與軟骨肉瘤相關;SP-C與呼吸窘迫綜合征相關;GKN1與胃癌相關[4-5]。本研究旨在通過比較GKN2在人胃癌組織和正常胃組織中的表達情況,探討GKN2在胃癌發生過程中的表達調節,為進一步研究GKN2在胃癌中的抑癌機制提供基礎。
材料與方法
一、材 料
1.組織標本
1.1 實時定量PCR(RT-PCR)標本
選取2013年1月至2014年12月由中山大學附屬第三醫院外科提供的70例胃癌組織及其相應的癌旁正常組織,所有標本均取自胃癌手術患者并通過組織病理學檢查確認。其中男62例、女8例,年齡(59.4±7.6)歲。
1.2 組織芯片標本
另外選取70例來源于中山大學附屬第三醫院的胃癌病灶手術標本用于組織芯片,其中男59例、女11例,年齡(61.6±6.6)歲,所有胃癌患者術前均未接受化學治療和放射治療。同時選取70例來源于內鏡中心的正常胃黏膜標本,男59例、女11例,年齡(61.0±6.0)歲。2組性別構成、年齡比較差異均無統計學意義(P均>0.05)。
本研究獲得醫院醫學倫理委員會批準,患者均簽署知情同意書。
2.主要試劑
GKN2 兔抗人單克隆抗體購自Abnova公司;β-actin鼠抗人單克隆抗體(BA2305)購自博士德公司;二步法抗兔/鼠通用型免疫組化檢測試劑盒購自DAKO公司;RNeasy Mini Kit購自Quiagen公司;ReverTra Ace-α-TM-RT-PCR Kit購自TOYOBO公司。
二、實驗方法
1.PCR法
1.1 總RNA 提取
使用RNeasy Mini Kit,根據說明書操作。液氮冷凍條件下將組織研磨成粉末狀,將其移入預先準備好的含350 μl RLT液的離心管中,用組織分散機分散組織粉末,5 ml一次性注射器反復抽打10次,4 ℃條件下12 000轉/分離心5 min,將上清液移入1.5 ml離心管。加入同等體積(約350 μl)70%乙醇液,充分混勻后,全部移入吸附柱中,12 000轉/分離心15 s,倒掉收集管內的液體。加入700 μl的RW1液,12 000轉/分離心15 s,倒掉收集管內的液體。先后兩次加RPE液入吸附柱內, 12 000轉/分分別離心15 s和2 min,均棄去收集管內的液體。將吸附柱移入一新的2 ml收集管內,12 000轉/分離心2 min。將吸附柱移入一新的1.5 ml收集管內,加入50 μl RNase-free水,12 000轉/分離心1 min。經紫外分光光度計測定判斷后將所得RNA存儲于-80℃備用。
1.2 逆轉錄合成cDNA
使用ReverTra Ace-α-TM-RT-PCR Kit,根據說明書操作。在0.5 ml Eppendorf管中加入中RNA 1 μg,5×RT Buffer 4 μl、Random Primer(25 pmol/μl)1 μl、10 μmol/L dNTP 2 μl、Rever Tra Ace逆轉錄酶1 μl,再用RNase-Free H2O調整至總反應體系20 μl,充分混勻。將離心管置于PCR儀,設置程序如下:30 ℃ 10 min,42 ℃ 20 min,99 ℃ 5 min,4 ℃ 5 min。反應結束后將離心管瞬間離心,所得cDNA儲存于-20℃冰箱備用。
1.3 PCR擴增
使用Primer 5.0 軟件設計引物:正向引物5′-GTGGCATTTTGGTGGTG-3′ ;反向引物 5′-CATTGTTGCTTGGGCTGA-3′,交由Invitrogen公司合成[6]。PCR擴增根據說明書操作。反應條件:預變性95 ℃ 5 min,變性94 ℃ 30 s,退火53 ℃ 30 s,延伸72 ℃ 1 min,28個循環后72 ℃延伸8 min。PCR擴增完畢后,取擴增產物10 μl混合上樣緩沖液2 μl充分混勻,用1%瓊脂糖凝膠在100 V穩壓下電泳40 min,電泳完畢后使用紫外線凝膠成像儀觀察。
2.免疫組織化學檢查(免疫組化)
2.1 組織芯片制備
從病理科調取原始標本石蠟塊,復習病理診斷及選取芯片打孔位置。比對帶有打孔標記的切片,在供體蠟塊上的相應部位打孔采集組織芯片,將組織芯片轉移到受體蠟塊的孔中,將組織芯片快速連續切片20張,每張約厚4 μm。
2.2 免疫組化染色
將所得組織芯片切片60 ℃烤片,二甲苯脫蠟10 min×3次,梯度濃度乙醇(100%,95%,85%,75%,70%)脫水各5 min,蒸餾水洗5 min×3次。切片置于10 mmol/L檸檬酸緩沖液(pH 6.0)中,微波加熱(95 ℃,10 min)修復抗原,室溫下自然冷卻后磷酸鹽緩沖液(PBS)洗3 min×3次。切片置于0.3%過氧化氫室溫孵育15 min以阻斷內源性過氧化物酶,后PBS洗5 min×3次。正常山羊血清封閉液室溫孵育10 min。滴加一抗室溫孵育1 h(GKN2一抗濃度1∶300)。滴加二抗(HRP標記的即用型二抗工作液)室溫孵育30 min。DAB顯色,蘇木素復染,中性樹膠封片。
三、統計學處理
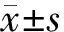
結 果
一、 胃癌組織和癌旁正常組織的GKN2 mRNA對比
RT-PCR結果顯示,GKN2 mRNA在癌旁正常組織中全部高表達,陽性率為100%;GKN2 mRNA在胃癌組織中僅有 7例表達但表達明顯下調,其余表達缺失,陽性率為10%。胃癌組織和癌旁正常組織GKN2 mRNA陽性表達率差異有統計學意義(χ2=63.00,P<0.001),見圖1。

圖1 胃癌組織和癌旁正常組織中GKN2 mRNA的表達
二、 胃癌組織和正常胃組織的GKN2蛋白表達對比
免疫組化結果顯示,70例正常胃組織的GKN2呈強染色,分布在正常胃黏膜上皮細胞的胞漿內,陽性率為100%。而70例胃癌組織標本中,僅有5例呈弱陽性表達,其余65例均表達缺失,陽性率為7%。胃癌組織和正常胃組織的GKN2蛋白陽性表達率差異有統計學意義(χ2=121.33,P<0.001),見圖2。
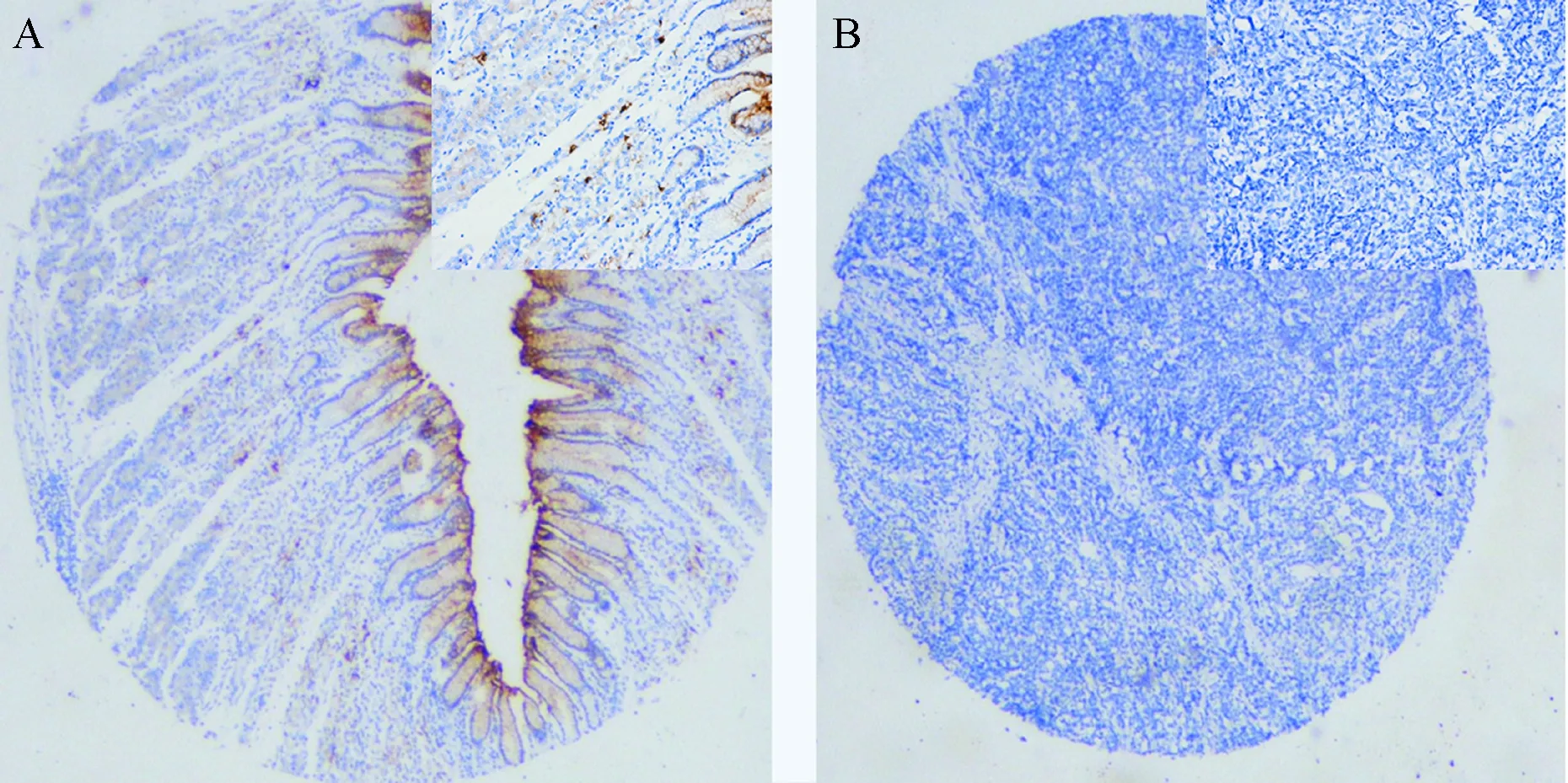
圖2 正常胃組織和胃癌組織的GKN2蛋白表達
討 論
GKN2只特異性地表達于正常胃黏膜上皮細胞,非胃上皮組織組織均無表達[7]。本研究顯示,GKN2主要表達于腺體的中上部分,以胃黏膜表面的上皮細胞最為明顯,越往深部其在腺體中的表達越弱。這與GKN1的表達分布十分相似,我們推測GKN2也可能通過胞吐的方式分泌出去,構成胃上皮黏液層的一部分抵御損害,并促進受損胃黏膜的修復。有研究顯示,在胃黏膜炎性反應過程中,GKN2起著胃黏膜保護作用,能夠抑制幽門螺桿菌對胃黏膜的炎性損害,避免胃黏膜進入癌變過程[8]。這提示GKN2能夠維護胃黏膜上皮的完整性并促進受損的胃黏膜進行修復。GKN2還可與TFF1形成二聚體在正常胃黏膜中表達。而TFF1在胃中起著胃黏膜保護因子的作用,能夠增強胃黏膜上皮防御酸和食物誘發損傷的能力;誘發細胞移行的信號傳導途徑,促進細胞移行從而促進受損黏膜重建;促進胃上皮細胞分化,幫助細胞內蛋白的折疊[9-10]。因此推測GKN2在胃中也扮演類似的黏膜保護作用。
本研究結果顯示,GKN2在正常胃粘膜細胞中高表達,但是在胃癌組織中表達明顯下調甚至缺失。有研究報道GKN2在胃癌細胞株、胃腸上皮化生組織和胃組織中表達明顯下降或缺失[11-12]。這與我們的結果相似,提示GKN2的表達缺失可能是胃癌發生的重要因素。Moss等[13]研究了155個遠端胃腺癌中GKN2的表達趨勢,發現GKN2在大多數胃癌組織中表達缺失或明顯下降;而且GKN2的表達缺失在臨床中可作為提示患者生存期縮短的一個獨立預測指標。目前已經證實GKN2能夠通過促進胃癌細胞的凋亡,抑制胃癌細胞的增殖和侵襲發揮,抑制上皮間質化等抑癌作用。其能夠激活包括JAK/STAT、PI3K/AKT/GSK3β、NF-Kβ等在內的信號通路發揮作用[14]。GKN2與TFF1形成的二聚體也在胃癌中表達下降[15]。而TFF1已經被證實在胃黏膜中具有抑癌作用,TFF1通過調節經典的cyclinD1-CDKs-CKIs-pRb-E2F通路,延遲腫瘤細胞從G1到S期的轉化,從而抑制腫瘤細胞增殖[16]。因而GKN2與TFF1二聚體表達的缺失也可能是參與了胃癌發生的進程。
綜上所述,GKN2在正常胃黏膜中高表達,但是在胃癌中表達下調甚至缺失,這可能是導致胃癌發生的重要因素。

