加味當歸貝母苦參丸對胃癌荷瘤鼠腫瘤組織VEGFA、MMP13和TGF-β表達的影響
樊曉明,翟宇,安霞,吳紅彥,李海龍*
(1.甘肅省定西市中醫院藥劑科,甘肅 定西 743000;2.甘肅中醫藥大學臨床醫學院臨檢基礎教研室,甘肅 蘭州 730000;3.甘肅省中醫方藥挖掘與創新轉化重點實驗室 甘肅省中藥新產品創制工程實驗室 甘肅省中藥藥理與毒理學重點實驗室,甘肅 蘭州 730000;4.甘肅中醫藥大學附屬醫院,甘肅 蘭州 730000)
胃癌是全球高發的惡性腫瘤之一,也是癌癥死因中排第二位的惡性腫瘤[1]。我國腫瘤統計資料顯示[2]:全國惡性腫瘤發病數據中,城市地區惡性腫瘤新發病胃癌排第3位,農村腫瘤登記發病胃癌排第2位,全國惡性腫瘤死亡胃癌排第3位,防控形勢嚴峻。腫瘤的侵襲、轉移是腫瘤復發、治愈率低的重要原因。中醫藥防治腫瘤的優勢十分明顯,在抑制腫瘤增殖、侵襲、轉移等方面具有一定的臨床應用和研究價值,然而相關機制并未闡明。本課題組前期研究顯示:當歸貝母苦參丸干預胃癌和肝癌的體內外實驗均顯示有明確的藥效。另外,加味當歸貝母苦參丸對MFC胃癌荷瘤小鼠具有顯著抑瘤作用,而且可以下調荷瘤小鼠腫瘤組織中的TLR2、TLR4、TLR6、TRAF6和My D88 mRNA和蛋白的表達[3]。當歸貝母苦參丸含藥血清可以抑制胃癌SGC-7901細胞的侵襲轉移[4],而其機制并未闡明。另外,當歸貝母苦參丸加味方可以下調H22肝癌荷瘤小鼠腫瘤組織中MMP13和bFGF mRNA和蛋白的表達[5],進而抑制腫瘤侵襲和血管生成。為明確當歸貝母苦參丸加味方對胃癌荷瘤小鼠腫瘤組織是否也有相同的作用,本研究擬通過實時熒光定量PCR法及免疫組化法檢測荷瘤小鼠胃癌組織中腫瘤侵襲轉移相關標志物VEGFA、MMP13、TGF-β mRNA和蛋白的表達變化,為中醫藥臨床防治胃癌提供有效的科學依據。
1 材料與方法
1.1 實驗動物
SPF級BALB/c-nu小鼠60只,體質量(20±2)g,雌、雄各半,購于北京維通利華實驗動物技術有限公司;合格證號:SCXK(京)2012-0001。飼養條件:室溫20~25℃,濕度45%~55%。實驗動物分籠飼養,進食標準飼料,飲水自由,飼料由甘肅中醫藥大學科研中心動物實驗室提供,MFC前胃癌細胞購自于中科院上海細胞庫。
1.2 儀器與試劑
生物安全柜(力康公司);CO2培養箱(力康公司);熒光倒置顯微鏡(日本OLYMPUS);ABI7500熒光PCR儀(ABI,美國ABI公司)。DMEM培養基(健順生物科技有限公司)、胎牛血清(杭州四季青公司);逆轉錄試劑盒(DR036A,大連寶生物工程有限公司),GoTaq?qPCR Master Mix擴增試劑盒(A6010,promega公司),一抗和二抗分別由博士德生物和中杉金橋公司提供。加味當歸貝母苦參丸主要藥物由黃芪、當歸、浙貝母、苦參、山慈菇等組成,購自甘肅中醫藥大學附屬醫院,順鉑注射液,20 mg/支,江蘇毫森藥業股份有限公司(批號:H20010743)。
1.3 方法
1.3.1 荷瘤鼠模型的建立
將收集好的小鼠體內傳代的細胞計數后,用PBS將細胞濃度調整為15×106/mL的懸液,在小鼠腋下接種胃癌MFC細胞,每只接種量為0.2 mL。
1.3.2 治療及分組
造模后觀察腫瘤達到0.5 cm左右直徑時,剔除體積過大或過小的小鼠,將篩選合格的48只小鼠隨機分設為模型組、順鉑陽性對照組、加味當歸貝母苦參丸高、低劑量組、順鉑聯合加味當歸貝母苦參丸高、低劑量組共6個組。分組后第二天開始治療,模型組:每只小鼠予蒸餾水0.2 mL灌胃, 同時予理鹽水0.1 mL腹腔注射;中藥組予中藥水提物0.2 mL灌胃;聯合組予中藥和順鉑0.1 mL(劑量25 mg/kg)腹腔注射;順鉑組:予蒸餾水0.2 mL灌胃, 同時予順鉑0.1 mL(劑量25 mg/kg)腹腔注射隔日給藥。以上藥物順鉑5日給藥1次,共3次,當歸貝母苦參丸加味方每日1次,共14 d。
1.3.3 RT-qPCR檢測VEGFA、MMP13和TGF-β mRNA的表達
將腫瘤組織從液氮中取出片刻后,用電子天平稱取30 mg置于經DEPC處理的EP管中,加入Trizol試劑裂解液勻漿,常規低溫抽提總RNA后,用無RNA酶水溶解并檢測其質量和濃度。用Takara 036A逆轉錄試劑盒逆轉錄合成cDNA,提取完成后,進行逆轉錄反應,反應條件如下:37 ℃ 15 min,85 ℃ 5 s。使用PREMEGO擴增試劑GoTaq?qPCR Master Mix擴增試劑進行PCR擴增反應。擴增條件為:95℃5 min預變性,95℃ 10 s變性、60℃ 20 s退火40個循環,而后分析溶解曲線,確認擴增產物的特異性,以β-actin作為內參基因,相對表達量計算采取2-△△CT法計算,獨立樣本重復3次檢測, 小鼠VEGF、 MMP13、TGF-β基因的引物序列見表1。
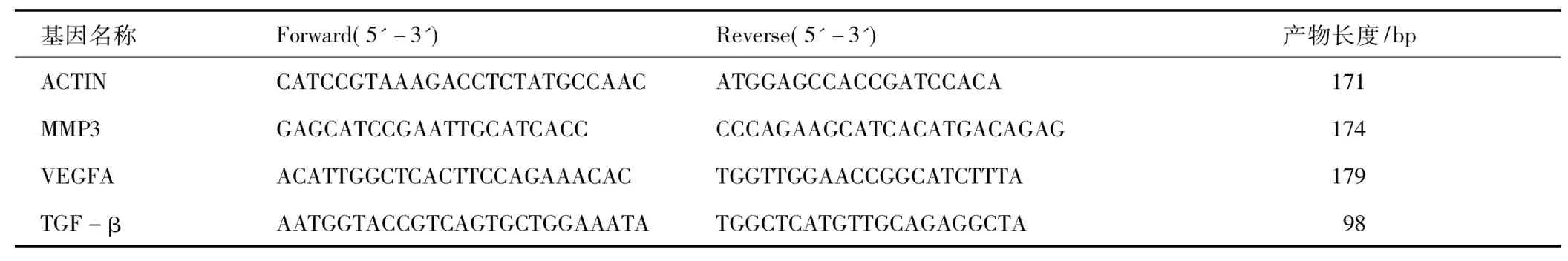
表1 小鼠MMP13、VEGF、TGF-β和基因的擴增引物序列
1.3.4 免疫組織化學技術檢測MMP13、VEGFA和TGF-β蛋白表達
免疫組織化學檢測方法采用ABC法。其簡要過程如下:各組腫瘤組織樣本石蠟切片常規脫蠟水化,以3%去離子水滅活內源性酶10 min,微波修復抗原5 min,間隔重復1次;然后依次滴加一抗、生物素化山羊抗兔;滴加SABC,DAB顯色,蘇木素復染,梯度脫水透明后封片,顯微鏡下觀察、拍照。結果判定:以胞漿中出現棕黃色顆粒為陽性。應用圖像分析系統記錄各組樣本的VEGF、MMP13和TGF-β平均灰度,作為蛋白表達的量化指標。
1.4 統計學處理
2 結果
2.1 RT-qPCR分別檢測VEGFA、MMP13和TGF-β mRNA的表達
各組RT-qPCR結果顯示,與對照組相比,各干預組VEGFA、MMP13、TGF-β mRNA表達量均顯示有不同程度下調,其中中藥高劑量組,順鉑組以及中藥高劑量加順鉑組下調較為明顯。尤其以中藥高劑量加順鉑組用藥組下調表達較為顯著(P<0.05,見表2)。
2.2 免疫組化法分別檢測VEGFA、MMP13和TGF-β蛋白的表達
免疫組化法檢測各指標,圖片顯示:胞漿或胞膜出現的黃色或棕黃色顆粒為陽性著色。各組蛋白表達結果顯示,VEGFA、MMP13、TGF-β蛋白著色與模型組相比呈現深著色現象,表明為強陽性或陽性表達,而模型組呈現弱陽性或陰性表達,差異具有統計學意義。平均灰度分析可見,與模型組比較,各治療VEGFA、MMP13和TGF-β的表達均有下降,順鉑組VEGFA、MMP13、TGF-β的表達改變優于中藥低劑量組、高劑量組;中藥高劑量加順鉑組、中藥低劑量加順鉑組VEGFA、MMP13、TGF-β的表達改變明顯優于順鉑組、中藥高劑量、低劑量組。見表3,圖1~3。
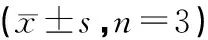
表2 各組腫瘤VEGFA、MMP13和TGF-β的mRNA表達的比較
注:與模型組比較,▲P<0.05,▲▲P<0.01;與中藥低劑量組比較,△△P<0.01;與順鉑組比較,▼P<0.05,▼▼P<0.01;與中藥高劑量組比較,※P<0.05,※※P<0.01

圖1 免疫組化染色檢測各組MMP13表達(免疫組化染色,×400)

圖2 免疫組化染色檢測各組VEGF表達(免疫組化染色,×400)
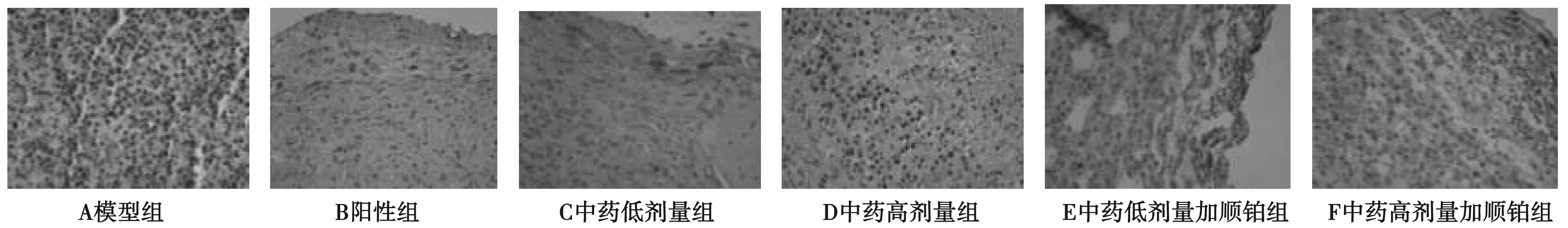
圖3 免疫組化染色檢測各組TGF-β表達(免疫組化染色,×400)

組別n MMP13VEGFATGF-β模型組571.43±4.5986.67±2.6597.34±3.77順鉑組599.53±2.12▲▲114.94±3.08▲▲119.53±1.47▲▲中藥低劑量組580.61±2.06▼▼95.61±3.12▲▼▼103.33±2.01▼▼中藥高劑量組587.45±1.65▲▲△△▼▼105.24±2.46▲▲△△▼▼114.86±1.97▲△△▼中藥低劑量加順鉑組5109.36±1.96▲▲△△▼▼※※119.29±1.12▲▲△△※※123.73±1.42▲▲△△▼※※中藥高劑量加順鉑組5115.71±2.25▲▲△△▼▼※※123.66±1.90▲▲△△▼※※127.92±1.84▲▲△△▼▼※※
注:與模型組比較,▲P<0.05,▲▲P<0.01;與中藥低劑量組比較,△△P<0.01;與順鉑組比較,▼P<0.05,▼▼P<0.01;與中藥高劑量組比較,※P<0.05,※※P<0.01
3 討論
侵襲轉移是腫瘤的惡性表征之一,難以徹底治愈的重要原因。近年來,通過重要生物標志物靶向治療是抑制腫瘤侵襲轉移研究的熱點之一。其中,血管內皮生長因子A(vascular endothelial growth factor A,VEGFA)具有促進細胞遷移、增殖和血管形成的作用[6],人基質金屬蛋白酶-13(matrix metalloproteinase-13,MMP13)作為蛋白水解酶降解細胞外基質參與腫瘤侵襲轉移[7],轉化生長因子-β(transforming growth factor-β,TGF-β)直接依賴于Smad,p38 MAPK, 和PI3K/Akt多個腫瘤抑制和腫瘤促進作用侵襲轉移[8]。因此,VEGFA、MMP13、TGF-β均為腫瘤侵襲轉移相關的重要腫瘤標志物。黃鋼丁等[9]研究顯示,胃癌組織MMP-13蛋白表達率顯著高于癌旁組織,淋巴結轉移組顯著高于無轉移組;胃癌組織MMP-13蛋白表達率增高與胃癌的浸潤和轉移有關。文獻報道,胃癌腫瘤組織中MMP-13的高表達與總生存期縮短呈顯著相關[10]。因此,MMP-13可作為判斷胃癌惡性程度和預測預后的參考指標。
TGF-β的表達與腫瘤的浸潤深度、淋巴結轉移及TNM分期密切相關;TGF-β1陽性的患者比其陰性的患者更易發生淋巴結和遠處轉移[11];研究報道,胃癌細胞中高表達的TGF-β1的可以誘導腹膜間皮細胞纖維化,伴有E-cadherin上調,αSMA下調[12]。TGF-β1受體阻滯劑SB-431542可以阻斷上述改變,部分減輕早期胃癌腹膜播散。TGF-β1誘導胃癌細胞的浸潤轉移,經由fascin蛋白介導,包括ERK和JNK信號轉導通路也參與其中。
胃癌組織中VEGF的表達顯著高于正常胃黏膜組織;且癌組織中VEGF的表達與腫瘤浸潤深度、淋巴轉移、遠處轉移、靜脈侵犯和TNM分期均有顯著相關性[13-14]。對于接受根治性手術治療的Ⅰ~Ⅲ期胃癌患者,VEGF和HIF-1α陽性表達可能是影響胃癌患者的不良預后因素[15]。高表達VEGFA和VEGFC的胃癌組織,其腫瘤體積較大,淋巴管密度、微血管密度、淋巴管浸潤、淋巴結轉移程度高于癌周組織[16]。而且,體外實驗研究顯示,沉默VEGF-A基因的表達能顯著抑制胃癌細胞增殖[16-17];動物體內試驗顯示,沉默VEGFA基因能縮小腫瘤體積。研究報道[7]:沉默VEGFA 基因還可以下調荷瘤鼠腫瘤組織中SIRT1、Survivin和Bcl-2的表達,而上調p53和p21的表達。
本研究顯示:當歸貝母苦參丸加味方可抑制腫瘤組織中VEGFA、MMP13和TGF-β mRNA RNA和蛋白的表達, 并且在與化療藥物聯用后,VEGFA、MMP13和TGF-β mRNA和蛋白的下調表達更加明顯,加味當歸貝母苦參丸可以調控VEGFA、MMP13和TGF-β的表達,發揮抗腫瘤作用。
當歸貝母苦參丸出自《金匱要略》,原用于治療妊娠小便困難,具有養血開郁清熱除濕的功效。加味當歸貝母苦參丸在此基礎上加黃芪、全蝎、山慈菇等益氣解毒藥組成新方。新方具有益氣扶正,養血活血,化痰散結,清熱利濕,解毒散結,通絡止痛等功效,新方契合了腫瘤正氣不足,痰(濕)濁、癌毒、瘀血內阻的發病機制。前期研究顯示,當歸貝母苦參丸對消化道常見腫瘤胃癌和肝癌具有明確抑瘤作用和相應機制[3-5]。現代藥理學研究表明,本研究中所用藥材含有效成分,如黃芪多糖、當歸多糖、貝母堿、苦參堿等成份均對多種癌細胞有明顯的抑制作用,這些有效成分可能是抗腫瘤作用的物質基礎。綜上所述,當歸貝母苦參丸加味方發揮對荷瘤小鼠MFC胃癌的抗腫瘤作用與下調VEGFA、MMP13和TGF-βmRNA的表達和蛋白的表達有關。

