血尿酸與非酒精性脂肪肝的相關性研究進展
王麗瑩,李強
非酒精性脂肪肝(NAFLD)病理學定義為肝臟脂肪含量超過肝總重量的5%,要求男性飲用乙醇量<20 g/d(140 g/周),女性飲用乙醇量<10 g/d(70 g/周)[1]。在西方國家,NAFLD患病率為20%~50%,亞洲為5%~18%[2]。并且NAFLD在各個年齡人群均有發病,在非肥胖型成年人中患病率為10%~15%,肥胖型成年人中為70%,特別值得注意的是在10歲以下兒童中其患病率約為10%,青少年中為17%,肥胖兒童甚至增長至40%~70%[3]。NAFLD患病率也在逐年增加,LU等[4]于我國浙江進行的歷時8年的隨訪研究表明,NAFLD患病率為35.47%,新發患者為17.30%,患病率增長46.46%,僅有6.31%患者恢復正常。血尿酸(SUA)是脊椎動物體內嘌呤代謝的終產物,其中人類由于嘌呤代謝過程短而迅速,與其他動物相比其SUA水平較高,較易發生高尿酸血癥。而SUA水平增加促進胰島素抵抗(IR)、線粒體和內質網氧化應激、NLRP3炎癥復合體的發生發展。SUA不僅與痛風、關節炎及腎臟疾病有關,還與包括心血管疾病和代謝綜合征相關的一系列疾病密切相關,且SUA水平升高在2型糖尿病(T2DM)、NAFLD發生發展中起至關重要的作用。
NAFLD具有廣泛的組織學圖譜,包括簡單脂肪變性、脂肪性肝炎、肝纖維化和肝硬化。簡單脂肪變性被認為是一個良性的過程,被稱為“沉默的肝臟疾病”,CHALASANI等[5]研究表明,1%~5%的簡單脂肪變性將進展為肝硬化,但脂肪性肝炎進展為肝纖維化及肝硬化的比例約為30%,其甚至可進展為終末期肝病和肝癌。CLEMENTE等[3]和WONG等[6]預測,在下一個10年NAFLD將成為肝臟移植的最重要病因,甚至發生在少年時期。可見加強NAFLD的綜合管理意義重大。為此,本文結合SUA病理生理作用與NAFLD流行病學特點、機制等,闡述SUA與NAFLD的相關性及相關機制,為有效管理與監測NAFLD提供理論支持。
1 SUA的病理生理作用
SUA生成及代謝途徑如圖1[7]。人體內SUA的來源包括內源性SUA(來自細胞代謝的核蛋白)和外源性SUA(飲食),而其排泄受腎臟血漿流量、腎小球濾過率等影響,生成和排泄的動態平衡是SUA穩定的前提。因此產生過量或排泄減少均會引起SUA水平增加。其常見的原因包括代謝綜合征(MS)、高糖高脂飲食、腎功能障礙等。SUA不僅與痛風、關節炎及腎臟疾病有關,還與心血管代謝疾病密切相關,包括心血管疾病和與MS相關的一系列疾病[8]。SUA在體內既有抗氧化作用,又有促氧化作用。
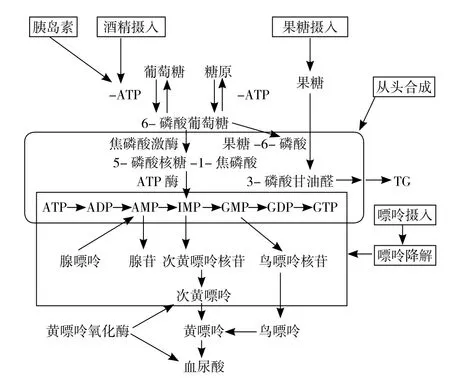
圖1 SUA生成及代謝途徑Figure 1 Production and metabolic pathway of SUA
1.1 SUA的抗氧化作用 SUA可以在尿酸酶的氧化作用下轉化為尿囊酸,在進化過程中,尿酸酶基因發生沉默,人體無法分解SUA,所以與其他哺乳動物相比其SUA水平較高,較易發生高尿酸血癥。但是,這種相對高SUA狀態對于人體仍具有保護作用,體內SUA可以通過中和氧化劑分子來起到抗氧化的作用;常見的氧化劑分子有羥自由基、過氧化氫和過氧亞硝酸鹽等[9]。KAMOGAWA等[10]采用電子自旋共振(ESR)法評估SUA、谷胱甘肽、依達拉奉清除氧自由基的能力,結果發現,對超氧陰離子自由基的清除速率常數最高的是SUA,并且SUA對甲基自由基及叔丁基過氧自由基清除速率常數僅略低于超氧陰離子自由基。對于部分中樞神經系統退行性變和神經炎性疾病,如多發性硬化癥、帕金森病和急性卒中,研究發現迅速提高SUA水平有助于緩解上述疾病的病情并延緩疾病進展[11],但值得注意的是慢性SUA水平升高會加重卒中風險。ASHTARI等[11]的Meta分析共納入研究對象2 493名,其中帕金森病患者1 217名,健康對照者1 276名(性別、年齡匹配),應用Stata 12.0統計數據軟件進行統計分析,結果顯示,帕金森病患者SUA水平明顯低于健康對照者,且男性患者較女性患者差異更明顯。不僅在神經系統,在心血管系統SUA也具有明顯的抗氧化作用,體外培養的主動脈內皮細胞及脂肪細胞發現,SUA可以阻斷神經元中過氧亞硝基陰離子介導的亞硝基化作用,減少白細胞滲出,但其對過氧亞硝基陰離子無直接的清除作用,而是通過減少內皮細胞對一氧化碳的利用度,進而抑制一氧化碳參與的亞硝基化作用[12]。在人類進化的過程中,SUA的抗氧化作用為生存優勢之一,這對人類的生存發展意義重大。
1.2 SUA的促氧化作用 SUA的抗氧化作用具有局限性,疏水環境對SUA的抗氧化作用是不利的,即SUA只有在親水環境中表現出顯著的清除氧自由基的抗氧化作用,但在親脂的環境下由于其不能打破脂質膜而失去抗氧化作用。氧化脂質可以使SUA轉變為促氧劑,SUA與其他氧化劑反應也可以轉變為促氧劑,進而產生氧自由基,而且產生的氧自由基靶目標為脂質〔低密度脂蛋白(LDL)、脂質膜〕。與未分化脂肪細胞相比,分化脂肪細胞的表型特征是具有較高的尿酸鹽攝取率、尿酸鹽轉運蛋白的超表達并且有大量活性氧(ROS)產生。有研究應用硝基氮藍四唑(NBT)測量ROS產生量,與無SUA組相比,SUA水平為1~15 mg/dl時,脂肪細胞分化過程中產生了大量ROS,隨著SUA水平及培養時間的增加,ROS產生量明顯增加,但未分化脂肪細胞組無明顯變化;應用ROS特異性熒光探針H2DCFDA檢測ROS,也發現相同結果,可見SUA可以誘導分化脂肪細胞產生ROS;應用尿酸鹽跨膜轉運抑制劑丙磺舒和苯溴馬隆處理細胞,發現兩種抑制劑均可阻止ROS產生,可見SUA必須進入細胞才能誘導ROS產生[13]。研究發現,SUA的這種作用可以被細胞滲透超氧化物歧化酶MnTMPyP阻斷,也可以被還原型煙酰胺腺嘌呤二核苷酸磷酸(NADPH)氧化酶的抑制劑〔N-乙酰半胱氨酸、夾竹桃麻素、二苯基碘(DPI)〕削弱,但線粒體呼吸鏈阻滯劑〔2-噻吩甲酰三氟丙酮(TTFA)、魚藤酮〕并未影響SUA的作用結果,表明SUA誘導ROS產生取決于NADPH氧化酶而不是線粒體呼吸鏈[14]。以上研究證明,SUA可以通過參與細胞內NADPH氧化酶過氧化物生成系統成為助氧化劑。SUA的促氧化作用與NAFLD、MS等多種代謝性疾病密切相關[7]。
2 SUA與NAFLD關系及相關機制
2.1 SUA與NAFLD的相關性 隨著研究的深入,越來越多的證據表明SUA與NAFLD的發生發展密切相關,但二者的因果關系,仍存在爭議[15-22]。LIU等[15]進行的橫斷面研究共納入1 365名肥胖成年人,通過超聲診斷NAFLD,NAFLD發生率男性為71.5%,女性為53.8%;NAFLD組SUA水平和高尿酸血癥發生率均顯著高于對照組;去除IR、MS和其他潛在混雜因素后,發現升高的SUA與NAFLD發生率的增加獨立相關,調整后的OR值為1.528~2.031(P<0.001);使用多變量分數多項式(MFP)建模,模型顯示,SUA水平與NAFLD的發生風險獨立相關且有線性相關關系;結構方程模型(SEM)顯示,SUA可能直接增加NAFLD的發生風險并且增加空腹胰島素、血壓、三酰甘油(TG)、高密度脂蛋白膽固醇(HDL-C)水平。除了簡單的脂肪定性研究,LIN等[16]進行了肝臟脂肪定量(LFC)研究,結果顯示,LFC為SUA的獨立影響因素,二者呈正相關,LFC>10%組較LFC<5%組SUA水平明顯升高。LIU等[17]進行的Meta分析共納入了9篇高質量的前瞻性研究,其中7篇是基于SUA與MS相關性的研究(共入選23 081名男性及12 195名女性),有6篇提供原始數據并且通過重新提取分析(共包括34 222名參與者,其中5 032名MS患者),結果顯示,SUA水平每增加1 mg/dl,MS發生率男性增加5%,女性增加9%,而且在同等SUA水平上年齡<52歲的女性與同年齡男性及老年女性相比更容易發展為MS;另2篇是基于SUA與NAFLD相關性的研究(入選4 492名男性及8 139名女性),結果顯示,SUA水平每增加1 mg/dl,NAFLD發生風險約增加1.03。為了排除性別對研究結果的影響,YU等[18]進行了一項性別特異性縱向研究,包括14 442名健康參與者(8 715名男性和5 727名女性),用Cox比例風險模型來量化SUA水平與MS的關聯性,經過6年的隨訪,有4 215名參與者(2 974名男性,1 241名女性)新發以NAFLD為主的代謝性疾病,并且SUA每增加1 mg/dl,風險比男性為1.094、女性為1.148。國內外多項研究也相繼驗證以上觀點[16,18-21]。
然而,流行病學研究無法從分子機制方面闡明SUA水平升高是否為NAFLD發生發展的決定性因素。WAN等[22]通過體內實驗及體外實驗證明了SUA在NAFLD發生發展中的核心作用;體內實驗選取C57BL/6小鼠,隨機分為高UA組(HUA組)、高脂飲食組(HFD組)及正常飲食組(SCD組),經過8周喂養后,分析小鼠血清學指標及肝內TG水平的組間差異,其中肝內TG水平通過HE染色和油紅O染色測定,結果顯示,HUA組及HFD組小鼠與SCD組相比SUA、血清TG水平和肝內TG水平均顯著升高,而且與HFD組相比,HUA組肝內TG水平更高;體外實驗選取人肝癌細胞系HepG2和人正常肝臟細胞系LO2,根據培養液不同分為SUA組、SUA+游離脂肪酸組、SUA+丙磺舒組,每個實驗組又根據SUA水平的不同分為4個亞組,培養48 h后,通過油紅O染色比較細胞內TG水平,結果顯示,細胞內TG水平隨著SUA水平升高而增加,SUA增加了游離脂肪酸誘導細胞內TG的積累,由于丙磺舒可以阻斷SUA進入細胞,SUA+丙磺舒組細胞內TG水平明顯低于其他兩組,SUA可以誘導HepG2細胞內的TG積累,同時丙磺舒顯著削弱SUA的這種促進作用。可見無論體內實驗或體外實驗均證明,SUA可增加肝內TG沉積,在NAFLD發生發展中起關鍵作用。
2.2 SUA與NAFLD發生的相關機制 SUA與NAFLD發生的可能機制可以概括為圖2[23],其包括MS、肥胖、高果糖飲食等導致SUA水平增加,引起胰島素敏感性降低、線粒體氧化應激、NLRP3炎癥復合體激活,進而導致體內ROS增加及內質網應激,最終導致NAFLD,而且在NAFLD發生過程中各種危險因素又相互促進,是一個復雜的過程。
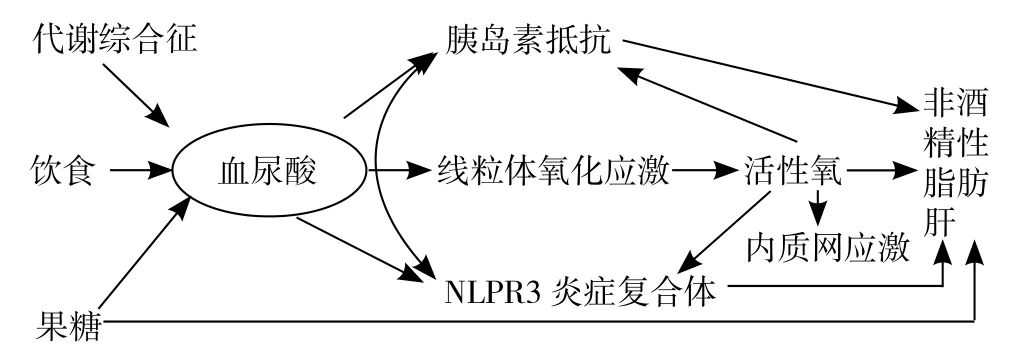
圖2 高尿酸血癥與NAFLD發生相關機制Figure 2 Relationship between hyperuricemia and NAFLD
2.2.1 高尿酸血癥與IR 胰島素的生理作用之一是其可以作用于近端腎小管,增加SUA的重吸收,導致體內SUA水平增加,但LI等[24]研究發現,SUA水平增加可以通過降低體內一氧化氮(NO)的生物利用度進而引起IR。而且胰島素是細胞色素P450 4A(CYP4A)的主要抑制劑,因此IR顯著增加了ROS,促進氧化應激。胰島素的主要抑制作用是細胞毒性和脂質過氧化。這些細胞毒性物質及脂質過氧化產物可以擴散到細胞外,影響枯氏細胞和肝星狀細胞誘導的核轉錄因子κB(NF-κB)通路,導致腫瘤壞死因子α(TNF-α)等促炎因子增加[25]。ZHI等[26]進行的小鼠實驗模型探究高尿酸血癥引起心肌細胞IR的具體機制,研究將小鼠心肌細胞暴露于高SUA的環境中,用熒光的方法量化葡萄糖的吸收,探究IR程度和ROS產生情況,通過免疫印跡技術檢測胰島素受體水平,研究發現,高SUA可以抑制胰島素誘導的葡萄糖吸收,通過抑制蛋白激酶B的磷酸化和增加肝臟、肌肉、脂肪組織胰島素受體底物磷酸化,進而抑制胰島素信號傳導,降低胰島素的敏感性,增加IR程度。高SUA也可誘導氧化應激和激活NLRP3炎癥復合體,進而加重IR[27]。相關前瞻性研究也進一步驗證,藥物降低SUA水平可以增加胰島素的敏感性,該研究共納入腎功能正常門診患者121例,包括高尿酸血癥組(73例)和SUA正常組(48例),將高尿酸血癥組隨機分為實驗組(40例,應用別嘌呤醇)和對照組(33例,應用安慰劑),經過3個月的觀察,結果顯示,實驗組空腹血糖、空腹胰島素、穩態胰島素評價指數(HOMA-IR)較基線水平均明顯改善,但其他兩組沒有明顯差別[28]。可見降低SUA水平有助于增加胰島素敏感性。
2.2.2 高尿酸血癥與線粒體、內質網氧化應激 在肝臟脂肪變性的過程中,線粒體、內質網氧化應激起至關重要的作用。線粒體氧化應激抑制三羧酸循環中順烏頭酸酶活性,檸檬酸堆積,從而促進肝細胞中的脂肪沉積與合成。LANASPA等[29]提出高SUA會激發細胞線粒體氧化應激,誘導肝細胞中脂質重新合成,最終使細胞內脂質合成增加;該研究通過測定DCF熒光強度比較氧化應激情況,結果顯示,隨著SUA水平的增加,DCF熒光強度明顯增加,而且別嘌呤醇能顯著降低高SUA組DCF熒光強度;研究人員應用線粒體染色(Mitsox)發現,與對照組相比,高SUA組線粒體熒光復合物顯著增加,通過JC-1染色測定線粒體膜電位也發現SUA可明顯降低線粒體膜電位;可見SUA誘導細胞氧化應激主要發生在線粒體。為探究SUA促進線粒體氧化應激是否與NADPH氧化酶亞基NOX4易位到線粒體有關,將HepG2細胞暴露于高SUA環境培養24 h,應用共聚焦顯微鏡及ACAA2標記線粒體,研究發現NOX4位于正常HepG2細胞的細胞質中,當細胞暴露于SUA中24 h后,NOX4轉移到線粒體中,應用免疫組化法分離出的NOX4水平也隨SUA水平的增加明顯增加;相反,NOX4基因敲除細胞與對照組相比,線粒體熒光復合物水平顯著下降;可見SUA聯合誘導線粒體氧化應激與NADPH氧化酶亞基NOX4的線粒體易位有關。
氧化應激產生的ROS也會引起內質網氧化應激,導致肝臟脂肪沉積。內質網是調節蛋白質合成后折疊及脂質類固醇產生的場所,任何原因引起內質網生理功能紊亂均會引起內質網對蓄積在網腔內的錯誤折疊或未折疊蛋白質進行處理,進而維持細胞的正常功能。當內質網應激時,會激活未折疊蛋白效應(UPR),以保持內質網穩態,但當UPR不足時,將誘導細胞損傷甚至凋亡。內質網氧化應激激活固醇調節元件結合蛋白-1c(SREBP-1c),調節脂質代謝,促進脂肪沉積。SUA可以誘導編碼內源性脂質酶基因的表達,進而增加內源性SREBP-1c的表達,誘導內質網氧化應激,當SUA水平>6 mg/dl時,HepG2細胞及大鼠干細胞內TG水平明顯增加,SUA水平為12 mg/dl時,細胞內會發生內質網氧化應激[30]。高尿酸血癥引起的線粒體、內質網氧化應激與多種代謝性疾病密切相關[31]。
2.2.3 高尿酸血癥與NLRP3炎癥復合體 NLRP3炎癥復合體是細胞內多蛋白復合物,為固有免疫的重要組成部分,包括NOD樣受體(NLR)、凋亡相關微粒蛋白(ASC)、效應分子胱冬肽酶-1前體(pro-caspase-1),能夠調節caspase-1的活化進而在固有免疫防御的過程中促進細胞因子前體pro-IL-1β和pro-IL-18的切割成熟,誘導分泌白介素(IL)-1β和IL-18,在機體免疫反應和疾病的發生中具有重要作用。而且NLRP3炎癥復合體在肥胖、IR、脂質代謝異常及肝細胞脂肪變性中均起到重要作用[32]。CAI等[33]通過蛋白質印跡法及PCR法檢測肝臟枯否細胞中NLRP3、ASC基因、caspase-1水平,并應用酶聯免疫吸附試驗法測定IL-1、IL-18水平,發現在NAFLD小鼠模型中,NLRP3通過誘導枯否細胞分泌IL-1β和IL-18發揮促炎作用;相反,NLRP3基因敲除小鼠模型在相同條件下其NLRP3炎性小體的上調和促炎因子IL-1β、IL-18的激活均明顯受抑制;實驗證明NLRP3炎癥復合體在NAFLD發生發展中起重要作用。SUA不僅促進肝細胞變性、增加胰島素信號傳導障礙,而且直接誘導肝細胞脂肪沉積和IR,還可以通過激活NLRP3炎癥復合體活性促進以上過程發展。用實時熒光定量PCR法檢測發現,經過高SUA喂養的小鼠與正常飲食及高脂喂養小鼠相比,肝細胞內NLRP3、caspase-1、IL-1β、IL-18 mRNA水平明顯上調,而且用蛋白質印跡法及酶聯免疫吸附試驗法檢測到NLRP3、caspase-1、IL-1β、IL-18水平均明顯高于對照組,用藥物降低SUA水平后NLRP3表達水平明顯下降[33]。不僅在體內,用類似的方法培養HepG2和LO2細胞系,也發現高SUA培養的細胞中NLRP3、caspase-1、IL-1β、IL-18水平增加,可見無論在體內還是體外,SUA均具有誘導NLRP3炎癥復合體表達的作用[34]。SUA可能是NAFLD和IR新的治療靶點。
2.2.4 SUA與果糖代謝 與葡萄糖相比,果糖更容易誘導小鼠發生IR。果糖可以誘導大鼠MS、氧化應激、內皮功能障礙、脂肪肝、蛋白尿和腎臟疾病的發生。RONCAL-JIMENEZ等[35]的動物實驗發現,與果糖相比,在同樣的攝入量下葡萄糖對MS等沒有明顯的誘導作用。對果糖的這種特殊的誘導作用存在多種假設,目前為大家普遍接受的是果糖的特殊代謝途徑,即果糖與葡萄糖的初始代謝不同,果糖代謝的第一個酶是果糖激酶(KHK),其主要發生在肝臟,是快速的、沒有任何負面反饋的過程,使細胞內磷酸鹽和ATP迅速下降。細胞內磷酸鹽的減少刺激AMP脫氨酶(AMPD)催化降解為一磷酸肌苷,最后代謝產物為SUA,進而使細胞內SUA水平增加[36]。細胞內尿酸由肝臟釋放入血引起SUA水平增加。KHK包括HKH-c和KHK-a兩個亞型,其中HKH-c迅速消耗ATP并生成SUA,KHK-a緩慢消耗ATP,ISHIMOTO等[37]研究表明,HKH-c和KHK-a基因敲除的小鼠中,沒有MS和脂肪肝的發生,但當選擇性敲除KHK-a基因時,在攝入總熱量及果糖量相同的情況下,上述疾病的發生比例明顯增加。SUA還可以激活核轉錄因子、碳水化合物反應結合蛋白(ChREBP),增加肝細胞內KHK水平,而KHK水平增加時TG對果糖的反應也會增強,導致脂肪堆積及MS。LANASPA等[38]將HepG2細胞于不同水平SUA培養基中培養72 h,應用免疫組化法檢測KHK水平,發現隨著SUA水平增加,KHK水平增加并且具有劑量依賴性,而且在SUA水平為750 mmol/L時,KHK水平于暴露24 h后增加35%,在暴露48 h和72 h時具有更大的增量。為探究果糖誘導的KHK水平上調是否同樣是SUA介導的,研究將HepG2細胞暴露于果糖中培養72 h,應用免疫組化法檢測到KHK水平明顯上調,但應用SUA KHK水平顯著降低[35]。可見SUA可以誘導KHK表達,并且可以促進果糖誘導KHK表達。有研究通過免疫沉淀法檢測ChREBP基因乙酰化狀態來確定ChREBP基因水平,發現SUA誘導KHK表達的作用是通過ChREBP介導的[35]。
3 小結及展望
SUA的病理生理作用決定其在人體代謝中的獨特性。越來越多的證據表明體內SUA水平與NAFLD發生發展密切相關[8,31,39-40]。SUA可以促進IR及線粒體、內質網氧化應激的發生發展,并且SUA可以誘導果糖代謝,這些機制均與NAFLD的發生發展有關。但目前仍缺乏大規模前瞻性研究,應進一步探究并明確SUA與NAFLD的因果關系,為有效管理相關代謝性疾病提供理論依據。

