氟比洛芬酯相關肝損害的自動監(jiān)測與風險因素研究
劉 浩,宋艷東,趙粟裕,柴 棟,馬 亮,郭代紅( .解放軍總醫(yī)院藥學部臨床藥學中心,北京 00853;.天津醫(yī)科大學藥學院,天津 300070)
氟比洛芬酯注射液(flurbiprofen axetil injection,FA)2004年在中國上市,商品名:凱紛。作為非甾體抗炎藥氟比洛芬的酯類前體藥物,能夠非選擇性地抑制環(huán)氧合酶,阻斷前列腺素合成,臨床上用于緩解術后及因癌癥引起的疼痛。常見的不良反應為惡心、嘔吐、頭痛、嗜睡等,罕見嚴重不良反應有急性腎衰、胃腸道出血、伴意識障礙的抽搐[1]。筆者臨床實踐中發(fā)現該藥對患者肝功能有相關影響,而查閱文獻及說明書等證據并不充分[2],因此利用我院自主研發(fā)的“醫(yī)療機構ADE主動監(jiān)測與智能評估警示系統”(adverse drug events active surveillance and assessment system,ADE-ASAS)[3-6],對真實世界中FA致藥物性肝損害(drug induced liver injury,DILI)的發(fā)生率進行評估測算,獲取FA相關DILI準確發(fā)生率,同時分析評估FA致DILI的相關風險因素。
1 資料與方法
1.1 研究對象
利用ADE-ASAS回顧性監(jiān)測2017年1月- 12月期間在我院使用FA(北京泰德制藥股份有限公司,注冊證號0499003IJ1,規(guī)格 5 mL:50 mg)的所有住院患者。采集患者年齡、身高、體重、體重指數(BMI)、性別、既往史、診斷信息、飲酒史、用藥史、手術史及DILI等基本信息,必要時查閱住院治療經過、臨床癥狀、基本生命體征、儀器檢查及實驗室檢查結果。
1.2 DILI事件配置器參數設置
基于國家藥品不良反應監(jiān)測中心制定的《藥品不良反應術語使用指南》設計“DILI”事件配置器標準,包括入選標準、排除標準、篩選標準。
1.2.1 病例入選標準經靜脈途徑使用FA;臨床資料及用藥醫(yī)囑完整、準確、可靠。
1.2.2 病例排除標準①排除以下病區(qū)的病例:肝膽外科、腫瘤外二科(接收肝膽癌患者);排除有以下基礎疾病的病例:肝膽癌、酒精性肝病、肝膽部位感染、遺傳代謝性肝病、非酒精性脂肪性肝病、妊娠急性脂肪肝、自身免疫性肝病、膽汁淤積性疾病、急性中毒、病毒性肝病等。②排除用藥前指標異常的患者:使用FA前丙氨酸氨基轉移酶(ALT)或天門冬氨酸氨基轉移酶(AST) > 40 IU·L-1或/和總膽紅素(TB) > 21 μmol·L-1或/和直接膽紅素(DB) > 8.6 μmol·L-1;系統篩選病例之前設置排除“肝功能指標缺失”選項。
1.2.3 病例篩選標準連續(xù)2次檢測ALT > 40 IU·L-1或/和TB > 21 μmo·L-1;或單次檢測ALT > 80 IU·L-1或/和TB > 42 μmol·L-1,該過程所篩選病例即為報警病例。
1.3 報警病例關聯性評價
ADE-ASAS監(jiān)測完成后給出的報警病例,由兩名藥師進行背靠背的人工逐一甄別,參照《藥品不良反應術語使用指南》中肯定、很可能、可能、可能無關、待評價及無法評價的6級評價標準進行因果關聯性評價,評價結果為“可能”、“很可能”、“肯定”為陽性病例。若所評結果有差異時,通過深度討論得出一致結論。
1.4 陽性病例嚴重程度分級評價
根據《藥物性肝損傷診治指南(2017年版)》[7]人工評價FA相關性肝損害的嚴重程度分級,見表1。

表1 DILI嚴重程度分級Tab 1 Severity grades of DILI
1.5 陽性病例肝損害分型評價
根據《藥物性肝損傷診治指南》(2017年版)[7]人工評價FA相關性肝損害的分型標準。國際醫(yī)學組織理事會(CIOMS)建立并修訂的DILI分型標準如下:①肝細胞損傷型:ALT ≥ 120 IU·L-1且R ≥ 5;②膽汁淤積型:ALP ≥ 260 μmo·L-1且R ≤ 2;③混合型:ALT ≥ 120 IU·L-1,ALP ≥ 260 μmo·L-1且2 < R < 5。若ALT和ALP達不到上述標準,則稱為“肝臟生化學檢查異常”,其中R = (ALT實測值/ALT正常值上限)/(ALP實測值/ALP正常值上限)。
1.6 統計學分析
采用Microsoft Excel 2013對數據進行整理,采用SPSS 22.0統計軟件進行分析。單因素分析時計量資料若滿足正態(tài)分布及方差齊性時則采用t檢驗,若不滿足則采用秩和檢驗,采用Mann-Whitney U檢驗;計數資料采用χ2檢驗;多因素分析時采用二分類logistic回歸分析。檢驗水準α = 0.05。
2 結果
2.1 系統自動篩查與再評價結果
ADE-ASAS預設排除標準及篩選標準后,用時9600 s完成了FA住院用藥患者7319例、8041例次的肝損害自動監(jiān)測,其中排除基值異常、診斷混雜及指標缺失3080例次,共納入4961例次,其中男性2240例次,女性2721例次,平均年齡(54.60 ± 14.68)歲;系統報警191例次,雙人盲評的陽性病例分別為156例、149例,最終人工評價確定陽性病例149例[很可能63例,可能86例,平均年齡(55.99 ± 13.43)歲],系統陽性報警率78.01%(149/191),肝損害發(fā)生率3.00%,發(fā)生時間主要集中在用藥后1 ~ 7 d(65.00%),平均(5.40 ± 4.06) d;42.62%的病例發(fā)生在停藥之前。具體肝損害類型及肝損害程度見表2。
2.2 FA致DILI相關危險因素分析
2.2.1 單因素分析對FA致DILI的性別、年齡、BMI、用藥劑量及用藥時長5種危險因素進行單因素檢驗,結果顯示性別及用藥時長差異有統計學意義(P < 0.05),具體見表3。

表2 149例ADR陽性病例基本情況Tab 2 The basic situation of 149 ADR positive cases
2.2.2 二分類logistic回歸分析臨床認為BMI也是肝損害發(fā)生的可能危險因素,為避免漏掉重要因素,將P值放寬至P < 0.15,暫時將BMI納入危險因素,因此以下logistic回歸模型中將納入以下自變量:性別、用藥時長及BMI,回歸過程默認各自變量為啞變量,以最高賦值作為參照,具體賦值見表4。模型似然比檢驗顯示該回歸模型有意義(χ2= 35.293,P <0.001),擬合優(yōu)度檢驗顯示模型擬合良好(P = 0.196),可以進行l(wèi)ogistic回歸分析。回歸結果顯示,在均衡其他因素的影響下,BMI對FA致DILI沒有影響(P >0.05),性別和用藥時長是其風險因素(P < 0.05),男性比女性較少發(fā)生FA相關DILI (OR = 0.652),患者用藥時間較長時更易發(fā)生該不良反應,詳見表5。
3 討論
3.1 FA致DILI特征分析
系統報警ADR經人工評價后DILI發(fā)生率3.00%,其中輕度88.59%、中度4.70%、重度2.01%,未見急性肝衰竭及致命情況。而說明書僅提示“消化系統有時可出現轉氨酶升高”[1],缺乏明確的DILI發(fā)生率及發(fā)生程度。國外報道藥物性肝損害發(fā)生率在1 ~ 20/100 000[8-9],本研究中FA發(fā)生率遠遠高于這個比例,考慮可能的原因如下:①Ohmuka[10]研究中1089例服用氟比洛芬酯的患者中有1%出現AST或ALT異常升高超過正常值,提示FA致DILI本身的概率超過其他常見藥物;②本研究納入患者均為住院患者,且筆者所在醫(yī)療機構接收患者大多病情較重,救治過程中用藥劑量及聯用種類較多,加重肝功能代謝負擔,導致用藥后DILI發(fā)生概率較高。
ADR發(fā)生時間多在用藥后1 ~ 7 d(65.00%),平均(5.40 ± 4.06) d;42.62%的病例發(fā)生在停藥之前。71.81%肝損害類型為肝臟生化學檢驗異常,20.13%為肝細胞損傷型,膽汁淤積型僅占1.34%。說明FA致DILI以輕度肝損害為主,較少達到肝細胞損傷型及膽汁淤積型。但有報道顯示肝細胞損傷型容易進一步發(fā)展成急性肝衰竭,死亡率較高[11],所以出現藥物性肝損害患者后,應及時判斷停藥指征并給予保肝治療。此外需指出的是,由于血清ALT敏感性高[12],本研究中僅以患者住院期間血生化ALT最高值血樣為標準評估肝損害類型及程度,今后的研究需多收集其他指標數據,更準確的評價DILI的動態(tài)變化。
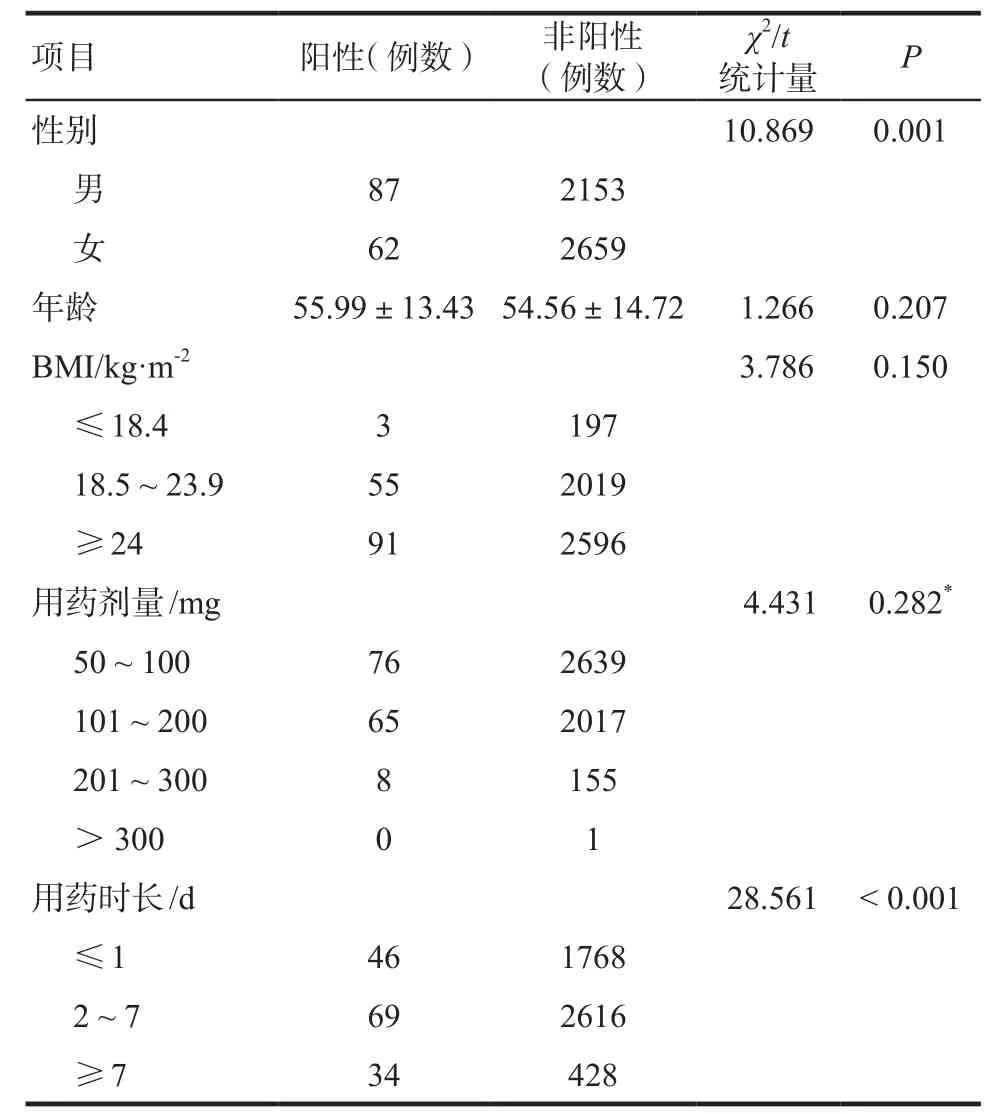
表3 FA致DILI相關因素分析Tab 3 Risk factor analysis study of FA-induced liver injury

表4 變量名及其賦值Tab 4 Variables and assignments

表5 FA致DILI的二分類logistic回歸分析Tab 5 Binary logistic regression analysis of FA-induced liver injury
3.2 FA致DILI風險因素分析
研究顯示年齡、BMI、用藥劑量不是FA致DILI的風險因素,性別和用藥時長是具有顯著性統計學差異。男性患者發(fā)生DILI的風險明顯低于女性(OR =0.652),為女性發(fā)生DILI的0.652倍。Fontana等[13]對660位確定、很可能以及可能DILI的患者進行危險因素回歸分析,其中59.5%的患者為女性,但并未指出性別是該不良反應的風險因素。是否由于男性與女性在機體免疫力、激素水平以及肝腎微粒體藥酶活性不同,導致不同性別的患者對藥物的敏感性各異,有待進一步證實。患者用藥時長與該ADR的發(fā)生概率呈正相關(< 1 d:OR = 0.353;2 ~ 7 d:OR = 0.362;> 7 d:OR = 1),但與用藥劑量無關,約65.00%的患者ADR發(fā)生在用藥一周內,分析部分DILI發(fā)生機制可能與特異質肝損害有關,此類型肝損害與代謝酶基因多態(tài)性[14]及個體異質性[15]密切相關,在藥物性肝損害中較為常見[8];相關機制尚未充分闡明。
3.3 ADE-ASAS自動監(jiān)測效能分析
ADE-ASAS用時9600 s完成了8041例次住院患者自動監(jiān)測與智能評估,且陽性報警率達78.01%,雙人盲評的陽性病例吻合度為95.51%。顯示基于信息化技術發(fā)展的自動監(jiān)測模式能夠大大減少人力物力的消耗,降低工作強度,為高效準確的開展藥品上市后安全性再評價提供了可能。而且在監(jiān)測相關患者肝損害異常指標的同時,能夠將基礎疾病、其他藥品使用情況如保肝藥、其他肝損害可疑藥清晰明了的呈現給研究人員,助其快速精準判斷FA與DILI的關聯性,也為其他藥品相關肝損害的發(fā)現提供了可能[5-6]。
3.4 研究局限性
本研究中考慮到系統導出信息量大而人力物力有限,設置ADE-ASAS事件配置器參數的排除條件較嚴格,用藥人群的納入率僅有61.70%;但是排除條件嚴苛難免漏報,放寬又降低陽性報警率,增加人工甄別量[16];盡管對非報警病例進行了隨機抽樣檢查,仍不能排除ADR發(fā)生率偏低的可能;本研究未進一步深度分析患者放射學和B超檢查結果,亦有可能會將某些肝功能指標正常但已經出現器質性改變的病例排除在報警病例之外。
綜上,FA致DILI損傷程度以輕度為主,發(fā)生率在常見范圍。損傷類型主要表現為肝臟生化學檢查異常,風險因素為性別及用藥時長。臨床用藥中對于女性及用藥時間較長的患者應更加關注其肝功能變化;一旦出現異常應及時評判,確定是否停藥并給予對癥治療。基于ADE-ASAS的自動監(jiān)測,病例篩選高效、快速,數據回溯完整,有助于開展藥品上市后安全性再評價研究。

