局部進展期直腸癌手術前后放化療的療效對比
楊 勇 張紅雁
直腸癌是消化道最常見的惡性腫瘤之一,近年來其發病率和死亡率呈上升趨勢[1]。手術是直腸癌主要治療手段,但對于局部進展期直腸癌,單純手術治療復發率高,長期生存率低,目前多采用放化療和手術相結合的綜合治療方案。放化療方案分為術前放化療、術后放化療,NCCN指南推薦對T3~4N0~2M0的直腸癌患者行術前放化療[2]。本文通過比較152例行根治術的局部進展期直腸癌患者術前放化療與術后放化療療效和急性不良反應的差異,探討局部進展期直腸癌行術前放化療與術后放化療的優劣。
1 資料與方法
1.1 一般資料 回顧分析2009年1月至2014年12月安徽省立醫院收治的152例經病理證實的局部進展期直腸癌患者臨床資料。所有患者均經多種臨床檢查和影像學(包括直腸指檢、纖維結直腸鏡,B超,胸片,盆腔CT或MRI)等檢查。納入標準:①術前臨床分期(2002版國際抗癌聯盟TNM標準[3])為T3~4N0~2M0的直腸癌患者;②手術方式為遵循直腸全系膜切除術原則進行根治性手術的患者;③一般狀況評分(Karnofsky,KPS評分)≥70分。排除標準:既往有腹盆腔腫瘤病史或放療的患者。根據放化療方案選擇的時機,分為術前放化療組與術后放化療組。其中術前放化療組67例,男性39例,女性28例;年齡36~71歲,平均(53.4±7.2)歲,其中Ⅱ期32例(12例cT3N0,20例cT4N0),Ⅲ期35例,腫瘤下緣距肛緣2~11cm,平均(4.7±2.1)cm,直腸中分化腺癌56例,高分化腺癌8例,黏液腺癌3例。術后放化療組85例,其中男性51例,女性34例;年齡21~74歲,平均(52.3±8.6)歲,其中Ⅱ期47例(21例cT3N0,26例cT4N0),Ⅲ期38例;腫瘤下緣距肛緣2~12 cm,平均(5.6±1.8)cm,直腸中分化腺癌69例,高分化腺癌11例,黏液腺癌4例,印戒細胞癌1例。兩組患者性別、年齡、腫瘤類型、腫瘤下緣距肛緣距離及TNM分期的差異均無統計學意義(P>0.05),具有可比性。
1.2 治療方法
1.2.1 術前放化療組 術前放化療組均完成術前同步放化療,放療采用IMRT放療技術,6MV能量X射線。IMRT照射技術:在CT下行放療定位,患者取仰臥位,膀胱充盈,真空袋固定。放療靶區臨床靶區(CTV)包括原發腫瘤、直腸系膜區、骶前淋巴結區、髂內血管區、部分髂外血管區、閉孔淋巴結區和/或坐骨直腸窩。計劃靶區(PTV)在CTV的基礎上外擴0.7 cm。照射劑量:常規分割量,1.8~2.0 Gy/d,5次/周,共25~28次,總照射劑量為45~50.4 Gy。正常危及器官限量:50%膀胱照射劑量小于50 Gy,照射50 Gy的股骨頭體積小于5%,50%小腸照射劑量小于20 Gy,小腸的最大照射劑量小于52 Gy。同步化療方案為卡培他濱(1 600 mg/m2·d,2次/天,放療第1天至放療結束)。放化療結束后4~6周行手術治療,術后完成4~6周期FOLFOX4方案治療。
1.2.2 術后放化療組 術后放化療組先行手術治療,術后4周行同步放化療,放化療方法同術前放化療組,放療后完成4~6周期FOLFOX4方案治療。
1.2.3 根治手術及術后處理 所有患者均遵循直腸全系膜切除術原則進行根治性手術,其中86例行經腹直腸癌切除術(Dixon手術),66例行經腹會陰聯合直腸癌根治術(Miles手術)。術后兩組患者均接受FOLFOX4方案(奧沙利鉑+亞葉酸鈣+5-氟尿嘧啶)化療4~6周期(奧沙利鉑 85 mg/m2,第1天;亞葉酸鈣200 mg/m2,第1天;5-氟尿嘧啶600 mg/m2;第1、2天)。
1.3 觀察指標及評價標準 生存情況(總生存率、無瘤生存率,局部復發率),急性不良反應(包括消化道、血液系統及泌尿系統反應),近期療效(保肛率、腫瘤緩解率)。無瘤生存期指從患者接受治療開始至局部復發和/或遠處轉移的時間,總生存期從患者接受治療開始至患者因腫瘤因素死亡的時間。急性不良反應按照美國腫瘤放射治療協作組(RTOG )急性放射損傷分級標準[4]進行分級。
1.4 隨訪 患者術后每3~6月進行1次門診隨訪,隨訪10~69個月,隨訪內容包括檢查有無局部復發、 遠處轉移。通過直腸指診、纖維結直腸鏡、盆腔CT掃描、MRI 以及腸道腫瘤標志等方法來判斷腫瘤的復發及轉移。失訪病例5例,總隨訪率96.7%。
1.5 統計學方法 運用 SPSS 19.0軟件對數據進行統計分析,采用Kaplan-Meier法計算生存率并行Log-rank檢驗,計數資料用例或百分比表示,采用χ2檢驗。以P<0.05為差異有統計學意義。
2 結果
2.1 兩組患者近期療效及生存率比較 ①術后放化療組保肛率為54.1%(46/85),術前放化療組保肛率為59.7%(40/67),差異無統計學意義(P>0.05);②術前放化療組:放化療4周后復查提示臨床完全緩解率為15例(22.4%),部分緩解33例(49.3%),無緩解18例(26.9%),術后病理完全緩解(pathological complete remission,pCR)12例(17.9%)。③術前放化療組、術后放化療組3年總生存率分別為75.8%、70.4%,差異無統計學意義(χ2=1.124,P=0.289);無瘤生存率分別為68.2%,65.4%,差異無統計學意義(χ2=0.826,P=0.363)。術前放化療組局部復發率分別為5.9%,低于術后放化療組16.4%,差異有統計學意義(χ2=3.975,P=0.047)。
2.2 兩組患者急性不良反應比較 術前放化療組發生的急性不良反應分級多為1、2級,患者均能耐受;術后放化療組有4例患者因腹瀉中斷化療,1例中斷放療。兩組同期放化療主要的不良反應為白細胞下降、腹瀉、惡心嘔吐及放射性直腸炎。術前放化療組患者無論是胃腸系統、泌尿系統還是血液系統急性反應發生率均小于術后放化療組,差異有統計學意義(P<0.05)。詳見表1。
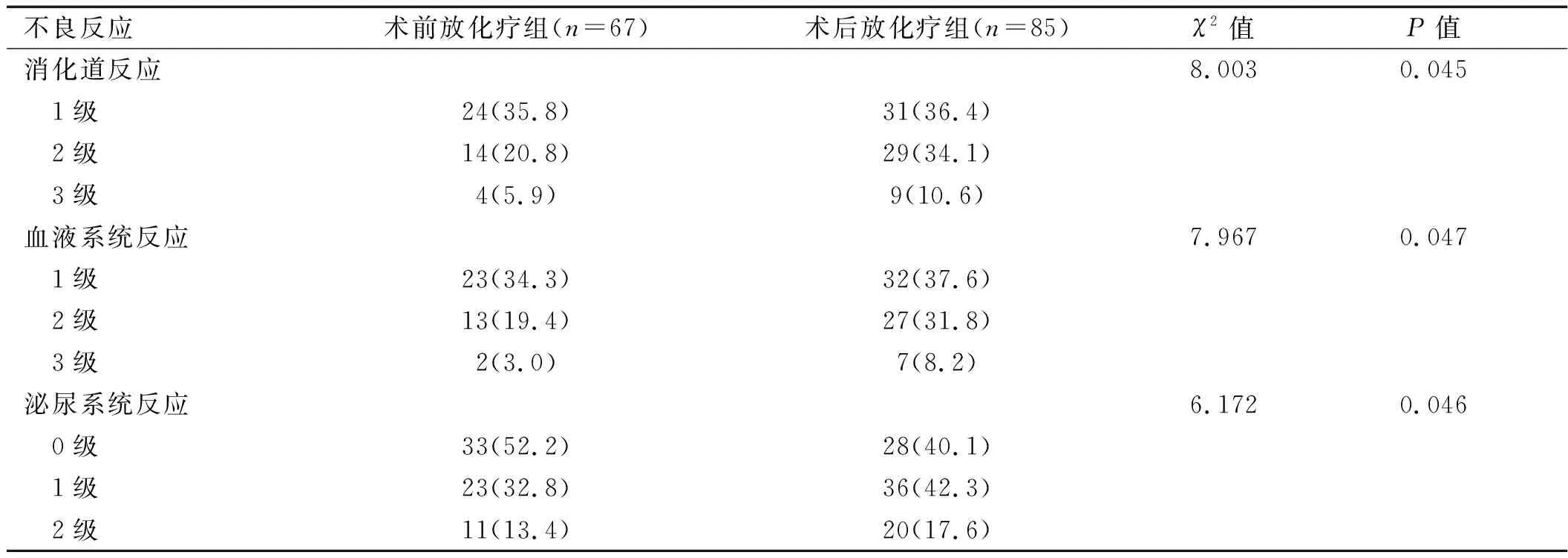
表1 兩組患者急性不良反應比較[例(%)]
3 討論
大量研究[5-8]證實,術前放化療可取得與術后放化療相同的長期生存率和無瘤生存期,且在腫瘤降期和病理緩解上有明顯優勢。Sauer 等[6]的研究結果提示,術前放化療比術后放化療降低了10年的局部復發率(7.1%比10.1%),而急性和晚期毒性反應率均明顯低于術后放化療(分別為6%比13%與27%比40%),但兩者總生存率無顯著差異(59.6%比59.9%)。最新的研究[9]顯示,對于局部進展期直腸癌行IMRT聯合Xelox方案術前放化療并不顯著降低放化療期間胃腸道反應。本研究結果顯示,術前放化療組與術后放化療組的3年總生存率和無瘤生存率差異無統計學意義(P>0.05),而術前放化療組3年局部復發率低于術后放化療組(P<0.05),表明兩組患者3年總生存率及無瘤生存率無顯著差異,但術前放化療組卻降低了局部復發率和治療的毒性反應。與上述研究結果相符。本組資料中,術前放化療組未出現嚴重的不良反應,未出現因毒副反應而中斷放射治療的患者。而術后放化療組患者因嚴重腹瀉中斷化療4例,中斷放療1例,在不良反應上,術前放化療組急性不良反應(血液系統、消化道及泌尿系統反應)均低于術后放化療組(P<0.05)。表明局部進展期直腸癌行術前放化療可降低急性不良反應,提高治療耐受性。
國內外多項研究[10-14]顯示,對于局部進展期直腸癌,術前同期放化療后pCR率為15%~34%,且術前放化療組顯著提高了保肛率。本研究中術前放化療組pCR率為18%,與上述研究結果相符,術后放化療組保肛率為54.1%,術前放化療組保肛率為59.7%,后者高于前者,但無統計學差異,考慮可能與本組患者中低位腫瘤所占比例高有關。
綜上所述,對于可切除的局部晚期直腸癌患者, 術前同期放化療方案優于術后同期放化療治療方案。

